一种制备氢氧化亚铁沉淀的装置及方法与流程
本发明属于化学学科教学实践领域,具体是涉及一种制备氢氧化亚铁沉淀的装置及方法。
背景技术:
高中化学教师在演示用硫酸亚铁溶液和氢氧化钠溶液,制备白色的氢氧化亚铁实验时,往往得到的是灰绿色沉淀,并非白色沉淀。对于这一现象,化学老师普遍解释为是氢氧化亚铁被溶液中溶解的氧气氧化所致。
为了排除溶液中溶解氧的影响,在氢氧化钠溶液中和硫酸亚铁溶液中均加入vc注射液以消耗掉溶液中溶解的氧气(除消耗溶解的氧气外vc并不参与其他反应),用溶解氧传感器检测确定无氧后,将硫酸亚铁溶液滴加到氢氧化钠溶液中,观察是否有灰绿色出现。将含有0.1mol/l硫酸亚铁溶液(滴有2滴vc注射液)的滴定管,插入到氢氧化钠溶液(滴有2滴vc注射液)液面下,缓慢滴加硫酸亚铁溶液,产生的白色沉淀迅速变为灰绿色。因此,使用溶解氧含量均为零的氢氧化钠溶液与硫酸亚铁溶液反应,白色沉淀依然迅速变为灰绿色,说明沉淀颜色的变化并不是由氧气所引起的。
另外,氢氧化亚铁的制备实验的改进装置有很多,有些改进实验可以长时间看到白色沉淀,但实验结果并不尽如人意,现选取了比较典型的三个实验进行分析。
①、植物油隔绝空气的改进装置
利用植物油隔绝试管中的氢氧化钠空气,硫酸亚铁溶液插入到氢氧化钠溶液液面下进行实验。也有人认为将氢氧化钠溶液滴加到硫酸亚铁溶液中效果更好,但经过重复该实验同样不能长时间看到白色絮状沉淀。
②、运用氢氧化钠乙醇溶液与0.1mol/l硫酸亚铁溶液反应
有作者使用氢氧化钠乙醇溶液(饱和,下同)与0.1mol/l硫酸亚铁溶液反应可以长时间看到白色沉淀,经过重复该实验发现确实如此。但是,利用实验方法验证沉淀成分,发现该白色沉淀并不是氢氧化亚铁沉淀,而是硫酸钠。
验证方法一:传统化学实验分析
步骤1:过滤出制得的白色沉淀,并使用乙醇清洗后。加入一定量的水,发现白色沉淀溶解,得到无色溶液;步骤2:用铂丝对该无色溶液进行焰色反应,发现火焰颜色呈黄色,说明溶液中含有钠离子;步骤3:往步骤1所得的无色溶液中加入过量1mol/l盐酸溶液,再滴加几滴0.1mol/l氯化钡溶液,出现白色沉淀,说明溶液中含有硫酸根离子。步骤4:往氢氧化钠乙醇溶液中,滴加0.1mol/l的硫酸溶液,也出现了白色沉淀。结论:氢氧化钠乙醇溶液与硫酸亚铁溶液反应,生成的白色沉淀中含有硫酸钠。
验证方法二:xrd检测法
待测样品xrd峰形峰位与标准卡片(78—2076)吻合,呈立方晶系。衍射峰从左到右分别对应于立方相的(110)、(111)、(200)、(220)、(311)及(222)晶面。除na2so4的衍射峰外,没有发现fe(oh)2的衍射峰。结论:白色沉淀为硫酸钠,而非氢氧化亚铁沉淀
③、碳酸氢钠与硫酸亚铁反应制备
有文章认为使用碳酸氢钠与硫酸亚铁溶液在橡胶管中反应,可长时间看到白色氢氧化亚铁沉淀。现选取文章中的可以看到白色沉淀的最佳浓度进行实验即1.5mol/l碳酸氢钠与1mol/l硫酸亚铁。在白色橡胶管中加入10ml、1.5mol/l碳酸氢钠溶液,使用注射器缓慢地注射约1ml、1mol/l的硫酸亚铁溶液,可以看到溶液中有大量气泡产生,同时可以较长时间看到白色沉淀。但是,往溶液中鼓入空气后,白色沉淀仍不变色,由此引起了发明人对于白色沉淀的质疑,发明人认为该白色沉淀有可能是碳酸亚铁而不是氢氧化亚铁。
技术实现要素:
为了解决传统制备制备强氧化亚铁方法存在无法得到白色沉淀的缺点,本发明提供了一种制备氢氧化亚铁沉淀的装置及方法,可以制备出长时间存在的氢氧化亚铁白色沉淀。
为解决本发明的技术问题,所采用的技术方案为:一种制备氢氧化亚铁沉淀的装置,由原料预处理及溶解氧含量检测装置和沉淀制备装置组成;
原料预处理及溶解氧含量检测装置包括烧杯和溶解氧传感器,烧杯内盛放制备原料,溶解氧传感器底端伸入烧杯中,其探测的溶解氧数值通过数据采集器传输至处理设备中,处理设备显示溶解氧数值;氮气导管通过一个铁夹安装在铁架台上,氮气导管的末端伸入烧杯中;
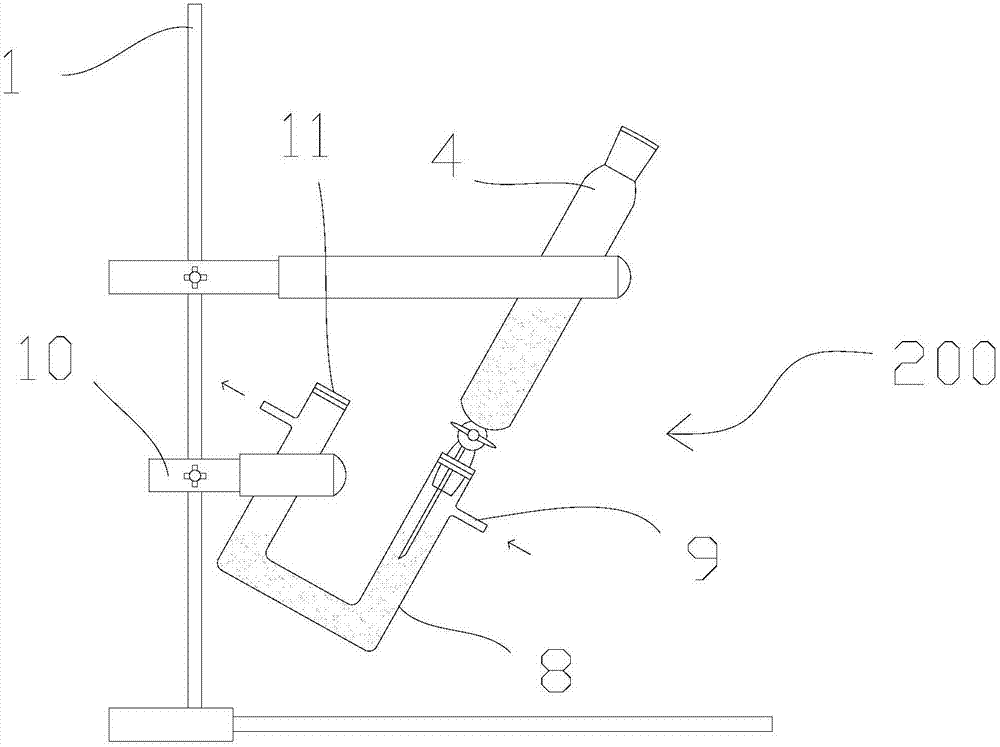
沉淀制备装置包括滴管和u型管,滴管和u型管分别通过一个铁夹安装在铁架台上,滴管的底端伸入u型管的一个入口内的液面以下并用密封塞封住;u型管的另一个入口直接用密封塞封住;u型管上有两个细的管口,分别用作氮气鼓入口和排气口,u型管安装在铁架台上时,倾斜一定角度,确保鼓入口置于排气口的下方;滴管和u型管内分别盛有硫酸亚铁溶液、经过通氮气预处理的氢氧化钠溶液。
利用上述装置制备氢氧化亚铁沉淀的方法,步骤如下:
①、利用原料预处理及溶解氧含量检测装置降低氢氧化钠溶液的溶解氧含量:
往盛有氢氧化钠溶液的烧杯中持续通入高纯氮气,利用溶解氧传感器测定溶解氧含量,并通过数据采集器传输至处理设备中,处理设备显示溶解氧数值并作出溶解氧变化曲线;
②、利用沉淀制备装置制备白色氢氧化亚铁沉淀:
向滴管和u型管内分别装入新制的硫酸亚铁溶液、经过通氮气预处理的氢氧化钠溶液,向u型管中持续通入氮气,然后开始滴加新制的硫酸亚铁溶液,即可在u型管中观察到有白色沉淀生成。
本发明相对于现有技术的有益效果是:
本发明通过实验装置可以证实,纵然在无氧环境下也很难长时间看到白色絮状沉淀,同时,灰绿色沉淀的形成之“氧化理论”是不严谨的。另外,本发明在鼓入氮气情况下可以长时间制得白色氢氧化亚铁,结合亚铁离子的颜色,有此可知灰绿色沉淀的出现,是因为生成氢氧化亚铁凝胶吸附亚铁离子所致(吸附过程)。
附图说明
以下结合实施例和附图对本发明作出进一步的详述。
图1是原料预处理及溶解氧含量检测装置的结构示意图。
图2是氢氧化亚铁沉淀制备装置的结构示意图。
图3是持续通入氮气情况下0.1mol/l氢氧化钠溶液中的溶解氧含量变化曲线。
图4是停止通入氮气下0.1mol/l氢氧化钠溶液中的溶解氧含量变化曲线。
图5是有无通入氮气对沉淀生成的影响对比图(左侧未通入氮气、右侧通入氮气)。
图6是沉淀生成后后续通入氮气对沉淀的影响对比图(左侧为向未通入氮气制备的沉淀中后续通入氮气、右侧为通入氮气下制得的沉淀)。
具体实施方式
本发明的目的是制备出可长时间存在的氢氧化亚铁白色沉淀
①、实验装置
原料预处理及溶解氧含量检测装置100的结构如图1所示,烧杯3内盛放制备原料硫酸亚铁或氢氧化钠,在烧杯3的外侧放置一个环形支撑架2,溶解氧传感器5底端伸入烧杯3中,上部抵靠在环形支撑架2上。溶解氧传感器5探测的溶解氧数值通过数据采集器6(如威尼尔数据采集器)传输至处理设备7(如装有威尼尔配套软件的电脑)中,处理设备7显示溶解氧数值。氮气导管12通过一个铁夹10安装在铁架台1上,氮气导管12的末端伸入烧杯3中。
沉淀制备装置200的结构如图2所示,滴管4和u型管8分别通过一个铁夹10安装在铁架台1上,滴管4的底端伸入u型管8的一个入口内的液面以下并用密封塞11封住;u型管8的另一个入口则直接用密封塞封住。u型管8上有两个细的管口,分别用作氮气鼓入口和排气口,u型管8安装在铁架台1上时,倾斜一定角度,确保鼓入口置于排气口的下方。滴管4和u型管8内分别盛有硫酸亚铁溶液、经过通氮气预处理的氢氧化钠溶液。
②、通入氮气对氢氧化钠溶液溶解氧含量的影响
毫无疑问,氧气会对氢氧化亚铁沉淀的制备造成影响,如果持续通入与氢氧化钠溶液不反应的气体,可以最大程度地赶走溶液中溶解的氧气。
利用原料预处理及溶解氧含量检测装置测定氮气通入时氢氧化钠溶液中溶解氧含量变化:
往200ml、0.1mol/l氢氧化钠溶液中通入近1小时的高纯氮气,并测定其中溶解氧含量,测出最终溶液中溶解氧含量从10.18mg/l降至0.76mg/l(具体数据如图3所示)。
测定停止通入氮气氢氧化钠溶液中溶解氧含量变化,如图4所示,从数据中可以得出,停止通入氧气后5min内溶解氧含量变化为0.08mg/l,变化程度非常小。
③、使用溶解氧含量很低的氢氧化钠溶液与新制硫酸亚铁溶液反应
使用溶解氧含量为0.76mg/l的氢氧化钠溶液与新制硫酸亚铁溶液(溶解氧含量为0.16mg/l)进行实验,装置如图2所示。
步骤1:分两组进行,一组通入氮气,另一组不通入氮气(其他条件完全相同),分别向两只u型管均加入上述氢氧化钠溶液15ml。
步骤2:两个滴管内均放入新制硫酸亚铁溶液,分别向两只u型管中滴入新制硫酸亚铁溶液1ml。观察实验现象。
如图5所示,左侧u型管中先出现白色沉淀很快变为灰绿色(约3秒);右侧u型管中沉淀是在通入氮气条件下制备的,维持通氮气状态可以长时间看到白色沉淀,继续通入氮气1小时未见明显改变。左侧u型管虽不是在氮气保护气下进行,从图4数据来看,溶液溶解空气中氧气并不快,所以两溶液中溶解氧含量应该是相当的。
为了考察未通入氮气制备的沉淀是否因为沉淀聚集而导致颜色变深,现向左侧的u型管中通入氮气,结果如图6所示,左侧生成沉淀再鼓入氮气颜色明显呈绿色,故左侧灰绿色沉淀(不同氮气制备的产物)不是聚集状态所致。
综上所述,本发明在氮气环境下可以制备出白色絮状沉淀,同时,通过实验证实:灰绿色沉淀的出现并不是溶液中溶解的氧气所致。可能是因为生成了氢氧化亚铁凝胶吸附亚铁离子所致,滴加硫酸亚铁时氮气鼓入可以阻碍这种聚集,故可以长时间看到白色絮状沉淀。
以上内容仅仅是对本发明的构思所作的举例和说明,所属本技术领域的技术人员对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,只要不偏离发明的构思或者超越本权利要求书所定义的范围,均应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!