在数字微流体装置中创建高分辨率温度谱线的制作方法
本申请要求于2016年6月29日提交的美国临时专利申请号62/356,418的权益,该临时专利申请的全部公开内容通过援引的方式并入到本文中。
本发明总体涉及(例如分子生物学领域中的)微流体装置。
背景技术:
液滴微流体(dropletmicrofluidics)是一个相对较新但快速发展的领域。它提供了通过采用以下机制来操纵液滴和/或液滴中的粒子的方法,比如电润湿[wo2008147568,基于电湿润的数字微流体(electrowettingbaseddigitalmicrofluidics)]、电泳[wo2014036914,用于基于电泳控制液体中的带电粒子的方法和装置(methodanddeviceforcontrolling,basedonelectrophoresis,chargedparticlesinliquid)]和介电电泳[wo2014036915,用于操纵液体中的粒子的基于介电电泳的设备和方法(dielectrophoresisbasedapparatusesandmethodsforthemanipulationofparticlesinliquids)]等。它提供了液滴操作能力,比如液滴分配和输送,多液滴合并和混合,将一个液滴分成两个(或更多个)子液滴,孵化,废物处理,粒子(如dna/rna/蛋白质分子、细胞、珠子等)再分配/浓缩/分离等。液滴微流体提供了处理液体分析的所有基本步骤的能力,包括取样、样品制备、反应、检测和废物处理等。它实际上可以处理体积在几皮升至几十微升(跨度超过6个数量级)范围内的液滴。它可用于医疗诊断、癌症筛查、药物发现、食品安全检查、环境监测、法医分析等。除微型化和集成外,它还提供其他优点,比如低成本、自动化、并行性、高通量、低能耗等。
典型的数字微流体(dmf)装置由两个由间隔物隔开的固体基质组成,以在两者之间形成间隙。液体以不连续的方式(即以液滴的形式)在间隙中操作。与基于通道的微流体不同,在数字微流体中,液体/液滴路径可以在运行期间通过控制软件来改变,并且液滴可以被单独操作。数字微流体真正实现了芯片实验室概念的承诺,即处理分析的所有基本步骤,包括取样、样品制备、反应、检测和废物处理等。数字微流体与基于工作台的液体处理有很大的相似之处。已建立的基于工作台的流程可以很容易地适应数字微流体格式。
化学和生化反应通常需要良好调节的温度谱线(temperatureprofile)才能高效地进行。例如,在如同聚合酶链式反应(pcr)、连接酶链式反应(lcr)、基于转录的扩增和限制性扩增等dna扩增方法中,反应需要在较高的变性温度和较低的聚合温度之间循环。其他核酸扩增方法需要反应在指定的恒定温度下进行,比如自持序列复制(3sr)、滚环扩增(rca)、链置换扩增(sda)和环介导扩增(lamp)、依赖解旋酶的扩增(had)等。检测当dna分子通过明确定义的温度谱线时荧光强度的变化可以提供很好的洞察力,比如单核苷酸多态性(snp)的存在和特性——一个被称为熔解曲线(meltingcurve)分析的过程。
良好调节的温度控制在rna和蛋白质分子的处理中也很重要,例如,用于rna检测的实时rt-pcr(逆转录-聚合酶链式反应)和等温rna信号生成(irsg)和用于蛋白质检测的实时免疫pcr和iar(等温抗体识别)。细胞裂解通常也与温度有关。
由于其高灵敏度,pcr是临床诊断、法医学和环境科学等中最常用的核酸扩增和定量方法之一。虽然分子水平的反应通常非常快,但pcr的速度通常受循环通过不同所需温度所耗费的时间的限制。快速/超快速pcr通常是非常需要的,特别是在传染病诊断、生物战和病原体鉴定、法医分析等情况下。甚至更希望实现具有低功耗、紧凑尺寸和简单操作的快速/超快速pcr。
微流体热管理一直是一个主要问题。已经探索了许多技术来调节微流体系统内的温度。这些技术包括使用珀尔帖效应[maltezos,g.等,microfluidicpolymerasechainreaction(微流体聚合酶链反应),appl.phys.lett.2008,93,243901:1–243901:3]、焦耳加热[mavraki,e.等,acontinuousflowμpcrdevicewithintegratedmicro-heatersonaflexiblepolyimidesubstrate(在柔性聚酰亚胺基板上具有集成微加热器的连续流动μpcr装置).procediaeng.2011,25,1245–1248]、吸热化学反应[guijt,r.m.等,chemicalandphysicalprocessesforintegratedtemperaturecontrolinmicrofluidicdevices(用于微流体装置中的集成温度控制的化学和物理过程).labchip2003,3,1–4]、微波[shaw,k.j.等,rapidpcramplificationusingamicrofluidicdevicewithintegratedmicrowaveheatingandairimpingementcooling(使用具有集成微波加热和空气冲击冷却的微流体装置进行快速pcr扩增).labchip2010,10,1725–1728]、和激光器[kim,h.等,laser-heatedreactionsinnanoliterdropletarrays(纳升液滴阵列中的激光加热反应).labchip2009,9,1230–1235]等。现在,人们仍在寻找可靠、易用且经济的方法来调节微流体系统的温度。
专利wo2009003184[用于热交换化学过程的基于数字微流体的装置]提出了使用外部温度控制模块在装置上产生不同温度区域的装置设计和方法。可以通过在不同温度区域之间来回传输反应液滴来进行热交换化学过程,比如pcr。
然而,上述在微流体装置上使用外部温度控制模块具有其局限性。当使用接触温度控制模块时,微流体装置的底部和覆盖基板充当扩散器,这限制了发生反应的装置间隙处的温度分辨率。当使用非接触式加热方法,比如光子加热[ultrafastphotonicpcr(超快光子pcr),jhson,等,light:science&applications(2015)4]或微波加热[kjshaw等,rapidpcramplificationusingamicrofluidicdevicewithintegratedmicrowaveheatingandairimpingementcooling(使用具有集成微波加热和空气冲击冷却的微流体装置的快速pcr扩增).labchip10:1725]时,需要复杂且昂贵的聚焦机制来实现高空间温度分辨率。
在一个实施方式中,提供了用于在液滴微流体装置中实施高空间分辨率温度控制的简单且成本有效的方法。通过将加热电极设置在面向操作液滴所处的装置间隙的盖板表面上,可以在装置间隙中产生许多不同的温度区域,从而为不同的化学/生化反应提供理想的反应环境。通常电接地的屏蔽电极被设置成(至少部分地)覆盖加热电极。该屏蔽电极防止液滴受到加热电极产生的可能的电场和/或磁场的影响。外部温度控制模块,比如珀耳帖(peltiers)或水/空气冷却块,可以与加热电极一起使用,将温度控制范围增加到例如室温以下。
液滴微流体装置的间隙中的受控区域的温度可以在-20℃(-4℃)至200℃的范围内,优选为0℃至120℃,更优选为20℃至98℃。
在一个方面,加热电极可以与反馈控制集成。例如,加热电极的典型实施方式是以特定的厚度、宽度和长度沉积导电材料层,使其具有特定的电阻。当电流通过加热电极时,产生热量——焦耳加热。加热电极可以被称为电阻加热器。通常,电阻加热器的电阻值取决于温度。通过测量电阻变化,可以计算温度变化(与起点相比)。这意味着电阻加热器也可以用作温度传感器。其他温度传感器,比如但不限于,热电偶、热敏电阻和分离电阻温度检测器(rtd)可以用于连续监测装置的温度曲线。这些传感器可以在设备间隙中或装置的顶板或底板上暂时放置以进行温度校准,或永久放置以在运行时间内实现闭环温度控制。
熔解曲线分析是对加热过程中双链dna的解离特征的评估。收集的信息可用于推断单核苷酸多态性的存在和身份。本发明提供了用于实施熔解曲线分析所需的温度扫描的方法。在一个方面,本发明提供了通过空间变化实施温度变化的方法。因此,在热平衡时,可以将装置的两个或更多个区域设定为不同的温度(适合于熔解曲线分析),可以在装置上设计从最高温度区域的温度到最低温度区域的温度的连续温度变化的路径(或多个路径)。可以沿着该路径(或多个路径)移动一滴pcr产物,并且在pcr产物沿着路径移动时测量荧光。荧光的变化可用于获得dna链的熔解曲线。在本发明的另一个方面,可以使pcr产物的液滴在一个位置保持静止,并且可以改变该位置的温度。可以在所述位置收集荧光数据以获得dna链的熔解曲线。
dna测序是确定构成dna分子的四种化学结构单元(称为“碱基”)的精确顺序的过程。在许多方面,序列数据可以突出可能导致疾病的基因变化。尽管dna测序技术和平台正在迅速发展,但样品处理(也被称为文库构建)滞后。这是液滴微流体可以提供帮助的领域。
文库构建通常有几个主要步骤-基因组dna片段化、末端修复、在dna片段的3'末端添加'a'碱基、dna片段的衔接子连接、连接产物纯化、衔接子修饰的dna片段的pcr扩增等。不同的步骤通常需要不同的温度谱线。本发明提供了一种方便的方法,用于在液滴微流体装置上产生所需的温度谱线,以实现快速的文库构建。
技术实现要素:
描述了用于液滴微流体装置中的独立温度控制的设备和方法,而不影响液滴操作,比如液滴分配和运输、合并和混合多个液滴、将一个液滴分成两个(或更多)子液滴、孵化、废物处理、粒子(比如dna/rna/蛋白质分子、细胞、珠子等)再分配/富集/分离等。
本设备和方法能够在微流体水平上进行快速且灵敏的dna分析。特别是,它允许整合不同的分析方法,比如等温扩增和qpcr、pcr和熔解曲线。在一些实施方式中,本文描述的装置可以在微流体装置中产生高分辨率温度谱线。这使得dna分析快速、简单、具有高通量、成本效益和高度灵敏度。
pcr需要重复加热和冷却循环,以便在原始dna靶分子、特异性dna引物、脱氧核苷酸三磷酸盐和热稳定dna聚合酶和辅因子的存在下重复变性、退火和延伸过程。每个温度循环使靶dna序列的量加倍,导致靶序列的指数积累。在典型的现有商业pcr仪器中,反应混合物存在于容器(比如pcr管或微量滴定板)中。pcr反应混合物、其容器和温度控制块被循环通过不同的温度设定点。样品、容器和温度控制块的组合质量限制了pcr反应的速度。一些快速pcr试剂可以在几秒内完成一个pcr循环,而大多数商业pcr系统需要几分钟。
专利wo2009003184提出了一种将dmf装置的不同区域控制到不同温度设定点的方法。通过在不同温度区域之间来回输送液滴,可以加速温度依赖性反应,因为仅需要对小液滴进行温度循环。然而,专利wo2009003184中的方法通常受到可以同时运行的pcr反应的数量的限制,这是由于在任何给定时间可以产生有限数量的温度区。原因在于用于制造微流体装置的材料(比如玻璃、硅、石英和塑料)中的热传递通常不是定向的。当热量从基板的一侧传递到另一侧时,热量横向扩散。在dmf装置的中间(或间隙)中产生的温度谱线的空间分辨率不能跟上外表面上的温度谱线的空间分辨率。例如,利用专利wo2009003184中提出的方法,当使用1mm厚的玻璃或塑料基板时,在装置的中间产生彼此间隔1mm的交替的95℃和60℃的温度区域是非常具有挑战性的。
数字pcr是核酸检测和定量的新方法。它是相对于常规qpcr的绝对定量和罕见等位基因检测的方法,因为它直接统计靶分子的数量而不是依赖于参考标准或内源对照。dmf装置可以被设计成与1nl(纳升)或更小的液滴一起工作,并且可以产生/分配几千个液滴并将其放置在装置中。因此,可以在这样的装置上执行数字pcr,并且具有快速的样品-结果周转时间。
附图说明
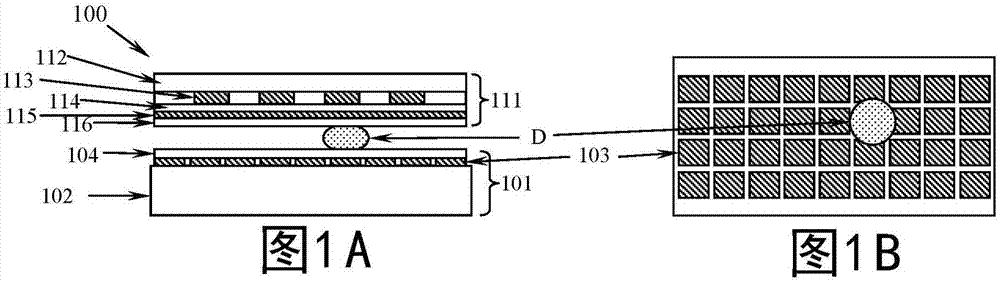
图1a-1c示出了在盖板上具有加热电极的液滴微流体装置的单层电极控制的横截面图,以及液滴控制电极和加热电极的顶视图。
图2a-2d呈现了在盖板上具有加热电极的液滴微流体装置的双层电极控制的两个相对于彼此90度的横截面视图,以及液滴控制电极和加热电极的顶视图。
图3a和3b示出了加热电极及其连接的一些可能的设计。
图4示出了类似于图1a但具有两个外部温度模块的液滴微流体装置。
图5a示出了加热电极的示意性设计,使得产生了许多温度区,每个温度区的温度谱线适合于特定的反应。图5b是从具有加热电极(集成加热器)的dmf装置收集的qpcr数据。
图6示出了加热电极的另一个示意性设计,该加热电极允许同时在所述装置上进行dna分子的等温扩增和pcr扩增。
图7示出了具有加热电极的液滴微流体装置的又一个应用,其中按照熔解曲线分析执行流通(flow-through)pcr扩增dna。
图8示出了具有加热电极的液滴微流体装置的又一个应用,其中细胞裂解、dna提取、扩增和分析全部在同一装置上进行。
具体实施方式
以下是本专利申请中使用的一些术语的定义和/或解释。
出于本公开的目的,术语“微流体”是指具有操纵至少一个横截面尺寸在几微米至约几百微米范围内的液体的能力的装置或系统。
出于本公开的目的,术语“液滴(droplet)”用于表示通过空气(或其他气体)、其他液体(通常并非不混溶的液体)或固体表面(比如dmf装置的内表面)等与同种类型的液体的其他部分分离的一种类型(或混合在一起的少数类型)的有限体积的液体。液滴的体积可以有很大的范围-从几皮升(pl)到几百微升(ul)。液滴可以采取任意形状,比如球形、半圆顶、扁平圆形或不规则形状等。液滴的体积可以为1pl至100pl,优选10ul至10ul,更优选50ul至5ul。
术语“粒子”用于表示微米或纳米实体,无论是天然实体还是人工实体,比如细胞、亚细胞组分、病毒、脂质体、纳米球和微球或甚至更小的实体,比如大分子、蛋白质、dna、rna等以及与悬浮介质或液体中的气泡不混溶的液滴。“粒子”的尺寸范围从几纳米到几百微米。
术语“电润湿(electrowetting)”用于表示由于施加的电场引起的液体与固体表面之间的接触角的变化的效果。应该指出的是,当施加ac电压或电场时,存在电润湿效应和介电电泳效应。随着ac电压或电场的频率增加,与电润湿效应相比,介电电泳效应将更加明显。目的并非严格区分电润湿效应和介电电泳效应。
术语“电泳”用于表示悬浮在液体介质或凝胶中的带电粒子在空间均匀电场的影响下受力的现象。电泳是实验室中使用的一种技术,用于根据分子大小和电荷分离并分析大分子(dna、rna和蛋白质)及其片段。
术语“介电电泳(dep)”用于表示中性粒子在经受非均匀电场时受力的现象。当悬浮在液体介质中的粒子暴露于非均匀电场时,它会受力,这个力使该粒子移动到较高电场区域(正介电电泳)或较低电场区域(负介电电泳)。与电泳不同,介电电泳力不需要粒子带电。介电电泳力也对电场的极性不敏感。介电电泳的效果可以在ac(时变)和dc(非时变)电场中进行。在存在非均匀电场的情况下,所有粒子都表现出介电电泳活性。介电电泳力的强度取决于粒子的大小和形状、介质和粒子的电性质以及电场的频率。
出于本公开的目的,短语“液滴微流体装置”和“数字微流体装置”可互换使用以表示以离散形式(即液滴)处理液体的微流体装置。液滴可以被单独操作。
出于本公开的目的,短语“微流体装置”和“微流体芯片”可互换使用,以表示以微升级别或更小的水平处理液体的装置。
本发明提供了用于检测样品溶液中的目标被分析物的装置和方法。如本领域技术人员所理解的,样品溶液可包括但不限于体液(包括但不限于血液、血清、唾液、尿液等)、经纯化的样品(比如经纯化的dna、rna、蛋白质等)、环境样品(包括但不限于水、空气、农业样品等)和生物战剂样品等。虽然体液可来自任何生物实体,但本公开内容对来自哺乳动物的体液(尤其是来自人的体液)更感兴趣。
出于本公开的目的,术语“扩增”是指可以增加目标被分析物的量或浓度的过程。实例包括但不限于聚合酶链式反应(pcr)及其变型(比如定量竞争性pcr、免疫pcr、逆转录酶pcr等)、链置换扩增(sda)、基于核酸序列的扩增(nasba)、环介导等温扩增(lamp)、依赖解旋酶的扩增(had)等。
出于本公开的目的,术语“层”和“膜”可互换使用以表示通常(但未必)平坦或大体平坦的身体结构,并且通常沉积在、形成、涂覆或以其他方式设置在另一结构上。
出于本公开的目的,术语“通信”(例如,第一部件与第二部件“通信”或“处于通信状态”)在本文中用于指示在两个或更多个部件或元件之间的结构、功能、机械、电气、光学或流体关系或其任何组合。因此,一个部件被描述为与第二部件通信的事实并不旨在排除下述可能性:附加的部件存在于第一和第二部件之间和/或可操作地与第一和第二部件相关联。
出于本公开的目的,应当理解,当给定部件(比如层、区域或基板)在本文中被称为设置或形成在另一部件“上”、“中”或“处”时,给定部件可以直接在该另一个部件上,或者替代性地,也可以存在中间部件(例如,一个或多个缓冲层、中间层、电极或触点)。将进一步理解,术语“设置在......上”和“形成在......上”可互换使用,以描述给定部件如何相对于另一个部件放置或定位。因此,术语“设置在......上”和“形成在......上”并不旨在引入与材料运输、沉积或制造的特定方法有关的任何限制。
出于本公开的目的,应当理解,当任何形式的液体(例如,液滴或连续体(无论是移动还是静止))被描述为在电极、阵列、矩阵或表面“上”、“处”或“上方”时,这种液体可以与电极/阵列/基质/表面直接接触,或者可以与被插设于液体与电极/阵列/基质/表面之间的一个或多个层或膜接触。
如本文所用,术语“试剂”描述了可用于与样品材料反应、稀释、溶剂化、悬浮、乳化、包封、相互作用或添加到样品材料中的任何材料。
如本文中所使用的,术语“电子选择器”描述了能够在有或没有中间电子装置的情况下将输出信号设置或改变到不同的电压或电流水平的任何电子装置。作为非限制性实例,微处理器连同一些驱动器芯片可用于在不同时间将不同电极设置在不同电压电位。
如本文所用,在“接地电极”或“接地电压”的上下文中的术语“接地”表示相应电极的电压被设定为零或基本接近零。
出于本公开的目的,术语“生物标记”是指可以用作生物体的特定疾病状态或一些其他生理状态或身体对治疗的反应的指示物的某物。生物标记可以是在(但不限于)血液中测量的蛋白质(蛋白质浓度反映疾病的存在或严重程度)、dna序列、被引入到生物体中作为检查器官功能或健康的其他方面的手段等的可追踪物质。
出于本公开的目的,术语“扩增”是指可以增加目标被分析物的量或浓度的过程。实例包括但不限于聚合酶链式反应(pcr)及其变型(比如定量竞争性pcr、免疫pcr、逆转录酶pcr等)、链置换扩增(sda)、基于核酸序列的扩增(nasba)、环介导等温扩增(lamp)、依赖解旋酶的扩增(had)等。
出于本公开的目的,术语“电子选择器”描述了能够在有或没有中间电子装置的情况下将输出信号设置或改变到不同的电压或电流水平的任何电子装置。作为非限制性实例,微处理器连同一些驱动器芯片可用于在不同时间将不同电极设置在不同电压电位。
“操纵”特别意味着包括以下操作之一和/或以下操作的组合:
1.选择,包括从含有多种类型粒子的样品中分离出特定类型的粒子;
2.重新排序,包括以不同于开头的顺序排列粒子。
3.联合,包括选择两种或多种类型的粒子并使它们靠近在一起直到彼此相互挤压,以使它们接触或将它们合并或将它们一个包括在另一个中。
4.分离,包括使最初彼此接触的粒子分离,彼此相隔一定距离,或均匀分布在介质中。
5.捕获(或集中),包括将粒子移动到装置上的特定位置,并将粒子保持在所述位置一段指定的时间。
出于本公开的目的,术语“检测”和“测量”可互换使用以表示确定物理量比如位置、电荷、温度、浓度、ph值、亮度和荧光等的过程。通常,至少一个检测器(或传感器)被用于测量物理量,并将其转换成可由仪器或人读取的信号或信息。可以在被测物体与传感器之间使用一个或多个部件,比如光学测量中的透镜、反射镜、光纤和滤光器,或电子测量中的电阻器、电容器和晶体管。另外,可以使用其他设备或部件来使得更容易或可能测量物理量。例如,当使用荧光强度来推断粒子浓度时,可以使用光源(比如激光或激光二极管)将粒子从其电子基态激发到电子激发态,电子激发态的粒子在返回到它们的基态时会发出荧光。传感器可以是光学测量中的ccd(电荷耦合器件)、apd、cmos相机、光电二极管和光电倍增管等,或电子测量中的运算放大器、模数转换器、热电偶和热敏电阻等。
可以同时或顺序地对来自多个产品的多个信号进行检测或测量。例如,光电二极管可以用于测量来自液滴中特定类型的粒子的荧光强度,同时通过电容测量感测液滴的位置。另外,检测器(或传感器)可以包括或可操作地连接到计算机,例如,该计算机具有用于将检测器信号转换成人或其他机器可以理解的信息的软件。例如,荧光强度信息被用于推断可以转换成粒子浓度的浓度。
焦耳加热,也被称为欧姆加热或电阻加热,是电流通过导体产生热量的过程。释放的热量与电流的平方成正比,使得
p=iv=i2r=v2/r
·p是从电能转换为热能的功率(每单位时间的能量),
·i是通过电阻器或其他元件的电流,
·v是元件上的电压降,
·r是电阻。
这种关系被称为焦耳第一定律或焦耳-伦兹定律(joule–lenzlaw)。焦耳加热与电流方向无关,与珀尔帖效应引起的加热不同。应该指出的是,公式中的电流(i)和电压(v)是有效值。当使用dc电压(或电流)时,有效电压(或电流)值与dc电压(或电流)值相同。当使用ac电压(或电流)源时,有效电压(或电流)是均方根(rms)值。例如,对于正弦ac波,rms值是峰值除以2的平方根;对于对称双极方波,rms值与峰值相同。
实际上,dc和低频ac信号都用于控制加热电极。用于控制加热电极的ac信号频率通常小于10mhz,并且优选地小于100khz,并且更优选地小于1khz。
加热元件的电阻可以为0.1欧姆至100,000欧姆,优选为1欧姆至10,000欧姆,更优选为10欧姆至1000欧姆。
出于本公开的目的,脉冲宽度调制(pwm)信号是具有可控脉冲宽度或占空比的方波信号(在导通和截止之间切换的信号)。术语“占空比”描述了“开启”时间与规则间隔或“时间段”的比例。占空比通常以百分比表示,100%表示完全开启,0%表示完全关闭。脉宽调制是一种常用的技术,用于使用数字输出控制模拟电路。
在电子学中,通路或via(垂直互连接入)是物理电子电路中的多层之间穿过一个或多个相邻层的平面的电连接。出于本公开的目的,通路是盖板中的小开口(非导电),小开口允许盖板的顶表面与加热电极之间的导电连接。
现在根据需要参考附图1-8说明所提供的加热电极的设计以及一些潜在的应用。
现在参照图1a、1b和1c,具有加热电极的液滴微流体装置(被标记为100)被示出为实现液滴d的热交换反应的优选实施方式。在该实施方式中,如图1a、1b和1c所示,液滴d被夹在下板(被标记为101)与上板(被标记为111)之间。术语“上”和“下”在本上下文中仅用于区分这两个平面101和111,而不是对平面101和111相对于水平取向的限制。通常,上板也被称为盖板,因为液滴控制电极(被标记为103)被设置在下板上。
用于制造下板或上/盖板的材料并不重要,只要设置电极或加热电极的表面是(或被制成)不导电的即可。该材料还应该足够刚性,使得下板和/或盖板一旦制成就可以基本上保持其原始形状。下板和/或盖板可以由(不限于)玻璃、陶瓷、石英或聚合物(诸如聚碳酸酯(pc)、聚对苯二甲酸乙二醇酯(pet)或环烯烃共聚物(coc))制成。
加热电极(被标记为113)的数量范围为1至1000,但优选为2至500,更优选为2至100。加热电极的宽度范围可以为约0.005mm至约200mm,但优选为约0.02mm至约100mm,更优选为约0.05mm至约50mm。加热电极的长度范围可以为约1mm至约1000mm,但优选为约5mm至约200mm,更优选为约10mm至约100mm。加热电极的形状可以是但不限于矩形、方形、锯齿形、蛇形和螺旋形等。
加热电极可以由任何导电材料制成,比如铂、铝、铜、铬和氧化铟锡(ito)等。
层104、114和116是介电材料的薄膜,该介电材料可以是但不限于teflon、cytop、su8、cep、parylenec和二氧化硅等。115是导电材料层,该导电材料可以是但不限于ito、铝、铜等。层115通常是电接地的。除了用作接地电极之外,电极115用作屏蔽层,以防止由加热电极113产生的可能的电场和/或磁场影响液滴的运动、形状、位置、粒子分布等。
应该指出的是,当设置覆盖介电层时,同一层上相邻电极之间的空间通常用介电材料填充。这些空间也可以留空或充满气体,比如空气或氮气。同一层上的所有电极以及不同层上的电极优选地是电隔离的。
图2a、2b、2c和2d示出了具有用于实现液滴d的热交换反应的加热电极的液滴微流体装置(标记为200)的另一个优选实施实施方式。装置200与装置100的不同之处在于,液滴控制电极203和205位于由介电材料层204隔开的两个不同层中。与装置100类似,在装置200中,加热电极(被标记为213)的数量范围为1至1000,但优选为2至500,更优选为2至100。加热电极的宽度可以为约0.005mm至约200mm,但优选为约0.02mm至约100mm,更优选为约0.05mm至约50mm。加热电极的长度可以为约1mm至约1000mm,但优选为约5mm至约200mm,更优选为约10mm至约100mm。加热电极的形状可以是但不限于矩形、方形、锯齿形、蛇形和螺旋形等。
加热电极可以由任何导电材料制成,比如铂、铝、铜、铬和氧化铟锡(ito)等。
层204、214和216是介电材料的薄膜,介电材料可以是但不限于teflon、cytop、su8、cep、parylenec和二氧化硅等。215是一层导电材料,该导电材料可以是但不限于ito、铝、铜等。层215是一层导电材料,该导电材料可以是但不限于ito、铝、铜等。层215通常电接地。除了用作接地电极之外,电极115用作屏蔽层,以防止由加热电极213产生的可能的电场和/或磁场影响液滴的运动、形状、位置、粒子分布等。
图3a和3b示出了加热电极及其连接的一些可能的设计。
在图3a中,加热电极1、2、3和4具有相同的电阻。它们串联连接,使得可以使用单个电流源为所有加热电极供电。每个加热电极产生相同的热量。加热电极6、7、8和9也串联连接,但它们具有不同的电阻值。当相同的电流通过它们时,不同的加热电极会产生不同的热量。在一些实施方式中,具有较高电阻值的加热电极可以产生更多热量。连接电极(31)通常被制成具有小得多的电阻,使得它们产生的热量在常规操作中是微不足道的。
在图3b中,加热电极1、2、3和4具有相同的电阻。它们并联连接。当在加热电极之间施加电压差(v1-v2)时,每个加热电极产生相同的热量。加热电极6、7、8和9也并联连接,但它们具有不同的电阻。当在它们上施加相同的电压差(v3-v4)时,不同的加热电极将产生不同的热量。具有较低电阻值的加热电极会产生更多的热量。连接电极(41、42、43和44)通常被制成具有小得多的电阻,使得它们产生的热量在常规操作中是微不足道的。
当适当地选择加热电极的电阻值时,在适当的电流或电压被施加到所述加热元件时,温度可以被控制到规定值。实际上,在向指定的加热电极施加电流或电压时,需要考虑其他加热电极的运行状态,尤其是相邻的加热电极的运行状态。但从理论上讲,这使得可以控制dmf装置的温度谱线,而无需闭环温度控制。
如前所述,虽然图3a和3b中所示的加热电极具有细长的矩形形状,但实际上它们可以采用许多不同的形状,比如:但不限于弯曲、z字形、螺旋形、锯齿形和蛇形等。
图4示出了液滴微流体装置的另一个实施例,除了结合了两个外部温度控制模块121和122之外,该液滴微流体装置与图1a、1b和1c中的装置100相同。在一些实施例中,121和122可以是温度控制模块,比如水或空气冷却块、珀尔帖加热器、电阻加热器等,或非接触式模块,比如微波加热和基于光子的加热固定装置。
值得一提的是,本文提出的装置中没有一个具有用于控制液滴或加热元件的有源元件,比如薄膜晶体管(tft)。目的是保持较低的制造成本,并使装置更可靠。
液滴微流体与集成温度控制相结合提供了许多优点。这是一些非限制性实施例。
实施例1
具有加热电极的高通量qpcr
本装置使得能够容易地分配许多反应液滴并将它们移动到具有用于热交换反应(如pcr)的特定温度谱线的区域。可以同时进行几百甚至几千个pcr反应。
作为实例,图5a示出了在液滴微流体装置中产生8个温度区域。圆圈代表pcr反应液滴。加热电极he1、he2和he3分别将左侧三个区域控制到温度设置t1、t2和t3;加热电极he4、he5和he6分别将中间的三个区域控制到温度设定t4、t6和t6;加热电极he7和he8分别将右侧的两个区域控制到温度设置t7和t8。区域1-3(温度值为t1、t2和t3)和区域4-6(温度值为t4、t5和t6)可以用于运行两个不同的三步pcr,其中dna变性、退火和延伸需要三个不同的温度。区域7和8(温度值在t7和t8)可以用于进行两步pcr,其中仅需要两个温度作为在相同温度下进行的退火和延伸。
图5b是在具有片上加热电极(on-chipheatingelectrode)的dmf装置上运行的两步qpcr数据。一层屏蔽电极被设置成覆盖加热电极。应该指出的是,屏蔽电极和加热电极位于由一层介电材料隔开的两个不同的层上。可以在没有屏蔽电极的情况下构建dmf装置。值得注意的是,当启用加热电极时,液滴操作成为问题。例如,一旦液滴移动到位于其中一个启用的加热电极下方的位置,就很难(有时不可能)使其背离该位置移动。
dbs-2000dnaanalyzer(由digitalbiosystems设计并制造的仪器)用于图5b中的液滴控制和荧光数据收集。加热电极的电阻约为200欧姆。反应液滴体积约为1.5ul。变性温度被设定为95℃,并且退火/延伸温度为60℃。
由于液滴通常具有厚度为几百微米或更小的圆盘形状,因此它达到温度平衡所需的时间非常短(小于一秒)。液滴也可以快速移动。因此,pcr反应在液滴微流体装置上运行得非常快。通过使用dbs-2000仪器,通常将pcr反应设计为:对于约2ul的液滴体积,每个温度循环时间小于20秒。在系统优化或更小的液滴的情况下,pcr反应可以更快地运行。
值得指出的是,可以使用具有类似设计的液滴微流体装置来实现数字pcr。通过稀释样品并使液滴变小,可以将样品分离成大量分区,并且在每个分区中单独进行反应。如前所述,可以在15分钟或更短时间内完成45个循环pcr。因此,本公开提出了用于数字pcr的新的和改进的平台。
实例2
在同一dmf装置上进行等温扩增和pcr
图6示出了dmf装置上的加热电极的示意性设计,使得加热电极he1将装置的左侧部分控制到温度(t1)(这适用于dna1的等温扩增)并且加热电极he2和he3将其他两个区域控制到温度(t2和t3)(这适用于两步pcrdna2)。
可以产生/分配用于等温扩增的反应液滴并移动到t1温度区域,并且产生/分配pcr反应液滴并移动到t2温度区域。在实验期间,区域t1中的液滴保持静止,并且t2区域中的液滴在t2与t3温度区域之间来回移动,使得可以执行pcr温度循环。可以在实验期间实时收集来自所有液滴的荧光,从而可以实现两个区域中dna的定量测量。
实施例3
利用加热电极的流通式pcr和熔解曲线分析
图7示出了dmf装置上的加热电极的示意性设计,使得温度区t1和t2重复(约40次),使得当液滴通过从左到右穿过区域进行时可以经历许多pcr温度循环(用于两步pcr)。也可以对三步pcr进行类似的设计。在装置的右侧,在装置上创建从t3(通常为50℃或更高)至t4(通常为95℃或更低)的温度梯度区域,使得可以对pcr扩增的液滴进行熔解曲线分析。
该装置可以被设计成液滴可以从装置左侧上的样品孔连续分配,并通过pcr区域移动,最终通过熔解曲线分析区,最后移动到右侧的废品孔中。
许多应用可以利用图7中的这种设计,其中之一是能够进行逮捕点法医分析。
人类基因组中有约30亿个碱基对-其中的大多数在不同人之间是相同的。然而,一小部分(小于0.5%)的人类dna序列不同,这些是法医学应用中使用的多态性序列。
用于法医dna纹印测试的dna序列是包含短串联重复序列或str段的非编码区。str是非常短的(通常2-5碱基对)dna序列,以直接头对尾的方式重复。例如,“gatagatagatagata”的16个碱基对序列将代表四聚体“gata”的4个头尾副本。str分析比较来自两个或更多个样品的dna的特定基因座(染色体区域)。这些差异允许区分个体,尽管人类共享绝大多数相同的dna。在刑事调查中,通常会对13个区域进行分析和比较以确定轮廓(profiles)。两个人拥有完全相同的十三个区域的可能性几乎是不可能的——概率不到十亿分之一。
str分析涉及从样品中的细胞中提取核dna,并提取dna的某些区域。目前,在提取的dna中找出str序列重复数的典型方法是通过pcr及后续凝胶电泳,这是一个漫长而昂贵的过程。本装置允许使用pcr进行str分析,然后进行熔解曲线测量[frenchdj,等,interrogationofshorttandemrepeatsusingfluorescentprobesandmeltingcurveanalysis:asteptowardsrapiddnaidentityscreening(使用荧光探针和熔解曲线分析对短串联重复序列进行审查:迈向快速dna同一性筛选的一步).forensicscienceinternational:genetics2(2008)333-339]——全部都在图7所示的同一装置上。由于片上pcr反应和熔解曲线测量可以快速完成并且实验室要求最低,因此本发明可以在逮捕点找到法医dna证据。
实例4
原始样品的qpcr分析
图8示出了从全血中提取dna样品并使用所述dmf装置分析dna样品的实例。在步骤s801中,向dmf装置装载患者全血样品和用于运行qpcr的试剂(包括dna引物、dna聚合酶、dntp等)。s802,从样品孔分配样品液滴,并将样品液滴移动到温度被控制在用于细胞热处理的特定值的装置上的区域。s803,通过将样品液滴的温度升高至约100℃一段短暂的时间(例如,30秒至40秒)来进行细胞裂解。s804,将样品液滴移动到使用磁珠进行dna提取的位置。s805,使用磁铁(dmf装置外部)将磁珠拖动到可以清洗磁珠的位置。s806,使用磁铁将磁珠移动到可以从磁珠上洗脱dna分子的位置。s807,移动含有洗脱的dna分子的上清液以与分配的pcr试剂液滴合并/混合,然后将混合液滴移动到可进行qpcr测量的温度区域。s808,将测量的液滴移动到装置上的废物存储位置。
图8仅显示了通过仅仅向所述dmf装置装载原料和相应的试剂进行生化分析的许多可能应用中的一种。dmf装置提供许多功能,比如从原料中提取被分析物,并对其进行检测。实例包括但不限于全血中的血液化学测量,比如血气、葡萄糖、电解质、尿素等;用于囊性纤维化诊断的汗液中的汗液电解质的测量;以及唾液中的白细胞介素1-β(il-1β)和白细胞介素8(il-8)等的测量(用于检测口腔鳞状上皮细胞癌);等等。
应该指出的是,与外部加热器相比,在dmf装置内使用加热电极提供了很大的优势,例如,为其他致动器(比如磁铁)节省了空间,并且清除激光激发和荧光检测之类的路径,仅举两个实例。
应该提到的是,上述实例和上述优点决不是穷举的。本发明的灵活性质可用于许多应用,并且与其他技术(比如具有外部温度控制的微流体装置)相比具有许多优点。
本申请中提及的所有印刷专利和出版物在此全部并入本文中。
虽然已经说明并描述了本发明的优选实施例,但是应该理解,在不脱离本发明的精神和范围的情况下,可以在其中进行各种改变。
上述实施例仅用于说明本发明的原理及其效果,并不用于限制本发明的范围。对于熟悉该技术领域的人,可以在不违反本发明的精神和范围的情况下进行各种修改和改变。因此,本发明仍然涵盖所有在本技术领域中具有常识的人在不脱离精神和技术指导的情况下的所有修改和变化。
- 还没有人留言评论。精彩留言会获得点赞!