一种用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂及其制备方法
1.本发明涉及化工与生物医药技术领域,具体而言,涉及一种用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂及其制备方法。
背景技术:
2.尿毒症(uremia)是各种晚期的慢性肾脏病(chronic kidney disease,ckd)共有的临床综合征,是指ckd导致的慢性肾功能衰竭进入终末阶段时出现的一系列临床表现所组成的综合征。尿毒症毒素是指随着肾功能的减退、肾脏对溶质的清除率下降时,在血液和组织中不断蓄积并具有毒性的一大组体内代谢的产物。欧洲尿毒症毒素工作组(eutox)根据其生化特性及清除方式将其分为三大类:1、水溶性、不与蛋白结合的小分子物质,分子质量通常小于500,如尿素、肌酐、尿酸等,此类物质容易被血液透析清除;2、中分子物质,分子质量通常大于500,如甲状旁腺素、β2‑
微球蛋白、瘦素等,此类物质常规血液透析清除效果不理想,部分物质可以通过大孔径(高通量)透析膜和腹膜透析等方式清除;3、蛋白结合类毒素,如硫酸吲哚酚、硫酸对甲酚、3
‑
羧基
‑4‑
甲基
‑5‑
丙基
‑2‑
呋喃丙酸(3
‑
carboxy
‑4‑
methyl
‑5‑
propyl
‑2‑
furanpropionic acid,cmpf)等,大多数透析方式对此类物质的清除效果较差。
3.蛋白结合类尿毒症毒素(protein bound uremic toxins,pbuts)是一种可与人血清白蛋白可逆性地结合,形成大分子复合物的毒素。目前已知有32种分子被认为是pbuts,约占尿毒症毒素的25%,大多数相对分子质量较小。pbuts主要来源于食物中的蛋白质降解,这些降解产物经肠道上皮细胞吸收及肝细胞进一步代谢后进入循环。pbuts与蛋白结合后导致蛋白自身分子结构、电荷甚至功能发生变化。有关研究表明,pbuts的游离、即未与蛋白结合形态是其造成机体组织毒性的主要因素。临床研究证实,随着ckd患者肾脏清除体内尿毒症毒素能力明显减退,高浓度的尿毒症毒素尤其是pbuts,是ckd患者首要死亡原因和最主要并发症心血管疾病(cardiovascular disease,cvd)发生及发展的重要因素。除此外,免疫功能紊乱、脏器纤维化、中枢神经系统异常、肾性骨病、肌无力等一系列尿毒症并发症也可由pbuts在体内的蓄积引起。
4.pbuts中比较有代表性的是硫酸吲哚酚(indoxyl sulfate,is)和硫酸对甲酚(p
‑
cresylsulphate,pcs),两者的相对分子质量分别为213.21和188.21,都属于小分子型的有机阴离子毒素。它们均来源于肠道细菌对膳食中氨基酸的发酵分解,其中色氨酸代谢为吲哚、酪氨酸和苯丙氨酸代谢为对甲酚,经肠道吸收、再经门静脉进入肝脏,在肝脏内经硫酸化等最终形成is和pcs。目前已证实在血液中,两者通过静电、偶极及范德华力等非共价键与白蛋白竞争结合于相同位点(sudlow siteⅱ),结合率均在90
‑
95%以上。经蛋白结合常数测定显示,is和pcs与白蛋白结合的亲和力属于中等强度,且该结合为可逆性结合,受血液的温度、ph值、稀释倍数及其内含离子和药物浓度的影响。体外实验和临床研究表明,两者均与慢性肾脏病、心血管疾病发生率以及全因死亡率显著相关,is可引发多种病理改变,
如促进肾性骨病的发生、引起血管内皮损伤等;pcs可降低内皮细胞粘附分子的表达,与维持性血液透析(mainte
‑
nance hemodialysis,mhd)患者高感染发生率、血管钙化等相关。
5.目前mhd是延长尿毒症患者生命主要替代方法,但临床研究显示,常规的低通量血液透析(low
‑
flux hemodialysis,lfhd)治疗可有效清除体内小分子毒素,高通量透析(high
‑
flux hemodialysis,hfhd)和腹膜透析(peritoneal dialysis,pd)对大多数中大分子毒素也有一定的清除效果,但对以is、pcs为代表的pbuts因其与蛋白结合、多室分布等特点均不能够进行有效清除,据报道临床对is、pcs的清除率lfhd在30%左右、hfhd则不超过35%,每周的清除效率不及肾脏的1/10,这将导致这些物质在体内的蓄积,引发相关并发症,影响血液透析的治疗效果,进而影响mhd患者的生活质量。
6.为了有效清除is、pcs等pbuts,临床发展并采用了其它一些血液净化手段,常见的有:1、增大透析膜孔径和超滤系数的超高通量血液透析(super
‑
flux hemodialysis,sfhd),可提高对is等的清除率,但患者损失白蛋白较多;2、综合血液透析的弥散机制与血液滤过的对流机制而形成的血液透析滤过(hemodiafiltration,hdf),可明显提高对中大分子毒素的清除率,但对pbuts的清除效果相关报道的结论并不一致,存在争论,对is、pcs的清除率整体不超过45%;3、应用吸附机制进行清除的血液灌流(hemoperfusion,hp),由于单一的hp对尿素和肌酐等小分子毒素的清除率不高,且本身纠正水、电解质及酸碱平衡紊乱的能力不足,常与常规hd联用以达到优势互补的效果,国内临床研究显示,hp联合hd可显著提高蛋白结合类毒素的清除效果,其中对is、pcs的清除率可达50%~60%,优于其它血液净化方式,尤其对结合力更强的cmpf等pbuts优势更为明显,长期hd+hp治疗可以使mhd患者蛋白结合类毒素维持在较低水平,并能改善mhd患者的生活质量。
7.hp是将患者的血液引入装有固态吸附剂的灌流器中,通过吸附作用,清除血液中透析不能清除的外源性或内源性毒素、药物或代谢废物的一种血液净化技术。它是最早用于临床清除各类尿毒症毒素的吸附模式,除尿毒症外,目前hp技术已在临床上应用于高胆红素血症、急性中毒、脓毒症、高脂血症、系统性红斑狼疮、重症肌无力等的治疗。hp中的固体吸附剂可能为球状颗粒、纤维束或膜等形态,其性能受吸附剂的比表面积、溶质相对分子质量、分子结构、温度、ph值等影响,最常用于治疗尿毒症患者的吸附材料为活性炭和树脂。
8.目前hd+hp清除pbuts的临床报道已见多例,使用的血液灌流器如珠海健帆ha系列、佛山博新mg系列等均为国产产品,其吸附材料为大孔吸附树脂,临床表明hd+hp可有效去除is、pcs、cmpf、马尿酸(hippuric acid,ha)、同型半胱氨酸hcy(homocysteine,hcy)、晚期糖基化终末产物(advanced glycation end products,ages)等pbuts,其中,ha130血液灌流器联合hd对is和pcs的整体清除率约为50%,mg150联合hd约为55%,明显优于hd、略优于hdf。另外,ha130联合hd对尿素氮(blood urea nitrogen,bun)和血肌酐(serum creatinine,scr)等小分子毒素的清除率约为60%,与hd相当;ha130联合hd对全段甲状旁腺素(intact parathyroid hormone,ipth)、mg350联合hd对β2‑
微球蛋白(β2‑
microglobulin,β2‑
mg)等中分子毒素分别有着40%左右的清除率,明显优于hd,但略低于hdf。可以看出,上述产品虽然取得了不错的临床治疗效果,但在继续提升pbuts清除能力、可同时清除中分子毒素这两方面还有改进的空间。
9.有鉴于此,特提出本发明。
技术实现要素:
10.本发明的一个目的在于提供一种用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂,其对硫酸吲哚酚、硫酸对甲酚等蛋白结合类毒素具有显著的清除效果,对β2‑
微球蛋白、维生素b
12
、肌酐、戊巴比妥钠等中大分子和小分子物质也有一定的清除能力,且安全性能和机械强度优异。
11.本发明的第二目的在于提供一种用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂的制备方法,该方法步骤简单、条件温和,有利于环保和成本的降低,得到的吸附剂在保持良好吸附性能的同时,具有较高的机械强度和良好的吸附动力学。
12.为了实现本发明的上述目的,特采用以下技术方案:
13.一种用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂,是具有酰胺基团的、以聚苯乙烯
‑
丙烯腈
‑
二乙烯苯为骨架的多孔树脂,所述多孔树脂具有印迹分子的印迹空穴;所述印迹分子包括蛋白结合类毒素和/或蛋白结合类毒素的相似物。
14.优选地,所述吸附剂中酰胺基团的含量为1.0~2.5mmol/g干树脂;
15.优选地,所述吸附剂的粒径为0.4~1.2mm;
16.优选地,所述吸附剂的含水量为50%~70%;
17.优选地,所述吸附剂的比表面积为700~900m2/g;
18.优选地,所述吸附剂的磨后圆球率≥90%;
19.优选地,所述蛋白结合类毒素包括硫酸对甲酚和硫酸吲哚酚中的至少一种;
20.优选地,所述蛋白结合类毒素的相似物包括对甲基苯磺酸和l
‑
色氨酸中的至少一种。
21.如上所述的用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂的制备方法,包括以下步骤:
22.(a)将油相与水相混合进行聚合反应,分离后得到树脂a;
23.所述油相包括苯乙烯、丙烯腈、二乙烯苯、致孔剂和过氧化苯甲酰;
24.所述水相包括明胶、氯化钠和水;
25.(b)向步骤(a)得到的树脂a中加入浓硫酸进行水解反应,得到树脂b;
26.(c)将所述印迹分子的乙醇溶液、所述树脂b、1,2
‑
二氯乙烷和无水三氯化铁混合进行交联
‑
印迹反应,得到用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂。
27.优选地,在步骤(a)中,所述油相主要由以下质量份数的组分组成:苯乙烯5~15份、丙烯腈5~15份、80%二乙烯苯70~90份、致孔剂100~150份和过氧化苯甲酰0.5~1.5份;
28.优选地,所述水相包括如下质量浓度的组分:明胶0.5%~2%和氯化钠5%~10%;
29.优选地,所述水相与所述油相的质量比为(2.5~4):1;
30.优选地,所述印迹分子与所述树脂b的质量比为(1~4):20;
31.优选地,所述无水三氯化铁与所述树脂b的质量比为(3
‑
8):20;
32.优选地,所述致孔剂包括组分a和组分b,所述组分a选自烷烃和/或芳香烃,所述组分b选自醇类和/或酯类;
33.优选地,所述组分a选自甲苯、乙苯、二甲苯、正庚烷和200#汽油中的至少一种;
34.优选地,所述组分b选自环己醇、异戊醇、正辛醇、十二醇和乙酸丁酯中的至少一种;
35.优选地,所述组分a的质量为所述致孔剂总质量的50%~70%。
36.优选地,在步骤(a)中,所述油相和所述水相初始的混合温度为48~52℃;
37.优选地,所述油相和所述水相混合后静置,再进行搅拌、加热及保温;
38.优选地,所述静置的时间为8~12min;
39.优选地,所述加热是以0.8~1.1℃/2min的速度升温至78~90℃;
40.优选地,在78~90℃保温4~12h。
41.优选地,在步骤(a)中,所述分离包括:将反应后的混合物进行固液分离,得到的树脂进行水洗、醇洗和筛分,得到树脂a;
42.优选地,所述水洗的温度为48~52℃。
43.优选地,在步骤(b)中,于20~25℃在树脂a中缓慢加入所述浓硫酸并进行搅拌,将反应后的混合物固液分离后,采用梯度浓硫酸对分离后的树脂进行洗涤,水洗至中性,干燥后得到树脂b。
44.优选地,所述于20~25℃在树脂a中缓慢加入所述浓硫酸并进行搅拌的时间为8~12h;
45.优选地,所述浓硫酸的浓度为90%~95%;
46.优选地,所述干燥后得到树脂b的干燥的温度为70~78℃;
47.优选地,干燥至所述树脂b的水分小于2%。
48.优选地,在步骤(c)中,将印迹分子的乙醇溶液、所述树脂b、1,2
‑
二氯乙烷的混合物进行搅拌溶胀,再加入无水三氯化铁并进行加热升温和保温,固液分离,得到用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂;
49.优选地,所述将印迹分子的乙醇溶液、所述树脂b、1,2
‑
二氯乙烷的混合物进行搅拌的温度为28~32℃,时间为1.8~2.2h;
50.优选地,所述树脂b的用量为20质量份;
51.优选地,所述印迹分子的醇溶液组成为:印迹分子1~4质量份和无水乙醇10~20体积份;
52.优选地,所述1,2
‑
二氯乙烷的用量为80~120质量份;
53.优选地,所述加热升温至65~80℃,保温时间为8~16h;
54.优选地,所述无水三氯化铁的用量为3~8质量份。
55.优选地,对步骤(c)中所述固液分离后的树脂进行乙醇洗和水洗,将树脂装柱,再用丙酮
‑
酸溶液洗涤,水洗至中性,干燥;
56.优选地,所述乙醇洗次数为2~3次,所述水洗次数为2~3次;每次用量为180~220质量份;
57.优选地,所述丙酮
‑
酸溶液是由体积比为(4.9~5.1):(3.9~4.1):1的丙酮、水和盐酸组成;
58.优选地,所述丙酮
‑
酸溶液的用量为8~12床体积。
59.与现有技术相比,本发明的有益效果为:
60.(1)本发明的血液灌流吸附剂,采用三元共聚引入极性基团,并与在悬挂双键后交
联反应基础上引入的印迹模板分子相互结合,洗脱后形成与硫酸吲哚酚、硫酸对甲酚等相匹配的分子印迹孔结构,可选择性提高对游离态pbuts的清除,效果明显。另外,树脂上残留的酰胺基增强了吸附剂的亲水性和生物相容性。
61.(2)本发明所提供的血液灌流吸附剂,通过悬浮聚合过程中混合致孔剂的使用引入20~50nm的介孔结构、悬挂双键后交联反应引入20nm以下的微孔结构,使得吸附剂在清除pbuts的同时,也保持了一定的对中大分子和小分子毒素的清除能力。而且多元的孔结构使得吸附剂在保持良好吸附性能的同时,具有较高的机械强度和良好的吸附动力学,毛细微孔的引入也改善了吸附剂的表面亲疏水性和血液相容性。悬挂双键后交联反应相比于市售的后交联型大孔吸附剂,步骤简单、条件温和,且减少了大量的有机溶剂的使用,有利于环保和成本的降低。
具体实施方式
62.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
63.根据本发明的一个方面,本发明涉及一种用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂,是具有酰胺基团的、以聚苯乙烯
‑
丙烯腈
‑
二乙烯苯为骨架的多孔树脂,所述多孔树脂具有印迹分子的印迹空穴;所述印迹分子包括蛋白结合类毒素和/或蛋白结合类毒素的相似物。
64.本发明的吸附剂对于硫酸吲哚酚、硫酸对甲酚等蛋白结合类毒素具有显著的清除效果,对β2‑
微球蛋白、维生素b
12
、肌酐、戊巴比妥钠等中大分子和小分子物质也有一定的清除能力,且安全性能和机械强度良好。
65.优选地,所述吸附剂中酰胺基团的含量为1.0~2.5mmol/g干树脂。
66.在一种实施方式中,所述吸附剂中酰胺基的含量为1.0~2.5mmol/g,还可以选择1.0mmol/g、1.1mmol/g、1.2mmol/g、1.3mmol/g、1.4mmol/g、1.5mmol/g、1.6mmol/g、1.7mmol/g、1.8mmol/g、1.9mmol/g、2mmol/g、2.1mmol/g、2.2mmol/g、2.3mmol/g、2.4mmol/g或2.5mmol/g。
67.优选地,所述吸附剂的粒径为0.4~1.2mm。
68.在一种实施方式中,所述吸附剂的粒径为0.4~1.2mm,还可以选择0.4mm、0.5mm、0.6mm、0.7mm、0.8mm、0.9mm、1.0mm、1.1mm或1.2mm。
69.优选地,所述吸附剂的含水量为50%~70%。
70.在一种实施方式中,所述吸附剂的含水量为50%~70%,还可以选择50%、52%、55%、57%、60%、62%、65%或70%。
71.优选地,所述吸附剂的比表面积为700~900m2/g。
72.在一种实施方式中,所述吸附剂的比表面积为700~900m2/g,还可以选择700m2/g、710m2/g、720m2/g、730m2/g、740m2/g、750m2/g、760m2/g、770m2/g、780m2/g、790m2/g、800m2/g、810m2/g、820m2/g、830m2/g、840m2/g、850m2/g、860m2/g、870m2/g、880m2/g、890m2/g或900m2/g。
73.优选地,所述吸附剂的磨后圆球率≥90%。
74.在一种实施方式中,所述吸附剂的磨后圆球率≥90%,还可以选择91%、92%、93%、94%、95%、96%、97%、98%或99%。
75.优选地,所述蛋白结合类毒素包括硫酸对甲酚和硫酸吲哚酚中的至少一种。
76.优选地,所述蛋白结合类毒素的相似物包括对甲基苯磺酸和l
‑
色氨酸中的至少一种。
77.根据本发明的另一个方面,本发明还涉及如上所述的用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂的制备方法,包括以下步骤:
78.(a)将油相与水相混合进行聚合反应,分离后得到树脂a;
79.所述油相包括苯乙烯、丙烯腈、二乙烯苯、致孔剂和过氧化苯甲酰;
80.所述水相包括明胶、氯化钠和水;
81.(b)向步骤(a)得到的树脂a中加入浓硫酸进行水解反应,得到树脂b;
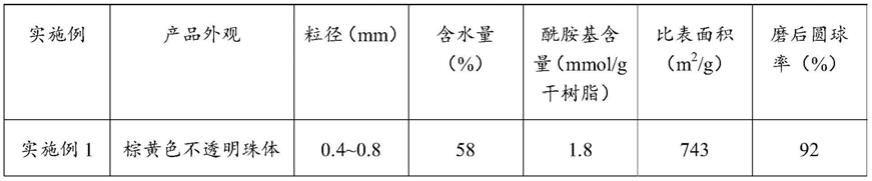
82.(c)将所述印迹分子的乙醇溶液、所述树脂b、1,2
‑
二氯乙烷和无水三氯化铁混合进行交联
‑
印迹反应,得到用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂。
83.本发明的制备方法步骤简单、条件温和,且减少了大量的有机溶剂的使用,有利于环保和成本的降低。
84.本发明的制备方法步骤(a)是正相悬浮聚合,得到聚苯乙烯
‑
丙烯腈
‑
二乙烯苯骨架的多孔白球;步骤(b)以浓硫酸对得到的多孔白球常温进行水解,得到含酰胺基的吸附树脂;步骤(c)悬挂双键后交联反应,并在反应过程中加入蛋白结合类毒素或结构类似的小分子物质作为印记模板,形成同时带有分子印迹空穴、微孔和介孔结构的新型血液灌流吸附剂,用于蛋白结合类尿毒症毒素的去除。
85.聚合过程通过单一或混合致孔剂使得吸附剂具备20~50nm的介孔结构,有利于分子量5000~20000的中大分子毒素的去除,并采用三元共聚引入可与印记模板分子相互作用的极性基团。悬挂双键后交联反应可增加20nm以下的微孔结构,提高对分子量500以下的小分子毒素的去除,在此基础上引入的印迹模板分子,可选择性提高对游离态蛋白结合类尿毒症毒素的吸附。
86.优选地,所述油相主要由以下质量份数的组分组成:苯乙烯5~15份、丙烯腈5~15份、80%二乙烯苯70~90份、致孔剂100~150份和过氧化苯甲酰0.5~1.5份。
87.在一种实施方式中,所述苯乙烯5~15份,还可以选择5份、6份、7份、8份、9份、10份、11份、12份、13份、14份或15份。
88.在一种实施方式中,所述丙烯腈5~15份,还可以选择5份、6份、7份、8份、9份、10份、11份、12份、13份、14份或15份。
89.在一种实施方式中,所述80%二乙烯苯70~90份,还可以选择70份、75份、80份、85份或90份。
90.在一种实施方式中,所述致孔剂100~150份,还可以选择100份、110份、120份、130份、140份或150份。
91.优选地,所述致孔剂包括组分a和组分b,所述组分a选自烷烃和/或芳香烃,所述组分b选自醇类和/或酯类。
92.优选地,所述组分a选自甲苯、乙苯、二甲苯、正庚烷和200#汽油中的至少一种。
93.优选地,所述组分b选自环己醇、异戊醇、正辛醇、十二醇和乙酸丁酯中的至少一种。
94.优选地,所述组分a的质量为致孔剂总质量的50%~70%。
95.在一种实施方式中,所述过氧化苯甲酰0.5~1.5份,还可以选择0.5份、0.6份、0.7份、0.8份、0.9份、1份、1.1份、1.2份、1.3份、1.4份或1.5份。
96.优选地,所述水相包括如下质量浓度的组分:明胶0.5%~2%和氯化钠5%~10%。
97.优选地,所述水相与所述油相的质量比为(2.5~4):1。
98.在一种实施方式中,所述水相与所述油相的质量比为(2.5~4):1,还可以选择2.5:1、3:1、3.5:1或4:1。
99.优选地,在步骤(a)中,所述油相和所述水相初始的混合温度为48~52℃。
100.在一种实施方式中,在步骤(a)中,所述油相和所述水相初始的混合温度为48~52℃,还可以选择48℃、49℃、50℃、51℃或52℃。
101.优选地,所述油相和所述水相混合后静置,再进行搅拌、加热及保温。
102.优选地,所述静置的时间为8~12min。
103.在一种实施方式中,所述静置的时间为8~12min,还可以选择8min、9min、10min、11min或12min。
104.优选地,所述加热是以0.8~1.1℃/2min的速度升温至78~90℃。
105.在一种实施方式中,所述所述加热是以1℃/2min的速度升温至78~90℃。
106.优选地,在78~90℃保温4~12h。
107.优选地,在步骤(a)中,所述分离包括:将反应后的混合物进行固液分离,得到的树脂进行水洗、醇洗和筛分,得到树脂a。
108.优选地,所述水洗的温度为48~52℃。
109.在一种实施方式中,所述水洗的温度为48~52℃,还可以选择48℃、49℃、50℃、51℃或52℃。
110.优选地,在步骤(b)中,于20~25℃在树脂a中缓慢加入所述浓硫酸并进行搅拌,将反应后的混合物固液分离后,采用梯度浓硫酸对分离后的树脂进行洗涤,水洗至中性,干燥后得到树脂b。
111.优选地,所述于20~25℃加入所述浓硫酸并进行搅拌的时间为8~12h。
112.优选地,所述浓硫酸的浓度为90%~95%。
113.优选地,所述干燥后得到树脂b的干燥的温度为70~78℃。
114.在一种实施方式中,所述干燥后得到树脂b的干燥的温度为70~78℃,还可以选择70℃、71℃、72℃、73℃、74℃、75℃、76℃、77℃或78℃。
115.优选地,干燥至所述树脂b的水分小于2%。
116.优选地,在步骤(c)中,将印迹分子的乙醇醇溶液、所述树脂b、1,2
‑
二氯乙烷的混合物进行搅拌溶胀,再加入无水三氯化铁并进行加热升温和保温,固液分离,得到用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂。
117.优选地,所述1,2
‑
二氯乙烷与所述树脂b的质量比为(80
‑
120):20。
118.优选地,所述印迹分子与所述树脂b的质量比为(1~4):20。
119.优选地,所述印迹分子与无水乙醇溶剂的质量/体积比为(1~4):(10~20)。
120.优选地,所述无水三氯化铁与所述树脂b的质量比为(3
‑
8):20。
121.优选地,所述将印迹分子的乙醇溶液、所述树脂b、1,2
‑
二氯乙烷的混合物进行搅拌的温度为28~32℃,时间为1.8~2.2h。
122.在一种实施方式中,所述将印迹分子的乙醇溶液、所述树脂b、1,2
‑
二氯乙烷的混合物进行搅拌的温度为28~32℃,还可以选择28℃、29℃、30℃、31℃或32℃。
123.在一种实施方式中,时间为1.8~2.2h,还可以选择1.8h、1.9h、2h、2.1h或2.2h。
124.优选地,所述加热升温至65~80℃,保温时间为8~16h。
125.优选地,所述树脂b的用量为20质量份。
126.优选地,所述印迹分子的醇溶液组成为:印迹分子1~4质量份和无水乙醇10~20体积份。
127.优选地,所述1,2
‑
二氯乙烷的用量为80~120质量份。
128.优选地,对步骤(c)中所述固液分离后的树脂进行乙醇洗和水洗,再用丙酮
‑
酸溶液洗涤,水洗至中性,干燥。
129.优选地,所述乙醇洗次数为2~3次,所述水洗次数为2~3次;每次用量为180~220质量份。
130.优选地,所述丙酮
‑
酸溶液是由体积比为(4.9~5.1):(3.9~4.1):1的丙酮、水和盐酸组成。
131.优选地,所述丙酮
‑
酸溶液的用量为8~12床体积。
132.在一种实施方式中,所述丙酮、水和盐酸的体积比为5:4:1;所述丙酮
‑
酸溶液的用量为10床体积。
133.下面将结合具体的实施例对本发明作进一步的解释说明。
134.实施例1
135.一种用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂的制备方法,包括以下步骤:
136.(a)聚合反应:将15质量份的苯乙烯、15质量份的丙烯腈、70质量份的80%二乙烯苯、50质量份的甲苯、50质量份的正辛醇、1.5质量份的过氧化苯甲酰(bpo)混合均匀配制成油相,50℃下投入预先配制好的含1%质量浓度的明胶、10%质量浓度的氯化钠的水相中,水相与油相的质量比为4:1;混匀后静置10min,开启搅拌,调节粒径至合适范围后,以1℃/2min的速度升温至90℃,保温12h;停止反应,抽干聚合母液,50℃水洗树脂至流出液澄清,常温下乙醇提取致孔剂后转至水相,湿态筛分得到0.4~1.2mm树脂,抽干游离水备用;
137.(b)水解反应:在上述步骤(a)得到的树脂中缓慢加入95%的浓硫酸,25℃搅拌下,反应12h;停止反应,抽干水解母液,以浓度由高到低的梯度硫酸对树脂进行洗涤,直至水洗中性;抽干游离水,将树脂晾干后,75℃下烘箱干燥至水分<2%,备用;
138.(c)后交联
‑
印迹反应:在20质量份的上述步骤(b)得到的树脂中加入80体积份的1,2
‑
二氯乙烷,再加入预先溶解了3质量份硫酸吲哚酚的20体积份无水乙醇,30℃搅拌下溶胀2h后,加入4质量份的无水三氯化铁,再升温至65℃反应10h;停止反应,抽干反应母液,依次用乙醇、水各洗涤树脂3次(每次200质量份),再将树脂装柱,用丙酮
‑
酸溶液(丙酮:水:盐酸=5:4:1,体积比)洗涤10bv后,纯水洗至中性;抽干游离水,制得成品。
139.实施例2
140.一种用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂的制备方法,包括以下步骤:
141.(a)聚合反应:将5质量份的苯乙烯、5质量份的丙烯腈、90质量份的80%二乙烯苯、100质量份的甲苯、50质量份的正辛醇、0.5质量份的bpo等混合均匀配制成油相,50℃下投入预先配制好的含0.5%质量浓度的明胶、5%质量浓度的氯化钠的水相中,水相与油相的质量比为3:1;混匀后静置10min,开启搅拌,调节粒径至合适范围后,以1℃/2min的速度升温至80℃,保温10h;停止反应,抽干聚合母液,50℃水洗树脂至流出液澄清,常温下乙醇提取致孔剂后转至水相,湿态筛分得到0.4~1.2mm树脂,抽干游离水备用;
142.(b)水解反应:在上述步骤(a)得到的树脂中缓慢加入90%的浓硫酸,25℃搅拌下,反应8h;停止反应,抽干水解母液,以浓度由高到低的梯度硫酸对树脂进行洗涤,直至水洗中性;抽干游离水,将树脂晾干后,75℃下烘箱干燥至水分<2%,备用;
143.(c)后交联
‑
印迹反应:在20质量份的上述步骤(b)得到的树脂中加入100体积份的1,2
‑
二氯乙烷,再加入预先溶解了2质量份硫酸吲哚酚的10体积份无水乙醇,30℃搅拌下溶胀2h后,加入6质量份的无水三氯化铁,再升温至80℃反应14h;停止反应,抽干反应母液,依次用乙醇、水各洗涤树脂3次(每次200质量份),再将树脂装柱,用丙酮酸溶液(丙酮:水:盐酸=5:4:1,体积比)洗涤10bv后,纯水洗至中性;抽干游离水,制得成品。
144.实施例3
145.一种用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂的制备方法,包括以下步骤:
146.(a)聚合反应:将5质量份的苯乙烯、15质量份的丙烯腈、80质量份的80%二乙烯苯、100质量份的正庚烷、50质量份的乙酸丁酯、0.5质量份的bpo混合均匀配制成油相,50℃下投入预先配制好的含1%质量浓度的明胶、10%质量浓度的氯化钠的水相中,水相与油相的质量比为4:1;混匀后静置10min,开启搅拌,调节粒径至合适范围后,以1℃/2min的速度升温至80℃,保温8h;停止反应,抽干聚合母液,50℃水洗树脂至流出液澄清,常温下乙醇提取致孔剂后转至水相,湿态筛分得到0.4~1.2mm树脂,抽干游离水备用;
147.(b)水解反应:在上述步骤(a)得到的树脂中缓慢加入95%的浓硫酸,20℃搅拌下,反应12h;停止反应,抽干水解母液,以浓度由高到低的梯度硫酸对树脂进行洗涤,直至水洗中性;抽干游离水,将树脂晾干后,75℃下烘箱干燥至水分<2%,备用;
148.(c)后交联
‑
印迹反应:在20质量份的上述步骤(b)得到的树脂中加入120体积份的1,2
‑
二氯乙烷,再加入预先溶解了3质量份硫酸对甲酚的15体积份无水乙醇,30℃搅拌下溶胀2h后,加入8质量份的无水三氯化铁,再升温至80℃反应16h;停止反应,抽干反应母液,依次用乙醇、水各洗涤树脂3次(每次200质量份),再将树脂装柱,用丙酮酸溶液(丙酮:水:盐酸=5:4:1,体积比)洗涤10bv后,纯水洗至中性;抽干游离水,制得成品。
149.实施例4
150.一种用于血液灌流去除蛋白结合类尿毒症毒素的吸附剂的制备方法,包括以下步骤:
151.(a)聚合反应:将5质量份的苯乙烯、10质量份的丙烯腈、85质量份的80%二乙烯苯、100质量份的甲苯、40质量份的十二醇、0.7质量份的bpo等混合均匀配制成油相,50℃下
投入预先配制好的含0.7%质量浓度的明胶、5%质量浓度的氯化钠的水相中,水相与油相的质量比为4:1;混匀后静置10min,开启搅拌,调节粒径至合适范围后,以1℃/2min的速度升温至85℃,保温10h;停止反应,抽干聚合母液,50℃水洗树脂至流出液澄清,常温下乙醇提取致孔剂后转至水相,湿态筛分得到0.4~1.2mm树脂,抽干游离水备用;
152.(b)水解反应:在上述步骤(a)得到的树脂中缓慢加入90%的浓硫酸,25℃搅拌下,反应10h;停止反应,抽干水解母液,以浓度由高到低的梯度硫酸对树脂进行洗涤,直至水洗中性;抽干游离水,将树脂晾干后,75℃下烘箱干燥至水分<2%,备用;
153.(c)后交联
‑
印迹反应:在20质量份的上述步骤(b)得到的树脂中加入120体积份的1,2
‑
二氯乙烷,再加入预先溶解了2质量份对甲基苯磺酸和2质量份l
‑
色氨酸的20体积份无水乙醇,30℃搅拌下溶胀2h后,加入6质量份的无水三氯化铁,再升温至70℃反应14h;停止反应,抽干反应母液,依次用乙醇、水各洗涤树脂3次(每次200质量份),再将树脂装柱,用丙酮酸溶液(丙酮:水:盐酸=5:4:1,体积比)洗涤10bv后,纯水洗至中性;抽干游离水,制得成品。
154.实验例
155.一、本发明中各实施例得到的吸附剂的基本指标,如表1所示;
156.表1吸附剂的基本指标
[0157][0158][0159]
本发明的方法制备得到的吸附剂外观为棕黄色至棕黑色不透明珠体,粒径为0.4~1.2mm,含水量为50%~70%,酰胺基含量为1.0~2.5mmol/g干树脂,比表面积700~900m2/g,磨后圆球率≥90%。
[0160]
二、各实施例得到的血液灌流吸附剂经火棉胶包膜后的体外吸附性能、安全性能,与市售灌流器中吸附剂性能的对比,结果如表2所示,其中硫酸吲哚酚、硫酸对甲酚、β2‑
微球蛋白为人体血液吸附,维生素b
12
、肌酐、戊巴比妥钠为标准溶液吸附。
[0161]
表2吸附性能和安全性能检测结果
[0162][0163]
本发明中聚合反应的交联度、致孔剂的用量及配比、丙烯腈的用量、过氧化苯甲酰的用量、聚合反应的温度和时间、后交联反应的温度和时间、无水三氯化铁的用量、印迹模板分子的用量及配比等因素对吸附剂的结构和吸附性能有着明显的影响。
[0164]
本发明实施例中的吸附剂对硫酸吲哚酚去除率≥55%、硫酸对甲酚去除率≥60%、β2‑
微球蛋白去除率≥82%、维生素b
12
(模拟中分子)去除率≥95%、肌酐去除率≥65%、戊巴比妥钠(模拟小分子)去除率≥98%。红细胞、白细胞、血小板下降率均≤10%,总蛋白吸附率≤15%。
[0165]
本发明的吸附剂对硫酸吲哚酚和硫酸对甲酚的去除率明显高于市售ha系列和mg系列血液灌流器所用的吸附剂,β2‑
微球蛋白去除率略高于ha吸附剂、肌酐去除率明显高于mg吸附剂。
[0166]
通过分子印迹技术,吸附剂对硫酸吲哚酚、硫酸对甲酚的清除能力大大提升,明显高于市售产品,推测其机理为对游离态pbuts的选择性吸附引起pbuts与白蛋白逐步解离,从而进一步被吸附剂的微孔部分吸附。
[0167]
分别通过一次聚合添加合适的致孔剂以及二次后交联程度的控制,使得吸附剂具有适宜的介孔结构且增加了大量的微孔结构,可同时保持对中大分子和小分子毒素的良好清除效果,优于部分市售产品。
[0168]
体外安全性能同市售产品相当,下一步可考虑进行吸附剂的优化、放大,用于动物实验和临床试验的考察。
[0169]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1