检测生物活性的方法与流程
检测生物活性的方法本申请是申请日为2011年10月28日、申请号为201180052850.0(国际申请号为PCT/US2011/058212)、发明名称为“检测生物活性的方法”的发明专利申请的分案申请。相关申请的交叉引用本专利申请要求均于2010年11月1日提交的美国临时专利申请No.61/408,966和61/408,977的优先权,这两篇临时专利申请的全文以引用方式并入本文。
背景技术:
用于检测样品中的细胞(如病原微生物或癌细胞)的方法通常涉及检测已知与该特定细胞相关的生物活性(如酶活性或生化途径)。通常,使用指示系统来活性,该指示系统通过生物活性转变成一种生物衍生物。一些方法采用两种指示系统来检测特定类型的细胞。例如,检测大肠杆菌的方法可包括第一指示系统,该第一指示系统包含与一种pH指示剂配合的乳糖。乳糖向有机酸的发酵指示存在着大肠杆菌成员(其包括大肠杆菌和其他肠道微生物)。这些方法还包括第二指示系统,例如4-甲基伞形酮酰-β-D-葡糖醛酸,其用于检测酶β-葡糖苷酸酶(一种存在于大多数大肠杆菌中的酶)。因此,在采用两种指示系统的方法中,来自乳糖的酸性终产物的积聚连同荧光化合物(4-甲基伞形酮)的积聚可表明样品中存在大肠杆菌。在样品中检测到特定生物活性可能表明该样品中存在活细胞。例如,细菌孢子包含可用于方法(如包括快速方法)中的生物活性(如酶活性,例如α-吡喃葡萄糖苷酶或β-吡喃葡萄糖苷酶),这可用来检测样品中活孢子的存在。这些或其他生物活性之一的破坏情形可用于验证和/或确认灭菌处理的功效。
技术实现要素:
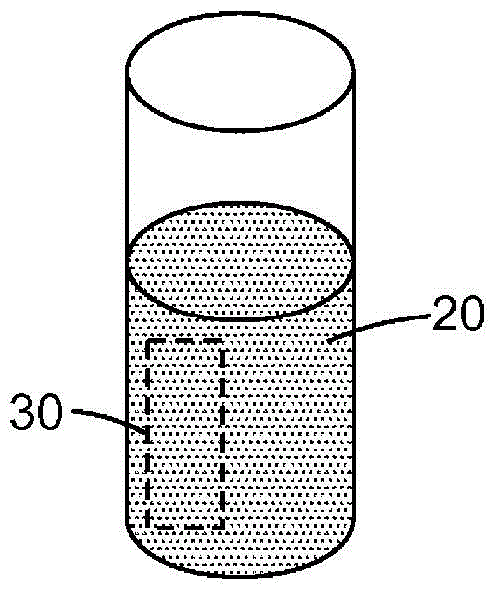
本发明总体上涉及检测样品中生物活性的方法。本发明的方法提供具有至少两种(即“第一”和“第二”)指示试剂的检测生物活性的办法。该方法提供对反应混合物中第二指示试剂的生物衍生物的快速灵敏检测,该反应混合物初始时包含足够高浓度的干扰检测生物衍生物的第一指示试剂。在一个方面,本发明提供检测生物活性的方法。该方法可包括提供:样品,该样品包含一种或多种预定生物活性源;第一指示系统,该第一指示系统包含具有第一吸收光谱的第一指示试剂;第二指示系统,该第二指示系统包含通过第二预定生物活性转化成具有第二发射光谱的第二生物衍生物的第二指示试剂;和底物,该底物接纳和聚集来自水性混合物的第一指示试剂。第一指示试剂可藉第一预定生物活性转化成第一生物衍生物。第一吸收光谱可在第二发射光谱的至少一部分波段上有可被检测出的吸光度。该方法还可包括形成第一水性混合物,该第一水性混合物包含样品、第一指示试剂和第二指示试剂。该方法还可包括使第一水性混合物与底物流体连通以形成第二水性混合物,第二水性混合物中的第一指示试剂的浓度低于第一水性混合物中的第一指示试剂的浓度。该方法还可包括检测第二生物衍生物中荧光的存在或不存在。在一些实施例中,检测第二生物衍生物中荧光的存在或不存在可包括检测第二水性混合物中荧光的存在或不存在。在一些实施例中,该方法还可包括观察底物以检测第一指示试剂或第一生物衍生物。在以上实施例的任一个中,第一水性混合物中第一指示试剂的浓度可足以抑制对原本具有可检出量的第二生物衍生物的检出。在以上实施例的任一个中,该方法还可包括提供营养物质以有利于生物细胞的生长,其中形成第一水性混合物包括形成包含营养物质的混合物。在以上实施例的任一个中,该方法还可包括使该生物活性暴露于灭菌剂。灭菌剂可选自蒸汽、环氧乙烷、过氧化氢、甲醛和臭氧。在以上实施例的任一个中,第一指示试剂可包含发色团,其中检测第一试剂的生物衍生物即成为检测颜色。在以上实施例的任一个中,第一指示试剂可包含发色指示试剂。在以上实施例的任一个中,所述第一指示试剂可包含pH指示试剂或酶底物。在一些实施例中,所述第一指示试剂可包含溴甲酚紫。在以上实施例的任一个中,所述第二指示试剂可包含发荧光化合物。该发荧光化合物可包含发荧光酶底物。在以上实施例的任一个中,检测第二生物衍生物的存在或不存在还包括测量第二生物衍生物的量。在以上实施例的任一个中,检测第一生物衍生物的存在或不存在还包括测量第一生物衍生物的量。在以上实施例的任一个中,该方法还可包括提供检测第一指示试剂或第二指示试剂的生物衍生物的仪器和使用该仪器来检测第一指示试剂或第二指示试剂的生物衍生物。在一些实施例中,该方法还可包括提供检测第一指示试剂或第二生物衍生物的仪器和使用该仪器来检测第一指示试剂或第二生物衍生物。在一些实施例中,该方法还可包括提供检测第一指示试剂和第二生物衍生物的仪器和使用该仪器来检测第一指示试剂和第二生物衍生物。在另一个方面,本发明提供检测生物活性的方法。该方法可包括提供壳体、容器、第二预定生物活性源和底物。壳体可包括第一室和第二室。容器可容纳第一含水液体。容器可设置在第一室中。容器的至少一部分可能易碎。第一含水液体可包含:第一指示系统,该第一指示系统包含具有第一吸收光谱的第一指示试剂;和第二指示系统,该第二指示系统包含藉预定生物活性转化成具有第二发射光谱的第二生物衍生物的第二指示试剂,其中第一吸收光谱在第二发射光谱的波长的至少一部分上有可检测的吸光度。第一指示试剂能通过第一预定生物活性转化成第一生物衍生物。预定生物活性源可设置在第二室中。底物可设置在壳体中并从第一含水液体中接纳和富集第一指示试剂。该方法还可包括使第一水性混合物与底物流体连通以形成第二水性混合物,第二水性混合物中的第一指示试剂的浓度低于第一水性混合物中的第一指示试剂的浓度。该方法还可包括检测第二生物衍生物中荧光的存在或不存在。在一些实施例中,检测第二生物衍生物中荧光的存在或不存在可在于检测第二水性混合物中荧光的存在或不存在。在一些实施例中,使第一水性混合物与底物流体连通以形成第二含水液体可包括打破易碎容器的至少一部分。在一些实施例中,生物灭菌指示器还可包括设置在壳体中的破碎装置,其中破碎易碎容器包括促使容器和破碎装置相挤压。在一些实施例中,生物灭菌指示器的壳体可包括第一部分和第二部分。第二部分可适于连接到第一部分,当连接至第一部分时,第二部分能够相对于第一部分在第一位置和第二位置之间移动。该方法还可包括将壳体的第二部分从第一位置移动至第二位置。在另一个方面,本发明提供检测预定生物活性的系统。该系统可包括:第一指示系统,该第一指示系统包含具有第一吸收光谱的第一指示试剂;第二指示系统,该第二指示系统包含藉预定生物活性转化成具有第二发射光谱的第二生物衍生物的第二指示试剂;器皿,该器皿被构造用于容纳液体介质;底物,该底物接纳和富集来自水性混合物的第一指示试剂;和仪器-被构造用于接纳器皿和检测第一指示试剂或第二指示试剂的生物衍生物。第一指示试剂能通过第一预定生物活性转化成第一生物衍生物。第一吸收光谱在第二发射光谱波段的至少一部分上有可检测的吸光度。在一些实施例中,该仪器可被构造用于检测第一生物衍生物。在一些实施例中,该系统还包括处理器。在该系统的以上实施例的任一个中,该仪器还可被构造用于调节液体介质的温度。在该系统的以上实施例的任一个中,该仪器可被构造用于检测第一指示试剂和第二生物衍生物两者。词语“优选的”和“优选地”是指在某些情况下可以提供某些有益效果的本发明的实施例。然而,在相同的情况或其他情况下,其他实施例也可为优选的。此外,对一个或多个优选实施例的表述并不暗示其他实施例是不可用的,且并非意图将其他实施例排除在本发明范围之外。当术语“包括”和其变型出现在说明书和权利要求书中时,这些术语不具有限制性含义。本文所用的“一种(个)”、“所述(该)”、“至少一种(个)”以及“一种或多种(一个或多个)”可互换使用。因此,例如,底物可解释为表示“一种或多种”底物。术语“和/或”意指所列要素的一个或全部,或所列要素的任何两个或两个以上的组合。如本文所用,“生物活性”是指与生物细胞相关的任何特定催化过程或一组过程。生物活性的非限制性实例包括分解代谢酶活性(如碳水化合物发酵途径)、合成代谢酶活性(如核酸、氨基酸或蛋白的合成途径)、偶联反应(如代谢途径)、生物分子介导的氧化还原反应(如电子传递体系)和生物荧光反应。“预定”生物活性意指所述方法针对特定的生物过程(如酶反应)或一组生物过程(如生化过程)的检测。本领域的普通技术人员会理解,某些预定生物活性可与特定类型的细胞(如癌细胞或微生物)或病理过程相关。如本文所用,“生物衍生物”是指某生物活性的产物。其包括,例如,酶反应和生物电子传递体系的产物。如本文所用,“生物分子”可为天然存在于活生物体中的任何化合物,以及此类天然存在的化合物的衍生物或片段。生物分子主要由碳和氢以及氮、氧、磷和硫组成。有时也含有其他元素,但很不常见。生物分子包括(但不限于)蛋白质、多肽、碳水化合物、多糖、脂质、脂肪酸、类固醇、前列腺素、环前列腺素、维生素、辅因子、细胞因子和核酸(包括DNA、RNA、核苷、核苷酸、嘌呤和嘧啶)、由活生物体产生的代谢产物(包括例如抗生素和毒素)。生物分子也可包括天然存在的生物分子的衍生物,如已用化学品改性(如用高碘酸钠氧化)的蛋白质或抗体。生物分子也可包括交联的天然存在的生物分子,或天然存在的生物分子与化学物质的交联产物。因此,“生物分子”包括但不限于未改性的和改性的分子(如糖基化的蛋白质、氧化的抗体)及其片段(如蛋白质片段)。生物分子的片段可包括源于例如由于化学处理、酶处理或照射处理而水解的那些。另外,本文通过端点表述的数值范围包括所述范围内包含的所有数值(如,1到5包括1、1.5、2、2.75、3、3.80、4、5等)。本发明的上述发明内容并不意图描述本发明的每个公开的实施例或每种实施方式。以下描述更具体地举例说明了示例性实施例。在整个申请的若干地方,通过实例清单提供了指导,所述实例可以按多种组合方式来使用。在各种情形下,所列举的清单仅仅作为代表性群组,而不应被理解为排他性清单。附图说明图1A为底物和容纳包含指示试剂的液体介质的器皿的顶部透视图。图1B为将图1A的底物刚刚浸没到液体介质中之后的图1A的器皿的顶部透视图。图1C为过了一段时间后图2A的器皿的顶部透视图。图2为溴甲酚紫的水溶液的紫外可见吸收光谱和4-甲基伞形酮的溶液的荧光发射光谱的示图。图3为根据本发明检测生物活性的方法的一个实施例的框图。图4为根据本发明的一个实施例的生物灭菌指示器的前透视图,该生物灭菌指示器包括壳体,壳体包括第一部分和第二部分。图5为图4的生物灭菌指示器的后部透视图。图6为图4-5的生物灭菌指示器的前分解图。图7为沿图4的线条4-4截取的图4-6生物灭菌指示器的侧剖视图,该生物灭菌指示器以第一状态示出,即生物灭菌指示器的壳体的第二部分被示出处于第一位置。图8为沿图6的线条5-5截取的图4-6的生物灭菌指示器的俯视剖视图。图9为图4-8的生物灭菌指示器的侧剖视图,该生物灭菌指示器以第二状态示出,即生物灭菌指示器的壳体的第二部分被示出处于第二位置。图10为图4-9的生物灭菌指示器的俯视剖视图,其中为清楚起见除去了一些部分。具体实施方式本发明涉及用于检测生物活性的快速方法。该方法包括使用两种或更多种指示试剂。该方法包括提供液体混合物,该液体混合物包含第一指示试剂和第二指示试剂,其中第一指示试剂在混合物中的存在浓度足以干扰对第二指示试剂的原本可检测的生物衍生物的检测(如光学检测)。本发明的方法通过将干扰量的第一指示试剂的至少一部分从液体混合物母液中析离出来,以有利于检测第二指示试剂的生物衍生物,从而提供对生物活性的快速灵敏检测。该方法还提供更易于观察第一指示试剂或其生物衍生物的装置。本发明的方法可用于自动化检测生物活性的系统。本发明的系统和/或本发明的方法可用于检测生物活性(如与酶、细胞或微生物相关的活性)。在一些实施例中,本发明的系统和/或方法可用于例如检测与特定类型的微生物(如营养性细胞或孢子)相关的生物活性(该生物活性经暴露于一定处理,如消毒处理、食品或饮料制备处理、灭菌处理后仍然存在)。本发明的方法涉及检测样品中的生物活性。样品可为包括如本文所述的生物活性的任何样品。合适样品的非限制性实例包括细胞(如哺乳动物细胞、昆虫细胞、酵母细胞、丝状真菌、细菌细胞)的悬浮液或培养物、环境样品(如表面拭子)、食品(如原材料、加工过程中的样品和成品样品)、饮料、临床样品(如血液、尿液、痰液、组织、粘液、粪便、伤口渗出物、脓液)和水(如地表水、饮用水、工业用水)。微生物(如细菌、真菌、病毒)为生物活性源并且可在来源于诸如以下的任何来源的试验样品中分析:生理流体如血液、唾液、眼球水晶体流体、滑液、脑脊髓液、脓液、汗液、渗出物、尿液、黏液、乳汁等。此外,试验样品可源自身体部位,如伤口、皮肤、鼻孔、头皮、指甲等。特别值得关注的样本包括含黏液的样本,如鼻样本(来自如前鼻孔、鼻咽腔、鼻腔、鼻前庭等)以及来自外耳、中耳、口、直肠、阴道或其他类似组织的样本。具体的粘膜组织的实例包括口腔、齿龈、鼻、眼、气管、支气管、胃肠、直肠、尿道、输尿管、阴道、子宫颈和子宫的粘膜。除了生理流体外,其他测试样品可包括其他液体以及溶于液体介质的固体。所关注的样品可包括工艺流、水、土壤、植物或其他植被、空气、表面(如被污染的表面)等。样品还可包括经培养的细胞。样品还可包括装置上或装置中的样品,包括细胞、孢子或酶(如生物指示器装置)。固体样品可(如通过混合、超声处理、均质化)粉碎并且可悬浮于液体(如水、缓冲液、肉汤)中。在一些实施例中,容纳样品材料的样品收集装置(如拭子、海绵)可用于所述方法中。或者,可将样品材料从样品收集装置中洗脱(如冲洗、刮擦、挤出),然后将样品材料用于所述方法中。在一些实施例中,液体或固体样品可稀释于液体(如水、缓冲液、肉汤)。合适样品还可以是曾暴露于灭菌剂的液体和/或固体样品。这些样品的非限制性实例包括孢子悬浮液、孢子条和上面已施加孢子或营养性微生物细胞的悬浮液的各种材料的试样块。合适样品还包括细胞悬浮液介质(如培养肉汤、半固体细胞培养基和组织培养基、滤液),该细胞悬浮液介质包含细胞或此前包含的细胞。合适样品还包括细胞裂解液。可通过化学方式(如清洁剂、酶)、机械方式(声振动、均质化、弗氏压碎器)或其他本领域已知的细胞裂解方式来制备细胞裂解液。图1A至1C示出根据本发明将指示试剂(或其生物衍生物)从液体介质接纳和富集到底物上或底物中的方法。图1A示出底物30和容纳包含显色指示试剂的液体混合物20的器皿10的一个实施例的顶部透视图。图1B示出将底物30立即浸没到液体混合物20中之后的图1A的器皿10的顶部透视图。图1C示出足以允许使底物30接纳和富集来自液体混合物20的显色指示试剂的一段时间后的图1B的器皿10的顶部透视图。从图1C中可看出,液体混合物的颜色已经变淡,而底物30已接纳并保留住了显色指示试剂,因此其从初始的无色状态转变成有色状态。在一些实施例中,底物可被动地接纳和富集指示试剂或其生物衍生物(如将试剂或衍生物通过液体介质简单扩散)。作为另外一种选择或附加做法(未示出),底物可主动地接纳和富集指示试剂和/或生物衍生物(如底物可通过混合或翻转而相对于液体移动和/或液体介质可通过流体流而相对于底物移动,该流体流大致侧向于、正切于或正交于底物的主表面)。指示试剂现有技术包括各种来源的多种铬和发荧光酶底物,这些铬和发荧光酶底物已知可商购获得,已经用于检测预定生物活性的方法中,并且适于用作根据本发明的第一指示试剂或第二指示试剂。其中包括多种发荧光4-甲基伞形酮酰衍生物(可水解成4-甲基伞形酮);7-酰胺基-4-甲基-香豆素的衍生物,如英国专利No.1,547,747和欧洲专利No.0,000,063中所公开,其中每篇专利均以引用的方式全文并入本文中;双乙酰荧光素衍生物;和荧光胺。根据本发明,第一指示试剂包含具有第一吸收光谱的试剂,因此其吸收电磁波谱的紫外线和/或可见波长中的光。在一些实施例中,第一指示试剂可为指示剂染料(如pH指示剂染料、氧化还原染料)。用于检测任何给定生物活性的具体指示剂染料将根据本领域中已知的标准进行选择,这些标准包括例如与待检测生物活性的相容性(如优选的非抑制性)、溶解度、检测系统(如目视和/或自动)。在所述方法的实施例的任一个中,指示剂染料可为适于检测生物活性的pH指示剂。指示剂染料可根据本领域中已知的标准进行选择,这些标准包括例如pH范围、与生物活性的相容性和溶解度。在一些实施例中,可使用pH指示剂的盐形式(例如)以提高pH指示剂在水性混合物中的溶解度。合适pH指示剂染料的非限制性实例包括例如百里酚蓝、金莲橙OO、甲基黄、甲基橙、溴酚蓝、溴甲酚绿、甲基红、溴百里酚蓝、酚红、中性红、酚酞、百里酚酞、茜素黄、金莲橙O、硝基胺、三硝基苯甲酸、百里酚蓝、溴酚蓝、四溴苯酚蓝、溴甲酚绿、溴甲酚紫、甲基红、溴百里酚蓝、酚红、刚果红和甲酚红。在所述方法的实施例的任一个中,指示剂染料可为适于检测生物活性的氧化还原指示剂(也称为氧化还原指示剂)。氧化还原指示剂染料可为pH依赖性或pH非依赖性的。氧化还原指示剂染料的非限制性实例包括2,2'-二吡啶(Ru络合物)、硝基菲咯啉铜(Fe络合物)、N-苯氨茴酸、1,10-菲咯啉(Fe络合物)、N-乙氧基柯衣定、2,2`-二吡啶(Fe络合物)、5,6-二甲基菲咯啉(Fe络合物)、邻联茴香胺、二苯胺磺酸钠、二苯基联苯胺、二苯胺、紫罗碱、2,6-二溴苯酚靛酚钠、2,6-二氯苯酚靛酚钠、邻甲酚靛酚钠、硫堇(合成劳思氏紫)、亚甲蓝、靛蓝四磺酸、靛蓝三磺酸、靛蓝二磺酸、靛蓝一磺酸、酚藏花红、藏红T和中性红。在一些实施例中,第一指示试剂可为磺酞pH指示剂(如溴甲酚紫),如实例4所示。磺酞pH指示剂(如溴甲酚紫)可以约0.03g/升的浓度存在于水性混合物中。可磺酞pH指示剂可被底物(如,带电荷的尼龙底物,例如MAGNAPROBE0.45微米带电荷的尼龙膜,产品编号NP0HY00010,得自明尼苏达州明尼唐卡(Minnetonka,MN)的GEOsmonicsLabstore)接纳和富集。底物可被构造成大致平坦的条带(如约3mm×约10mm的条带)。根据本发明,第二指示试剂可转化成第二生物衍生物。第二生物衍生物包含具有第二吸收光谱的试剂。此外,第二生物衍生物具有特征性的第二发射光谱(如荧光发射光谱)。在一些实施例中,第二生物衍生物具有特征性第二吸收光谱,该第二吸收光谱包括含电磁能量谱的紫外线部分中的波长。第二生物衍生物的第二发射光谱可包括电磁能量谱的可见光区的波长。适于用作第二指示试剂的化合物包括发荧光化合物(如发荧光酶底物)。发荧光酶底物包括4-甲基伞形酮酰衍生物、7-酰胺基-4-甲基香豆素衍生物和双乙酰荧光素衍生物。合适的4-甲基伞形酮酰衍生物包括例如:4-甲基伞形酮酰-2-乙酰胺基-4,6-O-亚苄基-2-脱氧-β-D-吡喃葡萄糖苷;4-甲基伞形酮酰乙酸酯;4-甲基伞形酮酰-N-乙酰基-β-D-氨基半乳糖苷;4-甲基伞形酮酰-N-乙酰基-α-D-氨基葡糖苷;4-甲基伞形酮酰-N-乙酰基-β-D-氨基葡糖苷;2'-(4-甲基伞形酮酰)-α-D-N-乙酰神经氨酸;4-甲基伞形酮酰α-L-阿拉伯呋喃糖苷;4-甲基伞形酮酰α-L-阿拉伯糖苷;4-甲基伞形酮酰丁酸酯;4-甲基伞形酮酰β-D-纤维二糖糖苷;甲基伞形酮酰β-D-N,N'二乙酰基壳二糖糖苷;4-甲基伞形酮酰反油酸脂;4-甲基伞形酮酰β-D-岩藻糖苷;4-甲基伞形酮酰α-L-岩藻糖苷;4-甲基伞形酮酰β-L-岩藻糖苷;4-甲基伞形酮酰α-D-半乳糖苷;4-甲基伞形酮酰β-D-半乳糖苷;4-甲基伞形酮酰α-D-葡糖苷;4-甲基伞形酮酰β-D-葡糖苷;4-甲基伞形酮酰β-D-葡萄糖醛酸苷;4-甲基伞形酮酰对胍基苯甲酸酯;4-甲基伞形酮酰庚酸酯;4-甲基伞形酮酰α-D-吡喃甘露糖苷;4-甲基伞形酮酰β-D-吡喃甘露糖苷;4-甲基伞形酮酰油酸酯;4-甲基伞形酮酰棕榈酸酯;4-甲基伞形酮酰磷酸酯;4-甲基伞形酮酰丙酸酯;4-甲基伞形酮酰硬脂酸酯;4-甲基伞形酮酰硫酸酯;4-甲基伞形酮酰β-D-N,N',N"-三乙酰壳三糖;4-甲基伞形酮酰2,3,5-三邻苯甲酰基-α-L-阿拉伯呋喃糖苷;4-甲基伞形酮酰-p-三甲铵肉桂酸酯氯化物;和4-甲基伞形酮酰β-D-木糖苷。合适的7-酰胺基-4-甲基香豆素衍生物包括例如:L-丙氨酸-7-酰胺基-4-甲基香豆素;L-脯氨酸-7-酰胺基-4-甲基香豆素;L-酪氨酸-7-酰胺基-4-甲基香豆素;L-亮氨酸-7-酰胺基-4-甲基香豆素;L-苯基丙氨酸-7-酰胺基-4-甲基香豆素;和7-戊二酰苯丙氨酸-7-酰胺基-4-甲基香豆素。7-酰胺基-4-甲基香豆素的合适肽衍生物包括例如:N-t-BOC-Ile-Glu-Gly-Arg7-酰胺基-4-甲基香豆素;N-t-BOC-Leu-Ser-Thr-Arg7-酰胺基-4-甲基香豆素;N-CBZ-Phe-Arg7-酰胺基-4-甲基-香豆素;Pro-Phe-Arg7-酰胺基-4-甲基香豆素;N-t-BOC-Val-Pro-Arg7-酰胺基-4-甲基香豆素;和N-戊二酰基-Gly-Arg7-酰胺基-4-甲基香豆素。合适的双乙酰荧光素衍生物包括例如荧光素二醋酸酯,荧光素二-(β-D-吡喃半乳糖苷)和荧光素二月桂酸酯。其中待检测的生物活性物为α-D-葡糖苷酶、胰凝乳蛋白酶或脂肪酸酯酶(如得自嗜热脂肪土芽孢杆菌(Geobacillusstearothermophilus),优选的发荧光酶底物分别为4-甲基伞形酮酰-α-D-葡糖苷、7-戊二酰苯丙氨酸-7-酰胺基4-甲基香豆素或4-甲基伞形酮酰庚酸酯。其中待检测的生物活性物为α-L-阿拉伯呋喃糖酶(如衍生自枯草芽孢杆菌(Bacillussubtilis),优选的发荧光酶底物为4-甲基伞形酮酰-α-L-阿拉伯呋喃糖苷。其中待检测的生物活性物为β-D-葡糖苷酶(如衍生枯草芽孢杆菌,优选的发荧光酶底物为4-甲基伞形酮酰-β-D-葡糖苷。为了进行使用本发明的检测包含酶的生物活性物的方法,操作人员应了解待检测的酶活性和酶底物,这些酶底物将与酶反应从而产生可通过其荧光、颜色等检测的产物(参见M.Roth,MethodsofBiochemicalAnalysis(生物化学分析方法)第7卷,D.Glock编,IntersciencePublishers,NewYork,NY,1969,其以引用的方式全文并入本文中)。待采用的适宜酶底物取决于待检测的生物活性。本发明方法包括具有第一吸收光谱的第一指示试剂和藉生物活性转化成具有第二发射光谱的第二生物衍生物的第二指示试剂,其中第一吸收光谱至少部分地覆盖第二发射光谱。因此,当第一指示试剂和第二生物衍生物均存在于液体混合物中时,第一指示试剂可吸收由第二指示试剂发出的光的至少一部分,从而降低检测第二生物衍生物的能力。示图可示出根据本发明的第一指示试剂与第二生物衍生物之间的关系。图2示出示例性的第一指示试剂溴甲酚紫(在下文中称为“BCP”)的吸收光谱,和示例性的第二指示试剂4-甲基伞形酮(在下文中称为“4MU”)(4-甲基伞形酮酰β-D-葡糖苷的可能的生物衍生物)的荧光发射光谱。光谱按照实例1和2所述测得。示出BCP吸收光谱的线条“A”表明最大吸光度在大约600nm的可见光范围内,而在425-550nm波长内BCP的吸光度较低。该数据示出在大约600nm的可见波长内的吸收峰和<330nm的紫外线波长内的吸收峰。示出4MU荧光发射光谱的线条“B”表明最大发射峰在大约450nm,而相对较低的发射峰在375-425nm和475-525nm的范围内。从图2中可看出,BCP吸收光谱基本上覆盖整个4MU荧光发射峰(在大约450nm集中)。相关领域的普通技术人员会知道,包含第一指示试剂的溶液对任何特定波长的光的吸光度受溶液中第一指示试剂的浓度和指示试剂在选定波长处的指示试剂的摩尔消光系数的影响。技术人员还知道,包含第二指示试剂的生物衍生物的溶液在任何特定波长的光发射量受溶液中第二生物衍生物的浓度和生物衍生物的荧光量子产率的影响。因此,液体混合物中第一指示试剂的浓度可结合适宜的底物进行选择,要使得i)底物从液体混合物中移除足够的第一指示底物以允许对第二生物衍生物的更加灵敏的检测,和ii)第一指示试剂(或其生物衍生物)易于在底物材料上被检测到。溴甲酚紫和4-甲基伞形酮酰-α-D-葡糖苷的组合分别表示根据本发明的合适的第一指示试剂和第二指示试剂的实例。该组合可用于检测第一生物活性(例如碳水化合物向酸性终产物的发酵)和第二生物活性(例如-α-D-葡糖苷酶酶活性)。这些活性可表明在例如将生物灭菌指示器暴露于灭菌处理之后活孢子的存在或不存在。例如,溴甲酚紫可以约0.03g/L的浓度用于水性混合物中。4-甲基伞形酮酰-α-D-葡糖苷可例如以约0.05至约0.5g/L(如约0.05g/L、约0.06g/L、约0.07g/L、约0.08g/L、约0.09g/L、约0.1g/L、约0.15g/L、约0.2g/L、约0.25g/L、约0.3g/L、约0.35g/L、约0.4g/L、约0.45g/L、约0.5g/L)的浓度用于水性混合物中。因此,根据本发明,第一指示试剂可干扰检测本来具有可检测量的第二指示试剂的生物衍生物。本领域的普通技术人员通过进行以下简易的实验可证实所推荐的第一指示试剂与第二指示试剂之间的光谱干扰。首先,操作人员要准备所推荐第二指示试剂的预期生物衍生物的较稀的、但可检测荧光的水溶液。例如,如果第二指示试剂为4-甲基伞形酮酰化合物,则预期生物衍生物为4MU。该溶液可包含例如约0.05至0.2微克/毫升4MU。然后,操作人员添加有效量的所推荐的第一指示试剂。例如,如果BCP为所推荐的第一指示试剂,则其可以用于微生物生长介质以检测发酵微生物的浓度(如0.04毫克/毫升)进行添加。通过比较含有和不含BCP的4MU溶液的荧光,可确定第一指示试剂(在此实例中为BCP)可干扰检测第二指示试剂的生物衍生物(在此实例中为4MU)。然后操作人员可测试将减量的BCP添加至4MU溶液是否可改善对较低浓度4MU的检测。此类型的实验可易于使用第一指示试剂和第二指示试剂的任何组合进行。此工序的一个例子在实例3中示出。底物根据本发明,合适的底物被构造用于接纳和富集指示试剂。可通过本领域已知的和本文所讨论的多种力中的一种或多种来影响底物富集指示试剂或其生物衍生物的能力。譬如,本领域的普通技术人员可选择(例如)已知带正电的底物以聚集已知带负电的指示试剂(或其生物衍生物)。反之,本领域的普通技术人员可选择(例如)已知带负电的底物以聚集已知带正电的指示试剂(或其生物衍生物)。本领域的普通技术人员可选择已知具有疏水性的底物以聚集已知包含疏水性部分的指示试剂(或其生物衍生物),这些疏水性部分将由疏水性底物保留。另外,本领域的普通技术人员可通过使候选底物材料与包含指示试剂或其生物衍生物的液体接触一段时间并分析底物以确定可检测量的指示试剂或其衍生物是否积聚到底物上或底物中,从而容易地选择合适的底物材料。对本领域的普通技术人员显而易见的是,可根据指示试剂或其生物衍生物的已知性质来选择底物材料。例如,当指示试剂的生物衍生物为带负电的分子时,带正电的底物可选择用于所述方法中。此外,当指示试剂的生物衍生物为带正电的分子时,带负电的底物可选择用于所述方法中。或者,在本发明的方法中任何给定底物材料与给定第一指示试剂一起使用的相互适合性可方便地用以下实验方法进行确定。在合适的器皿(如试管)中,可将预定生物活性源(如能够使碳水化合物发酵成酸性终产物的微生物细胞)与第一指示试剂(如pH指示剂)一起添加到经选择以有利于生物活性的液体介质(如包含发酵性碳水化合物的肉汤培养基)中。可在有利于预定生物活性的条件下使液体介质与候选底物接触,并可将底物从介质中移除,任选地进行冲洗和/或涂抹以移除过量的液体,并目测或通过机械方式(如使用光谱反射计或荧光计)进行观察,以确定底物材料是否在与液体介质接触期间聚集第一指示试剂和/或其生物衍生物。在示例性实例中,合适的底物/指示剂组合将显示第一指示试剂或其生物衍生物在接触时段期间聚集到底物材料上或底物材料中(离开液体介质)的证据。可进行不具有底物材料的对照反应以确认混合物中生物活性的存在。可将底物加工成大致平坦的薄片形式(如膜状条带,如图1A所示)。底物的尺寸和/或有效表面积还可影响底物聚集指示试剂(或其生物衍生物)的能力。优选的底物材料包括多孔材料(如织造材料、非织造材料、多孔膜、微孔膜、滤纸)。在一些实施例中,特别优选的底物材料包括带电荷的膜,例如带电荷的尼龙膜(如MAGNAPROBE0.45微米带电荷的尼龙膜,产品编号NP0HY00010,得自明尼苏达州明尼唐卡(Minnetonka,MN)的GEOsmonicsLabstore)。用于本发明中的底物可由多种材料制备。美国专利No.6,562,297(其以引用的方式全文并入本文中)描述了用于使pH指示剂固定化的膜。合适底物材料的非限制性实例包括例如天然材料(如纤维素)、合成材料(如尼龙)及其组合和/或衍生物。检测生物活性的方法:图3示出根据本发明检测多种生物活性之一的方法的一个实施例的框图。该方法包括提供可包含多种预定生物活性之一的样品;第一指示试剂和第二指示试剂;和接纳和聚集来自水性介质的第一指示试剂的底物;以及任选的其生物衍生物的步骤40。在一些实施例中,该方法可包括将生物活性暴露于消毒剂、抗生素或灭菌剂的任选步骤45。可包括此任选步骤以确定灭菌处理的功效或选择性富集培养过程之后检测预定生物活性(或微生物)。将生物活性暴露于灭菌剂可包括将生物活性暴露于灭菌处理。灭菌处理包括将样品暴露于例如灭菌剂,例如蒸汽、干热、环氧乙烷、甲醛、过氧化物、过氧化氢、过乙酸、臭氧或其混合物(如臭氧和过氧化氢的混合物)。该方法包括形成第一水性混合物的步骤50,该第一水性混合物包含样品以及第一指示试剂和第二指示试剂。第一水性混合物在水性介质中形成。方法中的生物活性源包含或认为包含一种或多种生物活性的任何样品,如本文所述。如本文所用,“水性介质”是指第一指示试剂和第二指示试剂溶解或悬浮或可溶解或悬浮于其中的含水液体。优选地,介质基本上不干扰对待检测预定生物活性的检测。在一些实施例中,水性介质可包含调节介质pH的组分(即,缓冲剂)。水性介质还可包含本领域中已知的有利于检测一种或多种生物活性的试剂(如清洁剂、辅因子、细胞裂解剂)。在一些实施例中,样品包含水,因此,可认为样品本身是水性介质。在任一实施例中,样品可任选地与第二液体(如中和消毒剂的水性介质、稀释剂、缓冲液、溶液)混合,然后样品与第一指示试剂和第二指示试剂混合。在一些实施例中,水性介质可与第一指示试剂和/或第二指示试剂组合,然后介质与样品混合。在一些实施例中,可将第一指示试剂和第二指示试剂以及样品相继添加到水性介质中以形成第一水性混合物。在一些实施例中,第一指示试剂和第二指示试剂可同时与水性介质和样品组合以形成第一水性混合物。在任一实施例中,在试剂与水性介质和/或样品组合以形成第一水性混合物之前,第一指示试剂和第二指示试剂中的一者或两者最初呈干试剂、液体、凝胶或膜的形式。第一指示试剂可为本文所述的任何合适的试剂。由于第一指示试剂经选择用于检测预定生物活性,第一指示试剂和其生物衍生物的化学性质是已知的,因此,可按照本文所述鉴定合适的底物材料。第二指示试剂可为本文所述的任何合适的试剂。在所述方法的任一实施例中,形成第一水性混合物可包括形成包含营养物质的第一水性混合物。可提供营养物质以有利于例如靶细胞或微生物的生长,例如,并且可将其以营养物质混合物的形式提供。有利于微生物生长的营养物质和营养介质是本领域中已知的并且可见于例如RonaldAtlas的“HandbookofMicrobiologicalMedia(微生物培养基手册)”,佛罗里达州博卡拉顿(BocaRaton,FL)的CRCPress出版。Matner等人(美国专利No.5,073,488)描述了用于生物灭菌指示器中的细菌孢子的生长和检测的营养介质。有利于真核细胞(如哺乳动物细胞、昆虫细胞)生长的营养物质和营养介质也是本领域中已知的,并且包括例如糖(如葡萄糖)、氨基酸、维生素(如硫胺素、烟酸)、胆碱、肌醇、血清及其混合物。本发明的方法还包括使第一水性混合物与底物流体连通以形成第二水性混合物的步骤60。通常,使第一水性混合物与底物流体连通的处理在器皿(如管、瓶、烧瓶、微孔)中进行。在任一实施例中,例如可密封器皿以尽可能减少蒸发和/或防止外源性生物活性的污染。在任一实施例中,使第一水性混合物与底物流体连通可包括在有利于预定生物活性的条件下使液体混合物与底物接触。本领域的普通技术人员都知道有利于预定生物活性的条件。这些条件可包括例如混合物的pH、离子强度或缓冲能力;第一指示试剂和/或第二指示试剂的浓度;混合物或器皿中辅因子的存在;和/或混合物的温度。在所述方法的任一实施例中,使第一水性混合物与底物流体连通可包括控制混合物的温度。在一些实施例中,可使用加热块、培养箱或一些本领域中已知的其他合适的加热部件将温度控制在高于环境温度的温度(如有利于涉及生物活性的反应如催化反应或结合反应的温度)。在一些实施例中,可将混合物的温度控制在低于环境温度的温度。在一些实施例中,混合物可经受瞬态温度变化(如热冲击或冷冲击)以有利于预定生物活性的检测。根据本发明使第一水性混合物与底物流体连通包括将第一指示试剂和;任选的其生物衍生物;聚集到底物上和/或底物中。因此,第二水性混合物中第一指示试剂的浓度低于第一水性混合物中第一指示试剂的浓度。如以上所讨论,底物经选择用于接纳和富集第一指示试剂。底物通过与水性介质接触来接纳第一指示试剂。底物通过多种方式来保留第一指示试剂或其生物衍生物。不受理论的约束,第一指示试剂或其生物衍生物在底物材料上和/或底物材料中的富集可藉多种化学吸引力中的一种或多种进行,这些化学吸引力包括但不限于(例如)离子相互作用、疏水性相互作用、范德华力和氢键合。底物接纳和富集第一指示试剂或其生物衍生物的过程发生在水性介质与底物的流体连通期间。在此流体连通期间,第一指示试剂或其生物衍生物以一定的速率积聚在底物上,该速率可取决于多种因素,包括例如第一指示试剂(或其生物衍生物)的浓度、底物材料接触液体介质的表面积、底物的孔隙度、与底物材料相关的电荷密度和/或液体介质中可以干扰底物接纳或聚集第一指示试剂或其生物衍生物的方式与底物和/或第一指示试剂(或其生物衍生物)进行相互作用的其他物质。第一指示试剂或其生物衍生物的至少一部分在底物上的接纳和富集可在较短的接触时间内(如在数分钟内)进行并且可持续较长的接触时间(如最多至1小时、最多至2小时、最多至4小时、最多至18小时、最多至24小时、最多至7天、最多至两周)。在一些实施例中,第一指示试剂可在较短的时间段内(如几分钟,几小时)富集到底物上或底物中,而第一生物衍生物(如果存在)在较长的时间段内(如几小时,几天)可能不会可检测地聚集到底物上或底物中。在上述水性混合物与底物之间流体连通的任何时段期间,底物可接纳和富集第一指示试剂(或其生物衍生物)的全部或一部分。在一些实施例中,底物接纳和富集至少5%的第一指示试剂(或其生物衍生物)。在一些实施例中,底物接纳和富集至少10%的第一指示试剂(或其生物衍生物)。在一些实施例中,底物接纳和富集至少20%的第一指示试剂(或其生物衍生物)。在一些实施例中,底物接纳和富集至少30%的第一指示试剂(或其生物衍生物)。在一些实施例中,底物接纳和富集至少40%的第一指示试剂(或其生物衍生物)。在一些实施例中,底物接纳和富集至少50%的第一指示试剂(或其生物衍生物)。在一些实施例中,底物接纳和富集至少75%的第一指示试剂(或其生物衍生物)。在一些实施例中,底物接纳和富集至少80%的第一指示试剂(或其生物衍生物)。在一些实施例中,底物接纳和富集至少90%的第一指示试剂(或其生物衍生物)。在一些实施例中,底物接纳和富集大于90%的第一指示试剂(或其生物衍生物)。在一些实施例中,底物接纳和富集大于95%的第一指示试剂(或其生物衍生物)。确定底物接纳和富集第一指示试剂(或其生物衍生物)可容易地通过以下过程实现:使包含第一指示试剂(或其生物衍生物)的液体介质与底物流体连通一段时间并分析底物中是否存在试剂(或其生物衍生物),如实例1中所示。优选地,将任何过量的液体介质从底物中移除(如通过涂抹或通过离心),然后分析底物,使得与底物相关的试剂或生物衍生物的量指示底物所保留的量。合适的分析方法对于本领域的普通技术人员而言是显而易见的。例如,可使用例如X-Rite530P型便携式分光光密度计通过反射光谱法来分析接纳和富集显色第一指示试剂(如pH指示剂)的底物。因此,当使包含样品和第一指示试剂(或其生物衍生物)的液体介质与合适的底物流体连通时,大量液体介质中第一指示试剂(或其生物衍生物)的浓度随着底物接纳和富集第一指示试剂(或其生物衍生物)而降低。本发明的特征有利于检测较小浓度的第二指示试剂的生物衍生物,因为第一指示试剂的干扰作用(即,荧光吸收)的至少一部分随着第一指示试剂从水性混合物中富集到底物上而被消除。在一些实施例中,当呈自由扩散形式(即,在大量液体介质中)时,第一指示试剂和/或其生物衍生物可以抑制生物活性。在这些实施例中,本发明的另一优点是底物可有效地隔离第一指示试剂的至少一部分,从而降低第一指示试剂对生物活性的抑制。再回到参考图3,所述方法还包括有利于细胞生长的任选步骤65。广义上使用有利于细胞生长包括提供条件(如营养物质、萌发剂、缓冲液、氧化-还原电位、气体)以有利于例如孢子萌发、能量代谢、生物合成和/或细胞分化。促进细胞生长可导致一种或多种预定生物活性从初始样品扩增,从而可改善检测预定生物活性的灵敏性。本发明的方法还包括检测第二指示试剂的生物衍生物(本文中称为“第二生物衍生物”)的步骤70。在一些实施例中,可在水性介质中检测到第二生物衍生物。检测第二生物衍生物的存在或不存在分别表明样品中对应预定生物活性的存在或不存在。可用若干种装置检测第二生物衍生物。在一些实施例中,可以光学方式检测第二生物衍生物。在一些实施例中,检测第二生物衍生物可包括目测检测生物衍生物。在一些实施例中,检测第二生物衍生物可包括使用仪器检测生物衍生物。例如,如果可使用光学仪器如荧光计来检测第二生物衍生物。在任一实施例中,检测其第二生物衍生物的存在或不存在还可包括测量第二生物衍生物的量。测量所述量可通过本领域中已知的任何装置进行,包括例如使用仪器(如荧光计)测量所述量。在一些实施例中,测量第二生物衍生物的量可包括将水性混合物中的荧光与标准物的荧光进行对比。在任一实施例中,本发明的方法任选地包括检测第一指示试剂或其第一生物衍生物的步骤75。如本领域的普通技术人员理解的,用于检测第一指示试剂或第一生物衍生物的装置取决于第一指示试剂或第一生物衍生物的性质。例如,如果第一指示试剂为铬(显色)和/或第一生物衍生物为铬化合物,则第一指示试剂和/或第一生物衍生物可以光学方式(目测或通过仪器(如分光光度计))进行检测。在一些实施例中,检测第一指示试剂或第一生物衍生物还可包括检测水性混合物的与底物无关的一部分中的第一指示试剂或第一生物衍生物(如在大量液体中)。例如,如果要使用光学仪器如分光光度计检测第一指示试剂或第一生物衍生物,则光程不与底物的任何部分相交。在任一实施例中,检测第一指示试剂或第一生物衍生物的存在或不存在还可包括测量第一指示试剂或第一生物衍生物的量。测量所述量可通过本领域中已知的任何装置进行,包括例如使用仪器(如分光光度计、分光光密度计)测量所述量。美国专利No.5,252,484和No.5,418,167;(均以引用的方式全文并入本文中);描述了快速读取生物指示器的实施例,其中生物指示器包含酶载体(孢子条带)和容纳含有4-甲基伞形酮酰-α-D-葡糖苷(“MUG”,发荧光酶底物)和溴甲酚紫(“BCP”,pH指示剂)的溶液的安瓿。已知MUG的可通过酶活性水解成4-甲基伞形酮(4MU)(MUG的荧光衍生物)。如美国专利No.5,252,484的实例1和2中所示,通过MUG的酶促水解所产生的4MU可在使酶载体与含有MUG和BCP的溶液流体连通之后几分钟内通过荧光目测检测。本发明的研究人员已经发现,用于类似于美国专利No.5,252,484的实例1中所述的溶液的BCP浓度足以干扰检测水溶液中4MU的浓度。根据本发明从溶液中除去BCP的至少一部分将允许检测生物指示器中更小量的4MU,从而允许对已暴露于灭菌处理并且未被以此灭活和/或杀死的生物活性(如孢子、酶)进行更早的检测。用于检测生物活性的系统本发明包括用于检测样品中预定生物活性的系统。该系统可根据本发明的方法来使用以检测样品中一种或多种生物活性。该系统包括包含第一指示试剂的第一指示系统,第一指示试剂能通过第一预定生物活性转化成第一生物衍生物。第一指示试剂具有第一个吸收光谱和任选的第一个发射光谱。该系统还包括包含第二指示试剂的第二指示系统,第二指示试剂可通过第二预定生物活性转化成第二生物衍生物。第二生物衍生物具有第一吸收光谱和第二发射光谱。该系统还包括被构造用于接纳液体样品的仪器,该液体样品可包含第一指示试剂、第二指示试剂、第一生物衍生物、第二生物衍生物或前述两种或更多种的任意组合。该仪器被构造用于经由分析仪器的“吸浆管”装置(如本领域中所已知)从外面容器吸取液体样品。或者,该仪器可被构造成用于接纳容纳液体样品的器皿(如管、微孔板等)。该仪器被构造成用于检测第二生物衍生物。任选地,该仪器还可被构造成用于检测第一指示试剂、第二指示试剂、第一生物衍生物或前述两种或更多种的任意组合。系统的指示试剂可为本文所述的用于检测特定预定生物活性的任何合适的指示试剂。第一指示试剂和第二指示试剂可做成在试剂盒中,例如,该试剂盒任选地可包括其中混合指示试剂与样品的水性介质(如缓冲液、悬浮介质、稀释剂)。如本文所讨论,样品可包含水,因此可构成水性介质。任选地,试剂盒还可包括器皿(如管、比色杯等),在该器皿中形成包含样品以及第一指示试剂和第二指示试剂的水性混合物。在一些实施例中,系统可与生物灭菌指示器一起使用,该生物灭菌指示器为例如2010年11月1日提交的美国专利申请No.61/408,977和No.61/408,988中的生物指示器,和美国专利No.5,252,484中描述的生物指示器;这些专利的全文以引用的方式并入本文。检测铬化合物吸收光谱的仪器是本文领域中已知的并且包括例如多种市售的分光光度计和分光光密度计。检测荧光化合物发射光谱的仪器也是本文领域中已知的并且包括例如多种市售的荧光计。此类仪器可容易地适于检测与液体样品相关的指示试剂(或其生物衍生物)和/或设置在预定位置的底物。在一些实施例中,可将底物从水性混合物中移除并设置(如在表面上或在小容器中)得使指示试剂(或其生物衍生物)可通过仪器进行检测。美国专利No.6,025,189;(其以引用的方式全文并入本文中)描述了仪器被构造用于在整装生物指示器的预定位置处检测与生物活性相关的荧光信号。对此仪器进行修改以检测铬信号在本领域普通技术人员的能力范围之内。在一些实施例中,系统还可包括处理器。在一些实施例中,仪器可包括微处理器,该微处理器能够控制仪器并且收集和/或传输与检测指示试剂或其生物衍生物相关的数据。在所述系统的一些实施例中,处理器可包括外部处理器。外部计算机可包括个人计算机(PC)、台式计算机、膝上型计算机、手持计算机、工作站等。例如,可将软件程序下载到外部计算机上以控制仪器和/或有利于收集、传输和/或分析来自仪器的数据。在一些实施例中,系统还可包括调节液体温度的装置。用于温度控制的装置可包括本领域中已知的任何装置,例如热电偶和热交换器。有利地,这些实施例提供了一种系统,该系统通过控制温度而有利于生物活性并且可检测生物活性的产物。生物灭菌指示器:图4-10示出根据本发明的一个实施例的生物灭菌指示器100。生物灭菌指示器的其他合适的实施例描述于共同待审的PCT公开号WO2011/011189,名称为“BiologicalSterilizationIndicatorandMethodofUsingSame(生物灭菌指示器及其使用方法)”;美国专利申请No.61/409,042,名称为“BiologicalSterilizationIndicatorSystemandMethod(生物灭菌指示系统及方法)”;美国专利申请No.61/408,997,名称为“BiologicalSterilizationIndicatorSystemandMethod(生物灭菌指示系统及方法)”;和美国专利申请No.61/408,977,名称为“BiologicalSterilizationIndicatorandMethodofUsingSame(生物灭菌指示器及其使用方法)”;这些专利的全文以引用的方式并入本文。生物灭菌指示器100可包括壳体102,该壳体可包括第一部分104和第二部分106(例如盖件),该第一部分和第二部分适于连接在一起以提供整装生物灭菌指示器。在一些实施例中,第一部分104和第二部分106可由相同的材料制成,而在一些实施例中,第一部分104和第二部分106可由不同的材料制成。壳体102可限定生物灭菌指示器100的贮存器103,在贮存器103中可设有其他组分并且可在灭菌处理期间将灭菌剂导入其中。壳体102可由至少一个不透液体的壁限定,所述壁例如第一部分104的壁108和/或第二部分106的壁110。应理解,在不背离本发明的精神和范围的前提下,也可采用一件式一体壳体102,或者第一部分104和第二部分106可具有他形状、维度或相对结构。壳体102(如壁108和110)的合适材料可包括但不限于玻璃、金属(如箔)、聚合物(如聚碳酸酯(PC)、聚丙烯(PP)、聚亚苯基(PPE)、聚乙烯(polythyene)、聚苯乙烯(PS)、聚酯、(如聚对苯二甲酸乙二醇酯(PET))、聚甲基丙烯酸甲酯(PMMA或丙烯酸类树脂)、丙烯腈丁二烯苯乙烯(ABS)、环状烯烃聚合物(COP)、环状烯烃共聚物(COC)、聚砜(PSU)、聚醚砜(PES)、聚醚酰亚胺(PEI)、聚对苯二甲酸丁二酯(PBT))、陶瓷或者它们的组合。在一些实施例中,生物灭菌指示器100还可包括易碎容器120,易碎容器120容纳液体122,并且其尺寸被设计为接纳在生物灭菌指示器100内,例如在壳体102的至少一部分内(如至少在壳体102的第一部分104内)。易碎容器120可由多种材料形成,包括但不限于金属(如箔)、聚合物(如以上针对壳体102所列举的聚合物的任何一种)、玻璃(如玻璃安瓿)中的一种或多种以及它们的组合。在一些实施例中,容器120的仅一部分是易碎的,例如,容器120可包括易碎部分或包覆覆盖件(如易碎屏障、膜、隔膜等)。易碎容器120可具有其为完整的并且液体122容纳于其中的第一状态和容器120的至少一部分破碎的第二状态。在容器120的第二状态中,如当容器120设置在生物灭菌指示器100中时,液体122可与生物灭菌指示器100的贮存器103流体连通。如图示实施例中所示,容器120在保持在生物灭菌指示器100中的适当位置和/或被插件130破碎,这将在下文中进行更加详细地描述。可通过促使容器120压迫插件130(如用作破碎装置的插件)或通过促使插件130压迫容器120来使容器120破碎。壳体102的第一部分104可适于容纳生物灭菌指示器100的大部分组分,并且可称为“管”、“管状体”、“基座”等。壳体102可包括贮存器103,该贮存器可由壳体102的第一部分104和第二部分106中的一者或两者限定。生物灭菌指示器100还可包括设置成与贮存器103流体连通的孢子或另一生物活性源115(或孢子座位)。如图4-6中所示,壳体102的第二部分106可包括一个或多个孔口107以提供壳体102内部(如贮存器103)与环境之间的流体连通。例如,该一个或多个孔口107可在灭菌处理过程中提供孢子115与环境之间的流体连通,且可充当进入生物灭菌指示器100的进口和充当灭菌剂路径164的进口(下文有更详细的描述)。在一些实施例中,壳体102的第二部分106可连接至壳体102的第一部分104的第一(如开口)端101,并且孢子115可设置在第二(如封闭)端105,与壳体102的第一部分104的第一端101相对。在一些实施例中,屏障或过滤器(如无菌屏障;未示出)可被设置在灭菌剂路径164中(如在孔口107所形成的进口处)以抑制污染性的或外来的生物体、物体或材料进入生物灭菌指示器100。这种屏障可包括能透过气体但不能透过微生物的材料,且可通过多种连接方式连接到壳体102,所述连接方式包括但不限于粘合剂、热密封、超声焊接等。或者,屏障可通过连接到壳体102的第一部分104的支承结构(如第二部分106)来连接到灭菌剂通道164(如以搭扣配合式接合、螺旋配合式接合、压力配合式接合或者它们的组合的方式连接)。在暴露于灭菌剂的过程中,灭菌剂可穿过屏障进入灭菌剂路径164并与孢子115接触。在一些实施例中,如图示实施例中所示,壳体102可包括可至少部分地被内壁(或部分壁)118、突架(ledge)、隔离件(partition)、凸缘等分开的下部114和上部116,在其中可形成开口117,开口117提供下部114和上部116之间的流体连通。在一些实施例中,壳体102的第一部分104的下部114(有时简称为“下部114”或“壳体102的下部114”)可适于容纳孢子115或孢子座位。在一些实施例中,下部114可称为壳体102的“检测部分”或“检测区域”,因为可检查下部114的至少一部分确认孢子生长的迹象。另外,在一些实施例中,壳体102的第一部分104的上部116(为简单起见有时称为“上部116”或“壳体102的上部116”)可适于容纳易碎容器120的至少一部分,特别是在启用前。在一些实施例中,贮存器103的至少部分地由壳体102的上部116限定的部分可称为第一室(或贮存器、区、区域或空间)109,并且贮存器103的至少部分地由壳体102的下部114限定的部分可称为第二室(或贮存器、区、区域或空间)111。在一些实施例中,第二室111可称为“孢子生长室”或“检测室”,并且可包括探查孢子活力以确定灭菌处理功效的空间。第一室109和第二室111可被设置成彼此流体连通,以使得灭菌剂和液体122从(即,透过)第一室109移动至第二室111。在一些实施例中,第一室109和第二室111之间的流体连接的程度(如连接第一室109和第二室111的开口如开口117的尺寸)可在启用步骤(即液体122从容器120释放出来)之后增加、与该启用步骤同时增加和/或响应该启用步骤而增加。在一些实施例中,对第一室109(如在上部116中)和第二室111(如下部114)之间的流体连通(或者流体连接的程度)的控制可由插件130的至少一部分提供。在灭菌期间并且当容器120处于第一未破碎状态时,容器120可设置并保持在第一室109中。当容器120处于第一状态时,孢子115可容纳在第二室111中并且与环境流体连通。第一室109和第二室111可被构造为使得容器120不存在于第二室111中,特别是当容器120未处于其第一未破碎状态时。当容器120破碎并且液体122释放到壳体102的内部中时,灭菌剂可在灭菌期间(如通过第一室109)移动到第二室111中,并且液体122可在启用期间(如从第一室109)移动到第二室111中。因此,当容器120处于第一状态时,第一室109和第二室111可彼此以及与环境流体连通(如在灭菌期间)。例如,第一室109和第二室111可通过一个或多个孔口107与环境流体连通。在一些实施例中,第一室109和第二室111可与环境成流体连通,该流体连通的方式使得当灭菌剂进入生物灭菌指示器100时第一室109位于第二室111上游。即,第一室109可设置在灭菌剂进口(如一个或多个孔口107)与第二室111之间,并且灭菌剂进口可设置在第一室109相对于第二室111的相对侧。如图7和9中所示,在一些实施例中,第一室109可被第一部分104和第二部分106中的一者或两者限定,特别是当容器120处于第一状态时。此外,在一些实施例中,第一室109可包括第一端112,第一端112的设置邻近壳体102的第一部分104的开口端101,邻近壳体102的第二部分106和/或至少部分地被第二部分106限定。第一室109还可包括第二端13,第二端13邻近第二室111并与其呈流体连通设置,并且朝向壳体102的封闭端105设置。第一室109的第一端112可被壳体102的第一部分104和/或第二部分106限定。如图7和9中进一步所示,在一些实施例中,第二室111可包括第一端124,其邻近第一室109并与其呈流体连通设置并且朝向壳体102的开口端101设置;和第二端125,其至少部分地被壳体102的封闭端105限定,包括该封闭端或邻近该封闭端设置。换句话讲,如图7和9中所示,生物灭菌指示器100可包括纵向DL,并且在一些实施例中,第一室109可纵向设置在第二室111上方。在一些实施例中,第二室111可至少部分地被生物灭菌指示器100的封闭端105限定,可包括该封闭端或邻近该封闭端设置。此外,在一些实施例中,第二室111可小于(如按体积和/或横截面积计)第一室109和容器120中液体122的体积中的至少一者,液体122在生物灭菌指示器100被启用时释放。因此,在此类实施例中,第二室111可表现出气锁效应,其中存在于第二室111中的气体(如空气)可抑制向第二室111中的流体移动。在一些实施例中,如下文更详细地描述,允许第二室111排放至生物灭菌指示器100的另一部分的流体路径可有利于向第二室111中的流体移动。在一些实施例中,壁118(有时称为“分隔壁”)可以是成角度的或倾斜的,例如相对于壳体102的纵向DL(如其中纵向DL沿着壳体102的长度延伸)以非零度和非直角的角度取向。壁118这样成角度或倾斜可有利于在灭菌之后和在容器120已被打破以释放液体122后液体122从上部分116移动到下部分114。如图4-6中所示,在一些实施例中,壁118可至少部分地由壳体102的内部维度变化形成。例如,如图所示,壁118可通过横截面积从第一室109中的第一纵向位置到第二室111中的第二纵向位置减小而形成。此外,仅以举例的方式,壳体102的内部横截面形状可在第一室109至第二室111的过渡部变化,从第一室109中的大致圆形(如具有组成小于50%的周边的扁平侧面)到第二室111中的大致平行立面体(如大致方形)。此外,在一些实施例中,壁118还可至少部分地由壳体102的外部维度变化形成。如图4-6中所示,在一些实施例中,壳体102包括梯步(或突架、悬突部、过渡部等)123,其始终与壁118成角度(如果壁118是有角度的),并且其包括壳体102的外部形状和维度的变化。然而,应当理解在一些实施例中,即使壳体102的内部维度发生变化以形成具有不同于第一室109的横截面形状或维度的第二室111,壳体102的外部形状和维度未必变化或始终随着内部形状和/或维度的变化而变化。例如,在一些实施例中,步骤123可相对于纵向DL大致垂直取向。在一些实施例中,贮存器103的体积为至少约0.5毫升(mL),在一些实施例中,至少约1mL,而在一些实施例中,至少约1.5mL。在一些实施例中,贮存器103的体积不大于约5mL,在一些实施例中,不大于约3mL,而在一些实施例中,不大于约2mL。在一些实施例中,易碎容器120的体积为至少约0.25mL,在一些实施例中,至少约0.5mL,而在一些实施例中,至少约1mL。在一些实施例中,易碎容器120的体积为不大于约5mL,在一些实施例中,不大于约3mL,而在一些实施例中,不大于约2mL。在一些实施例中,易碎容器120中所含的液体122的体积为至少约50微升,在一些实施例中,至少约75微升,而在一些实施例中,至少约100微升。在一些实施例中,易碎容器120中所含的液体122的体积不大于约5mL,在一些实施例中,不大于约3mL,而在一些实施例中,不大于约2mL。在一些实施例中,第一室109(即,由壳体102的第一部分104的上部116形成)的体积为至少约500微升(或立方毫米),在一些实施例中,至少约1000微升,在一些实施例中,至少约2000微升,在一些实施例中,至少约2500微升。在一些实施例中,第一室109的体积不大于约5000微升,在一些实施例中,不大于约4000微升,在一些实施例中,不大于约3000微升。在一些实施例中,第一室109的体积为约2790微升或2800微升。在一些实施例中,第二室111(即,由壳体102的第一部分104的下部114形成)的体积为至少约5微升,在一些实施例中,至少约20微升,在一些实施例中,至少约35微升。在一些实施例中,第二室111的体积不大于约250微升,在一些实施例中,不大于约200微升,在一些实施例中,不大于约175微升,在一些实施例中,不大于约100微升。在一些实施例中,第二室111的体积为约208微升或210微升。在一些实施例中,第二室111的体积为第一室109的体积的至少约5%,在一些实施例中,至少约7%。在一些实施例中,第二室111的体积不大于第一室109的体积的约20%,在一些实施例中,不大于约15%,在一些实施例中,不大于约12%,在一些实施例中,不大于约10%。在一些实施例中,第二室111的体积为第一室109的体积的约7.5%。在一些实施例中,第二室111的体积不大于容纳在容器120中的液体122的体积的约60%,在一些实施例中,不大于约50%,在一些实施例中,不大于约25%。在一些实施例中,将第二室111设计成体积显著小于容纳在容器120中的液体122的体积可确保另外的液体体积可补偿非预期的蒸发。在一些实施例中,第一室109(即,通过壳体102的第一部分104的上部116形成)在第一室109与第二室111的过渡部或邻近第二室111的位置的横截面积(或平均横截面积)为至少约25mm2;在一些实施例中,至少约30mm2;在一些实施例中,至少约40mm2。在一些实施例中,第一室109在第一室109与第二室111的过渡部或邻近第二室111的位置的横截面积不大于约100mm2,在一些实施例中,不大于约75mm2,在一些实施例中,不大于约50mm2。在一些实施例中,第二室111(即,通过壳体102的第一部分104的下部114形成)在第一室109与第二室111的过渡部或邻近第一室109的位置的横截面积为至少约5mm2,在一些实施例中,至少约10mm2,在一些实施例中,至少约15mm2。在一些实施例中,第二室111的横截面积(或平均横截面积)不大于约30mm2,在一些实施例中,不大于约25mm2,在一些实施例中,不大于约mm2。在一些实施例中,第二室111在第一室109与第二室111的过渡部的横截面积可不大于第一室109在过渡部的横截面积的约60%,在一些实施例中,不大于约50%,在一些实施例中,不大于约40%,在一些实施例中,不大于约30%。在一些实施例中,生物灭菌指示器100还可包括底物119。在一些实施例中,如图4-7和9中所示,底物119的尺寸被设计为邻近壁118设置,特别是倚靠在壁118的上方。底物119可设置在生物灭菌指示器100的上部116(即,第一室109)与下部114(即,第二室111)之间,并且在一些实施例中可至少部分地限定第一室109和第二室111。因此,在一些实施例中,底物119可置于容器120与孢子115之间。在一些实施例中,底物119可置于第一室109中或壁118的第一室侧面上,使得底物119未设置在第二室111中。此外,底物119可设置成能最小化分析信号(如荧光)向第二室111外的扩散。在一些实施例中,根据组成底物119的材料,底物119还可吸收来自溶液的染料、指示试剂或可抑制来自生物灭菌指示器100的信号的准确读数的其他材料(即,“抑制剂”)。在一些实施例中,如图4-7、9和10中所示,底物119可包括一个或多个孔口121,该孔口可被构造用于控制(即,有利于和/或限制,根据数量、尺寸、形状和/或位置)生物灭菌指示器100的第一室109与第二室111之间的流体移动,特别是其可有利于容器120破碎时液体122向孢子115的移动。仅以举例的方式,当孔口121设置在底物119中部的前部(或“前侧”)时可观察到特定的有益效果或优点,如图所示。在图4-10中示出的实施例中,生物灭菌指示器100的“前部”或其中的部件可通常被描述为朝向平面126。通常,生物灭菌指示器100的“前部”可指将通过读取设备探查的生物灭菌指示器100的部分。此外,仅以举例的方式,示出孔口121为环形或圆形;然而,其他横截面孔口形状是可能的并且在本发明的范围之内。此外,仅以举例的方式并且如图6所示,底物119被成形为基本上填充在第一室109与第二室111之间的过渡部的第一室横截面积。然而,底物119的其他形状是可能的并且可适于容纳壳体102、第一室109、第二室111、壁118或生物灭菌指示器100的另一部件。如上所述,第二室111可包括待探查的空间。可分析此类空间的孢子活力以确定灭菌工序的致死率或有效性。在一些实施例中,待探查的空间可为第二室111的全部或一部分。在一些实施例中,底物119可设置在待探查空间的外部,这可使空间中干扰分析过程的结构数量最小化。例如,在一些实施例中,底物119可设置为使得底物119不与孢子115、孢子载体135和孢子贮存器136中的至少一者直接接触。在一些实施例中,底物119可设置为使得底物119未设置在检测系统(如光学检测系统,如荧光激发源和发射检测器)与孢子115、孢子载体135和孢子贮存器136中的至少一者之间。当容器120处于第一状态和/或第二状态,但特别是当容器120处于第二状态时,底物119可具有上述位置。在一些实施例中,生物灭菌指示器100的底物位置可影响孢子活力的快速检测系统(如荧光检测)与慢速(如过夜或24小时)检测系统(如响应于孢子生长而表现出颜色变化(在24小时内)的pH指示剂)的相关性。例如,在一些实施例中,底物119可改善不同时间点的荧光读数与24小时后的生长结果的相关性。特别地,当底物119位于“第一”位置–如本文所述和如图1、2和4-7中所示时–荧光可准确地与生长相互关联。此类相关性相对于其他底物位置和不具有底物的生物灭菌指示器而言具有改善。此外,底物119可设置生物灭菌指示器100中,使得底物119在容器120处于第一状态时不与容器120直接接触。例如,在一些实施例中,底物119可设置在第一室109中(如邻近第一室109的底端(如第二端113)),但即使在此类实施例中,底物119仍可设置为使得底物119不接触容器120。例如,如图4-5和7-9中所示,在一些实施例中,当容器120处于第一状态时,插件130可设置在容器120与底物119之间,使得插件130将容器120保持在第一状态。插件130或其一部分可邻近底物119设置。例如,如图示实施例中所示,底物119可设置在插件130与壁118之间(如被夹在之间)。同样,在一些实施例中,底物119可设置在插件130与第二室111之间。如上所述,在一些实施例中,底物119可设置在生物灭菌指示器100中并且被构造用于控制或影响生物灭菌指示器100中的流体流动,特别是控制第一室109与第二室111之间的流体流动。例如,在一些实施例中,底物119可被构造(如尺寸被设计、成形、取向和/或由某些材料构造)用于控制灭菌剂递送至第二室111(和递送至孢子115)的速率。例如,如果第一室109与第二室111之间不存在底物119,灭菌剂递送速率可能小于否则应具有的速率。此外,在一些实施例中,底物119可被构造(如尺寸、形、状、位置、取向和/或由某些材料构成)得用于控制可检测的产物扩散处待探查空间的速率。在一些实施例中,可检测的产物可包括表明孢子活力的信号(如荧光信号),并且在一些实施例中,可检测的产物可为孢115本身。控制可检测的产物向待探查空间外的扩散可在其中液体122的体积大于第二室111的空间(或待探查的空间)的实施例中特别有用,因为此类实施例中的液体112可在容器120处于其第二破碎状态时在生物灭菌指示器100中扩充至比第二室111(或待探查的空间)更高的水平。在此类实施例中,可检测的产物可在液体122的整个空间内自由移动(即,移动至待探查空间外部的空间),除非存在一些用于控制此类扩散屏障或装置,例如底物119。例如,在一些实施例中,底物119可设置在恰好高于待探查空间的水平(即,低于液体122的水平),以抑制可检测的产物向液体122的位于底物119上方的部分的移动。在一些实施例中,通过提供灭菌剂和/或可检测的产物的物理屏障或封阻,底物119可控制灭菌剂递送速率(如进入第二室111)和/或可检测的产物的扩散速率(如离开第二室111)。此类物理屏障可还用于在容器120处于第二破碎状态时收集容器120的碎裂部分,以抑制碎裂部分向待探查空间内的移动,其中碎裂部分可阻挡、折射、反射或以其他方式干扰检测过程(如光学检测过程)。此外,在一些实施例中,与孢子115流体连通之前或之后的液体122可包括一种或多种抑制剂或其他组分,其可干扰准确分析或检测过程。在一些实施例中,抑制剂的实例可包括以下中的至少一者:染料、指示试剂、可抑制反应(例如酶促反应)且对于检测孢子活力(如盐类等)而言所必需的其他材料或物质、可干扰检测过程的其他材料或物质或其组合。在此类实施例中,底物119可被构造用于吸收和/或选择性地富集来自液体122或至少来自待探查的液体122体积的一种或多种抑制剂。例如,在一些实施例中,在接触孢子115之间或由于接触孢子115,不止一种指示试剂可存在于液体122中。在此类实施例中,虽然第一指示试剂(如用于荧光检测)可能对于孢子活力检测必不可少,但第二指示试剂(如pH指示剂)可实际上干扰第一指示试剂的检测。仅以举例的方式,在其中第二指示试剂为pH指示剂(如溴甲酚紫、甲基红或其组合的一种或多种)的实施例中,pH指示剂可抵触或干扰第一指示试剂的荧光读数,例如在其中pH指示剂发出的电磁辐射的波长第一指示试剂的荧光的光谱带时(如当pH指示剂表现出色移时)的实施例中。在此类实施例中,底物119可被构造(如由适宜的材料形成)用于当设置成与液体122接触以降低122中或至少待探查的液体122的体积中第二指示试剂的浓度时吸收和/或选择性地富集第二指示试剂。此外,在一些实施例中(如其中壁118是倾斜的并且底物119邻近壁118设置的实施例中),底物119可为成角度的或倾斜的,例如,相对于壳体102的纵向DL以非零度和非直角的角度取向。底物119这样成角度或倾斜可有利于在灭菌之后和在容器120已被打破以释放液体122后液体122从第一室109移动至第二室111。在一些实施例中,底物119可由多种材料制成以实现上述功能中的一种或多种。底物材料的实例可包括但不限于棉布、玻璃棉、织物、非织造聚丙烯、非织造人造丝、非织造聚丙烯/人造丝共混物、非织造尼龙、非织造玻璃纤维或其他非织造纤维、滤纸、微孔的疏水性和亲水性膜、玻璃纤维、开孔聚合物泡沫和半渗透性塑料膜(如颗粒填充膜、热诱导相分离(TIPS)隔膜等)及其组合。例如,在其中底物119可用于选择性地富集一种或多种指示试剂(如溴甲酚紫(BCP))的实施例中,底物119可由带电荷的尼龙(例如得自GEOsmonics的重测、带电荷的转移膜(商品名“MAGNAPROBE”(如0.45微米,目录号NP0HY00010,材料号1226566))形成。可采用底物119的方法和系统的实例同样描述于2010年11月1日提交的名称为“MethodofDetectingaBiologicalActivity(检测生物活性的方法)”的共同待审的美国专利申请No.61/408,887中,该专利以引用的方式全文并入本文中。在一些实施例中,插件130、壁118和/或底物119或其开口中的一者或多者的至少一部分可提供第一室109(如在上部116中)与第二室111(如在下部114中)之间的流体连通和/或可控制第一室109与第二室111之间的流体连通(如通过控制第一室109与第二室111之间的流体连接的程度)。生物灭菌指示器100可包括第一流体路径160,其可设置为将在第一室109和第二室111流体连接,并且其可允许灭菌剂(如在灭菌期间,当容器120处于第一未破碎状态时)和/或液体122(如在灭菌后并且在启用期间,当容器120处于第二未破碎状态时)抵达孢子115。在图示实施例中,第一流体路径160可总体上被以下中的一者或多者限定:(1)插件130,如通过下述孔口177,形成于插件130中的开口,和/或插件130周围的任何开放空间,例如介于插件130(如其前部)与壳体102之间;(2)壁118,如通过壁118限定的孔口117;(3)底物119,如形成于其中的孔口121或底物119周围的开放空间,例如介于底物119(如其前部)与壳体102之间;(4)壳体102,如任何开口或形成于其中的空间;以及它们的组合。因此,第一流体路径160在图示实施例中通常通过图7和10中的箭头表示。生物灭菌指示器100还可包括第二流体路径162,其设置为将第二室111与其他室或生物灭菌指示器100的部分例如第一室109流体连接。可进一步将第二流体路径162设置为允许此前存在于第二室111中的气体排出并退出第二室111,例如当灭菌剂和/或液体122移动到第二室111中时。因此,第二流体路径162(其在下文更详细地描述)可用作生物灭菌指示器100中的内部排放口。在一些实施例中,底物119可在第一室109与第二室111之间提供物理屏障或封阻,其可允许下列中的至少一者:控制灭菌剂递送至第二室111中的灭菌剂递送速率/杀灭速率;控制孢子115和/或可检测的产物向第二室111外的扩散;控制当容器120处于第二破碎状态时液体122向第二室111(和向孢子115)的递送速率;或它们的组合。在一些实施例中,由于底物119可在启用期间(即,当容器120处于第二状态时)提供液体122递送至第二室111的物理屏障,底物119中的孔口121和/或底物119的角度可进行控制以实现所需液体递送速率。除此之外或作为另外一种选择,第二流体路径162可提供针对截留在第二室111中的气体或空气的排放口,以有利于在需要时使液体122移动透过或穿过底物119并进入第二室111中。除此之外或作为另外一种选择,壳体102可被构造(例如由适宜的材料形成和/或构造为具有微结构化的凹槽或其他物理表面修饰)得有利于在需要时使液体122移动至第二室111。在一些实施例中,液体122可以包括用于孢子的营养介质,例如将促进活孢子萌芽的萌发介质。在一些实施例中,液体122可以包括水(或另一种溶剂),其可与营养物质混合而形成营养介质。合适的营养物可包括促进存活的孢子的萌发和/或生长所必需的营养物,且可以以干燥形式(例如粉末形式、片剂形式、胶囊形片剂形式、胶囊形式、膜或涂层、包埋在小珠或其他载体中、另一合适的形状或构造或者它们的组合)提供在贮存器103中,例如在生物灭菌指示器100的靠近孢子115的区域中。营养培养基通常可被选择成能引发孢子(如果是活的)的发芽和初始生长。营养介质可以包括一种或多种糖,包括(但不限于)葡萄糖、果糖、纤维二糖等,或者它们的组合。营养介质还可以包括盐,包括(但不限于)氯化钾、氯化钙等,或者它们的组合。在一些实施例中,营养物质还可以包括至少一种氨基酸,包括(但不限于)甲硫氨酸、苯基丙氨酸和色氨酸中的至少一种。在一些实施例中,营养介质可以包含指示分子,例如具有随孢子的萌发或生长而变化的光学性质的指示分子。合适的指示分子可以包括(但不限于)pH指示分子、酶底物、DNA结合染料、RNA结合染料、其他合适的指示分子或者它们的组合。如图4-10中所示,生物灭菌指示器100还可包括插件130。在一些实施例中,插件130可适于保持或负载容器120,使得容器120在灭菌过程中被完整保持在与孢子115分开的某个部位。即,在一些实施例中,插件130可包括(或者充当)容器120的载体132(参见图4),特别是在容器120在启用步骤(即其中液体122从容器120中释放出来并被引入孢子115的步骤,这可出现在灭菌处理之后)中被打破之前。在一些实施例中,插件130可进一步适于允许容器120在壳体102中至少一定程度地(例如相对于壳体102纵向地)移动。图示实施例的插件130在下文更详细地进行描述。其他合适的插件和载体的实例描述于共同待审的PCT公开No.WO2011/011189中。在一些实施例中,生物灭菌指示器100还可包括孢子载体135,如图4-7和9中所示。然而,在一些实施例中,插件130可经改进以包括适于容纳孢子115的部分。例如,在一些实施例中,插件130和孢子载体135可一体地形成为一插件,该插件包括适于在需要时保持并最终破碎容器120第一部分,和适于将孢子115容纳在生物灭菌指示器100的一定区域的第二部分,所述区域在灭菌期间(在破碎之前)与容器120分离。如图4-7和9中所示,孢子载体135可包括孢子贮存器136(其还可被称为凹陷、凹坑、孔、凹陷部等),孢子115在贮存器136中可直接设置在底物上或位于底物上。在采用被设置成在液体122从容器120中释放出来时与该液体进行混合的营养物介质的实施例中,营养物介质可设置成在孢子贮存器136附近或当中,且当水从容器120中释放出来时营养物介质可与水进行混合(如溶于水中)。仅以举例方式来说,在其中营养物介质以干燥形式提供的实施例中,该干燥形式可存在于贮存器103内、孢子贮存器136内、孢子的基材上或者它们的组合。在一些实施例中,可以采用液体和干燥营养介质的混合。在一些实施例中,孢子储存器136的体积至少为约1微升,在一些实施例中,至少为约5微升,而在一些实施例中,至少为约10微升。在一些实施例中,孢子贮存器136的体积不大于约250微升,在一些实施例中,不大于约175微升,而在一些实施例中,不大于约100微升。如图7和9中所示,在一些实施例中,生物灭菌指示器100还可包括可连接至或与壳体102的壁108一体地形成的肋或凸起165,其可设置为将孢子载体135保持在壳体102中的所需位置和/或相对于读取设备12的检测系统(如光学检测系统)保持在所需角度或取向。如图4-7和9中所示,壳体102的第二部分106可适于连接到第一部分104。例如,如图所示,第二部分106可适于连接到壳体102的第一部分104的上部116(如第一端101)。在一些实施例中,如图4-7中所示,第二部分106可为盖件的形式,该盖件其尺寸被设计为使其能接纳壳体102的第一部分104的至少一部分。如图4-5和7-8中所示,在灭菌期间和在启用之前,第二部分106可相对于第一部分104处于第一“未启用”位置148,并且容器120可处于第一完整状态。如图9中所示,壳体102的第二部分106可相对于第一部分104移动至第二“启用”位置150(如第二部分106完全凹陷),并且容器120可处于第二破碎状态。例如,在灭菌后,生物灭菌指示器100可通过将第二部分106从第一位置148移动至第二位置150(即,足够量)来启用,从而导致容器120破碎,并且使液体122从容器120中释放,以允许液体122与孢子115流体连通。生物灭菌指示器100可在将生物灭菌指示器100定位在读取设备的孔中之前、将生物灭菌指示器100定位在孔中之后或将生物灭菌指示器100定位在孔中期间启用(即,生物灭菌指示器100可滑入读取设备中的适当位置,并且第二部分106可继续下压直至处于其第二位置150,例如其中孔的底部提供第二部分106向其第二位置150移动的足够阻力)。相比第一位置148,第二位置150可更靠近生物灭菌指示器100的第一部分104的封闭端105设置。如图示实施例中所示,在一些实施例中,壳体102的第一部分104可包括梯部、悬突部或扁平至圆形的过渡部152。梯部152在第二部分106处于其第一位置148时被示出暴露在外,而在第二部分106处于其第二位置150时被示出经阻挡或覆盖。因此,可检测梯部152以确定第二部分106是否处于第一位置148(即,生物灭菌指示器100未启用)或处于第二位置150(即,生物灭菌指示器100被启用)。使用生物灭菌指示器100的此类特征来确定生物灭菌指示器100的状态(例如确认生物灭菌指示器100是否已启用)在共同待审的美国专利申请No.61/409,042中有更加详细地描述。梯部152的纵向位置仅举例的方式示出;然而,应当理解梯部152可代替地设置在不同的纵向位置(如更靠近生物灭菌指示器100的封闭端105),或在一些实施例中,从圆形部分至平面的过渡部可为渐进的、渐缩的或倾斜的。在壳体102的第一部分104和第二部分106之间可采用多种结合手段,以让第一部分104和第二部分106可移除地互相结合在一起,所述手段包括但不限于重力(例如一个部件可被设置在另一部件或其配合部分的顶上)、螺纹、压装配合式接合(有时也称“摩擦配合式接合”或“干涉配合式接合”)、按扣配合式接合、磁铁、粘合剂、热密封、其他合适的可移除的结合手段以及它们的组合。在一些实施例中,生物灭菌指示器100不需要重新打开,第一部分104和第二部分106不需要可移除地互相连接在一起,而是可永久性或半永久性互相连接在一起。这些永久性或半永久性连接方式可以包括(但不限于)粘接剂、缝线、缝钉、螺钉、钉子、铆钉、平头钉、卷边、焊接(如声波(如超声波)焊接)、任何热粘结技术(例如,向被连接的一个或两个部件施加热量和/或压力)、搭扣配合、压力配合、热密封、其他合适的永久性或半永久性连接方式以及它们的组合。本领域的普通技术人员会知道,某些永久性或半永久性连接装置也可以适于被拆除的,反之亦然,并且仅仅是为了举例说明才按这种方式分类。如图7和9中所示,第二部分106可在第一纵向位置148(相对于第一部分104)与第二纵向位置150(相对于第一部分104)之间移动;然而,应当理解生物灭菌指示器100可替代地以不同方式构造,使得相对于壳体102的第一部分104和第二部分106中的一者或两者而言,第一位置148和第二位置150未必是纵向位置。第二部分106还可包括密封件156(如凸出部、凸起、翼部、凸缘形圈等或者它们的组合),该密封件可设置成接触第一部分104的第一端101,特别是第一部分104的开口上端157,以在第二部分106移动到第二位置150并且液体122从容器120释放出来后(即,当容器120处于第二破碎状态时)封闭或密封(如气密地密封)生物灭菌指示器100。即,孢子115可在容器120处于第二状态时从环境中密封。密封件156可呈多种形式,在图7和9以举例方式显示为形成内环或腔体,该内环或腔体与第二部分106的壁110一起其尺寸被设计为使其能接纳壳体102的第一部分104的上端157以密封生物灭菌指示器100。在一些实施例中,密封件156和上端157中的一者或两者还可包括被构造成分别接合上端157和密封件156中的另一者的结构(如凸起),以使壳体102的第二部分106连接到壳体102的第一部分104。此外,在一些实施例中,壳体102的第二部分106可连接至壳体102的第一部分104以在启用后将生物灭菌指示器100从环境中密封。此类密封可抑制液体122在其从容器120中释放出来后受污染、蒸发或泄漏,和/或可抑制生物灭菌指示器100的内部受污染。插件130将在下文更详细地进行描述。如图4-5和7中所示,在灭菌期间和在启用之前,第二部分106可相对于第一部分104处于第一位置148。在第一位置148中,容器120可完整地保持在与下部114、第二室111或孢子115分开的位置,液体122可容纳在容器120内。如图9中所示,在灭菌之后,可启用生物灭菌指示器100可以将液体122从容器120释放出来,从而使液体122移动至第二室111。即,壳体102的第二部分106可相对于第一部分104移动到第二位置150。当第二部分106从第一位置148移动至第二位置150时,壳体102的第二部分106的密封件156可接合第一部分104的上端157,以将生物灭菌指示器100的贮存器103从环境中密封。在这种实施例中,第二部分106可以在第二位置150可逆地接合第一部分104,而在一些实施例中,第二部分106可以不可逆地接合第一部分104。然而,应当理解,用于第一部分104和第二部分106的结构和连接装置在图示实施例中仅以举例的方式示出,并且任何以上描述的连接装置可替代地在壳体102的第一部分104与第二部分106之间采用。插件130可适于保持或负载容器120,使得容器120在灭菌过程中被完整保持在与孢子115分开的某个位置。即,如上所述,在一些实施例中,插件130可包括(或者充当)容器120的载体132,特别是在容器120在启用步骤(即其中液体122从容器120中释放出来并被引入孢子115的步骤,通常出现在灭菌处理之后)中被打破之前。此外,插件130可做成适于将容器120完整地保持在壳体102的某个位置,该位置维持容器120与壳体102之间和/或容器120与壳体102中的任何其他部件或结构(如插件130的至少一部分,例如载体132等)之间的至少最小间距(如最小横截面积),例如以在生物灭菌指示器100中维持基本上恒定的灭菌剂路径164。在一些实施例中,插件130可做成适于将容器120支持在壳体102中基本上一致的部位。在一些实施例中,如图6所示,壳体102的至少一部分可包括锥形部分146,其中壳体102(例如壁108和/或其内表面)通常在壳体102的纵向DL渐缩。因此,壳体102中的横截面积通常会沿着纵向纵向DL减小。在一些情况中,如不提供维持容器120周围(例如容器120和周围结构之间)的至少最小间距的方式,则有可能容器120会变成在壳体102中(例如在锥形部分146中)被设置成导致它阻塞或堵住灭菌剂路径164。但是,本发明的生物灭菌指示器100被设计成能防止发生这种情况。例如,在图示的实施例中,插件130(特别是载体132)可被构造用于将容器120保持在壳体102的锥形部分146之外,使得在启用之前在生物灭菌指示器100呈任何取向的情况下在容器120周围都维持至少最小的横截面积。例如,在图4-8中所示的实施例中,尽管生物灭菌指示器100被翻倒过来,容器120可能倒落而与插件130脱离接触,但在任何取向下,在生物灭菌指示器100被启用之前容器120都不会移动成更靠近锥形部分146或孢子115。另外,直至启用时,容器120和壳体102和/或插件130之间的最小间距可得到维持,以提供例如在容器120周围的基本上恒定的灭菌剂路径164,经由第一流体路径160并进入第二室111。在一些实施例中,生物灭菌指示器100的各部件其相对大小和位置可被构造成使得在启用之前,容器120被完整保持在生物灭菌指示器100中基本上一致的部位。这种构造可提供基本上恒定的灭菌剂路径164,并可将容器120维持在这么一个位置,在该位置,容器120即使在生物灭菌指示器100启用之前会在其中移动的话,也不能够充分移动。在一些实施例中,插件130的至少一部分可适于允许容器120在壳体102中例如相对于壳体102纵向地在第一(纵向)位置(其中容器120是完整的)与第二(纵向)位置(其中容器120的至少一部分是破碎的)之间移动。仅以举例的方式,插件130可包括一个或多个凸出部或臂158(仅以举例方式显示了在容器120周围间隔的两个凸出部158),凸出部或臂158适于在启用之前保持和支承容器120并在启用期间允许容器120在壳体102中移动,例如当第二部分106相对于壳体102的第一部分104移动时。凸出部158可做成适于(如成形为和/或设置为)在启用生物灭菌指示器时使容器120破碎。因此,插件130可有时用于在启用之前保持容器120完整,并且可用于在启用期间打破容器120。因此,插件130或其一部分有时可称为“载体”(如载体132)和/或“破碎装置”。仅以举例的方式,凸出部158在图4和6-10中被显示为连接至适于邻接分隔壁118的基座或支承件127。例如,基座127的尺寸被设计为使其被接纳在贮存器103中,且其尺寸被设计为使其能位于分隔壁118的顶部、邻接分隔壁118或者以其他方式配合或连接到分隔壁118。与生物灭菌指示器100的内部结构的此类连接可提供在需要时打破容器120的必要阻力或力。但是,在一些实施例中,插件130不包括基座127,并且凸出部158可连接到或形成壳体102的一部分。在一些实施例中,插件130与壳体102一体地形成或由壳体102提供。如图所示,插件130还可包括连接凸出部158并且被成形为容纳壳体102的内表面和/或容器120的外表面的侧壁131。此侧壁131可向凸出部158提供支承和刚度,从而有助于以持续的方式牢靠地打破容器120。侧壁131也可被成形且其尺寸可被设计为在其于启用期间在壳体102中移动时以所需方式引导容器120,(例如)从而以所需方式接触凸出部158,以牢靠地使容器120破碎。壳体102的侧壁131和/或壁108(或其内表面)也可被成形用于将生物灭菌指示器100的第二流体路径162的至少一部分限定在例如插件130的外表面和壳体102的内表面之间。例如,在一些实施例中,如图4-5、8和9中所示,插件130的侧壁131可包括被构造用于形成第二流体路径162的至少一部分的沟槽(或凹槽、凹陷部等)169。第二流体路径162可用作生物灭菌指示器100内的“内部排放口”或“排放沟槽”,以允许气体(如排出的气体,例如已截留在第二室111中的空气(如靠近生物灭菌指示器100的封闭端105)从生物灭菌指示器100的第二室111中逸出。在一些实施例中,第二流体路径162可在启用期间向第二室111中存在的气体提供出口或内部排放口,以有利于在其从容器120中释放时将液体122从第一室109移动到第二室111中。另外或或者,在一些实施例中,第二流体路径162可在灭菌期间向第二室111中存在的气体提供出口或内部排放口,以有利于将灭菌剂移动到生物灭菌指示器100的第二室111中,并将其移动至孢子115,同时更有效地将灭菌剂渗入第二室111中。仅以举例的方式,如图5和10中所示,第二流体路径162可至少部分地被插件130(如沟槽169)的一部分和形成于壳体102的壁108中(如壁108的内表面中)的沟槽(或凹槽、凹陷部等)163限定。然而,应当理解,在一些实施例中,第二流体路径162可完全由壳体102或由生物灭菌指示器100的其他部件的各个组合构成,使得第二流体路径162在第二室111与生物灭菌指示器100的另一个内部部分或区域之间提供流体连接。例如,第二流体路径162无需由壳体102和插件130形成,但可由这些部件或其他部件之一形成。此外,如图5和10中所示,限定第二流体路径162的至少一部分的沟槽163被模制到壳体102的外表面和内表面中,使得沟槽163在壳体102的内部和外部可见。然而,壳体102的外表面无需具有此形状,相反,在一些实施例中,壳体102的外表面可保持大致均匀或不变,并且壳体102的内表面(如壳体102的壁108)可包括沟槽163。此外,在一些实施例中,插件130和壳体102分别均不包括沟槽169或沟槽163,而是,插件130和壳体102被成形且其尺寸被设计为使得与第二室111流体连通的间隔或间隙提供在插件130和壳体102之间,并且此间隔或间隙用作第二流体路径162。如图7和9中进一步所示,在一些实施例中,第一流体路径160和/或第二流体路径162可至少部分地被壁118、底物119、插件130和壳体102中的一个或多个限定。此外,第一流体路径160和第二流体路径162中的至少一者可至少部分地被孢子载体135或其一部分限定。在一些实施例中,当容器120处于第一、即未破碎状态时,生物灭菌指示器100可包括依次布置的以下部件:生物灭菌指示器100的壳体102的封闭端105、第二室111、底物119、插件130、第一室109、容器120、壳体102的开口端101(或壳体102的第二部分106)。如图示实施例中所示,第二流体路径162可允许第二室111排放至生物灭菌指示器100的另一部分,例如第一室109。在一些实施例中,第二流体路径162可在高于(如垂直地高于)第一流体路径160进入第二室111的位置的位置处退出第二室111,特别是在第二流体路径162将第二室111排回到第一室109的实施例中。换句话讲,在一些实施例中,第二流体路径162可从第二室111延伸至生物灭菌指示器100中高于第一流体路径160进入第二室111的位置(如下文所述的第一水平L1或第二水平L2)的位置(如下文所述的第四水平L4)。还有,在一些实施例中,第二流体路径162进入第一室109的位置可高于(如垂直地高于)第一流体路径160进入第二室111的位置。在一些实施例中,第一流体路径160可被设置成将第二室111与生物灭菌指示器100的近端部分(如第一室109中靠近或邻近第二室111设置的一部分,如位于第一水平L1和/或第二水平L2)流体连接,并且第二流体路径162可被设置成将第二室111与生物灭菌指示器100的远端部分(即,第一室109中远离第二室111设置的一部分,如位于下文所述的第三水平L3,和/或第四水平L4)流体连接。这样,第二流体路径162进入第一室109的位置可比第一流体路径160进入第二室111的位置更远离第二室111设置。更具体地讲,并且仅以举例的方式,参照图7和9,在一些实施例中,流体可在多个位置进入第二室111,这些位置为例如在通常位于插件130、底物119、壳体102和/或第二室111的前部的第一水平、高度或位置(如纵向位置)L1以及在大致位于底物119中的孔口121的水平上的第二水平、高度或位置(如纵向位置)L2。如上所述,应当理解,位于第一室109与第二室111之间允许流体移动到第二室111中的多个开口和间隔可统称为第一流体路径160。如图7中进一步所示,在一些实施例中,气体(如排出的气体)可在通常位于插件130、底物119、壳体102和/或第二室111的后部的第三水平、高度或位置(如纵向位置)L3通过第二流体路径162退出第二室111(即,当流体通过第一流体路径160移动到第二室111中时)。在图7和9中所示的生物灭菌指示器100的竖直取向上,第三水平L3位于或高于第一水平L1和第二水平L2。此外,在一些实施例中,第三水平L3在生物灭菌指示器100的操作中(如位于读取设备的孔中时、在灭菌期间和/或在启用期间)仍可位于或高于第一水平L1和第二水平L2。即,在一些实施例中,生物灭菌指示器100可在操作中倾斜(如朝向图7或9的左侧,朝向图4或6的右侧,进入图4或6的页面,和/或离开图7或9的页面)。第一、第二和第三水平L1、L2和L3仅以举例的方式示出;然而,应当理解,第一流体路径160进入第二室111的确切位置和/或第二流体路径162退出第二室111的确切位置可与图7和9中所示的不同。如图7和9中所示,第二流体路径162至少部分地被插件130的沟槽169和/或壳体102的沟槽163限定,这些沟槽在下面的讨论中通常被简称为“沟槽”,可将其理解为是指图示实施例的沟槽163和/或沟槽169的至少一部分。在图示实施例中,沟槽具有可被描述为位于第二室111中的任何点或第三水平L3的入口和通常设置在第四水平、高度或位置(如纵向位置)L4的出口。如图7和9中所示,沟槽的退出位置(即,第四水平L4)通常位于第一流体路径160与第二室111连接的位置(即,第一水平L1和/或第二水平L2)上方,例如在生物灭菌指示器100的操作中。换句话讲,第一流体路径160可被设置成将第一室109的第二(下)端113流体连接到第二室111的第一(上)端124。另一方面,第二流体路径162可被设置成将第二室111(如第二室111的第一(上)端124)流体连接到第一室109的上部(如第一(上)端112)。此外,在一些实施例中,第二流体路径162(或沟槽)与第二室111连接的位置或水平可被描述为位于第二室111的部分处,该部分在容器120处于其第二破碎状态时最后填充有液体122。在一些实施例中,当容器120处于第二破碎状态并且第二室111至少部分地填充有液体122时,液体122可具有水平、高度或位置(如纵向位置)L,并且第二流体路径162可在低于水平L的位置与高于水平L的位置之间延伸。因此,当第二室111在该容器处于第二状态时填充有液体122时,第二室111可被第二流体路径162连续地排放。在一些实施例中,第一流体路径160可用作第一室109和第二室111之间的主要或一级流体连通路径,并且第二流体路径162可用作第二室111和第一室109之间的辅助或二级流体连通路径(如当第二流体路径162在第一室109而非生物灭菌指示器100的另一部分中退出时)。在此类实施例中,第二流体路径162的总空间、空间和/或面积可显著小于第一流体路径160。在一些实施例中,第一流体路径160和第二流体路径162的至少一部分可被描述为彼此大致隔离或大致平行和不相交。在一些实施例中,第一流体路径160和第二流体路径162可各自在第一室109和第二室111之间大致纵向(如大致平行于纵向DL)延伸。即,一般来讲,包括(1)第一流体路径,例如被构造用于容纳从第一室109到第二室111的至少大部分流体移动的第一流体路径160;和(2)第二流体路径,例如被构造用于从第二室111排放气体的第二流体路径162的生物灭菌指示器100将优于以下生物灭菌指示器100,其包括仅一个内室或仅一个连接第一室109和第二室111的流体路径,使得气体将不得不通过流体进入第二室111的相同流体路径退出第二室111。通过构造第一流体路径160和第二流体路径162(如图示实施例中所示),在一些实施例中,生物灭菌指示器100可至少部分地消除由于尝试将灭菌剂和/或液体122移动到第二室111中而可能发生的任何气锁效应。此外,在一些实施例中,第二流体路径162可允许生物灭菌指示器100被启用,并且可允许液体122由于重力而被移动到第二室111中,同时生物灭菌指示器100保持在相同的取向上(如大致竖直取向,如图4-5、7和9中所示),而无需将生物灭菌指示器100翻倒过来,或以其他方式重新取向,便可将液体122移动到第二室111中。继续参照插件130,插件130的凸出部158被示为相对刚性和静止的。即,在一些实施例中,凸出部158可能不适于显著挠曲、扭曲、变形,否则在其于壳体102中移动时,请注意容器120。相反,在一些实施例中,如图4-7和9中所示,凸出部158可各自被构造用于具有上端159,容器120可设置在该上端的顶部且在启用之前保持完整。如图4-5和7中所示,在一些实施例中,凸出部158可被设置成使容器120在其圆角末端破碎,例如当采用椭圆形或胶囊形状的容器120时。使凸出部158形成载体132的至少一部分的一个潜在优点是,当容器120破碎时,容器120的底部可以不受限制,使得液体122可相对容易和可靠地从容器120释放并向孢子115移动。在此类实施例中,插件130可用于在与容器120的平坦侧面基本上垂直的方向使容器120破碎,例如当采用椭圆形或胶囊形状的容器120时。在此类实施例中,可实现沿着容器120的侧面使其破碎,同时在容器120的下端周围维持一些开放空间,以有利于当容器120破碎时使液体122从容器120移动到孢子115的近邻。如上所述,凸出部158可适于在容器120相对于壳体102移动(如沿着纵向DL)时使容器120破碎,例如,所述移动是响应壳体102的第二部分106相对于壳体102的第一部分104移动(如从第一位置148移动到第二位置150)而发生。在一些实施例中,凸出部158可包括一个或多个边缘(如锥形边缘)或尖端或者以别的方式被构造成使挤压力集中以增加在邻近凸出部158的区域中对容器120的压力,并有利于更容易地和在一个或多个所需区域使容器120破碎。在一些实施例中,这种使力量的集中可减少使第二部分106相对于第一部分104移动并使容器120(或其一部分)破碎所需要的总作用力或力量。如图4-7和9中所示,凸出部158与插件130的基座127做成一体;然而,应当理解,凸出部158相反也可与壳体102的壁108做成一体。此外,在一些实施例中,凸出部158可连接到壳体102或凸出部158,并且基座127可由单独的插件提供。在此类实施例中,各凸出部158可各自为单独的插件,或者多个凸出部158可由一个或多个插件提供。此外,插件130可被构造成用于邻接壁118,以防止插件130的第一部分移动到孢子115的邻近(如壳体102的下部114)。此外,在一些实施例中,如图4-7和9中所示,凸出部158可沿着纵向DL延伸一定距离,并且可定制凸出部158的长度和/或厚度(如其可沿着长度变化)以控制容器120在壳体102中的所需位置和以所需的方式破碎。凸出部158的构造在图4-10中仅以举例的方式示出。通常,每个凸出部158仅以举例的方式被示出为厚度沿着纵向DL朝向孢子115增加(如朝着容器120或壳体102的中央向内增加)。这种构造可递减随着容器120移动朝向孢子115而对于容器120可用的横截面积,所述移动例如是响应第二部分106移动到第二位置150而发生。此外,生物灭菌指示器100在图3-10中仅以举例方式示出为包括两个凸出部158和一个侧壁131,但应理解,可采用一个凸出部158或者在结构上可能的情况下采用尽可能多的凸出部,以及其他构造。此外,凸出部158可根据需要成形和设计其尺寸,这取决于壳体102的形状和维度、容器120的形状和维度、插件130的形状和维度、和/或使容器120破碎所需的方式和位置。如上所述,在一些实施例中,壳体102的至少一部分可为渐缩的(见如图6中的锥形部分146)。因此,壳体102中的横截面积通常会沿着纵向DL减少。但应理解,壳体102的内部维度通常可沿着纵向D1在锥形部分中减少,而壳体102的外部维度则不变。在一些实施例中,壳体102的外部维度可沿着其长度方向是相同的,尽管壳体102的内部部分沿着其长度方向逐渐变细。在一些实施例中,该一个或多个凸出部158独自可沿着纵向DL改变厚度(即朝向容器120,如沿径向方向),使得随着在启用期间容器120在壳体102中移动,对于容器120可用的横截面积通常递减,尽管壳体102的尺寸不改变(如尽管壳体102不包括任何锥形部分146,无论在内部还是在外部)。如如图4-10中所示,每个凸出部158的上端159包括圆形的、弧形的或弓形的表面,这可有利于容器120从其中容器120至少部分地居于凸出部158的上端159之上的第一位置148移动到这么一个位置,在该位置,容器120被至少部分地迫使进入各凸出部158之间(或壳体102的壁108和一个或多个凸出部158之间)的较小横截面积区域中。另外,圆形上端159可防止容器120的过早打破,而这可防止生物灭菌指示器100的过早启用(即液体122的过早释放)。在一些实施例中,如图6中所示,插件130的大小和形状可被确定为使得容器120被支持在凸出部158上方并在邻近一个或多个凸出部158的朝内表面的任何部分的区域之外,以防止生物灭菌指示器100的意外或过早启用。这种构造还可防止因震动或材料膨胀(如由于灭菌处理过程中暴露于热所致)而发生的意外破碎。载体132(其可至少部分地由凸出部158的上端159形成)可被构造用于容纳容器120的底部部分,而凸出部158可被设置成在容器120被设置在壳体102中时在容器120底部附近的位置使容器120破碎。这种构造可使得容器120可以在其底部附近被打破,且可有利于液体122从容器120的排出,而这可提高液体122对孢子115的可利用率,和可提高液体122释放出来与孢子115(如与孢子贮存器136)成流体连通的可靠性。这种构造是仅以举例方式示出的,但是应理解,凸出部158可被构造和设置成按任何所需的方式使容器120破碎。本发明的一些实施例用较小的力向易碎容器120提供最佳和安全的打破,同时提高液体122至生物灭菌指示器100的孢子区域(如壳体102的第二室111)中的转移,和/或提高液体122在生物灭菌指示器100的孢子区域中的容纳。此外,实施本发明的一些实施例,以将液体驱动至生物灭菌指示器100的特定区域,例如生物灭菌指示器100的检测室(如第二室111)。在图4-10中所示的实施例中,插件130被示为包括两个在容器120周围和/或侧壁131周围大约等距间隔的凸出部158。然而,在一些实施例中,侧壁131可包括一个从侧壁131径向向内延伸的实体(如大致环形或半环形)凸出部158。此外,在一些实施例中,侧壁131可比如图所示在壳体102的内表面周围延伸得更远。但是,采用一个或多个较窄(如在角维度上)的凸出部158,如图4-10中所示的那些凸出部,可提供围绕容器120的基本上恒定或基本上畅通无阻的灭菌剂路径164。无论插件130是否包括一个或多个凸出部158或侧壁131,插件130均可被构造用于将容器120支持在壳体102中的一致的位置,以在灭菌期间提供基本上恒定的灭菌剂路径164。例如,插件130可将容器120支持在基本上一致的位置,而不是让容器120在启用之前(如在灭菌过程中)在壳体102中移动或转动(如径向和/或纵向),这可给灭菌剂留出在容器120的外表面和壳体102的内表面之间的基本上一致和相对畅通无阻的路径,发生无意堵住的机会极少或不存在。如图示实施例中所示,插件130还可包括相对于生物灭菌指示器的纵向DL大致水平或垂直设置(如在插件130设置在生物灭菌指示器中时)的一个或多个凸出部161。凸出部161可被称为“第二凸出部”或“水平凸出部”,而用于保持和/或打破容器120的凸出部158可被称为“第一凸出部”或“垂直凸出部”。第二凸出部161不像基座127那样向下成角度。因此,第二凸出部161可用于多种目的。例如,第二凸出部161在破碎容器120的力下可使插件130稳固(如有助于将插件130保持在生物灭菌指示器100的壳体102中的所需位置)。另外,第二凸出部161可起到在容器被破碎后保留和/或收集容器120的破碎部分的作用,以防止这些部分移动到生物灭菌指示器中的孢子的近邻中,若这些部分发生这种移动的话会不利影响孢子生长和/或孢子生长的检测。可采用第二凸出部161的其他形状和构造,其仍允许流体向下移动至孢子115,同时防止固体向下移动至孢子115。在一些实施例中,插件130(如基座127)可适于有利于或允许流体移动(如移动液体122)到壳体102的第二室111(即,下部114)中;最小化破碎容器120的小部分或部分(如固体)移动到壳体102的第二室111中,即收集和/或保持破碎容器120的部分;和/或最小化孢子115和/或信号向壳体102的第二室111外的扩散中的一者或多者。例如,在一些实施例中,基座127可被构造用于用作格栅或过滤器。在一些实施例中,通过荧光指示剂/分子(如荧光团)或其他标志物来确定孢子生长。在一些实施例中,如果在启用之后生物灭菌指示器100中的液位在孢子115的部位的上方,则这种分子或标志物或者孢子115本身可移动或扩散离开孢子贮存器136或者移动或扩散到孢子贮存器136之外,并潜在地移动或扩散到壳体102的第二室111之外。因此,生物灭菌指示器100的部分(如插件130)可被构造用于抑制多个指示剂、分子和/或标志物向生物灭菌指示器100的第二室111外的不良扩散。在一些实施例中,如上所述,底物119也可抑制此不良扩散。在图4-7中所示的实施例中,插件130的基座127通常为U形或马蹄形且包括中央孔口177(参见图5),该孔口有利于灭菌过程中灭菌剂向孢子115的移动和启用过程中液体122向孢子115的移动。基座127的马蹄形状可增加壳体102的上部116(即,第一室109)和下部114(即,第二室111)之间的开口;然而,该形状仅以举例的方式示出,并且可采用其他形状。在一些实施例中,插件130可被描述为包括一个或多个向下延伸的凸出部127,这些凸出部适于邻接或以其他方式连接到壁118或生物灭菌指示器100的另一个内部结构,以向插件130提供基座或支承件来防止在启用之前插件130和容器120相对于壳体102移动,和/或提供阻力或力来有助于在启用期间打破容器120。因此,在一些实施例中,基座127相反可被称为“第三凸出部”127。如图示实施例中所示,在一些实施例中,插件130可被构造用于完全位于生物灭菌指示器100的第一室109中,使得插件130不会延伸至第二室111中,否则会潜在地干扰探查或检测过程。此外,插件130可被构造用于防止生物灭菌指示器100的其他部分(如破碎容器120)移动到第二室111中。图示实施例的插件130通常对中央纵向对称线对称,使得这里存在两个相同的第一凸出部158、两个相同的第二凸出部161和两个相同的第三凸出部127。然而,插件130无需包括任何对称线,并且第一凸出部158无需彼此相同,第二凸出部161无需彼此相同,并且第三凸出部127无需彼此相同。插件130以及多个凸出部158、161和127的大小和位置可被确定成控制灭菌剂路径164,例如定制生物灭菌指示器100的杀灭/存活率,防止容器容器120的无意破碎,有利于容器120在壳体120中的移动,配合或接合壳体102和/或控制容器120的打破。仅以举例的方式,示出的插件130被示为包括至少以下的一体装置:用于在启用之前保持容器120、用于在启用期间破碎容器120的装置;用于允许容器120在壳体102中移动;用于提供基本上恒定的灭菌剂路径164,用于在启用之后收集和/或保持破碎容器120的部分(或至少部分地防止破碎容器120的部分移动到壳体102的第二室111中);和/或用于在启用之后最小化孢子115和/或信号从第二室111向壳体102的第一室109扩散。但应理解,在一些实施例中,插件130可包括多个部分,这些部分可能不是单个一体装置的零件,且这些部分中的每一个都可适于完成上述功能中的一个或多个。插件130被称为“插件”,这是因为在图示实施例中,执行上述功能的装置是可被插入到壳体102的贮存器103(特别是第一室109)中的装置。但应理解,插件130可改为由壳体102本身或者生物灭菌指示器100的另一部件来提供,且不需要必定可插入到壳体102中。出于简便起见,在本说明书通篇中将描述到术语“插件”,但应理解,该术语并不意在具有限制意义,且应认识到,可使用其他能执行一个或多个上述功能的等同结构来代替可插入的插件130或者与可插入的插件130组合使用。此外,图示实施例中,插件130既可以插入壳体102中也可以从壳体102移除,具体而言是插入壳体102的第一部分104(和第一室109)中和从中移除。但应理解,尽管插件130可插入壳体102中,但插件130不必需可从壳体102移除,而是可固定连接到壳体102,使得在将插件130设置在所需的部位后防止插件130从壳体102脱除。在一些实施例中,壳体102的至少一部分例如壳体102的下部114可对某个电磁辐射波长或者波长范围透明(如当采用可见光光学检测方法时对可见光透明),这可有利于孢子生长的检测。即,在一些实施例中,如图6、7和9中所示,壳体102的至少一部分可包括或构成检测窗167。另外,在一些实施例中,如图6中所示,壳体102的至少一部分例如下部114可包括一个或多个平坦壁168。这种平坦壁168可有利于孢子生长的检测(如光学检测)。另外,如上所示且如上所述,壳体102的第一部分104的壁108可包括一个或多个阶梯或锥形区域,如梯部152、梯部123以及锥形壁或梯部170。锥形壁170可起到减小壳体102的下部或检测部分114的整体厚度和尺寸的作用,使得除了减小内部维度之外,还要减小壳体102的外部维度。生物灭菌指示器100的下部114的尺寸和/或厚度的这种减小可有利于检测。另外,具有一个或多个特征,例如梯部和/或锥形壁123、152、170,可允许生物灭菌指示器100以唯一一个取向连接到读数器或检测装置,使得生物灭菌指示器100相对于读取设备被“锁定”,这可最小化用户误差并提高检测过程的可靠性。在一些实施例中,生物灭菌指示器100的一个或多个部分可相对于读取设备被锁定。本发明的生物灭菌指示器通常在灭菌过程中保持液体122和孢子115分开但又相对紧密近邻(如在整装生物灭菌指示器100内),使得液体122和孢子115在暴露于灭菌处理后可容易地组合。液体122和孢子115可在检测过程期间温育(如读取设备12可温育生物灭菌指示器100),或生物灭菌指示器100可在检测过程之前温育。在一些实施例中,当将孢子与液体122一起温育时,可使用室温以上的温育温度。例如,在一些实施例中,温育温度为至少约37℃,在一些实施例中,温育温度为至少约50℃(如56℃),在一些实施例中,至少约60℃。在一些实施例中,温育温度不大于约60℃,在一些实施例中,不大于约50℃,在一些实施例中,不大于约40℃。检测过程可适于检测来自孢子115(如来自孢子贮存器136内)或围绕孢子115的液体122的可检测变化。也即,检测过程可适于检测多种特性,包括但不限于电磁辐射(如在紫外、可见光和/或红外波段)、荧光、发光、光散射、电子性质(如电导、阻抗等或者它们的组合)、浊度、吸收、拉曼光谱、椭圆光度法等或者它们的组合。对这些特性的检测可通过用荧光计、分光光度计、比色计等或者它们的组合中的一种或多种来进行。在一些实施例中,例如在测量荧光、可见光等的实施例中,通过以特定的波长进行检测来测量可检测变化。由于作为孢子生存能力的标志的生化反应,孢子和/或液体122可适于(如被标记成)产生一个或多个上述特性。结果,没有可检测变化(如,与基线或背景读数相比)可表示有效的消毒处理,而可检测变化则可表示无效的消毒处理。在一些实施例中,可检测变化可包括一个或多个上述特性的变化率(如,增加的荧光、降低的浊度等)。在一些实施例中,孢子生存能力可以通过利用酶活性来确定。如在Matner等人的标题为“RapidMethodforDeterminingEfficacyofaSterilizationCycleandRapidRead-outBiologicalIndicator”(测定灭菌循环的有效性的快速方法及快速读出生物指示器)的美国专利No.5,073,488(其以引用方式并入本文)中所述,对于特定类型的孢子可进行酶类的鉴定,在所述孢子中该酶具有特别有用的特性,可利用该特性测定灭菌处理的有效性。此类特性可包括以下特性:(1)当经受足以将1×106的测试微生物的总数减少大约6个对数单位(即,减少至大约为零,如没有测试微生物增长出时测得的那样)的消毒条件时,酶具有与通过与酶底物系统反应所测量的“背景”相等的残留活性;和(2)当经受仅仅足以将1×106的测试微生物的总数减少至少1个对数单位但小于6个对数单位的消毒条件时,酶具有的酶活性大于通过与酶底物系统反应所测量的“背景”。酶底物系统可包括底物或底物的混合物,底物受到酶的作用而产生可检测的酶改性产物,通过可检测变化而显见。在一些实施例中,生物灭菌指示器100可以以单侧模式进行测试,其中生物灭菌指示器100仅包括一个设置成例如靠近孢子115的检测窗(如图6的检测窗167)。但是,在一些实施例中,生物灭菌指示器100可包括超过一个检测窗(如由壳体102的下部114的两个平行壁168的全部或一部分所形成的窗),使得生物灭菌指示器100可通过超过一个检测窗进行测试。在采用多个检测窗的实施例中,检测窗可并排设置(类似于单侧模式),或者检测窗可相对于彼此成角度(如90度、180度等)取向。一般地,孢子115被设置在与贮存器103成流体连通的孢子贮存器136内。在一些实施例中,孢子贮存器136构成贮存器103的一部分(如第二室111的一部分)。如图7中所示,贮存器103在灭菌过程中与周围环境成流体连通(如通过孔口107),以让灭菌剂在灭菌处理的过程中进入贮存器103来对孢子115进行灭菌。容器120可被设置成在灭菌过程中装着液体122,以防止液体122在灭菌过程中与孢子115、贮存器103和灭菌剂成流体连通。下面来更详细地描述孢子115和/或孢子贮存器136的各个细节。在一些实施例中,孢子115可被直接设置在壳体102的下部114中,或者孢子115可被设置在孢子贮存器如孢子贮存器136中(如由孢子载体135提供)。无论孢子115被直接设置在壳体102的下部114还是在孢子贮存器中,孢子115都可以以多种方式提供。在一些实施例中,孢子115可在孢子悬浮液中,该孢子悬浮液可被设置在生物灭菌指示器100中的所需部位并被干燥。在一些实施例中,孢子115可在基材(未示出)上提供,该基材可被设置和/或紧固在生物灭菌指示器100中的所需部位。一些实施例可包括以干燥形式提供的孢子115和在基材上提供的孢子115的组合。在一些实施例中,基材可被设置成支承孢子115和/或帮助将孢子115维持在所需座位。这种基材可包括多种材料,包括但不限于纸张、聚合物(如以上针对壳体102所列举的聚合物的任何一种)、粘合剂(如丙烯酸酯、天然或合成橡胶、硅树脂、硅树脂聚脲、异氰酸酯、环氧树脂或者它们的组合)、织造布、非织造布、微孔材料(如微孔聚合物材料)、反射材料(如金属箔)、玻璃、瓷、陶、凝胶形成材料(如瓜耳胶)或者它们的组合。除此之外,或者作为另外一种选择,这种基材可包括或被连接到亲水涂层,以有利于使液体122与孢子115密切接触(如当所采用的液体122为含水液体时)。除此之外,或者作为另外一种选择,这种亲水涂层可施加到任何设置成使液体122和孢子115成流体连接(fluidlycouple)的流体通道。在一些实施例中,除了亲水涂层,或者代替亲水涂层,可将疏水涂层施加到壳体102的其他部分(如壳体102的下部114)和/或孢子贮存器136,使得液体122优先移动到与孢子115接触。生物灭菌指示器100的一些实施例不包括孢子载体135。相反,孢子贮存器136由壳体102的下部114本身提供,孢子115可被设置在下部114中、吸附到下部114的内表面或壁、或者这两种情况的组合。在一些实施例中,孢子115可在被设置在壳体102的下部114中的基材上提供。在一些实施例中,孢子115可被设置在一个孢子座位中或者在多个孢子座位中,这些座位都可被设置在贮存器103中、壳体102的下部114中和/或孢子贮存器136中。在一些实施例中,具有多个孢子座位的话可最大程度地使孢子暴露于灭菌剂和暴露于液体122,可改进制造过程(如通过将每个孢子座位放置在生物灭菌指示器100内的凹部,可有利于孢子的放置),且可改进检测特性(如因为处于一个大的孢子座位的中间的孢子可能不那么容易检测)。在采用多个孢子座位的实施例中,每个孢子座位都可以包括单独的、已知数量的孢子,和/或每个孢子座位都可以包括不同的孢子,使得可以测试多种孢子类型。通过采用多种类型的孢子,生物灭菌指示器100可以用于各种灭菌处理,并且针对特定的灭菌处理可以分析特定的孢子座位,或者多种类型的孢子可以用来进一步测试灭菌处理的有效性或者说可信度。另外,在一些实施例中,生物灭菌指示器100可包括多个孢子贮存器136,且每个孢子贮存器136可包括一个或多个孢子座位115。在采用多个孢子贮存器136的一些实施例中,所述多个孢子贮存器136可被设置成与贮存器103成流体连通。在一些实施例中,孢子115可用适于装在孢子115和/或孢子贮存器136之中或之上的覆盖件(未示出)盖住。这种覆盖件可有助于在制造、灭菌和/或使用过程中将孢子维持在生物灭菌指示器100的所需区域内。如果采用覆盖件的话,其可由基本上不会干扰检测过程和/或至少部分地能透过目标电磁辐射波长的材料形成。另外,取决于覆盖件的材料构成,在一些实施例中,此盖子可有利于顺着孢子115芯吸液体122(如营养物介质)。在一些实施例中,盖件还可包含有利于流体流入孢子贮存器136中(或流至孢子115)的特征,如毛细管通道、亲水性微孔纤维或膜等,或者它们的组合。此外,在一些实施例中,覆盖件可以隔离信号,或增强信号,这可以有助于检测。无论孢子115被设置在孢子贮存器136内还是直接设置在壳体102的下部114中,都可以采用这种覆盖件。另外,这种覆盖件可在采用多个孢子座位的实施例中采用。覆盖件可以包括各种材料,包括(但不限于)纸张、聚合物(如,以上对壳体102所列举的聚合物中的任一种)、粘合剂(如,丙烯酸酯、天然或合成橡胶、硅树脂、硅树脂聚脲、异氰酸酯、环氧树脂,或者它们的组合)、织造布、非织造布、微孔材料(如,微孔聚合物材料)、玻璃、瓷、陶、凝胶形成材料(如,瓜耳胶),或者它们的组合。在一些实施例中,生物灭菌指示器100还可以包括改性的内表面,如反射表面、白色表面、黑色表面、或适合于使表面的光学性质最优化的另一种表面改性。反射表面(如由金属箔提供)可被设置成将从分析或检测装置发送到孢子贮存器136的信号反射回到分析装置和/或将孢子贮存器136内产生的任何信号反射回到分析装置。结果,反射表面可起到改进来自生物灭菌指示器100的信号(如改进信号的强度)的作用。此反射表面可由以下提供,壳体102的内表面;连接到壳体102的内表面的材料;孢子贮存器136的内表面;连接到孢子贮存器136的内表面的材料;等;或反射表面可形成孢子底物的一部分或连接到孢子底物;或它们的组合。类似地,在一些实施例中,生物灭菌指示器100还可包括白色和/或黑色表面,所述表面设置成增强和/或降低被从测试装置输送到孢子贮存器136中的特定信号,和/或设置成增强和/或降低孢子贮存器136内产生的特定信号。仅以举例方式来说,白色表面可用来增强信号,黑色表面可用来减少信号(如噪声)。在一些实施例中,孢子115可被设置在官能化表面上,以促进孢子115在期望的表面上的固定化。例如,这种官能化表面可由壳体102的内表面、孢子贮存器136的内表面来提供,可形成孢子底物的一部分或者连接到孢子底物,等等,或者它们的组合。在一些实施例中,孢子115被设置(如通过涂覆或其它施加方法施加)在微结构化或微复制型表面上(如诸如Halverson等人,PCT公开号WO2007/070310、Hanschen等人,美国公开号US2003/0235677和Graham等人,PCT公开号WO2004/000569中所公开的那些微结构化表面,所有这些专利都以引用方式并入本文)。例如,这种微结构化表面可由壳体102的内表面提供,可由孢子贮存器136的内表面提供,可形成孢子底物的一部分或者连接到孢子底物,等等,或者它们的组合。在一些实施例中,生物灭菌指示器100还可包括凝胶形成材料,该凝胶形成材料设置成在液体122从容器120中释放出来时与孢子115和液体122组合。例如,凝胶形成材料可被设置在孢子115附近(如在孢子贮存器136中)、在壳体102的下部114中,可形成孢子底物的一部分或者连接到孢子底物,等等,或者它们的组合。当液体122与孢子接触时,这种凝胶形成材料可以形成包含孢子和营养物质的凝胶(如,水凝胶)或基质。凝胶形成材料(如,瓜耳胶)可特别有用,因为它具有在水化时形成凝胶的能力,可有助于使信号(如,荧光)定域化,可将孢子115固定就位,可帮助使来自孢子贮存器136的孢子115和/或信号的扩散最小化,和/或可增强检测。在一些实施例中,生物灭菌指示器100还可以包括吸收剂或芯吸材料。例如,芯吸材料可被设置在孢子115附近(如在孢子贮存器136中),可形成孢子底物的一部分或者连接到孢子底物,等等,或者它们的组合。这种芯吸材料可包括多孔的芯吸垫、浸泡垫等,或者它们的组合,以有利于使液体122与孢子紧密接触。在一些实施例中,易碎容器120可被构造成有利于以所需的方式使易碎容器120破碎。例如,在一些实施例中,易碎容器120的下部可由较薄和/或较弱的材料形成,使得下部先于易碎容器120的其余部分而破碎。另外,在一些实施例中,易碎容器120可包括多个设置成有利于以所需的方式使易碎容器120碎裂的特征,包括但不限于薄的和/或弱化的区域、刻线、穿孔等,或者它们的组合。易碎容器120可具有第一封闭状态和第二开放状态,在第一封闭状态中,液体122被包含在易碎容器120内,而在第二开放状态中,易碎容器120发生破碎,液体122被释放到贮存器103和/或孢子贮存器136中,并与孢子115流体连通。在一些实施例中,生物灭菌指示器100可以手动方式进行启用(如可将第二部分106移动到第二位置150)。在一些实施例中,生物灭菌指示器100可通过读取设备启用(如当生物灭菌指示器100设置在读取设备中时)。在一些实施例中,生物灭菌指示器100可通过独立于此读取设备的装置(如启用装置)启用,例如通过在将生物灭菌指示器100设置在读取设备的孔中之前将生物灭菌指示器100设置在该装置中。在一些实施例中,生物灭菌指示器100可由该读取设备、独立于该读取设备的装置和手动启用中的两者或更多者的组合来启用。生物灭菌指示器100和另一装置(如读取设备)中的一者或两者可进一步被构造为用于防止易碎容器120的过早或意外破碎。例如,在一些实施例中,生物灭菌指示器100、启用装置或读取设备可包括可包括锁或锁定机构,该锁或锁定机构被设置成防止壳体102的第二部分106在有需要之前移动到第二位置150中。在此类实施例中,在该锁移动、移除或解锁之前,生物灭菌指示器100不能被启用。除此之外,或者作为另外一种选择,在一些实施例中,生物灭菌指示器100、启用装置和/或读取设备可包括被设置成防止在启用之后壳体102的第二部分106从第二位置150移动回到第一位置148中的锁或锁定机构。在一些实施例中,如图示实施例中所示,壳体的至少一部分可以是平坦的(如平行的壁168),且可以相对于孢子贮存器136基本上是平坦的,而且各平行壁168中的一个或两个或者它们的部分(如检测窗167)其大小可被确定成使得壁168(或检测窗167)的至少一个维度基本上匹配孢子贮存器136和/或孢子座位115的至少一个维度。换句话说,壁168或其部分(如检测窗167)可包括与孢子贮存器136和/或孢子座位115的横截面积基本上相同大小的横截面积。壁168/检测窗167和孢子贮存器136和/或孢子座位115之间的这种大小匹配可使在检测或测试处理的过程中检测到的信号最大化。作为另外一种选择,或者除此之外,壁168或检测窗167其大小可被确定成使其匹配贮存器103(如至少一个维度或横截面积的大小可被确定成匹配)。各检测区域之间的这种大小匹配可改进孢子测试和检测。对于图4-10中所示的生物灭菌指示器100,至少该生物灭菌指示器100的设置孢子115的部分是较薄的(即“z维度”被减至最低),使得从孢子到壁168(或检测窗167)的光学路径被减至最低和/或干扰性物质在液体122(或营养物培养基)中的任何效应被减至最低。在使用时,可将生物灭菌指示器100与一批要灭菌的物品放在一起进行灭菌处理。在灭菌期间,灭菌剂主要通过灭菌剂路径164与贮存器103(即,第一室109和第二室111)、孢子贮存器136和孢子115流体连通,使得灭菌剂可抵达这些孢子而产生灭菌的孢子。如上所述,第一流体路径160与第二流体路径162的配合可有利于灭菌剂移动到第二室111中,特别是移动到生物灭菌指示器100的封闭端105中。此外,在灭菌期间,易碎容器120处于封闭状态,其至少部分地被插件130的载体132保持完整。当易碎容器120处于封闭状态时,液体122不受灭菌剂的影响,并且不与贮存器103(特别是至少部分地由壳体102的下部114构成的第二贮存器111)、孢子贮存器136、孢子115或灭菌剂路径164流体连通。灭菌还可包括在容器120处于第一状态时将灭菌剂通过第一流体路径160从第一室109移动至第二室111,并将排出的气体(如截留的空气)通过第二流体路径162移出第二室111以响应或有利于将灭菌剂从第一室109移动至第二室111。在灭菌之后,可使用生物灭菌指示器100来测定灭菌处理的有效性。可解锁壳体102的第二部分106(如果此前被锁定在第一位置148的话),并且将其从第一位置148(见图6)移动至第二位置150(见图7)以启用生物灭菌指示器100。第二部分106的这种移动可造成易碎容器120在壳体102中例如沿着纵向DL从各凸出部158的上端159上方的位置移动至各凸出部158的内部中的某个位置,这可造成易碎容器120破碎。使易碎容器120破碎,可使易碎容器120从其封闭状态变成其开放状态,从而使液体122释放到贮存器103中并使其与孢子贮存器136和孢子115成流体连通。液体122可包含孢子的营养物介质(如萌发介质),或者液体122可接触干燥形式(如粉末形式或片剂形式)的营养物介质以形成营养物介质,使得形成包含经灭菌的孢子和营养物介质的混合物。然后可在检测或分析过程之前或期间将该混合物进行温育,并可探查生物灭菌指示器100以确认孢子生长的迹象。启用还可包括在容器120处于第二状态时将液体122通过第一流体路径160从第一室109移动至第二室111,并将排出的气体(如截留的空气)通过第二流体路径162移出第二室111以响应或有利于将液体122通过第一流体路径160从第一室109移动至第二室111。为检测孢子115中的可检测变化,可在液体122和孢子115进行了组合后立即分析生物灭菌指示器100以获得基线读数。之后,可检测任何偏离基线读数的可检测变化。生物灭菌指示器100可连续地或间断地进行监测和测量。在一些实施例中,可以在测量可检测变化之前执行温育步骤的一部分或全部。在一些实施例中,温育可在一个温度下(如在37℃、在50-60℃下,等等)进行,而可检测变化的测量可在另一不同的温度(如在室温、25℃或37℃下)进行。从生物消毒指示器100的读取时间(即用来确定灭菌处理有效性的时间)可以(在一些实施例中)少于8小时、(在一些实施例中)少于1小时、(在一些实施例中)少于30分钟、(在一些实施例中)少于15分钟、(在一些实施例中)少于5分钟以及(在一些实施例中)少于1分钟。实施例实施例1为检测生物活性的方法,其包括:提供样品,其可包含一种或多种预定生物活性源;第一指示系统,其包含具有第一吸收光谱的第一指示试剂,其中第一指示试剂能通过第一预定生物活性转化成第一生物衍生物;第二指示系统,其包含通过预定生物活性转化成具有第二发射光谱的第二生物衍生物的第二指示试剂;和底物,其接纳和富集来自水性混合物的第一指示试剂;形成第一水性混合物,其包含样品、第一指示试剂和第二指示试剂;使第一水性混合物与底物流体连通以形成第二水性混合物,第二水性混合物中的第一指示试剂的浓度低于第一水性混合物中的第一指示试剂的浓度;和检测第二生物衍生物中荧光的存在或不存在;其中第一吸收光谱包括在第二发射光谱中存在的波长的至少一部分中的可检测吸光度。实施例2为实施例1所述的方法,其中检测第二生物衍生物中荧光的存在或不存在包括检测第二水性混合物中荧光的存在或不存在。实施例3为实施例1或实施例2的所述方法,其还包括观察底物以检测第一指示试剂或第一生物衍生物。实施例4为前述实施例中任一项所述的方法,其中第一水性混合物中第一指示试剂的浓度足以抑制对本来可检测量的第二生物衍生物的检测。实施例5为前述实施例中任一项所述的方法,其还包括提供营养物质以有利于生物细胞的生长,其中形成第一水性混合物包括形成包含营养物质的混合物。实施例6为前述实施例中任一项所述的方法,其还包括将生物活性暴露于灭菌剂。实施例7为实施例6所述的方法,其中灭菌剂选自蒸汽、环氧乙烷、过氧化氢、甲醛和臭氧。实施例8为前述实施例中任一项所述的方法,其还包括将生物活性暴露于温度变化达一段时间。实施例9为前述实施例中任一项所述的方法,其中第一指示试剂包含发色团,其中检测第一生物衍生物包括检测颜色实施例10为实施例9所述的方法,其中第一指示试剂包含显色指示试剂。实施例11为实施例9或实施例10所述的方法,其中第一指示试剂包含pH指示剂或酶底物。实施例12实施例11所述的方法,其中第一指示试剂选自溴甲酚紫、溴甲酚绿、刚果红和甲基橙。实施例13为前述实施例中任一项所述的方法,其中第二指示试剂包含发荧光化合物。实施例14为实施例13所述的方法,其中发荧光化合物包含发荧光酶底物。实施例15为前述实施例中任一项所述的方法,其中检测第二生物衍生物的存在或不存在还包括测量第二生物衍生物的量。实施例16为前述实施例中任一项所述的方法,其中检测第一生物衍生物的存在或不存在还包括测量第一生物衍生物的量。实施例17为实施例16所述的方法,其中测量第一生物衍生物的量包括将在第二水性混合物中与底物不相关的一部分中测量的颜色的量与颜色标准进行比较。实施例18为前述实施例中任一项所述的方法,其还包括:提供检测第一指示试剂或第二生物衍生物的仪器;和使用该仪器来检测第一指示试剂或第二生物衍生物。实施例19为前述实施例中任一项所述的方法,其还包括提供检测第一指示试剂和第二生物衍生物的仪器;和使用该仪器来检测第一指示试剂和第二生物衍生物。实施例20为检测生物活性的方法,其包括:提供生物灭菌指示器,其包括:具有第一室和第二室的壳体;容纳第一含水液体的容器,该容器设置在第一室中,其中该容器的至少一部分是易碎的,所述液体包含:第一指示系统,其包含具有第一吸收光谱的第一指示试剂;和第二指示系统,其包含通过第二预定生物活性转化成具有第二发射光谱的第二生物衍生物的第二指示试剂,其中第一指示试剂能通过第一预定生物活性转化成第一生物衍生物,其中第一吸收光谱包括在第二发射光谱中存在的波长的至少一部分中的可检测吸光度;设置在第二室中的第二预定生物活性源;和接纳和富集来自第一含水液体的第一指示试剂的底物,该底物设置在壳体中;使第一含水液体与底物流体连通以形成第二含水液体,第二含水液体中的第一指示试剂的浓度低于第一含水液体中的第一指示试剂的浓度;和检测来自第二水性混合物中第二生物衍生物的荧光的存在或不存在。实施例21为实施例20所述的方法,其中使第一含水液体与底物流体连通包括破碎易碎容器的至少一部分。实施例22为实施例21所述的方法,其中生物灭菌指示器还可包括设置在壳体中的破碎装置,并且其中破碎易碎容器包括促使容器和破碎装置彼此紧靠。实施例23为实施例20至21中任一项所述的方法,其中生物灭菌指示器的壳体包括:第一部分,和适于连接到第一部分的第二部分,当连接至第一部分时,第二部分能够相对于第一部分在第一位置和第二位置之间移动;其中所述方法还包括将壳体的第二部分从其第一位置移动至其第二位置。实施例24为实施例23所述的方法,其中所述壳体包括纵向方向,并且其中使所述壳体的第二部分移动包括使所述壳体的第二部分沿着所述纵向方向移动。实施例25为实施例23所述的方法,其还包括响应壳体的第二部分从第一位置移动到第二位置而使容器在壳体中移动。实施例26为实施例25所述的方法,其中使容器在壳体中移动导致容器破碎。实施例27为一种检测预定生物活性的系统,其包括:第一指示系统,其包含具有第一吸收光谱的第一指示试剂,其中第一指示试剂能通过第一预定生物活性转化成第一生物衍生物;第二指示系统,其包含通过预定生物活性转化成具有第二发射光谱的第二生物衍生物的第二指示试剂;器皿,其被构造用于容纳液体介质;底物,其接纳和富集来自水性混合物的第一指示试剂;和仪器,其被构造用于容纳器皿和检测第一指示试剂或第二生物衍生物,其中第一吸收光谱包括在第二发射光谱中存在的波长的至少一部分中的可检测吸光度。实施例28为实施例27所述的系统,其还包括处理器。实施例29为实施例27或实施例28所述的系统,其中仪器还被构造用于调节液体介质的温度。实施例30为实施例27至29中任一项所述的系统,其中仪器被构造用于检测第一指示试剂和第二生物衍生物两者。通过以下实例说明本发明。应当理解,特定实例、材料、量和程序应根据如本文中所阐述的本发明的范围和精神进行广义地解释。实例参考实例1-溴甲酚紫(BCP)的吸收光谱。此参考实例示出溴甲酚紫的吸收光谱。将得自密苏里州圣路易斯的西格玛化学公司(SigmaChemicalCo.,St.Louis,MO)(目录号B-5880)的溴甲酚紫溶解于磷酸盐缓冲盐水(pH7.3)中,浓度为0.004。将该溶液置于石英比色杯中并使用设有TECANINFINITEM200板读数器(北卡罗莱纳州达勒姆的帝肯(美国)公司(TecanUS,Durham,NC))的1cm比色杯适配器扫描紫外可见吸收光谱。扫描参数在表1中示出。结果由图2的曲线示出。可在约300nm、约380nm和约600nm的波长处观察到吸收峰。表1:BCP吸收光谱的扫描参数。模式荧光顶部读数发射波长起点380nm发射波长终点650nm发射波长步长2nm发射扫描次数136激发波长350nm带宽(Em)280…850:20nm带宽(Ex)(范围1)230…295:5nm带宽(Ex)(范围2)296…850:9nm增益80手动读取次数10整合时间20ms滞后时间0ms稳定时间0ms参考实例2:7-羟基-4-甲基香豆素(4-甲基伞形酮)的发射光谱。此参考实例示出4-甲基伞形酮的发射光谱。。将得自密苏里州圣路易斯的西格玛化学公司的4-甲基伞形酮(4MU)(目录号m1381)溶解于磷酸盐缓冲盐水(pH7.3)中,浓度为0.004mg/mL。将该溶液置于石英比色杯中并且使用设有TECANINFINITEM200板读数器的1cm比色杯适配器扫描发射光谱。扫描参数在表2中示出。结果由图2的曲线示出。可在约450nm的波长处观察到发射峰。表2:4-甲基伞形酮发射光谱的扫描参数。模式吸光度波长起点250nm波长终点800nm波长步长2nm扫描次数276带宽(范围1)230…295:5nm带宽(范围2)296…1000:9nm增益80手动读取次数10稳定时间0ms板的部件B1-B1参考实例3-BCP对检测4MU的影响此参考实例示出当化合物存在于同一溶液中时BCP对检测4MU的影响。将按照实例2中所述制备的4-甲基伞形酮(4MU)的粗溶液在磷酸盐缓冲盐水中连续稀释至表3中示出的浓度。在磷酸盐缓冲盐水中制备溴甲酚紫(BCP)的储备溶液,如实例1中所述。将溴甲酚紫(0.03mg/mL终浓度)与表3中所示相应的4MU溶液混合。将每种相应溶液的一式三份的等分试样(100微升/孔)加载到96孔板中,并使用TECANINFINITEM200板读数器测量每个孔中的荧光。激发波长为350nm并且在420nm检测。表3中示出以相对荧光单位(RFU)列出的结果。数据显示,在每种所测试的4MU浓度下,溶液中溴甲酚紫的存在导致可测量荧光的减少。表3:在存在或不存在BCP的情况下的4MU荧光检测结果为3次重复的平均值。所有值均以相对荧光单位(RFU)报导。参考实例4-来自液体介质的BCP的吸附此参考实例示出BCP从生长介质吸附到底物材料上。制备孢子生长介质溶液,其由每升水中的17g细菌蛋白胨、0.17gL-丙氨酸和0.03g溴甲酚紫pH指示剂染料组成。用0.1N氢氧化钠将营养介质溶液的pH调节至7.6。向每个60硼硅酸盐玻璃管(12mL,VWRCat#53283-802)的每一者中添加1.0mL制备的生长介质并用无衬封闭盖件(VWRCat#66010-680)进行封盖。评估两种不同的底物材料:GE带电荷的尼龙(MAGNAPROBE0.45微米带电荷的尼龙膜,产品编号NP0HY00010,得自明尼苏达州明尼唐卡的GEOsmonicsLabstore)和纸材(WhatmanGrade1Chr纤维素色层分析纸,得自美国新泽西州皮斯卡塔韦的沃特曼有限公司(WhatmanInc.USA,Piscataway,NJ))。将两种底物材料的每一者的二十个条带切割成4mm×10mm大小。将这些条带置于PropperCHEX-ALLII即时密封小袋(纽约长岛市Propper制造公司(Propper,ManufacturingInc.,LongIslandCity,NY))中进行预先灭菌并在AMSCO杀菌器(俄亥俄州门特的思泰瑞公司(Steris,Mentor,OH))中在121℃下以蒸汽液体循环将其灭菌30分钟。将灭菌的底物条带从小袋中以无菌方式移出并转移至玻璃管中,20个管中每个管中五个尼龙底物条带,20个不同管中每个管中五个纸材底物条带。孢子条带获自容纳有嗜热脂肪土芽孢杆菌(G.stearothermophilus)孢子(ATCC7953)的未组装的1292ATTEST快速读取生物指示器蒸汽杀菌器(明尼苏达州圣保罗市的3M公司)。将孢子条带切割成四等份,每份大约6.4mm×6.4mm,并根据表4添加到玻璃管中并在下文中进一步描述。将一(6.4mm×6.4mm)片1292ATTEST孢子条带添加到10个玻璃管的每一者中,每个玻璃管容纳5片尼龙底物和生长介质。将一片孢子条带添加到10个玻璃管的每一者中,每个玻璃管容纳5片Whatman纸和生长介质。将一片孢子条带添加到10个玻璃管的每一者中,每个管仅容纳生长介质且无底物。剩下的30个管中不添加孢子条带片:10个管容纳5片尼龙底物;10个管容纳5片纸材底物;10个管未容纳底物。表4:制备用于实例4的样品样品管的数量生长介质5个底物条带孢子条带1.尼龙+孢子10有尼龙有2.尼龙-无孢子10有尼龙无3.纸材+孢子10有纸张有4.纸材-无孢子10有纸无5.对照物-无底物+孢子10有无有6.对照物-无底物-无孢子10有无无选择以上样品的每一者的两个管用于进行以下观察并在1分钟的时间点进行分析。将尼龙或纸材底物材料在位于管中时的颜色与周围液体生长介质的颜色进行比较,以确定底物是否比介质暗或淡。当取出容纳生长介质的玻璃管时观察并记录底物材料的颜色。将尼龙和纸材底物条带从管中移出并置于KIMWIPE(Kimberly-Clark)上,然后使用X-Rite530P光密度计(密歇根州大急流城的色丽公司(X-Rite,GrandRapidsMI))获取光密度测定读数。将X-Rite530P光密度计的光密度设置设定为“颜色”以提供V过滤器结果。针对所选Pantone2665U和102U的ΔE底物结果,将X-Rite光密度计设定为“比较”。使用CIE76公式计算每个Pantone处的ΔE。ΔE值为从测量点到参考值(Pantone颜色)的L*A*B色隙中的距离。较低的ΔE表明测量的颜色更接近参考值。约2.5ΔE's的值大致为人眼可区分颜色的最低阈值。两个所用参考值为Pantone2665U(淡紫色)和Pantone102U(鲜黄色)。注意:由于这两个值并未与“色轮”完全相对,因此2665U处ΔE的增加并不必然意味着102U处ΔE的严格的减少。换句话讲,2665U处的ΔE仅表明某些物质是否变得更“紫”,而并非某些物质是否变得更“黄”。还观察和记录了每个管中介质的颜色(表5)。一式三份地,将一定量的200μL介质从每个管中移出并置于96孔板(COSTARCLS-3603-48EA黑色组织培养物处理的具有透光底部的96孔板)中,并用具有Gen5软件的SYNERGY4分光光度计测量590nm和430nm处的光密度。使用Monochromater(单色光源)(佛蒙特州威努斯基市的伯腾公司(BioTek,Winooski,VT))获取OD(光密度)测量值。将剩下的管在56℃下温育。在以下每个时间:30分钟、1小时、4小时和24小时的温育;将每种样品的2个管移出培养箱,目视观察,并通过仪器测量,如上所述。表5:介质的颜色观察样品1分钟30分钟1小时4小时24小时1.尼龙+孢子紫色紫色紫色紫色黄色3.纸材+孢子紫色紫色紫色紫色黄色5.对照物-无底物+孢子紫色紫色紫色紫色黄色2.尼龙-无孢子紫色紫色紫色紫色紫色4.纸材-无孢子紫色紫色紫色紫色紫色6.对照物-无底物-无孢子紫色紫色紫色紫色紫色所有小瓶中的介质均保持紫色至读数后至4小时。那些不含有孢子的样品在24小时之后还保持紫色。由于细胞的生长导致介质中pH的降低(由BCPpH指示剂染料显示),所有含有孢子的样品截止24小时转变成视觉上的黄色,。在每个时间间隔,在将底物移出介质之前,将底物的颜色与介质的颜色进行比较(参见表6)。如果两种颜色之间有任何差异,则记录该差异。在将尼龙底物用作底物的所有情况下,底物呈现出的颜色阴影要比周围介质的颜色阴影暗。在将纸材用作底物的所有情况下,底物呈现出的颜色阴影要比周围介质的颜色阴影淡。这些结果表明在接纳和富集指示试剂方面,尼龙底物要优于纸材底物。表6:底物颜色对介质颜色样品1分钟0.5小时1小时4小时24小时1.尼龙+孢子较暗较暗较暗较暗暗黄2.尼龙-无孢子较暗较暗较暗较暗较暗3.纸材+孢子较淡较淡较淡较淡淡黄4.纸材-无孢子较淡较淡较淡较淡较淡在大多数情况下,“较暗”意指底物具有比介质明显较暗的紫色,不同的是24小时时含有孢子的尼龙,其具有较暗的黄色。在大多数情况下,“较淡”意指底物具有比介质明显较淡的紫色,不同的是24小时时含有孢子的纸材,其具有较淡的黄色。对于含有孢子的样品,24小时时590nm处的OD测量值将不能显示黄色强度的差异。因此,仅评估在24小时时在430nm处获取的OD值。表7:24小时时介质在430nm处的平均光密度样品24小时1.尼龙+孢子0.2713.纸材+孢子0.8275.对照物-无底物+孢子0.835含有孢子的介质样品在存在纸材底物的情况下和不含有带孢子的底物的介质样品(对照物)在430nm处的24小时读数具有类似的OD值,分别为0.827和0.835,如表7中所示。然而,含有孢子的介质样品在存在尼龙的情况下的OD仅为0.271;其比对照物或含有纸材底物的样品小0.5个OD单位。这表明在存在尼龙的情况下介质的黄色强度由于尼龙底物接纳和富集指示试剂而降低。表8:介质在590nm处的平均光密度样品1分钟30分钟1小时4小时24小时1.含有孢子的尼龙1.1241.1220.6981.063***3.含有孢子的纸材1.4041.7861.4401.697***5.对照物-不具有含有孢子的底物1.4021.8011.4631.776***2.尼龙-无孢子1.1581.1360.6531.1021.1224.纸材w/o孢子1.4351.7161.4681.8631.708*6.对照物-无底物-无孢子1.3451.7971.4651.8281.812所有的值表示n=6(3个读数×2管)。*n=5个读数:管1为3个读数,管2为2个读数。***样品的颜色为黄色,因此590nm处的OD未准确量度介质的颜色。注意不含底物(具有或不具有孢子)的对照物在1分钟时的吸光度,介质的初始基线OD测量值。表8显示,即使在1分钟时含有孢子的样品介质在存在尼龙的情况下的590nm处的OD(1.124)小于样品介质在存在含有孢子的纸材的情况下的OD(1.404)或含有孢子的对照物的OD(1.402)。此差异表明介质的紫色强度由于尼龙底物快速接纳和富集BCP指示试剂而已经降低。在24小时时,不含有孢子的样品介质在存在尼龙龙的情况下的590nm处的OD为1.122,其远低于在存在纸材的情况下的OD(1.708)或不含有孢子的对照样品的OD1.812。表9:24小时时底物的Pantone颜色1.尼龙底物+孢子黄色Pantone102U2.尼龙底物-无孢子紫色Pantone1345U3.纸材底物+孢子黄色Pantone100U4.纸材底物-无孢子紫色Pantone256U初始紫色介质颜色紫色Pantone2665U黄色介质颜色黄色Pantone102U表10:使用V过滤器得到的底物的平均光密度读数样品0分钟1分钟0.5小时1小时4小时24小时1.尼龙+孢子0.050.170.300.220.26***2.尼龙-无孢子0.050.200.240.280.260.263.纸材+孢子0.110.120.260.160.12***4.纸材-无孢子0.110.110.150.140.110.18***含有孢子的底物样品在24小时时的颜色为黄色,且V过滤器并未能准确测量底物的颜色。表11:底物的平均光密测定度读数:来自Pantone2665U(紫色)的ΔE样品0分钟1分钟0.5小时1小时4小时24小时1.尼龙+孢子68.1864.4863.5764.3656.42***2.尼龙-无孢子68.1866.3758.4774.4554.6257.493.纸材+孢子66.2368.1861.2767.0666.96***4.纸材-无孢子66.2368.7065.2963.6967.4559.31***含有孢子的底物样品在24小时时的颜色为黄色,且V过滤器并未能准确测量底物的颜色。表12:底物的平均光密度测定读数:来自Pantone102U(黄色)的ΔE样品0分钟24小时尼龙底物+孢子83.7856.83纸材底物+孢子83.6776.15上面的表示出底物在介质(含有或不含有孢子)下暴露不同时长后的光密度测定读数。每种底物的0时读数为底物样品置于介质中之前的初始光密度测定读数。当评估紫色的底物时,V过滤器和ΔE(Pantone2665U)显示出最强的对比。使用V过滤器得到的尼龙底物的平均光密度测定读数(如表10中所示)在整个实验期间增加并保持升高(唯一的不同是对于“含有孢子”的样品当底物在24小时的时间点为黄色时)。相比之下,纸材底物的光密度测定读数在整个时间点上保持相当稳定。同样,表11中示出的尼龙底物ΔE(Pantone2665U)值通常在整个实验期间降低(唯一的不同是对于“含有孢子”的样品当底物在24小时的时间点为黄色时)。这表明尼龙底物在接纳和富集BCP指示试剂。而相比之下,纸材底物的ΔE(Pantone2665U)值保持相当稳定。表12示出在24小时的时间点,尼龙底物的ΔE(Pantone102U)值显著低于纸材底物的E(Pantone102U)值,这表明尼龙底物比纸材底物更接近pantone102U颜色(更加鲜艳的黄色)。参考实例5来自液体介质的BCP在两次24小时温育后的尼龙底物吸附此参考实例显示出BCP从液体生长介质吸附到尼龙底物上。实例5中使用实例4中所用的相同介质和组分。向4个玻璃管的每一个中加入1.0mL制备的生长介质。将切割成大约6.4mm×6.4mm的一片1292ATTEST孢子条带加入每个玻璃管中。将管在56℃的培养箱中放置24小时以促进嗜热脂肪土芽孢杆菌(G.stearothermophilus)的生长。在24小时温育后,将尼龙底物的五(5)个条带(每个切割成4mm×10mm)加入其中两(2)个管中。将这些管在56℃的培养箱中放置另外24小时。在第二个24小时温育周期后(将尼龙底物添加到管中后24小时),进行以下分析。将尼龙底物片从管中移出,置于KIMWIPE上,并且获取底物条带的光密度测定读数。从每个管中取出三个200μL的等分试样并置于96孔板。测量介质在430nm处的光密度。表13:介质在48小时时于430nm处;尼龙底物后24小时的平均OD样品平均OD包含尼龙底物+孢子的介质0.365对照介质-无底物+孢子1.241n=12(4个管中每个管3个读数)n=3(一个对照管中1个读数)表13示出与未添加底物的对照相比,向管中添加尼龙底物后24小时的430nm处OD的降低。两种样品之间的OD测量值的差异表明样品介质中所含黄色的量的差异。这表明在存在尼龙的情况下介质的黄色强度由于尼龙底物接纳和富集指示试剂而降低。表14:底物的平均光密度测定读数:来自Pantone102U(黄色)的ΔE样品平均ΔE(102U)在介质中24小时后的尼龙底物+孢子37.86加入介质之前的尼龙底物83.78n=10(5个尼龙底物条带×2个管)表14示出在向管中加入已经温育24小时后的含有孢子的介质之后的24小时,尼龙底物的ΔE(102U)值。将其与未放进介质中的尼龙底物比较。两种样品之间的ΔE测量值的差异表明与未暴露于介质的底物相比,暴露于生长中的介质的底物(黄色)在颜色上更接近pantone102U(鲜黄色)。参考实例6-各种底物对来自液体介质的BCP的吸收此参考实例示出BCP从液体生长介质到各种底物上的吸附。制备孢子生长介质溶液,其由每升水中的17g细菌蛋白胨、0.17gL-丙氨酸和0.03g甲酚紫pH指示剂染料组成。用0.1N氢氧化钠将营养介质溶液的pH调节至7.6。向每个硼硅酸盐玻璃管(12mL,VWRCat#53283-802)中加入1.0mL制备的生长介质并用无衬封闭盖件(VWRCat#66010-680)封盖。评估四种不同的底物材料:(1)GE带电荷的尼龙(MAGNAPROBE0.45微米带电荷的尼龙膜,产品编号NP0HY00010得自明尼苏达州明尼唐卡的GEOsmonicsLabstore);(2)含有季铵基团的带正电的BIO-RAD高强度尼龙膜(ZETA-PROBEGTGenomics,Cat#162-0196,得自加利福尼亚州赫尔克里的BIO-RAD生命科学仪器公司(BIO-RADLifeSciences,Hercules));(3)0.2mM硝化纤维(Cat#LC-2000,得自加利福尼亚州卡尔斯巴德的英潍捷基公司(InvitrogenCorporationCarlsbad,CA)),和(4)0.2mM聚偏二氟乙烯(PVDF)膜(Cat#LC-2002,得自加利福尼亚州卡尔斯巴德的英潍捷基公司)。将每种底物材料切割成以下大小的多个条带:4mm×10mm,足以使每个玻璃管中有一(1)个条带。将这些条带置于PropperCHEX-ALLII即时密封小袋(纽约长岛市Propper制造公司)中进行预先灭菌并在AMSCO杀菌器(俄亥俄州门特的思泰瑞公司)中(在121℃下)以蒸汽液体循环将其灭菌30分钟。然后将条带从小袋中以无菌方式转移至每个管中。将每种底物的两个管子与不含底物的两个对照管一起进行评估。在0时刻、30分钟、1小时、4小时和24小时的时间点进行以下观察和分析:(1)将每个管中底物材料的颜色与同一管中周围介质的颜色进行比较。(较暗或较淡);(2)将底物材料从管中移出,置于KIMWIPE上吸干,然后用上述V过滤器获取光密度测定读数;(3)将200mL介质从每个管中移出并一式三份地转移到96孔板COSTARCLS-3603-48EA黑色组织培养物处理的具有透光底部的96孔板)中,并用具有Gen5软件的SYNERGY4分光光度计测量590nm处的光密度。使用Monochromater(单色光源)(佛蒙特州威努斯基市的伯腾公司)获取OD测量值。将剩下的管在56℃下温育。在以下每个时刻:30分钟、1小时、4小时和24小时的温育;将每种样品的2个管移出培养箱,目测观察,并通过仪器测量,如上所述。表15:各种底物的底物颜色与介质颜色之比较较暗=底物具有比介质明显较暗的紫色较淡=底物具有比介质明显较淡的紫色在每次将底物移出介质之前进行读数时,将介质的颜色与底物的颜色进行比较。观察底物的颜色与介质的颜色之间的差异并在表15中报导。在与介质接触30分钟后,两种尼龙底物材料明显暗于介质并且在整个实验期间保持较暗。表16:在加入含有BCP介质之后的各种底物的平均光密度测定读数表16示出底物材料在介质下暴露不同时长后的光密度测定读数。每种底物的0时刻读数为底物置于介质中30秒内的初始光密度测定读数。在所有情况下,尼龙底物光密度测定读数在30分钟内增加并且在整个实验期间保持升高。表17:介质在有各种底物材料存在情况下的590nm处的O.D.表17示出在指定时间从含有各底物材料的管中移出的介质的平均光密度读数。值得注意的是在每个时间点,介质在存在任一尼龙底物的情况下的OD低于含有硝化纤维或PVDF的介质的OD读数。另外,硝化纤维或PVDF显示出OD读数的非常小的变化并且与对照OD值非常相似。参考实例7–底物对液体介质中的甲基红(MR)的吸收此参考实例示出BCP从液体生长介质中吸附到多种底物材料上。制备孢子生长介质溶液,其由每升水中的17g细菌蛋白胨、0.17gL-丙氨酸和0.03g甲基红pH指示剂染料组成。用0.1N盐酸将营养介质溶液的pH调节至4.2。向每个硼硅酸盐玻璃管(12mL,VWRCat#53283-802)中入加1.0mL制备的生长介质并用无衬封闭盖件(VWRCat#66010-680)封盖。评估两种不同的底物材料:GE带电荷的尼龙(MAGNAPROBE0.45微米带电荷的尼龙膜,产品编号NP0HY00010,得自明尼苏达州明尼唐卡的GEOsmonicsLabstore)和含有季铵基团的带正电的BIO-RAD高强度尼龙膜(ZETA-PROBEGTGenomics,Cat#162-0196,得自加利福尼亚州赫尔克里的BIO-RAD生命科学仪器公司)。将每种底物材料切割成以下大小的若干个条带:4mm×10mm,足够使每个玻璃管中都有一(1)个条带。将这些条带置于PropperCHEX-ALLII即时密封小袋(纽约长岛市Propper制造公司)中进行预先灭菌并在AMSCO杀菌器(俄亥俄州门特的思泰瑞公司)中(在121℃下)以蒸汽液体循环将其灭菌30分钟。然后将条带从小袋中以无菌方式转移至每个管中。在0时刻、30分钟、1小时、4小时和24小时的时间点对每种底物的两个管进行以下观察和分析:(1)将底物材料从管中移出,置于KIMWIPE上吸干,然后用上述V过滤器获取光密度测定读数;(2)将每个管中底物材料的颜色与同一管中周围介质的颜色进行比较。(较暗或较淡)。将剩下的各管在56℃下温育。在以下每个时间:30分钟、1小时、4小时和24小时的温育;将每种样品的2个管移出培养箱,目测观察,并通过仪器测量,如上所述。表18:在加入甲基红之后的底物的平均光密度测定读数,V过滤器时间点GEMAGNAPROBE尼龙Bio-RadZETA-PROBE尼龙0小时0.1600.2000.5小时0.2850.3301小时0.3250.3764小时0.2050.45024小时0.470上面的表示出底物在介质下暴露不同时长后的光密度测定读数。每种底物的0时读数为底物置于介质中30秒内的初始光密度测定读数。在所有情况下,尼龙底物光密度测定读数在30分钟内增加并且在整个实验期间保持升高。表19:加入甲基红之后的底物颜色与介质颜色之比较时间点GEMAGNAPROBE尼龙Bio-RadZETA-PROBE尼龙0小时较淡较淡0.5小时较暗较暗1小时较暗较暗4小时较暗较暗24小时较暗较暗较暗=底物明显暗于介质较淡=底物明显淡于介质在每次将底物材料移出介质之前进行读数时,将介质的颜色与底物的颜色进行比较(参见表19)。观察并报导底物的颜色与介质的颜色之间的差异。在与介质接触30分钟后,两种尼龙底物材料明显暗于介质并且在整个实验期间保持较暗。参考实例8BCP和甲基红对吖啶橙(AO)检测的抑制此参考实例示出当pH指示剂之一(即,BCP或MR)存在于含有吖啶橙的溶液中时,BCP和甲基红对吖啶橙荧光检测的影响。制备孢子生长介质溶液,其由17g细菌蛋白胨和0.17gL-丙氨酸组成。将200mL体积的生长介质添加到两(2)个96孔板中的每个孔中。制备针对甲基红(MR)和溴甲酚紫(BCP)的pH指示剂溶液的系列稀释液,开始为4.8g/L并稀释至0.75g/L。制备吖啶橙的系列稀释液,开始为1:50并稀释至1:800在#1板中,将20mLBCP的适当稀释液添加到板的每一行中,并将20mL吖啶橙(AO)的适当稀释液添加到#1板的每一列中。在#2板中,将20mL甲基红的适当稀释液添加到板的每一行中,并将20mL吖啶橙(AO)的适当稀释液添加到#2板的每一列中。#1板和#2板的设置参见表20。表2096孔#1板BCP和#2板MR的设置将#1板和#2板置于SYNERGY4分光光度计中并获取590nm处的吸光度读数。另外,还收集435nm/530nm处的荧光激发/发射读数(参见表21A-B)。表21A:BCP对吖啶橙检测的抑制**仪器检测阈值以上的信号表21B:BCP对吖啶橙检测的抑制**仪器检测阈值以上的信号对于所有吖啶橙浓度,由于溶液中溴甲酚紫的量减少,吖啶橙所产生的信号增加。换句话讲,BCP的存在掩蔽了吖啶橙信号。例如,0.3g/L初始BCP浓度的一行,与0BCP的一行相比较,其吖啶橙荧光信号损失了约27-36%。表22A:甲基红对吖啶橙检测的抑制**仪器检测阈值以上的信号表22B:甲基红对吖啶橙检测的抑制**仪器检测阈值以上的信号类似于BCP,甲基红也掩蔽了吖啶橙荧光信号。甲基红的浓度越高,所检测到的吖啶橙的荧光信号越低。例如,甲基红初始浓度为0.3g/L的一行与没有甲基红的一行相比,其吖啶橙荧光信号损失约在3-27%之间(参见表22A-B)。实例1-3:检测生物活性3MATTEST1291快速读取生物指示器得自明尼苏达州圣保罗市的3M公司(3MCompany,St.Paul,MN)。带电荷的尼龙膜(MAGNAPROBE0.45微米带电荷的尼龙膜,产品编号NP0HY00010)得自明尼苏达州明尼唐卡的GEOsmonicsLabstore。移除生物指示器的盖件,并且通过倒置生物指示器管来移除玻璃安瓿。将这些安瓿置于一旁以备后用。将尼龙膜切成小条带(0.5cm×2cm)。将条带邻近生物指示器管底部的壁放置(纵向地),并且将玻璃安瓿重新放回每个管中。将盖子小心地重新盖回每个管上。将改进的生物指示器于蒸汽中暴露不同的时间长度(在表23中示出)。蒸汽暴露在270℉/132℃的重力蒸汽下于H&W蒸汽阻力计(可得自纽约州罗切斯特市的H&W技术有限责任公司(H&WTechnologyLLC,Rochester,NY))中进行。在暴露于蒸汽中之后,使生物指示器冷却,并且根据制造商的说明书将安瓿挤碎在生物指示器中。将安瓿放置于56℃的培养箱中,并且定期(如15分钟、30分钟、45分钟、60分钟、90分钟、120分钟、3小时、4小时、6小时、8小时、12小时、18小时、24小时、36小时、48小时和/或72小时后)取出,以观察液体介质的颜色、尼龙膜的颜色和液体介质的荧光。可通过用手持紫外线光源照亮管来目测荧光,或者可将管(或其中的液体)放置于合适的荧光计中以测量荧光。经受少量蒸汽暴露或无蒸汽暴露(如0-1分钟蒸汽暴露)的生物指示器将显示pH指示剂(溴甲酚紫)在肉汤中和尼龙膜上从紫色转化成黄色。这些生物指示器也将显示发荧光酶底物基本上转化成荧光终产物(4-甲基伞形酮)。经受致命的蒸汽暴露(如≥15分钟)的生物指示器将显示溴甲酚紫积聚在尼龙膜上,但不会显示该指示剂从紫色基本上转化成黄色。这些生物指示器不会显示发荧光酶底物基本上转化成荧光终产物。表23:第一位置中的底物-荧光制备实例1-生物灭菌指示器(BI)的制备为了举例说明本发明,根据以上提供的说明和如图4-7中所示,制备了若干生物灭菌指示器(BI)。下面提供实例中所用的生物灭菌指示器的某些细节。如图4-7中所示,生物灭菌指示器100包括壳体102,该壳体包括第一部分104(如中空管)和第二部分106(如盖件),该第一部分和第二部分连接在一起以提供整装生物灭菌指示器。盖件为模制的聚丙烯,其总维度为大约21mm长×14mm直径。第一部分104(中空管)为模制的聚碳酸酯,其顶部总维度为约52mm长和12mm直径,形状在图4-6中示出。第一部分104(即中空管)的总体积为大约3mL。如图4-6中所示,壳体102的第二部分(盖件)106包括6个孔口或开口107,其提供壳体102(如贮存器103)的内部与环境之间的流体连通。用作屏障的滤纸材料(图4-6中未示出)设置在孔口107上方的灭菌剂路径中,并用压敏粘合剂背衬的纸质标签保持在适当的位置。该滤纸材料与蒸汽杀菌器目前可用的3MATTEST1291快速读取生物指示器(得自明尼苏达州圣保罗市的3M公司)的盖件中存在材料相同。生物灭菌指示器100还包括包含液体生长介质122的易碎容器120。易碎容器120由硼硅酸盐玻璃制成,并包含孢子生长介质。该介质由改良的胰酶大豆肉汤(TSB)组成,该胰酶大豆肉汤包含pH指示剂溴甲酚紫和荧光酶底物4-甲基伞形酮酰-α-D-葡糖苷。安瓿为大约40mm长×约4mm直径,并容纳大约500μL的介质液体。液体生长介质122与目前可得自明尼苏达州圣保罗市的3M公司的作为用于蒸汽杀菌器的3MATTEST1291快速读取生物指示器的产品中所使用的介质相同。如图4-7中所示,将液体介质容器120通过插件130保持在生物灭菌指示器100内的适当位置。插件(也称为破碎装置)130既用于将容器120保持在适当的位置,又起作用以有利于容器120的受控打破,这发生在生物灭菌指示器的启用步骤期间,此时向下推动第二部分106以打破液体介质容器120。插件130为模制的聚碳酸酯结构,其概略维度为22mm长×9mm宽。第二部分106具有密封凸出部156,该凸出部可设置成在第一部分104的开放上端157接触第一部分104的第一端101,以在启用之后封闭或密封(如气密地密封)生物灭菌指示器100。生物灭菌指示器100还包括设置成与第一部分104流体连通的嗜热脂肪土芽孢杆菌(G.stearothermophilus)孢子(ATCC7953)115。孢子115存放于聚丙烯孢子载体135(9mm×4mm)的孢子贮存器136中。孢子115直接存放在聚丙烯表面上,并且孢子贮存器136的体积为大约15μL。壳体102包括部分地被内部的部分壁或突架118分开的下部114(其至少部分地限定第一室109)和上部116(其至少部分地限定第二室111),在其中形成开口117,开口117提供第一室109和第二室111之间的流体连通。第二室111适于容纳孢子115。第一室109适于容纳易碎容器120,特别是在启用之前。壁118相对于壳体102的纵向以非零角度和非直角成角度或倾斜,如图4-7中所示。也可称为“孢子生长室”或“检测室”的第二室111包括探查孢子活力以确定灭菌处理功效的空间。在灭菌期间并且当容器120破碎时,液体介质容器120设置并保持在第一室109中。孢子115在灭菌期间容纳在第二室111中并且与环境流体连通。灭菌剂在灭菌期间移动至第二室111中(如通过第一室109)。然后,当容器120破碎并且液体122释放到壳体102的内部中时,液体介质122在启用期间移动至第二室111中(如从第一室109)。第一室109的体积为约2800微升(排空所有内部组分)。第一室109在壁118正上方的横截面积为大约50mm2。第二室111的体积为约210微升。第二室111在壁118正下方的横截面积为大约20mm2。生物灭菌指示器100还包括底物119。底物119的尺寸为大约9mm×8mm,并且尺寸被设计为在其顶部停靠壁118。底物119设置在生物灭菌指示器100的第一室109和第二室111之间。底物119包括穿过其形成的直径为约3.2mm(0.125英寸)的孔口121,该孔在该底物中大致保持居中。底物119设置在插件130和壁118之间(如被夹在其间)。底物119由带电荷的尼龙形成,特别是为重测、带电荷的转移膜,其可以商品名“MAGNAPROBE”(0.45微米孔径、30cm×3m卷,目录号NP0HY00010、材料号1226566)得自宾夕法尼亚州特莱沃斯的GE水&处理技术公司(GEWater&ProcessTechnologies,Trevose,PA)。生物灭菌指示器100具有排放特征件162(如图7中所示),该排放特征件可设置成将第二室111与第一室109流体连接。另外,如图7中所示,生物灭菌指示器100具有与壳体102的壁108一体地形成的肋或凸起165,其可设置成将孢子载体135保持在壳体102中的所需位置。壳体102为渐缩的(见如图6中的锥形部分146),以使得壳体102中的横截面积通常沿着纵向DL减小。实例1-荧光读数与24小时后的生长的相关性图4-7中所示的和以上在制备例1中描述的设计的生物指示器(BI)用嗜热脂肪土芽孢杆菌(G.stearothermophilus)ATCC7953孢子作物的~1×107CFU构建。一些生物灭菌指示器(结果在表26和27中示出并在下面进行讨论)的制备不含底物材料。液体生长介质122与用于蒸汽杀菌器的3MATTEST1292快速读取生物指示器(可得自圣保罗市的3M公司)中所用的相同。然后,每个BI在270℉/132℃的重力蒸汽下于H&W蒸汽阻力计(可得自纽约州罗切斯特市的H&W技术有限责任公司)中经过1分钟、1分45秒、2分钟、2分15秒、2分30秒和3分钟的不同长度的蒸汽灭菌循环。在灭菌之后,使BI冷却并在490AUTOREADER读取设备中启用,该读取设备可得自明尼苏达州圣保罗市的3M公司,其与可得自3M公司的290AUTOREADER读取设备类似;490AUTOREADER读取设备的某些特征描述于共同待审的美国申请No.61/409042(代理人案卷号66175US002)和61/408997(代理人案卷号66176US002)中。每1分钟读取激发/发射为365/460nm处的荧光读数并持续60分钟。如果检测到荧光,则报导为“有”;如果未检测到荧光,则报导为“NF”(即,无荧光)。另外,在读取设备中温育24小时之后,移出BI并且根据介质中从紫色到黄色的颜色变化(pH指示剂的颜色变化)进行评估以确定生长。如果观察到颜色变化,则报导为“有”,如果未观察到颜色变化,则报导为“无”。以下表24和表25中示出的结果表明,当底物设置在暴露于所有灭菌循环长度的所有BI的第一位置中时,荧光结果与24小时生长确认结果之间存在良好的相关性。以下表26和表27中示出的结果表明,当底物不存在时,特别是在2分15秒、2分30秒和3分钟的循环时间时,观察到这些BI有不一致的结果。表24:荧光观察表25:生长观察(24小时后的颜色变化)表26:无底物-荧光表27:无底物-24小时后的生长虽然设定本发明的广泛范围所给出的数字范围和参数为近似值,但具体实例中所示的数值会尽可能准确地报告。尽管如此,在各自测试过程中产生的标准偏差不可避免地导致所有数值固有地包括一定范围。所有的标题是为了阅读者方便,而不应该被用于限制该标题后面的正文的含义,除非是这么规定的。本文引用的所有专利、专利申请、出版物以及核酸和蛋白质数据库条款的完全公开内容全部以引用方式并入本文,如同每个都单独引入一样。在不背离本发明的范围和精神的前提下,本发明的各种修改和更改对本领域的技术人员来说将是显而易见的,并且应该理解,本发明不应不当地受限于本文所述的示例性实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种基于网状载体的硫氧化细菌固定化直筒状生物活性填料制备及应用的制作方法
- 一种基于聚氨酯载体的硫氧化细菌固定化生物活性填料制备及应用的制作方法
- 一种基于网状载体的固定化直筒状生物活性填料制备及应用的制作方法
- 一种基于网状载体的厌氧氨氧化细菌固定化星形生物活性填料制备及应用的制作方法
- 一种氨氧化细菌固定式生物活性填料、制备及应用的制作方法
- 一种以纺织物和聚乙烯醇无纺布为载体的反硝化细菌固定化固定式生物活性填料制备及应用的制作方法
- 一种基于网状载体的硫酸盐还原菌固定化星形生物活性填料制备及应用的制作方法
- 一种固定式生物活性填料制备及应用的制作方法
- 一种颗粒状反硝化细菌三明治型多层固定化生物活性填料、制备及应用的制作方法
- 一种基于网状载体的反硝化细菌固定化直筒状生物活性填料制备及应用的制作方法