快速定量检测小分子化合物的试剂盒和方法与流程
本发明涉及检测领域,具体地,涉及一种快速定量检测小分子化合物的试剂盒和方法。
背景技术:
常用的小分子化合物的检测方法,包括化学显色法、免疫层析检测法、高效液相色谱检测法(HPLC)和气质联用色谱检测法(GC/MS)法等。其中,化学显色法需要大量检测样品,而且灵敏度及精密度均不高;后两者有较高的灵敏度及精密度,但检测要求高,难以推广。
免疫层析检测法(Immunochromatographic test)是80年代兴起的一项快速检测技术。经过多年的发展,此项技术已经广泛应用于临床诊断,毒品检测和食品安全等领域。在免疫层析方法中,将小分子物质的完全抗原固定于硝酸纤维膜上的检测区(固相抗原),待检样品溶液中的小分子物质(游离抗原)与固相抗原竞争结合胶体金或彩色乳胶微球标记的抗小分子物质的单克隆抗体(标记抗体)。如果待检样品中含有的小分子物质,将抑制标记抗体与固定抗原的结合,抑制在硝酸纤维素膜的检测区形成色带。测定后检测区如果形成色带,则结果为阴性,待测样品不含待测小分子物质;反之,不形成色带,则结果为阳性,检测样品含有待测小分子物质。由于胶体金或彩色乳胶微球标记检测是通过肉眼来判别结果,目前以胶体金或彩色微球标记的检测方法只能作为一种定性或半定量的检测。
荧光定量免疫层析技术,是免疫荧光技术(Immunofluorescence technique)和传统免疫层析技术相结合发展创新的一种定量检测技术。该技术以荧光微球作为标记,通过检测荧光信号实现了检测结果的定量。
但是,由于免疫层析检测的材料中硝酸纤维膜等均会在激发光作用下发出不同程度的荧光,同时检测样本如血液、尿样及唾液等均含有蛋白、核酸、糖类均具有荧光效应,因此而导致检测的背景较高,影响检测结果的准确性。为克服上述问题,有研究者开发了时间分辨荧光免疫层析技术,以消除样本中的荧 光物质、激发光和膜本身对检测的干扰。
然而,虽然时间分辨荧光免疫层析有助于提高检测的准确性,但是由于种种原因,在定量检测时仍会出现较大的偏差和波动,导致检测结果无法满足实际需要。尤其是对于小分子化合物(如苯丙胺、吗啡等毒品),定量检测结果的准确性一方面与遏制毒品的行动密切相关,也是对于罪犯的量刑的重要参考因素。
因此,本领域迫切需要开发快速、定量、且准确(偏差小)的检测小分子化合物的新方法。
技术实现要素:
本发明的目的在于提供一种快速定量检测小分子化合物的试剂盒和方法。
在本发明的第一方面,提供了一种用于检测小分子化合物的试剂盒,所述试剂盒包括:
(a)测试条,所述测试条包括背衬以及位于背衬上的样品垫、反应膜和吸收垫,其中所述反应膜上设置有检测区和质控区;以及
(b)第一容器,以及位于所述第一容器内且与所述测试条独立设置(或放置)的抗体复合物,其中所述抗体复合物包含荧光乳胶微粒以及特异性针对小分子化合物的抗体,所述特异性针对小分子化合物的抗体偶联于所述荧光乳胶微粒;
其中,所述的检测区固定有所述小分子化合物的完全抗原。
在另一优选例中,在所述的测试条上,所述样品垫和反应膜是直接相邻或相接触的。
在另一优选例中,按样品的液体流动方向,所述的测试条上依次包括样品垫、反应膜、和吸收垫。
在另一优选例中,所述测试条由样品垫、反应膜、吸收垫、和背衬构成。
在另一优选例中,所述的抗体复合物位于独立的包装或容器内。
在另一优选例中,所述的测试条不设有结合区。
在另一优选例中,所述的测试条在未使用时,不含有用于特异性与所述小分子化合物结合的抗体或所述抗体复合物。
在另一优选例中,所述的第一容器为独立的且封闭的包装或试剂杯。
在另一优选例中,所述的第一容器中还含有
在另一优选例中,所述小分子化合物的分子量为1-1000Da,较佳地为5-800Da,更佳地为10-500Da。
在另一优选例中,所述的小分子化合物为苯丙胺。
在另一优选例中,所述荧光乳胶微粒为镧系金属和/或镧系金属螯合物包被的乳胶微粒。
在另一优选例中,所述质控区包含第二抗体,所述第二抗体特异性结合于特异性针对小分子化合物的抗体。
在另一优选例中,所述的第二抗体为多抗或抗血清。
在另一优选例中,所述的特异性针对小分子化合物的抗体为鼠抗体,而所述的第二抗体为兔抗鼠IgG抗体或羊抗鼠IgG抗体。
在另一优选例中,所述的特异性针对小分子化合物的抗体为兔抗体,而所述的第二抗体为羊抗兔IgG抗体。
在另一优选例中,所述的小分子化合物的完全抗原为小分子化合物与载体蛋白的偶联物。
在另一优选例中,所述的载体蛋白包括BSA蛋白。
在本发明的第二方面,提供了一种检测小分子化合物的方法,包括步骤:
(1)将待测物样品与一抗体复合物进行混合,获得第一处理混合物,其中所述抗体复合物包含荧光乳胶微粒以及特异性针对小分子化合物的抗体,并且所述特异性针对小分子化合物的抗体偶联于所述荧光乳胶微粒;
(2)将所述的第一处理混合物加至一测试条的样品垫,其中,所述测试条包括背衬以及位于背衬上的样品垫、反应膜和吸收垫,其中所述反应膜上设置有检测区和质控区;所述的检测区固定有所述小分子化合物的完全抗原;
(3)采用时间分辨荧光免疫层析方法测量所述测试片的检测区的荧光强度及质控区的荧光强度,从而确定小分子化合物是否存在,和/或确定为小分子化合物的含量。
在另一优选例中,所述的小分子化合物包括苯丙胺。
在另一优选例中,所述的样品包括水溶液、饮料、全血、血浆、血清、尿液、汗液、泪液或唾液。
在另一优选例中,在步骤(3)中,将测试区的荧光强度与质控区的荧光强度的比值,和标准曲线进行比较,从而确定小分子化合物的含量。
在另一优选例中,所述荧光乳胶微粒为镧系金属和/或镧系金属螯合物包被的乳胶微粒。
在本发明的第三方面,提供了一种定量检测待测物的荧光测量装置,所述的装置包括:
(a)本发明第一方面所述的试剂盒;和
(b)用于检测荧光强度的检测器。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
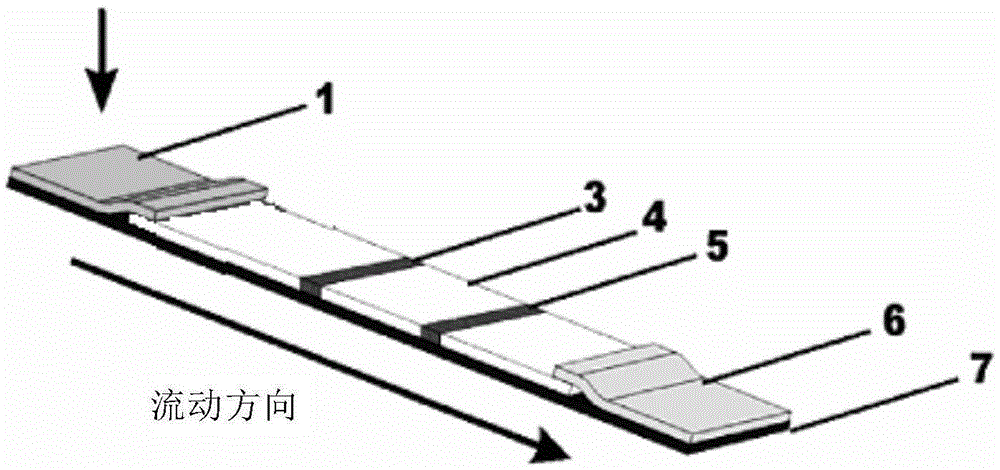
图1显示了本发明的一种实施例中免疫层析试纸条(板)的结构示意图,
其中,各标识如下:1为样品垫,3为检测区,4为反应膜,5为质控区(对照区),6为吸收垫,7为背衬。
具体实施方式
本发明人经过广泛而深入的研究,通过大量筛选和摸索,发现首次意外地发现了一种新的快速定量检测小分子化合物的试剂盒和方法。实验表明,检测时先将待测样品和独立放置的荧光乳胶微粒-抗体偶联物混合,再将该混合物加至测试条,并通过时间分辨荧光免疫层析方法进行检测,可以显著提高检测的灵敏度、特异性和稳定性,在此基础上完成了本发明。
具体而言,本发明人经过研究发现,现有的层析检测条的结构对于定量检测结果的波动(或偏差)造成较大的影响。一个主要的影响因素是结合垫部分(或结合区)。如果将偶联抗体的乳胶微粒包被在结合垫上,进行干燥。检测时乳胶从结合垫上释放就成为影响检测准确性的关键因素之一。此外,乳胶微粒释放的程度、释放的快慢和/或结合垫的材质,都可能是导致定量测定结果波动性大的因素。本发明人还发现,在对结合垫进行处理时,结合垫的处理方式以及乳胶的干燥程度也难以保持一致,且固定或位于所述结合垫的检测抗体(如荧光乳胶微粒标记的抗体偶联物)的性质易发生变化,导致长期稳定性下降,从而导致检测结果的波动性大。
此外,发明人的实验结果还表明,在检测区(或检测线)直接设置苯丙胺等小分子化合物(标准品)时,也会导致检测结果的波动性大。
为此,申请人优化了检测试剂的结构,一方面省略了结合垫,另一方面在质控区(或质控线)设置第二抗体(如针对荧光乳胶微粒标记的抗体偶联物的第二抗体),并在检测区(或检测线)涉及所述小分子化合物的完全抗原,这样不仅可以显著提高检测结果的准确性,减少偏差,而且所述检测试剂即使长期存放(≥2年)仍可保持稳定,并具有较高的准确性和灵敏度。
术语
苯丙胺
如本文所用,“苯丙胺”包括苯丙胺及其类似物,苯丙胺又称苯基乙丙胺、α-甲基苯乙胺、外语音译为安非他明,分子式为C9H13N,相对分子量135.21。苯丙胺是一系列对中枢神经系统具有显著兴奋作用的合成药物(统称苯丙胺类)的原型。苯丙胺可引起诸多不良反应,最常见的是过度兴奋,有不安、失眠、震颤、紧张和烦躁等症状。对苯丙胺的躯体耐受性出现的非常快,所以长期服用者必须越服用越多。这些服用者当药力消失时出现“垮掉”的感觉,表现为深度抑郁。服用大剂量苯丙胺后最严重的后果就是一种毒性神经病,其症状类似类偏执型精神分裂症。苯丙胺的滥用常和巴比妥药物及酒精的滥用一同发生。
免疫层析技术
免疫层析技术(Immunochromatography)是20世纪80年代末90年代初建立的一种快速检测技术。由于免疫层析技术不须进行结合标记物与自由标记物的分离,因而操作简单、快速,非常适合现场检测之用。
时间分辨荧光免疫分析
时间分辨荧光免疫分析(Time resolved fluoro immunoassay,TRFIA)是20世纪80年代初在传统荧光免疫分析的基础上创立的一种新型非放射性标记免疫分析技术,是目前最灵敏的微量分析技术。
测试条上检测区域的检测信号的获取,将测试条上的检测信号传递过来的光信号,通过光学聚光装置、分光装置,和光学光路整形等,得到615nm±10nm 左右的荧光光斑,将此荧光光斑传递到光学传感器光电倍增管,获得测试条上检测区域的检测光信号。通过控制信号读取时间为10微秒到400微秒,得到一个扣除荧光本底的检测信号。通过光电信号转换,将光信号转换为电信号传送给计算控制部件处理,最终完成检测。
与传统的荧光素标记不同,它所用的示踪物是具有独特荧光特性的镧系元素及其螯合物,可有效排除样品自然荧光的干扰,具有灵敏度高、特异性强、稳定性好和无放射性污染等特点,灵敏度高达10-19,较放射免疫分析(RIA)高出3个数量级。在临床免疫检验和科学研究中的应用越来越广泛。
时间分辨荧光免疫层析技术
时间分辨荧光免疫层析技术是基于免疫层析技术的时间分辨荧光分析技术,是在时间分辨荧光免疫分析仪的基础上,将时间分辨荧光免疫分析和免疫层析技术相结合,省去了繁琐的加样、洗涤步骤,试剂稳定性好,操作简单,检测速度快,灵敏度高,可广泛应用于现场定量检测,也可作为POCT(Point of Care Test,床边诊断或即时检测)分析仪。
镧系元素
目前,己有5种镧系元素被用于TRFIA,其中常用的有Eu、Tb和Sm,而Eu(铕元素)又是在标记抗原抗体中应用最广的元素。镧系元素在游离状态下,荧光信号很微弱,仅仅是分子间共振能级的能量传递,无辐射跃迁回基态发射荧光的机率很小,但其螯合物在紫外光源的激发下能发射荧光。与传统的荧光素标记物相比,镧系元素具有较宽的激发光谱带和较窄的发射光谱带,荧光持续时间长,且荧光光谱的Stocks位移较大,利用光谱分辨技术和时间分辨技术可有效排除激发光和非特异性荧光的干扰。
乳胶微粒
如本文所用,术语“乳胶微粒”、“乳胶微球”可以互换使用;“荧光微球”、“荧光微粒”、“荧光乳胶”、“荧光乳胶微粒”、“荧光乳胶微球”可以互换使用。
在医学诊断领域,从最早的乳胶凝集试验发展到今天复杂的多元化检测。以乳胶微粒作为抗原抗体的标记物,主要是由于乳胶微粒本身的特性,它可以 进行多种形式表面功能化修饰,密度改变和特殊属性的改变(比如:颜色改变、荧光或磁性等),使得乳胶成为检测中的一个重要部分。
乳胶微球的直径一般为100-300nm,最佳地为150-200nm。
在本发明中,优选的时间分辨荧光乳胶微粒是具有发射波长在610-620nm的荧光乳胶微粒,以便于检测。一种优选的乳胶微粒是含镧系元素的荧光乳胶微粒,较佳地,含有铕螯合物。可用于本发明的乳胶微球没有特别限制,可以选用市售的或用常规方法制备的乳胶微球。
采用内部含铕的乳胶微粒,即结合铕螯合物的荧光微粒。该结合铕螯合物的荧光微粒,在紫外光激发下,发出610-620nm的红色荧光,可以用来作为抗体标记。
抗体复合物
如本文所用“抗体复合物”、“荧光乳胶微粒-抗体偶联物”和“荧光微粒标记抗体”可互换使用。
本发明中,经荧光乳胶微粒标记的抗体为单/多克隆抗体。经标记后,抗体被偶联于荧光乳胶微粒。当然,也可视为乳胶微粒被偶联于抗体。
较佳地,抗体共价偶联于荧光乳胶微粒。
更佳地,将抗体偶联于荧光乳胶微粒是将抗体通过荧光乳胶微粒表面活化的羧基、羟基或醛基而共价偶联于荧光乳胶微粒。
其中,所述荧光乳胶微球的直径为100-300nm,较佳地为150-200nm。
此外,所述抗体与所述乳胶微粒的重量比例为为1:2~1:50,较佳地为1:5~1:25。
更佳地,所述抗体与所述乳胶微粒的重量比例为1:8~12。
检测试剂盒
本发明提供了一种可用于检测饮用水、饮料、全血、血浆、血清、尿液、汗液、泪液、唾液等样本中特定小分子化合物的检测试剂盒。
所述试剂盒包括:
(a)测试条,所述测试条包括背衬以及位于背衬上的样品垫、反应膜和吸收垫,其中所述反应膜上设置有检测区和质控区;以及
(b)第一容器,以及位于所述第一容器内且与所述测试条独立设置(或放 置)的抗体复合物,其中所述抗体复合物包含荧光乳胶微粒以及特异性针对小分子化合物的抗体,所述特异性针对小分子化合物的抗体偶联于所述荧光乳胶微粒;
其中,所述的检测区固定有所述小分子化合物的完全抗原;
较佳地,所述特异性针对小分子化合物的抗体采用含铕的荧光乳胶微粒标记。
一种优选的测试条是利用侧流原理的免疫层析侧流片或免疫层析试纸条。
在本发明中,术语“测流片”、“试纸片”、“试纸条”、“试纸板”、“层析条”、“测试条”具有相同的含义,可以互换使用。
本发明优选的免疫层析侧流片(或测试条)的结构如图1所示,其中包括:样品垫1,检测区(或检测线)3,反应膜4,对照区(或质控区、对照线、质控线)5,吸收垫6,背衬7。
其中,背衬7的长度与测试条相同。
样品垫1位于测试条的一端,吸收垫6位于测试条的另一端。
检测区3(也称检测线)位于样品垫1和吸收垫6之间,通常检测区3设置在反应膜4上,通过所述反应膜连接样品垫1和吸水垫6。优选地,所述反应膜4上还设置有质控区5(也称质控线),质控区5位于检测区3和吸收垫6之间。
其中,所述检测区固定有小分子化合物的完全抗原,所述质控区固定有羊抗鼠IgG,通过对两个区域的荧光信号分别加以分析,获得检测物的定量指标。
测试条的制造方法,优选地,分别将样品垫1、反应膜4、吸收垫6通过粘合剂粘贴于背衬7上,即得所述测试条。
在本发明中,所述测试条的各组成元件(或组件)可选用本领域已有的材料制成。
背衬7可以用任何稳定的、无孔的材料制成,其强度应足以支承材料和粘于其上的各组成元件。因为许多测定用水作为扩散介质,因此背衬7较佳地是基本上不透水的。在一个优选例中,背衬7是用聚合物膜制成的,更佳地是用聚氯乙烯膜制成的(如PVC胶板)。
样品垫1可用任何吸收性材料制成。可使用的材料例子包括:纤维素、硝酸纤维素、乙酸纤维素、玻璃纤维、尼龙、聚电解质离子交换膜、丙烯共聚物/尼龙、和聚醚砜。
反应膜4可以用任何材料制成,只要该材料有足够孔隙度从而允许在表面和内部发生流体的毛细管作用。反应膜4应有足够的孔隙度,从而允许涂有抗体或抗原的颗粒移动。反应膜4还可被含待检测分析物的样品中所用的液体润湿(例如,对于水性液体具有亲水性,对于有机溶剂具有疏水性)。通过例如在美国专利No.4,340,482或No.4,618,533中所述的方法(这些方法描述了将疏水表面转变成亲水表面),可以改变其疏水性从而使其具有亲水性以便用于水性液体。可用于制造反应膜4的材料例子包括但不限于:聚脂膜、纤维素、硝酸纤维素、乙酸纤维素、玻璃纤维、尼龙、聚电解质离子交换膜、丙烯共聚物/尼龙、和聚醚砜(polyethersulfone)。在一个优选例中,反应膜4是用硝酸纤维素膜制成的。
吸收垫6可以用任何能吸收作为样品和缓冲液的液体的材料制成。吸收垫6的吸收能力应足够大,以便吸收添加至测试条的液体。适用于吸收垫6的材料的例子包括纤维素和吸水滤纸。
为了便于理解本发明,给出本发明试剂盒的检测原理。应理解,本发明的保护范围并不受该原理的影响或限制。
本发明采用竞争法免疫层析的原理,将小分子物质的完全抗原固定于硝酸纤维膜上的检测区(固相抗原)。预混合待测样本和独立放置的荧光乳胶微粒-抗体偶联物,将该混合物加至测试条的样品垫,如果样本中不含有特定的小分子化合物,所述荧光乳胶微粒-抗体偶联物将沿反应膜(如硝酸纤维膜)向前流动,到达检测线位置时,荧光微粒标记抗体被固定在反应膜上的小分子与载体蛋白偶联物捕获,通过365nm紫外光的激发,在检测区T线位置形成红色的615nm荧光条带。如果待检样品中含有一定浓度的小分子物质,将会抑制荧光微粒标记抗体与固定抗原的结合,在硝酸纤维素膜的检测区的荧光条带将会减弱。荧光条带的强弱与待检样品中含有的小分子物质的浓度呈一定的线性关系,通过光电倍增管采集荧光信号进行计数,从而计算出待检样品中含有的小分子物质的浓度。本发明在反应膜(如硝酸纤维膜)的质控区设置羊抗鼠IgG多抗,无论待检样品中是否含有待测小分子化合物,荧光微粒标记抗体总能与质控区的羊抗鼠IgG多抗结合形成一条荧光质控带,该荧光条带是判定层析过程是否正常和检测板是否失效的标准,同时也作为定量分析中控制批间差的计算指标。
检测装置
本发明的检测装置可以包括:测试条、检测器、光源、光导纤维和计算机。还可以包括一份检测方法的使用说明。其中测试条的工作原理如上所述,任何可用于检测荧光强度的时间分辨荧光分析方法均可用于本发明的检测装置。
本发明的主要优点包括:
(a)本发明的试剂盒稳定性好,灵敏度和准确性高。
(b)本发明的试剂盒特异性好。
(c)本发明的试剂盒可以用于多种样品的检测。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
材料
抗苯丙胺单克隆抗体和苯丙胺完全抗原以及羊抗鼠IgG多克隆抗体购自上海八通生物科技有限公司;含铕的乳胶微粒(Carboxylate-Modified Dyed Microparticles,Fluoro-MAX,PART NO:93470520010150)粒径为0.199nm,购自于ThermoFisher Scientific公司。EDC(1-乙基-3-(3-二甲基氨丙基)-碳化二亚胺)、NHS(N-羟基琥珀酰亚胺)和小牛血清白蛋白(BSA)均为Sigma公司产品;硝酸纤维素膜为Millipore公司产品,孔径为8μm;玻璃纤维膜为Millipore公司产品;苯丙胺对照品为中检所国家麻醉品实验室提供;时间分辨荧光定量检测仪由上海伊思柏生物科技有限公司提供。
实施例1
荧光乳胶微粒-抗体偶联物的制备
取1%荧光乳胶微球250μL加1000μL 0.05M 2-(N-吗啉)乙磺酸(MES)(ph6.0)混匀。15000rpm离心20分钟,弃上清液,用1000μL 0.05M MES重悬,超声(50W,工作时间1秒,间隔时间1秒)后15000rpm离心20分钟。 弃上清液,用0.05M MES稀释至500μL,超声。加入38.5μL的NHS(10mg/ml)和5μL EDC(15mg/ml)混匀后反应15分钟。加入0.15mg的苯丙胺单克隆抗体混匀。摇床上避光室温下反应2小时。加入25μL 0.1M乙醇胺反应30分钟以封闭微球表面未结合羧基。13000rpm离心10分钟后弃上清,用500μL酪蛋白封闭液反应1小时。15000rpm离心10分钟,收集标记的荧光乳胶微球用酪蛋白封闭液稀释至250μL,超声后2-8℃保存。
实施例2
冷冻干燥的荧光乳胶微粒-抗体偶联物的制备
将标记上抗体的荧光乳胶微粒溶液与冷冻干燥处理液(Borax0.1M、BSA1%、S172%、蔗糖5%、海藻糖5%)混合,将混合溶液加入96孔板中25μL/孔,放入-80℃冰箱冷冻30分钟。将冷冻后的96孔板放入预先开启并已经降温至-35℃的真空冷冻干燥机中,分段升温并进行真空干燥,2小时30分钟后取出,用真空包装机将冷冻干燥后的乳胶微粒进行真空包装,包装后放置于2-8℃保存。
实施例3
样品垫的封闭处理
样品垫采用玻璃纤维,为减少检测中的非特异性结合和增加稳定性,用表面活性剂和聚合物对样品垫进行封闭处理。具体地,用含有0.2%Tween 20和0.5%PVA的pH 8.0,0.1M Tris缓冲液水溶液浸泡吸水滤纸,37℃烘16小时。
实施例4
免疫层析测试条的制备
在硝酸纤维素膜上用点膜机分别划检测线和质控线,检测线为苯丙胺-BSA(完全抗原)(0.8mg/mL),质控线(C线)为纯化后的羊抗鼠IgG多抗(1.0mg/mL),37℃干燥后18-24小时。依次将硝酸纤维薄膜和样品垫粘贴于PVC支持材料上。用切条机切成4mm的试剂条,置于塑料盒内,加样孔对准检测条样品垫位置,压紧后组装成检测试剂盒,加入干燥剂密封保存。
进行检测时,样品中的苯丙胺与固定在硝酸纤维膜上的苯丙胺-BSA竞争结合荧光乳胶微粒-抗体偶联物,检测区(T)的荧光强弱与样品中的苯丙胺含量相 关,通过时间分辨定量检测仪阅读观察窗检测区(T)位置的荧光条带的荧光值,通过不同浓度的标准品可以得出荧光值和苯丙胺浓度的相关曲线和计算公式,由此可以准确地对样品中的苯丙胺进行定量。
实施例5
标准曲线的制备
从密封袋中取出冷冻干燥的荧光微粒抗体偶联物,用移液枪加100μL不同浓度的苯丙胺标准品于孔内,用移液枪将溶液吹打混匀,取50μL滴入加样孔内,10分钟后加入100μL冲洗液,再等待5分钟,将试剂板插入检测仪中读取荧光值。根据不同浓度的苯丙胺标准品和荧光值,通过四参数法制备标准曲线。
结果显示,通过四参数拟合的回归方程为:Y=(A-D)/[1+(X/C)^B]+D,且R2<0.99。
实施例6
样品检测方法
方法同实施例5所述方法,将100μL待测样品与荧光微粒抗体偶联物混合后进行检测,获得荧光值,通过标准曲线的计算公式,计算样本中苯丙胺的含量。
实施例7
特异性分析
特异性测试,对提供的多种常见毒品、毒物和药物,在一定的浓度范围内进行交叉实验。
a)选择的毒品、毒物和药物标准品对照物如下表所示:
注:K为千
b)以无毒品的冻融尿作为阴性对照,检测各交叉干扰物(标准品)对阴性样品的干扰,即在阴性样品检测时有阳性反应,表现为仪器读数反应为T线读数下降(相对于阴性对照仪器读数)。
c)通过实验确定无交叉反应的各标准品浓度,获得可用于评估的可能发生交叉反应的浓度。
d)获得用于评估的发生交叉反应的浓度大于检测限浓度100倍以上,则可认定为满足特异性测试要求。
结果如下表所示:本发明试剂盒仅与苯丙胺类样品发生反应,与其他物质没有交叉反应,具有很强的特异性。
实施例8
稳定性分析
将检测试剂盒密封后置于烘箱45℃温度下破坏性试验一个月。方法同实施例5所述方法,分别用破坏性处理的试剂盒与未烘烤过的试剂盒,对含不同浓度苯丙胺的样本及阴性样本进行测试。
结果表明,45℃破坏性处理一个月的试剂盒与未烘烤过的试剂盒检测结果一致(偏差≤±2%)。表明该检测试剂盒具有良好的稳定性。
实施例9
灵敏度分析
方法同实施例5中的方法,分别检测浓度为2.5ng/mL、5ng/mL、10ng/mL的苯丙胺样品,每个检测浓度重复检测5次。计算检测结果的标准差(SD值)、平均值(AVG值)和变异系数(CV值),其中,CV值应在10%以内,则可认为满足灵敏度测试要求。
结果如下表所示:本发明的苯丙胺测试条的灵敏度约为2.0ng/ml。检测的CV<10%。
实施例10
准确性分析
方法同实施例5中的方法,同本发明试剂盒对10例实际案例样本进行检测,检测数据与GC-MS的结果进行比较,符合率均大于95%。结果表明,本发明的检测试剂盒具有很高的准确性。
实施例11
检测速度测试
将准备好的测试条(卡)插入检测仪器,开始测试并计时,测试完成得到测试读数,停止计时,得到计时时间,计时时间在10分钟内则可认定为满足测试要求。
实验结果:检测时间均小于5分钟,检测速度符合现场检测和快速检测的要求。
对比例C1
测试条C1的制备和性能测试
1.制备
测试条C1的结构与本发明测试条类似,其区别在于,测试条C1包括一结合垫,所述结合垫位于样品垫1和吸收垫6之间,在样品垫1的近端和吸收垫6的远端,临近样品垫1。并且,所述结合垫上包含抗体复合物,所述抗体复合物包含荧光乳胶微粒以及小分子化合物抗体,所述小分子化合物抗体偶联于所述荧光乳胶微粒。
2.准确性
采用该测试条C1,对于实施例10中的实际案例样本进行检测,检测数据与GC-MS的结果进行比较,符合率仅为70%。这表明,检测条C1的准确性不高,不适合准确性要求高的定量检测应用。
3.稳定性
方法同实施例8,对该测试条C1进行稳定性测试。
结果表明,45℃破坏性处理一个月的试剂盒与未烘烤过的试剂盒检测结果发生了一定程度的偏差(偏差度≥10%),此外,45℃破坏性处理二个月后,偏差度进一步上升到≥20%。这表明,测试条C1的长期稳定性较差。
4.灵敏度
方法同实施例9,对该测试条C1进行灵敏度测试。
结果表明,该测试条C1的灵敏度为约10ng/ml,虽然可以满足一般需要,但是灵敏度远低于本发明测试条。
对比例C2
测试条C1的制备和性能测试
在对比例C2中,测试条C2的结构与本发明测试条类似,其区别在于,检测区设有苯丙胺小分子化合物,而不设置苯丙胺完全抗原。
方法同实施例9,对该测试条C2进行灵敏度测试。
结果表明,该测试条C2的灵敏度为大于20ng/ml,灵敏度远低于本发明测试条。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种st2定量检测方法及试剂盒的制作方法
- 一种定量药粉取用盒的制作方法
- 一种层粘连蛋白(ln)测试试剂盒及其测试方法
- 一种抗核糖体P蛋白抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种阿胶胶液半成品或成品中驴、牛源性成分的定量检测方法、组合物及试剂盒的制作方法
- 一种抗PM-Scl抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种抗LKM-1抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种抗SLA/LP抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种快速定量检测h-fabp的时间分辨荧光免疫层析试剂及制备方法
- 一种定量检测液体样品中汞离子的方法及试剂盒的制作方法
- 一种定量药粉取用盒的制作方法
- 一种层粘连蛋白(ln)测试试剂盒及其测试方法
- 一种抗核糖体P蛋白抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种阿胶胶液半成品或成品中驴、牛源性成分的定量检测方法、组合物及试剂盒的制作方法
- 一种抗PM-Scl抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种抗LKM-1抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种抗SLA/LP抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种快速定量检测h-fabp的时间分辨荧光免疫层析试剂及制备方法
- 一种定量检测液体样品中汞离子的方法及试剂盒的制作方法
- 一种轴抑制蛋白2基因突变检测试剂及应用