微流体感测的制作方法
背景技术:
微流体技术适用于多种学科并且涉及对少量流体的研究以及对如何在各种系统和装置(诸如微流体芯片)中操纵、控制和使用这样的少量流体的研究。例如,在一些实例中,可以将微流体芯片用作“芯片上实验室”,诸如,用于医疗和生物领域中对流体及其组分进行评估。
附图说明
图1是示意性地图示了根据本公开的示例的微流体装置的框图。
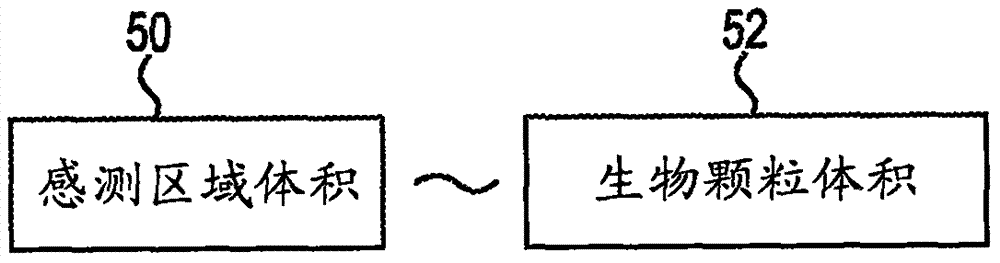
图2是示意性地图示了根据本公开的示例的感测区域体积与生物颗粒体积之间的关系的框图。
图3是示意性地图示了根据本公开的示例的容装微流体装置的匣盒的框图。
图4是示意性地图示了根据本公开的示例的微流体装置的框图。
图5是示意性地图示了根据本公开的示例的微流体装置的部件的框图。
图6是示意性地图示了根据本公开的示例的微流体装置的部件的框图。
图7是示意性地图示了根据本公开的示例的微流体测试系统的框图。
图8是示意性地图示了根据本公开的示例的图7系统的主机装置的框图。
图9是示意性地图示了根据本公开的示例的图7系统控制接口的框图。
图10是示意性地图示了根据本公开的示例的微流体装置的包括通道结构和关联部件的部分的平面图。
图11是示意性地图示了根据本公开的示例的微流体通道结构内的感测部的放大局部平面图。
图12是示意性地图示了根据本公开的示例的感测区域体积和生物颗粒体积的示意图。
图13是示意性地图示了根据本公开的示例的微流体通道结构内的感测部的放大局部平面图。
图14是沿图13的线14-14截取的截面图,其示意性地图示了根据本公开的示例的与感测区域相关联的收缩部。
图15是示意性地图示了根据本公开的示例的微流体通道结构内的感测区域的放大局部平面图。
图16是包括示意性地图示了根据本公开的示例的微流体通道结构内的一串感测部的侧视平面图的示意图。
图17是示意性地图示了根据本公开的示例的微流体通道结构内的平行设置的多个感测部的侧视平面图。
具体实施方式
在以下的详细说明中,对附图进行参照,这些附图构成了说明书的一部分,在这些附图中,以图示的方式示出了可以实践本公开的具体示例。要理解,在不脱离本发明的范围的情况下,可以利用其它示例,并且可以进行结构性的或者逻辑性的改变。因此,以下详细说明不应视为具有限制意义。
本公开的至少一些示例涉及用于评估生物流体的微流体装置。在一些实例中,可以在细胞学中部署这种微流体装置,诸如,细胞计数和分析。例如,一种常见的医疗过程包括对血液样本进行评估以确定白血球数或者红血球数,该白血球数或者红血球数可以指示特定医疗状况、器官健康等。
除了其它特征和属性之外,本公开的至少一些样本经由高信噪比在微流体芯片上实现了细胞学的高吞吐量并且提高了准确度,该高信噪比可通过采用单行感测和低流体稀释因子来实现。在一些实例中,经由在微流体芯片的通道结构内设置感测区域,来至少部分地实现这种布置,其中,感测区域具有与感兴趣的生物颗粒的体积的数量级相同的体积(例如,感测体积)。
通过使感兴趣的生物颗粒在单行模式下通过感测区域,该布置按照每次一个生物颗粒的方式实现了对生物颗粒的感测或者计数。
在一些实例中,经由在通道结构内在感测区域之前和/或在感测区域内设置非均匀流场,来至少部分地实现该布置。在一些实例中,经由位于感测区域上游的排除结构来至少部分地实现非均匀流场,该非均匀流场用于排除大于感兴趣的目标生物颗粒的生物颗粒。在一些实例中,经由减少刚好在感测区域之前的通道结构的截面积,来至少部分地实现非均匀流场。
而且,当将上述特征与微流体装置的其它操作方面相结合时,在一些实例中,可实现高达每秒1百万个生物颗粒的感测吞吐率(例如,计数)。在一些实例中,微流体装置的这种操作方面包括使用机载泵、机载加热器、机载混合、和/或机载传感器,所有这些都存在于占地面积很小的基底上。
经由这些高吞吐率进行快速计数又明显减少了涉及特定生物颗粒的总测试时间,从而使用于现实世界、临床设置的即时诊断测试变为可行,而且利用较低成本的测试芯片即可完成。
利用本公开的至少一些示例的细胞学过程不限于血液,还扩展至其它生物流体或者生物流体配制物以检测唾液、尿、脊髓流体等中的细菌和/或病毒。其它适用的示例包括对啤酒环境中的酵母细胞进行计数或者获取精子细胞计数或者卵子计数。如下面进一步描述的,经由设置大小和形状被设计为增强对感兴趣的特定生物颗粒的感测(例如,计数)的感测结构,本公开的至少一些示例针对这许多不同类型和大小的生物颗粒实现了高准确度和高吞吐量。
结合至少图1至图17对这些示例和其它示例进行描述和图示。
图1是示意性地图示了根据本公开的示例的微流体装置20的框图。如图1所示,微流体装置20形成在基底22上,并且包括通道结构30,该通道结构30又包括第一通道32和使流体运动通过至少第一通道32的流体致动器34。第一通道32包括用于促进对感兴趣的生物颗粒(即,目标生物颗粒)进行感测的感测区域40。
在一些实例中,目标生物颗粒形成生物流体的一部分,诸如,全血或者成分血。一些示例生物颗粒包括在全血或者成分血中发现的红血球、白血球、病毒等。在一些示例中,生物颗粒形成如上面提到的其它自然生物流体或者其它生物流体配制物的一部分。
在一些实例中,微流体装置20称为微流体芯片或者生物测试芯片。
如图2中进一步图示的,在一些示例中,感测区域的体积50与在第一通道32中流动的流体内的目标生物颗粒的体积52相当。具体地,在一些示例中,感测区域的体积50与生物颗粒的体积52的数量级相同。在一些实例中,感测区域的体积50在本文称为感测体积。
稍后将进一步描述不同类型的生物颗粒的一些示例的尺寸和体积。
图3示意性地图示了根据本公开的示例的包括微流体装置20(图1至图2)的模块60的框图。在一些实例中,该模块称为匣盒或者容器。如图3所示,模块60包括至少部分地包含和/或支撑微流体装置20的壳体61。
在一些示例中,如图3所示,流体贮存器64限定在壳体61内,非常靠近微流体装置20,以实现在其间的流体连通。如图3所示,(经由进口62)储存流体样本67以进入流体贮存器64并且在流到微流体装置20中之前与(多个)试剂66混合。在一些实例中,微流体装置20包括自己的贮存器以在流体流到微流体装置20的通道中之前首先接收来自贮存器64的流体样本(已与试剂66混合)。
如果流体样本67是血液,则在一些示例中,(多个)试剂66包括诸如乙二胺四乙酸(edta)等抗凝血剂和/或磷酸盐缓冲盐水(pbs)等缓冲溶液。在一些示例中,合适的血液样本的体积为约2微升,而试剂的体积为约8微升,由此产生待经由微流体装置20处理的10微升的体积。因此,在这种布置中,将约为5的稀释因子应用于全血的流体样本。在一些示例中,将大于或者小于5的稀释因子应用于全血。在一些示例中,这种低稀释因子确保了在感测体积的流体(待测)通过对目标生物颗粒进行计数的感测区域时的高信噪比。另外,稀释因子越低,待由微流体装置处理的流体的总体积越小,这又减少了特定流体样本的总测试时间。在一些示例中,采用等于或者小于10的稀释因子。
在一些示例中,无论流体样本67是血液还是另一种类型的生物流体,都可以使用大于或者小于2微升的体积。另外,在一些示例中,无论流体样本67是血液还是另一种类型的生物流体,都可以使用大于或者小于8微升的试剂体积。在一些示例中,也利用除了试剂66之外的其它或者附加流体来稀释流体样本67。
在一些示例中,可以根据十的量级来实施针对血液或者任何流体样本67的稀释因子,该稀释因子包括诸如10、20、30、40、50、60、70、80和90的稀释因子、以及介于这些列出来的值之间的量。
要理解,在一些示例中,可以根据1阶来实施(应用于流体样本67的)稀释因子,该稀释因子包括稀释因子1、2、3、4、5、6、7、8和9。
要进一步理解,当全血是流体样本67时,在一些示例中,(多个)试剂66包括其它或者附加试剂以制备要进行感兴趣的诊断测试的血液。在一些示例中,这种(多个)试剂66帮助传感器识别流体样本中的某些颗粒以便追踪这些颗粒,对这些颗粒进行计数,移动这些颗粒等。在一些示例中,这种(多个)试剂66与流体样本67中的某些颗粒结合以便有利于将这某些颗粒从流体排除或者过滤掉这某些颗粒,以更好地隔离或者聚集感兴趣的特定生物颗粒。在一些示例中,(多个)试剂66的操作与过滤器和/或其它分类和分离机构配合使用以从微流体装置20的感测区域排除某些生物颗粒。
在一些示例中,(多个)试剂66包括适合执行抗体-抗原结合以便进行微粒标记的材料和/或适合实施纳米粒子标记技术、磁性颗粒分类技术、和/或高密度颗粒标记技术的材料。
在一些示例中,至少一些(多个)试剂66包括裂解剂,诸如(但不限于),当需要在实施后续的对白血球进行计数或者分析之前将红血球分离出来时。
当然,在流体样本67不是血液但却是不同的生物流体(诸如,尿、脊髓流体等)的情况下,(多个)试剂66可包括合适类型和数量的、适合处理这种流体并且能够实现期望的对这些流体的组分的分离和分类的(多个)试剂66。
图4是示意性地图示了根据本公开的示例的微流体装置80的框图。在一些示例中,微流体装置80包括与图1至图3的微流体装置20大体上相同的至少一些特征和属性。在一些示例中,图3的微流体装置80的至少一些部件包含在图1至图3的微流体装置20内。
如图3所示,微流体装置80包括(多个)致动器82和(多个)属性传感器84,致动器82用作泵85a和/或用作加热器85b。在一些示例中,致动器82包括电阻元件,诸如,热敏电阻。当在高强度和足够的脉冲宽度下被启动时,致动器82可以使气泡成核排开通道结构30内的流体,以驱动流体沿着通道结构30通过。作为副产物,可能会产生适度量的热能。在一个方面中,这种高强度启动涉及较短的脉冲宽度和更高的电力。
然而,当在低强度和不足的脉冲宽度下启动时,致动器82不用作泵,这是因为导致成核事件所需的能量不足,因此不会导致明显的流体排开。相反,可能会产生热能,从而使致动器82用作加热器85b,而不排开流体。在一个方面中,这种低强度启动涉及较长的脉冲宽度和更低的电力。
在一些示例中,微流体装置80包括用于检测流体或者流体的构成成分的属性的(多个)属性传感器84。在一些示例中,属性传感器84包括用于对流经通道结构30的生物颗粒进行计数的阻抗传感器,如下面至少结合图10至图17进一步描述的。
稍后描述的控制接口106可联接至微流体装置的用于对(多个)致动器82和(多个)传感器84上电并且控制其操作的电气接口。在一些示例中,通过使用集成电路微制造技术,诸如,电成型、激光烧蚀、各向异性蚀刻、溅射、干法蚀刻和湿法蚀刻、光刻、铸造、模塑、冲压、加工、旋涂、层压等,来制造基于芯片的微流体装置20、80的结构和部件。
图5是示意性地图示了根据本公开的示例的微流体装置的部件86、87的框图。在一些示例中,微流体装置,诸如装置20、80(图1至图4),进一步包括进口/出口腔室86和/或过滤器87。进口/出口腔室使流体能够进入和离开通道结构30的各个部分,而过滤器87使流体的不同组分彼此隔离,诸如,使更大的颗粒不能进一步通过通道结构30,如稍后进一步提到的。在一些实例中,这种过滤器87称为排除结构。
图6是示意性地图示了根据本公开的示例的微流体装置的热传感器88的框图。在一些示例中,微流体装置,诸如装置20、80(图1至图4),进一步包括(多个)热传感器88。在一些示例中,热传感器88追踪至少通道结构30和其中的流体的温度以方便管理与对通道结构30内存在的给定生物流体实施感兴趣的测试相关联的反应过程。在一个示例中,(多个)热传感器88是根据电阻元件的温度改变电阻的电阳元件。
图7是示意性地图示了根据本公开的示例的微流体测试系统的框图。如图7所示,系统100包括匣盒60、控制接口106(具有壳体107)、和主机装置108。在一些示例中,匣盒60包括与如前面至少结合图3所描述的匣盒60大体上相同的至少一些特征和属性,并且,微流体装置20包括与如前面至少结合图1至图6所描述的微流体装置20、80大体上相同的至少一些特征和属性。
如图7所示,除了至少微流体装置20之外,匣盒60包括用于在微流体装置20(在匣盒60内)与控制接口106之间传送电力、数据和/或控制信号等的输入/输出(i/o)模块102,该输入/输出(i/o)模块102又与主机装置108通信。
在一些示例中,如图7所示,匣盒60可移除地联接至控制接口106,从而,若需要,可以将其联接和解除联接。控制接口106可移除地联接至主机装置108,如下文进一步描述的。在一些实例中,控制接口106称为或者体现为电子狗或者连接器。
通常,通过微流体学来处理流体样本67(图3),并且在控制接口106的控制下将流体样本67施加至微流体装置20中的感测区域。微流体装置20将表示传感器数据(例如,生物颗粒的计数)的电输出信号提供至控制接口20。利用在主机装置108控制下的控制接口20,主机装置108可以向控制接口106发送数据和接收来自控制接口106的数据,包括:用于控制微流体装置20和获取从微流体装置20获得的传感器数据的命令信息。
图8是示意性地图示了根据本公开的示例的主机装置108(图7)的框图。如图8所示,在一些示例中,主机装置108通常包括中央处理单元(cpu)110、各种支持电路112、存储器114、各种输入/输出(io)电路116、和外部接口118。cpu110包括微处理器。在一些示例中,支持电路112包括缓存、电源、时钟电路、数据寄存器等。在一些示例中,存储器114包括随机存取存储器、只读存储器、高速缓冲存储器、磁性读/写存储器等、或者这种存储器装置的任何组合。在一些示例中,io电路116与外部接口118协作以促进通过通信介质(如图7所示)与控制接口106的通信。通信介质19可以涉及任何类型的有线和/或无线通信协议,并且可以包括电气的、光学的、射频等的传送路径。
在一些示例中,外部接口118包括通用串行总线(usb)控制器,用于向控制接口106发送数据和从控制接口106接收数据、以及通过usb电缆向控制接口106供电。要理解,在一些示例中,使用其它类型的通往控制接口106的电气的、光学的或者射频接口来发送、接收数据和/或供电。
在一些示例中,如图8所示,主机装置108的存储器114存储操作系统(os)109和驱动器111。os109和驱动器111包括可由cpu110执行以便控制主机装置108并且通过外部接口118控制控制接口106的指令。驱动器111在os109与控制接口106之间提供接口。在一些示例中,主机装置108包括可编程装置,该可编程装置包括存储在非暂时性处理器/计算机可读介质(例如,存储器114)上的机器可读指令。
在一些示例中,如图8所示,主机装置108包括显示器120,通过该显示器120,os109可以提供图形用户界面(gui)122。用户可以使用用户界面122来与os109和驱动器111交互以控制控制接口106,并且显示从控制接口106接收到的数据。要理解,主机装置108可以是任何类型的通用或者专用计算装置。在示例中,主机装置108是移动计算装置,诸如,“智能电话”、“平板电脑”等。
图9是示意性地图示了根据本公开的示例的控制接口106的框图。在一个示例中,控制接口106包括控制器134、io电路136、和存储器138。控制器134包括微控制器或者微处理器。在一些示例中,控制接口106从主机装置108接收电力,而在一些示例中,控制接口106包括电源142。
在一些示例中,存储器138存储可由控制器134执行以便至少部分地控制微流体装置20和/或与主机装置108通信的指令140。同样,控制接口106包括可编程装置,该可编程装置包括存储在非暂时性处理器/计算机可读介质(例如,存储器138)上的机器可读指令。在一些示例中,可以通过使用硬件、软件的组合、和存储在存储器138中的指令140来实施控制接口106。例如,在一些示例中,通过使用可编程逻辑器件(pld)、专用集成电路(asic)等来实施控制接口106的所有或者一部分。
图10是示意性地图示了根据本公开的示例的微流体装置20的一部分微流体结构200的示意图。在一些示例中,微流体结构200包括与之前至少结合图1至图9描述的微流体装置20、80大体上相同的至少一些特征和属性。
如图10所示,在一些示例中,微流体结构200包括微流体通道202、流体致动器204、传感器206、喷嘴205(例如,出口)、和进口208。图10还描绘了流体贮存器214,该流体贮存器214与匣盒60(图3)的流体贮存器64连通。在一些示例中,在流体贮存器214中设置有筛网过滤器212以便过滤掉所施加的流体样本中的颗粒。虽然图10中的流体通道202的形状被示出为是“u形”的,但是这并不旨在是对通道202形状的普遍限制。因此,通道202的形状可以包括其它形状,诸如,弯曲形状、蜿蜒形状、具有角部的形状、上述的组合等。而且,并未以任何特定的比例或者比率来示出通道202。通道202在装置上的制造宽度可与本公开附图中示出的任何比例或者比率不同。通道中的箭头表示流体流经通道的示例方向。
进口208为通道202提供了接收流体的开口。在一些示例中,过滤器210设置在进口208中并且防止特定流体中特定大小(取决于过滤器210的大小)的颗粒进入通道202。在一些示例中,进口208可以具有比通道202更大的宽度和体积。例如,进口208可以在下游方位中限定出逐渐变窄的截面积。在一个方面中,如下面进一步描述的,这些结构帮助建立非均匀流场,该非均匀流场有助于生物颗粒单行流动到通道202中。
然而,要理解,在一些示例中,这种过滤器210不位于进口208中,而是位于进口208上游并且在通道202外部。在一些示例中,过滤器位于匣盒60中,位于贮存器214上游。如其它地方提到的,在一些实例中,该过滤器称为排除结构。在一些示例中,传感器206设置在通道202中,靠近进口208(例如,比泵致动器204更靠近进口208),如图10所示。在一些示例中,传感器206设置在进口208中。在一些示例中,传感器206是阻抗传感器并且在流体中的生物颗粒经过传感器206时检测阻抗变化。在一些示例中,传感器206产生强度与经过/通过传感器206的生物颗粒的大小成正比的信号,从而为对生物颗粒进行计数提供了基础。
下面至少结合图11至图16描述有关这种结构的进一步细节。
如图10进一步示出的,在一些示例中,流体致动器204(例如,泵)设置在通道202的闭合端附近,位于传感器206下游。流体致动器204可以是流体惯性泵致动器,可以通过使用多种结构来实施该流体惯性泵致动器。在一些示例中,流体致动器204是产生气泡以在通道202内建立流体排开的热敏电阻。排开的流体从喷嘴405排出,从而在通道202内/通过通道202实现惯性流动模式。在一些示例中,流体致动器204被实施为压电元件(例如,pzt),该压电元件的电致变形在通道202内生成流体排开。通过电力、磁力和其它力启动的其它变形薄膜元件也可以用于实施流体致动器204。
在一些示例中,流体致动器204使流体排开小于10微微升,并且可以在1hz至100khz范围的频率内被激发。
通常,将流体致动器204定位为足够靠近传感器20以确保高流体流速,因此确保高颗粒计数速率,诸如,高达每秒1百万。虽然未示出,但是在一些示例中,将流体致动器204定位为产生推动生物颗粒通过如图10所示的传感器206处的区域的惯性泵送,而在一些示例中,将流体致动器204定位为产生拉动生物颗粒通过传感器206处的区域的惯性泵送。
图11是示意性地图示了根据本公开的示例的微流体通道结构的感测部221的放大局部侧视图。在一些示例中,感测部221形成具有与之前至少结合图1至图10描述的微流体装置20、80大体上相同的至少一些特征和属性的微流体装置的一部分。如图11所示,感测部221包括与通道202连通的进口208。在一些示例中,进口208具有锥体形状,该锥体形状(在a处)开始,直径大体上大于通道202的宽度(w1),然后该锥体形状在与通道202接合的230处减小到端点(在b处)以与通道202的宽度匹配。除了其它特征之外,锥体形状的进口208有助于形成非均匀流场以便于将生物颗粒排列成单行以便在(多个)属性传感器220处按照每次一个生物颗粒的方式运动通过通道202。虽然出于清楚起见省略掉了过滤器,但是在一些示例中,将过滤器210设置在进口208内以排除大小大于感兴趣的生物颗粒(即,要进行计数的目标生物颗粒)的生物颗粒。在一些示例中,该过滤器210包括柱形物,这些柱形物彼此间隔开一定距离,该距离使得目标生物颗粒能够流体流动和通过,但却阻止更大的生物颗粒通过。该过滤器210进一步有助于形成非均匀流场,该非均匀流场将目标生物颗粒排列以便在(多个)属性传感器220处以单行的方式进入和通过通道202。如之前提到的,该过滤器210有时称为排除结构。
在一些示例中,传感器220包括用作阻抗传感器以检测目标生物颗粒的属性的电阻元件。例如,经由传感器220检测到的一个属性包括在生物颗粒以每次一个生物颗粒的方式通过通道202的感测区域时对生物颗粒进行计数。
在一些示例中,通道202形成有截面积以限定出流经通道202和从传感器220经过的流体(包括单个目标生物颗粒)的感测体积240。如至少部分地在图11中示出的,感测体积240具有宽度(w1)、长度(l1)和高度(h1),将在图12中进一步描绘感测体积240。在图11至图12中描绘的感测体积240不是物理结构,而是对流经通道202传感器220经过/通过传感器220的流体的体积的表示,并且该体积的大小仅仅是足够携带单个生物颗粒260。虽然图12描绘了红血球(rbc),但要理解,生物颗粒260不限于血液的生物颗粒,也可以是生物流体(生物流体配制物)的任何生物颗粒或者其它与食物有关的生物颗粒,诸如,酵母细胞。
要理解,感测体积240不必是立方体,也可以形成通常与通道202(流体通过通道202在传感器220所在区域中运动)的横截面形状对应的其它形状。例如,如果在该区域中的通道202具有通常为圆形的横截面形状,则感测体积采用大体上圆盘形形状、圆柱形形状或者球形形状。因此,感测体积表示在对生物颗粒进行感测以便对其计数的时候在目标生物颗粒运动通过传感器220所在区域的通道时特定生物颗粒所在的流体的体积。
要进一步理解,任何给定类型的目标生物颗粒都具有自己的唯一几何结构,并且本文描述的目标生物颗粒不限于图12所示的生物颗粒的形状和大小。因此,目标生物颗粒的体积不必具有统一的形状、拓扑等。尽管如此,作为一个示例,图12描绘了具有直径(d1)和厚度(t1)以及大体上圆盘形外观的红血球。而且,在一些示例中,为了经由传感器220对细胞进行计数并且为了在传感器220所在区域中的通道202中将生物颗粒排列成单行,生物颗粒260的总体积与生物颗粒的最大尺寸(例如,高度、宽度、长度、直径等)的值相比意义较小,该最大尺寸可能是生物颗粒被分类排列成单行的因素。因此,取决于感兴趣的目标生物颗粒,选择通道202的大小/形状以形成流体的感测体积,从定义上来讲,该感测体积会携带仅一个生物颗粒。
在一些示例中,感测体积的数量级与感测体积内携带的目标生物颗粒的体积相同。换言之,感测区域的体积与在感测的时候运动通过传感器220或者传感器220经过的流体的体积内携带的目标生物颗粒的体积的数量级相同。
这种布置能够在传感器220所在位置处实现高信噪比(snr)以获得高效且有效的计数结构。具体地,由于对于每个待计数的生物颗粒在传感器220附近存在少量的流体,所以对于特定感测实例中(即,在感测数据信号的特定快照或者窗口处)存在的各个生物颗粒能够记录相对较强的信号。
在一些示例中,通过单个生物颗粒的体积与感测体积之比来定义体积分数。在一些示例中,体积分数是十分之一的量级,诸如,0.1(即,10%)。例如,如果流体样本是全血并且目标生物颗粒是红血球,则目标生物颗粒的最大尺寸(在本实例中,直径)为约6微米,并且体积的数量级为0.1微微升(例如,在一些实例中,9×10-17升)。假设第一感测通道提供了约100微米的截面积和10微米的长度,则第一通道的大小设计为限定出约1微微升的感测体积。在这种情况下,体积分数会为约0.1,如上面提到的。要理解,该示例并非是严格限制性的,取决于特定生物颗粒和在感测区域处的通道的特定大小和形状,在一些示例中,感测体积的范围可以是生物颗粒的体积的1-10倍。
考虑到市售血细胞计数器极大地稀释生物颗粒所在的流体(例如,高达100倍至1000倍)以便充分分离生物颗粒以经由适用的技术实现计数,这些血细胞计数器提供体积分数,诸如,0.001(0.1%),这比在本公开的至少一些示例中实现的体积分数高出约2个数量级。
然而,本公开的示例不严格局限于根据0.1的体积分数操作,也可以根据不同的体积分数(例如,0.25、0.4、0.5、0.6、1.1、1.5等)操作,这取决于生物颗粒的具体类型,该生物颗粒具有自己唯一的形状和大小。
在一些示例中,感测区域中的通道的大小和形状导致了感兴趣的特定生物颗粒的行为特性。例如,红血球是非常顺应的,因此,可以将用于接收红血球的感测区域处的通道的大小和形状制作成极其匹配红血球的大小,这是因为可以预料到红血球会进行足够的弯曲、压缩或者适应以使红血球能进入感测区域中。相反,具有奇怪尺寸(长形、三角形等)或者不太顺应的其它颗粒可能会涉及:鉴于感兴趣的该生物颗粒的特定特性提供的通道的感测区域的大小和形状更具包容性。
在一些示例中,采用微流体装置来对血细胞之外的生物颗粒进行计数。例如,可以对流体样本内的一些病毒或者细菌进行计数。一些病毒的直径为50纳米至300纳米数量级,而一些细菌的尺寸为3x0.6微米数量级。在一些示例中,对精子或者卵子进行计数,精子的尺寸为5微米数量级,而卵子的尺寸为130微米数量级。这些生物颗粒(例如,一些病毒)中的一些类型可以比其它生物颗粒(诸如,红血球)小1个数量级或者2个数量级。因此,在一些这种实例中,在通道202内采用附加结构以提供所需的感测体积,诸如,稍后至少结合图13至图15进一步描述的。
要进一步理解,由于如何将通道202的形状和大小(至少在传感器220所在区域中)定义为大体上与目标生物颗粒的大小和形状对应的重要性,所以,在一些示例中,提供了一种不同的微流体装置或者芯片来测试各个不同的目标生物颗粒。在一些示例中,单个微流体装置对不同的目标生物颗粒进行计数,但是这是通过设置不同的通道202而各个不同的通道专用于针对特定目标生物颗粒的测试而排除不同大小/类型的其它生物颗粒来实现的。在一些示例中,如稍后至少结合图16进一步描述的,单个微流体装置包括一串通道部,各个通道部的大小和形状设计为提供与目标生物颗粒对应的感测体积(在传感器220所在区域处),从而使得这串通道部按顺序提供对不同目标生物颗粒的单行(每次一个)计数。在一些示例中,如稍后至少结合图17进一步描述的,单个微流体装置包括平行的通道,其中,各个通道检测来自单个流体样本的不同类型/大小的目标生物颗粒,这些不同的通道中的至少一些利用的感测体积与其它相应通道限定的感测体积不同。
图13是示意性地图示了根据本公开的示例的微流体通道结构的感测部241的放大局部侧视图。在一些示例中,感测部241包括具有与之前至少结合图11至图12描述的感测部221大体上相同的至少一些特征和属性的感测部。
如图13所示,感测部241限定出通道202,该通道202具有感测区域243,在该感测区域243处,提供了在通道202中形成的(多个)凸起242以在非常靠近传感器220处限定出收缩部244。在沿着通道202的该点处,收缩部244限定出小于通道202的总体宽度(w1)的宽度(w2)。在一些示例中,当需要保持通道202的总体宽度(w1)但仍然需要提供结构(例如,收缩部244)来实现对体积(或者最大尺寸)明显小于通道202的截面积的目标生物颗粒的单行排列和计数时,采用该布置。
图14是沿图13的线14-14截取的截面图,其示意性地图示了可使用的狭槽248(具有宽度w2),流体和颗粒可以在收缩部244所在点处流经该狭槽248。
图15是示意性地图示了根据本公开的示例的在感测区域附近的通道中的收缩部244的放大局部侧视图。如图15所示,经由在通道202的相对侧壁上的两个凸起242来形成收缩部244。
在一些示例中,如图13、图15所示,收缩部244的位置设计为与传感器220的至少一部分共同延伸。换言之,收缩部占用了至少一些与传感器220的一部分占用的大体上相同的空间。在如图15所示的特定非限制性示例中,传感器220的电阻元件跨设在凸起266限定的收缩部244上。这样,在非常靠近传感器220处限定出感测体积270,从而使得,在感测目标生物颗粒272的时候(或者接近这个时候),目标生物颗粒272所在的感测体积270具有与目标生物颗粒272的体积的数量级相同的体积,从而确保单个目标生物颗粒272通过感测区域(例如,单行),以按照每次一个的方式对生物颗粒提供感测。在一些示例中,收缩部244的位置刚好在传感器220的电阳元件之前(例如,上游)并且直接相邻。
在一些示例中,如图15中进一步示出的,通道202刚好在收缩部244之前进一步限定出过滤器(280)(包括元件282)以进一步排除比收缩部244的大小和形状设计所针对的目标生物颗粒272更大的生物颗粒(未示出)。除了提供大小/形状限制以使目标生物颗粒272能够通过(同时排除其它更大的颗粒)之外,结合过滤器280的凸起242的存在产生了非均匀流体流动,使得将目标生物颗粒272排列成单行以便通过收缩部244并且通过传感器220。
图16是示意性地图示了根据本公开的示例的微流体通道结构的感测部300的侧视图。在一些示例中,感测部300形成具有与之前至少结合图1至图10描述的微流体装置20、80大体上相同的至少一些特征和属性的微流体装置的一部分,感测部300包括之前至少结合图11至图15描述的大体上相同的至少一些特征和属性。
至少参照图16,要理解,感测部300的元件不一定是按照比例绘制而成,但是,至少提供了相对大小和形状的示范。
如图16所示,感测部300包括一串感测区301a(第一区)、301b(第二区)、301c(第三区),这几个区通过虚线隔开。各个不同的区301a、301b、301c的提供是为了对不同大小的生物颗粒进行检测或者计数。例如,如图16所示,第一区301a对直径(或者最大尺寸)小于尺寸d3的生物颗粒进行计数,而第二区301b对直径(或者最大尺寸)小于尺寸d4(d4也小于尺寸d3)的生物颗粒进行计数。第三区301c对直径(或者最大尺寸)小于尺寸d5(d5也小于尺寸d4)的生物颗粒进行计数。在每个区中,通道部302a、302b、302c具有截面积,该截面积的大小和形状设计为针对该特定通道部302a、302b、302c使目标生物颗粒单行流动,以确保通过传感器进行的计数只涉及针对该特定区的目标生物颗粒。因此,通道部302a具有与通道部302b不同的截面积,并且通道部302b具有与通道部302d不同的截面积,以此类推。
在一些示例中,各个区301a、301b、301c包括进口308a、308b、308c(分别)和过滤器310a、310b、310c(分别)以建立非均匀流场,以便促进针对各个相应区的目标生物颗粒的单行流动。而且,为达到此目的,各个相应过滤器310a、310b、310c排除比针对该特定区的目标生物颗粒更大的生物颗粒。
各个区301a、301b、301c包括感测区域,该感测区域限定出相应的感测体积340a、340b、340c(在生物颗粒通过时),该感测体积的大小设计为与待在对应的相应区301a、301b、301c中感测的特定目标生物颗粒的数量级相同。区301a包括属性传感器322a,该属性传感器322a包括元件323a;而区301b包括属性传感器322b,该属性传感器322b包括元件323b,并且区301c包括属性传感器322c,该属性传感器322c包括元件323c。
虽然为了使图示清楚并未在图16中描绘不同的区,但是要理解,在一些示例中,不同的区301a、301b、301c并非彼此紧接着,在相邻或者连续的区301a、301b、301c之间也可以具有其它通道部或者部件(例如,泵、加热器、其它属性传感器、流速传感器等)。
而且,要理解,在一些示例中,如图16所示,可以将多个不同的感测部沿着单个通道连续设置,但是各个感测部的感测体积的大小与其它感测部大体上相同以便对一种大小的目标生物颗粒进行计数/感测。在一些示例中,这种布置方便验证测量准确度或者通过提供内部控制(例如,可靠性因子)。
图17是示意性地图示了根据本公开的示例的微流体通道结构的感测部400的示意图。在一些示例中,感测部400具有与感测部300大体上相同的至少一些特征和属性,不同之处在于,并非连续布置不同的区301a、301b、301c(各个区包括各自的特征和属性),相反,感测部400提供平行的相似的区401a、401b、401c,各个区具有对应的通道部402a、402b、402c。因此,并非连续对生物颗粒进行计数,相反,感测部400并行地对生物颗粒进行计数。在一些示例中,不同的区401a、401b、401c具有大小相同的感测体积以实现给定流体样本的校准或者促进给定流体样本的更快处理。
在一些示例中,所有这三个通道部402a、402b、402c与公共贮存器(诸如,贮存器214(图10))流体连通。然而,在一些示例中,各个通道部402a、402b、402c从单独的流体贮存器部而非从单个公共贮存器接收流体(包含待处理和计数的生物颗粒)。同样,在一些示例中,各个独立的贮存器可以包括不同的流体组成。在一些示例中,经由在贮存器214中形成的分离挡板来形成独立的贮存器。
除了其它特征和属性之外,本公开的至少一些示例利用高信噪比实现了细胞学的高吞吐量并且提高了准确度,该高信噪比可通过采用单行感测和低流体稀释因子来实现。因此,这种布置非常适合部署在即时诊断(poc)设置中以实现快速诊断和评价性信息。
虽然本文图示和描述了具体示例,但是在不脱离本公开的范围的情况下,可以利用多种替代和/或等效实施方式来替代所示出和描述的具体示例。本申请旨在涵盖本文讨论的具体示例的任何更改或者变型。
- 还没有人留言评论。精彩留言会获得点赞!