一种基于双链DNA保护的荧光探针及在制备检测恶性疟原虫乳酸脱氢酶药物中的应用的制作方法
本发明属于荧光探针技术领域,具体涉及一种基于双链DNA保护的银纳米簇荧光探针及其在制备检测恶性虐原虫乳酸脱氢酶药物中的应用。
背景技术:
疟疾是一种由于感染疟原虫而导致的疾病,严重威胁着人类的健康。据世界卫生组织(WHO)统计,在2015年全球约有2.14亿疟疾病例,共导致约43.8万人死亡,其中90%在非洲,7%在东南亚。
目前关于疟疾的检测主要包括两种方法,一种为显微镜直接观察法,即对疑似高烧患者的血液样品直接用显微镜观察,该方法是目前应用最广泛的检测疟疾的方法,但是该方法在良好的光学条件下也只有75~90%的准确率;另一种方法为基于抗原的快速诊断法,该方法具有较高的诊断准确率,但其灵敏度和准确率都依赖于企业生产抗原的质量,并且对感染程度无法检测。因此,建立一种对疟原虫有效而实用的原位、实时、快速检测方法,将为诊断和治疗疟疾提供直接有效的帮助,在人类对抗疟疾的研究上具有重大意义。
近年来,人们发现一种新的疟疾生物靶标分子——疟原虫乳酸脱氢酶(PLDH),它能够催化丙酮酸与乳酸之间的还原与氧化反应,是参与糖无氧酵解和糖异生的重要酶。主要有四种疟原虫会使人类感染疟疾,包括:恶性疟原虫(plasmodium falciparum)、间日疟原虫(plasmodium vivax)、三日疟原虫(Plasmodium malariae)和卵形疟原虫(Plasmodium ovale)。在全球范围内,90%以上的凶险型疟疾由恶性疟原虫所致,因此恶性疟原虫的乳酸脱氢酶(PfLDH)是一种极其重要的靶标分子,发展一种简单、快速、精确、特异、灵敏的PfLDH检测方法将对疟疾的诊断和治疗至关重要。
贵金属纳米簇在量子尺寸效应、体积效应、表面效应和宏观量子隧道效应方面有独特的光、电以及化学性能,因而成为纳米材料研究领域的热点之一。其较小的尺寸、无毒性以及光稳定性好等特点,使其作为一种新型的荧光探针在化学检测及生物标记等领域具有广泛的应用前景。尤其是使用DNA作为模板剂的银纳米簇(AgNCs)受到了越来越多的关注。主要是由于DNA的序列多种多样,空间构象更加灵活,具有发夹型、G四联体、i-motif等结构,甚至溶液的离子强度导致的DNA卷曲变化,都可以影响到合成AgNCs的光学性质。并且在生物体系中的应用也极为广泛,如:DNA检测、RNA检测、蛋白质检测、多巴胺、葡萄糖、生物活体成像等。目前还无法确切的预测某个 DNA序列保护AgNCs的荧光,这也是DNA合成AgNCs吸引了众多研究者的重要原因。
技术实现要素:
本发明的目的在于提供一种基于双链DNA保护的银纳米簇荧光探针及其在制备检测恶性虐原虫乳酸脱氢酶药物中的应用。
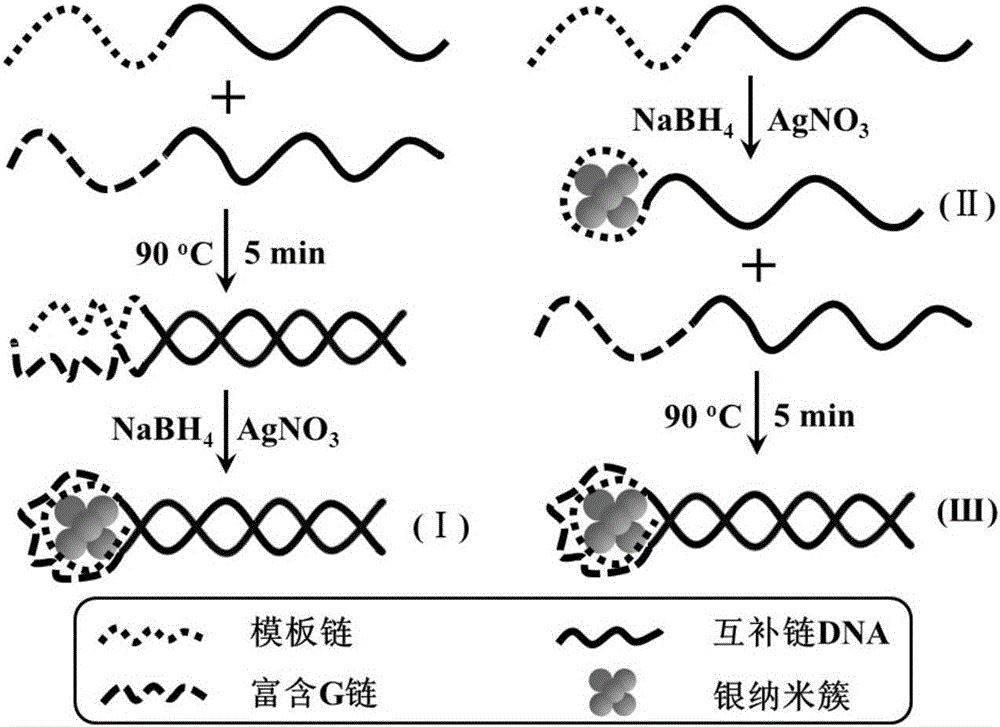
本发明中所述的一种基于双链DNA保护的银纳米簇荧光探针的结构如图1所示(本发明中所述的基于双链DNA保护的银纳米簇荧光探针,DNA为双链结构,一条链由互补链DNA和模板链DNA组成,另一条链由互补链DNA和富含G碱基DNA组成;由文献(Anal.Chem.2016,88,1294-1302)已报道工作可知,模板链DNA是银纳米簇合成过程中的保护基团,能够与银纳米簇表面配位,阻止银纳米簇的进一步增大;富含G碱基DNA通过靠近银纳米簇,增强银纳米簇的荧光发射强度;这两条链通过加热之后室温冷却使互补链部分形成双链结构)。图中灰色圆球代表银纳米簇,是该荧光探针的荧光发色团;黑色实线代表具有互补性的单链DNA(互补链DNA);黑色点线代表模板链DNA,是银纳米簇的表面配体(保护基团);黑色虚线条代表富含G(鸟嘌呤)链DNA,是银纳米簇荧光信号的放大器。
本发明所述的一种基于DNA保护的银纳米簇荧光探针中,银纳米簇一般由2~100个银原子组成,平均粒径为1.0~4.0nm,发光范围为450~700nm,是银离子在水溶液中被还原的产物;互补链DNA其长度一般为10~30个碱基,且富含(≥50%)A(腺嘌呤)和T(胸腺嘧啶)碱基,特别地,其核苷酸序列如SEQ ID NO.1所示;模板链DNA其长度一般为10~20个碱基,且富含(≥50%)C(胞嘧啶)碱基,特别地,其核苷酸序列如SEQ ID NO.2~4所示;富含G碱基DNA其长度一般为10~25个碱基,且富含(≥50%)G碱基,特别地,其核苷酸序列如SEQ ID NO.5所示。
在实际应用过程中,我们一般分别使用互补链DNA延长模板链DNA和富含G碱基DNA,即在向厂家订购时直接设计序列为含有互补链和模板链的DNA以及含有对应互补链和富含G碱基的DNA,如:含有互补链的模板链DNA,其核苷酸序列如SEQ IDNO.6所示,和含有富含G碱基的互补链DNA,其核苷酸序列如SEQ ID NO.7所示。然后通过加热室温冷却的方法使互补链部分形成双链DNA,再用来保护和稳定银纳米簇,具体过程如图1所示。
双链DNA保护的银纳米簇荧光探针的合成可参照之前文献报道,具体过程参照J.Am.Chem.Soc.2004,126,5207-5212所述合成方法,略有修改(详见实施例1)。首先利用蒸馏水配制1.0~10mmol/L的硝酸银母液、5.0~50mmol/L的硼氢化钠溶液和pH=6.50~7.50、10~50mmol/L的磷酸缓冲溶液;然后利用该磷酸缓冲溶液配制10~100 μmol/L的含有互补链的模板链DNA母液和含有富含G碱基的互补链DNA母液(固体样品直接溶解,含有互补链的模板链DNA和含有富含G碱基的互补链DNA均向生工生物工程(上海)股份有限公司购买)。双链DNA保护的银纳米簇的制备过程为:将10.0~500μL含有互补链的模板链DNA母液和含有富含G碱基的互补链DNA母液混合,在85~95℃水浴中加热反应3~10min,然后于室温下冷却1~2h即获得双链DNA溶液;再向其中依次加入硝酸银母液和硼氢化钠溶液充分混匀(1~10min),从而制备得到双链DNA保护的银纳米簇荧光探针;或者先将含有互补链的模板链DNA母液与硝酸银母液混合,再加入硼氢化钠溶液制备单链DNA保护的银纳米簇,然后加入富含G碱基的互补链DNA母液,从而制备得到双链DNA保护的银纳米簇荧光探针溶液。在制备过程中控制含有互补链的模板链DNA、含有富含G碱基的互补链DNA、硝酸银、硼氢化钠的用量摩尔比为1:1:x:x(3≤x≤10),最后将获得的双链DNA保护的银纳米簇荧光探针溶液在4℃条件下避光保存。
本发明主要基于上述DNA保护的银纳米簇荧光探针对溶液样品中的乳酸脱氢酶进行定量检测。在磷酸缓冲溶液中,上述双链DNA保护的银纳米簇荧光探针能够高选择性地与乳酸脱氢酶相互作用,并引起大幅度的线性荧光增强,而对其它蛋白质则几乎没有荧光响应,据此实现定量检测溶液中的乳酸脱氢酶;尤其是与恶性疟原虫乳酸脱氢酶作用,在相同条件下,其荧光增强幅度更大,响应更灵敏,检测限能够达到1.0×10-9mol/L(37pg/μL)。进一步通过向体系中引入恶性疟原虫乳酸脱氢酶的适配子(一段特定序列的DNA,能够与恶性疟原虫乳酸脱氢酶高选择性结合,详见Proc.Natl.Acad.Sci.USA,2013,110,15967–15972,其核苷酸序列如SEQ ID NO.8所示),它能够高选择性的猝灭双链DNA保护的银纳米簇和恶性疟原虫乳酸脱氢酶相互作用引起的荧光增强,而对其它乳酸脱氢酶与双链DNA保护的银纳米簇作用引起的荧光增强没有响应,从而实现对恶性疟原虫乳酸脱氢酶的高选择性识别响应。
本发明制备的DNA保护的银纳米簇荧光探针与其它的荧光探针相比具有结构相对简单、易于合成、稳定性强、响应灵敏度高等特点,能够对溶液中的恶性疟原虫乳酸脱氢酶产生大幅度的线性荧光增强响应。并且该方法检测速度快、操作简便,体系简单、信号稳定、灵敏度高、无需任何预处理,无需复杂的检测仪器,在医疗诊断和生物样品分析等领域具有非常重要的意义,尤其是在疟疾诊断和治疗效果的评估方面有着非常广阔的应用前景。
附图说明
图1:DNA保护的银纳米簇荧光探针制备过程示意图。
图2:双链DNA保护的银纳米簇(Ⅰ)荧光探针溶液(1.0×10-6mol/L)与不同浓度 恶性疟原虫乳酸脱氢酶(PfLDH)相互作用的荧光发射光谱图。
图3:双链DNA保护的银纳米簇(Ⅰ)荧光探针溶液(1.0×10-6mol/L)与不同浓度恶性疟原虫乳酸脱氢酶(PfLDH)相互作用的荧光发射强度与浓度的线性响应关系曲线图;横坐标为PfLDH浓度,纵坐标为其在535nm处荧光发射强度。
图4:低浓度的双链DNA保护的银纳米簇(Ⅰ)荧光探针溶液(0.10×10-6mol/L)与低浓度恶性疟原虫乳酸脱氢酶(PfLDH)相互作用的荧光发射强度与浓度的线性响应关系曲线图;其横坐标为PfLDH浓度,纵坐标为其在555nm处荧光发射强度。
图5:双链DNA保护的银纳米簇(Ⅰ)荧光探针溶液(1.0×10-6mol/L)与不同蛋白质(1.0×10-6mol/L)相互作用诱导的荧光增强倍数(535nm)柱型图;其中PfLDH为恶性疟原虫乳酸脱氢酶,PvLDH为间日疟原虫乳酸脱氢酶,HLDH为人源乳酸脱氢酶,BSA为牛血清白蛋白,Tryp为胰酶,Lys为溶菌酶,Rib为核糖核酸酶;荧光增强倍数为荧光发射强度增量与原始强度的比值(I-I0)/I0。
图6:双链DNA保护的银纳米簇(Ⅰ)荧光探针溶液(1.0×10-6mol/L)与不同待测蛋白质作用诱导的荧光增强倍数(535nm)与蛋白质浓度的关系曲线图;其中PfLDH为恶性疟原虫乳酸脱氢酶,PvLDH为间日疟原虫乳酸脱氢酶,HLDH为人源乳酸脱氢酶,BSA为牛血清白蛋白,荧光增强倍数为荧光发射强度增量与原始强度的比值(I-I0)/I0。
图7:双链DNA保护的银纳米簇(Ⅰ)荧光探针溶液(1.0×10-6mol/L)与不同乳酸脱氢酶(1.0×10-6mol/L)相互作用,以及恶性疟原虫乳酸脱氢酶适配子的引入诱导的荧光发射强度变化的时间依赖光谱图;其中PfLDH为恶性疟原虫乳酸脱氢酶,PvLDH为间日疟原虫乳酸脱氢酶,HLDH为人源乳酸脱氢酶。
图8:单链DNA保护的银纳米簇(Ⅱ)荧光探针溶液(1.0×10-6mol/L)和双链DNA保护的银纳米簇(Ⅲ)荧光探针溶液(1.0×10-6mol/L)与恶性疟原虫乳酸脱氢酶(PfLDH,1.0×10-6mol/L)相互作用前后的荧光发射光谱图。
具体实施方式
本发明中使用的所有DNA样品都是在生工生物工程(上海)股份有限公司订购;硝酸银、磷酸氢二钠、磷酸二氢钠、硼氢化钠等化学试剂都购自国药集团化学试剂有限公司;牛血清白蛋白(BSA),胰酶(Tryp),溶菌酶(Lys),核糖核酸酶(Rib)等都是购自美国Sigma公司。另外,恶性疟原虫乳酸脱氢酶(PfLDH),间日疟原虫乳酸脱氢酶(PvLDH),人源乳酸脱氢酶(HLDH)等都是参照文献(Proc.Natl.Acad.Sci.USA,2013,110,15967–15972)方法克隆、表达、纯化,并最终通过利用pH=7.40的20mmol/L的磷酸缓冲溶液透析获得。所得乳酸脱氢酶浓度通过仪器Nano Drop 2000c测 得,并利用所配磷酸缓冲溶液稀释获得50×10-6mol/L的母液。牛血清白蛋白(BSA),胰酶(Tryp),溶菌酶(Lys),核糖核酸酶(Rib)等都分别称量后,通过加入对应体积的所配磷酸缓冲溶液获得100×10-6mol/L的母液。
实施例1:
参照文献(Proc.Natl.Acad.Sci.USA,2013,110,15967–15972)方法,将含有pET28a-PfLDH质粒的E.coli BL21(DE3)37℃,220转/分钟振摇培养过夜。以1:100的比例接种,37℃,180转/分钟振摇培养后OD600=0.8~1.0后加入IPTG诱导LDH的表达,25℃,180转/分钟振摇诱导表达13h后,4℃4000rpm离心30min收集菌体。以20mM磷酸缓冲液(pH=7.4)重悬菌体,经超声破碎后离心收集上清。
对收集的上清使用Ni2+-NTA柱纯化本发明的乳酸脱氢酶:将上清液缓慢流过Ni2+-NTA柱,重复3次,然后用3倍柱体积缓冲液(20mM磷酸缓冲液)洗柱,重复3次,最后用3倍柱体积洗脱缓冲液(20m磷酸缓冲液中含50mM、100mM、200mM、300mM、400mM咪唑)梯度洗脱本发明的乳酸脱氢酶。经SDS-PAGE鉴定,所表达、纯化得到的恶性疟原虫乳酸脱氢酶(PfLDH),单体分子量约为37kDa。通过替换对应质粒(pET28a-PvLDH,pET28a-HLDH),分别表达纯化得到间日疟原虫乳酸脱氢酶(PvLDH),人源乳酸脱氢酶(HLDH)。
实施例2:
DNA保护的银纳米簇荧光探针的制备:以含有互补链的模板链DNA(其核苷酸序列如SEQ ID NO.6所示)和含有富含G碱基的互补链DNA(其核苷酸序列如SEQ IDNO.7所示)制备DNA保护的银纳米簇荧光探针为例,具体步骤如图1所示。
称取硝酸银(AgNO3)17.0mg,加入20mL蒸馏水配置5mmol/L硝酸银母液备用(避光保存);称取358mg磷酸氢二钠(Na2HPO4·12H2O)加入50mL水配置20mmol/L磷酸氢二钠溶液;再称取156mg磷酸二氢钠(Na2HPO4·12H2O)加入50mL水配置20mmol/L磷酸二氢钠溶液;分别取40.5mL磷酸氢二钠溶液和9.5mL磷酸二氢钠溶液混合,配置pH=7.40、20mmol/L的磷酸缓冲溶液备用;称取硼氢化钠(NaBH4)18.9mg,加入20mL蒸馏水配置25mmol/L的新制硼氢化钠溶液备用;取50OD(1.65mg)的含有互补链的模板链DNA,加入2.19mL蒸馏水配置100μmol/L含有互补链的模板链DNA母液备用(4℃保存);取50OD(1.65mg)的含有富含G碱基的互补链DNA,加入1.60mL蒸馏水配置100μmol/L含有富含G碱基的互补链DNA母液备用(4℃保存)。
第一种方法:分别取320μL含有互补链的模板链DNA母液和320μL含有富含G 碱基的互补链DNA母液混合充分,置于90℃水浴加热反应5min,室温下冷却1h即可获得双链DNA溶液;向该体系中加入2514μL磷酸缓冲溶液,38.4μL硝酸银母液充分混合均匀,再加入7.7μL新制硼氢化钠溶液,充分混合均匀,得淡黄色溶液,即双链DNA保护的银纳米簇(Ⅰ)溶液,浓度是10μmol/L,避光4℃保存。
第二种方法:取320μL含有互补链的模板链DNA母液与38.4μL硝酸银母液充分混合,加入2514μL磷酸缓冲溶液,充分混合均匀,再加入7.7μL新制硼氢化钠溶液,充分混合均匀,得淡黄色溶液,即DNA保护的银纳米簇(Ⅱ)溶液;再向上述体系中加入320μL含有富含G碱基的互补链DNA母液,置于90℃水浴中加热反应5min,室温下冷却1h即可获得双链DNA保护的银纳米簇(Ⅲ)溶液,浓度是10μmol/L,避光4℃保存。
其中,双链DNA保护的银纳米簇(Ⅰ)与(Ⅲ)结构相同,只是制备路径不同,从而使它们的荧光发射强度不同,对恶性疟原虫乳酸脱氢酶荧光响应的增强倍数也有差异(详见实施例8);单链DNA保护的银纳米簇(Ⅱ)同样对恶性疟原虫乳酸脱氢酶(PfLDH)具有荧光响应,但是荧光增强幅度较小(详见实施例8)。
实施例3:
建立以DNA保护的银纳米簇荧光探针检测溶液中恶性疟原虫乳酸脱氢酶的方法:将实施例2制备的双链DNA保护的银纳米簇(Ⅰ)荧光探针溶液用磷酸缓冲溶液再稀释至10倍体积,配制成浓度为1.0×10-6mol/L的溶液。分别取1mL该荧光探针溶液,向每1mL荧光探针溶液中分别加入恶性疟原虫乳酸脱氢酶的母液,使其终浓度分别为50~2000×10-9mol/L(50,100,150,200,250,300,350,400,450,500,600,700,800,900,1000,1200,1400,1600,1800,2000×10-9mol/L)(浓度通过仪器nano 2000测得),并利用荧光光谱仪记录荧光探针溶液对不同浓度的恶性疟原虫乳酸脱氢酶响应的荧光发射光谱(激发波长为470nm)。如图2所示,随着恶性疟原虫乳酸脱氢酶浓度的增加,其在555nm处的荧光发射峰强度逐渐增强并蓝移至535nm。同时,通过绘制该体系荧光发射强度(535nm)与恶性疟原虫乳酸脱氢酶(PfLDH)浓度的关系曲线图(如图3所示),进一步通过线性拟合即可获得双链DNA保护的银纳米簇(Ⅰ)荧光探针对恶性疟原虫乳酸脱氢酶的荧光检测线性关系(如图3所示),进而利用工作曲线即可实现对恶性疟原虫乳酸脱氢酶的定量检测。结果表明(如图3所示)其对恶性疟原虫乳酸脱氢酶的线性检测范围可达到0.05~1.6×10-6mol/L(当恶性疟原虫乳酸脱氢酶的浓度大于1.6×10-6mol/L后,体系的荧光发射强度基本保持不变),并具有极佳的线性依赖关系(如图3中R2=0.99951),因而本发明制备的双链DNA保护的银纳米簇(Ⅰ)荧光探针能够用来定量检测恶性疟原虫乳酸脱氢酶。
实施例4:
将实施例2制备的双链DNA保护的银纳米簇(Ⅰ)荧光探针溶液进一步利用磷酸缓冲溶液稀释至0.10×10-6mol/L,分别取1mL作为荧光探针溶液。向每1mL荧光探针溶液中分别加入恶性疟原虫乳酸脱氢酶的母液,使其终浓度分别为5、10、15、20、25、30、35、40、45×10-9mol/L,并利用荧光光谱仪记录该荧光探针溶液对不同浓度的恶性疟原虫乳酸脱氢酶响应的荧光发射光谱(激发波长为470nm)。并绘制该体系的荧光发射强度(555nm)与恶性疟原虫乳酸脱氢酶(PfLDH)浓度的关系曲线图,进一步通过线性拟合即可获得该双链DNA保护的银纳米簇(Ⅰ)对恶性疟原虫乳酸脱氢酶的荧光检测线性关系,如图4所示,发现其对恶性疟原虫乳酸脱氢酶浓度具有较好的线性依赖关系。进而计算出(信噪比(S/N)等于3:1时的浓度)该双链DNA保护的银纳米簇(Ⅰ)荧光探针对恶性疟原虫乳酸脱氢酶的检测限为1.0×10-9mol/L(37pg/μL),与疟疾患者体内的实际PfLDH浓度(3~15pg/μL)相接近,因此通过进一步优化检测体系以及对疟疾疑似患者的血液样本进行一定的前处理(浓缩),能够实现其对实际样品中PfLDH的定量检测以及疟疾疾病实际诊断的目的。因而本发明制备的双链DNA保护的银纳米簇(Ⅰ)荧光探针可以高灵敏度地检测恶性疟原虫乳酸脱氢酶。
实施例5:
将实施例2制备的双链DNA保护的银纳米簇(Ⅰ)荧光探针溶液稀释10倍,配制成浓度为1.0×10-6mol/L的溶液,分别取1mL作为荧光探针溶液。向每1mL荧光探针溶液中分别加入不同待测蛋白质的母液,使其终浓度为1.0×10-6mol/L,蛋白质包括:恶性疟原虫乳酸脱氢酶(PfLDH),间日疟原虫乳酸脱氢酶(PvLDH),人源乳酸脱氢酶(HLDH),牛血清白蛋白(BSA),胰酶(Tryp),溶菌酶(Lys),核糖核酸酶(Rib)等,并利用荧光光谱仪检测该荧光探针溶液对不同待测蛋白质响应的荧光发射光谱(激发波长为470nm)。同时计算该双链DNA保护的银纳米簇(Ⅰ)荧光探针溶液对不同待测蛋白质响应的荧光发射强度(535nm)增强倍数(荧光发射强度增量与原始强度的比值(I-I0)/I0)。如图5所示,发现其对恶性疟原虫乳酸脱氢酶(PfLDH)产生了约9倍的荧光增强响应,对间日疟原虫乳酸脱氢酶(PvLDH)产生了约4倍的荧光增强响应,对人源乳酸脱氢酶(HLDH)产生了约2.5倍的荧光增强响应;而对其它蛋白(牛血清白蛋白(BSA),胰酶(Tryp),溶菌酶(Lys),核糖核酸酶(Rib)等)则基本没有荧光增强响应。该结果表明该双链DNA保护的银纳米簇(Ⅰ)荧光探针对乳酸脱氢酶具有高选择性的荧光增强响应,但是该探针溶液不能区分不同种类的乳酸脱氢酶。
实施例6:
将实施例2制备的双链DNA保护的银纳米簇(Ⅰ)荧光探针溶液稀释10倍,配制成浓度为1.0×10-6mol/L的溶液,分别取1mL作为荧光探针溶液。向每1mL荧光探针溶液中分别加入各种待测蛋白质的母液,使其终浓度分别为50~2000×10-9mol/L(50,100,150,200,250,300,350,400,450,500,600,700,800,900,1000,1200,1400,1600,1800,2000×10-9mol/L),待测蛋白质包括:恶性疟原虫乳酸脱氢酶(PfLDH),间日疟原虫乳酸脱氢酶(PvLDH),人源乳酸脱氢酶(HLDH),牛血清白蛋白(BSA),利用荧光光谱仪检测该荧光探针溶液对不同待测蛋白质响应的荧光发射光谱(激发波长为470nm)。并绘制该体系的荧光发射强度(535nm)增强倍数(荧光发射强度增量与原始强度的比值(I-I0)/I0)与不同待测蛋白质响应的浓度关系曲线图,结果如图6所示,随着乳酸脱氢酶浓度的增加,其荧光发射增强幅度逐渐增大,并且不同种类的乳酸脱氢酶诱导的荧光发射强度增强倍数具有较大差异,同时牛血清白蛋白则没有该种荧光增强响应。该结果进一步证明双链DNA保护的银纳米簇(Ⅰ)荧光探针溶液对乳酸脱氢酶具有荧光线性增强响应,且对不同种类的乳酸脱氢酶响应差异较大。因而本发明制备的双链DNA保护的银纳米簇(Ⅰ)荧光探针可以用来定量检测不同种类的乳酸脱氢酶。实施例7:
将实施例2制备的双链DNA保护的银纳米簇(Ⅰ)荧光探针溶液稀释10倍,配制成浓度为1.0×10-6mol/L的溶液,分别取1mL作为荧光探针溶液。向每1mL荧光探针溶液中分别加入不同种类的乳酸脱氢酶的母液,使其终浓度为1.0×10-6mol/L,乳酸脱氢酶包括:恶性疟原虫乳酸脱氢酶(PfLDH),间日疟原虫乳酸脱氢酶(PvLDH),人源乳酸脱氢酶(HLDH),并利用荧光光谱仪记录该荧光探针溶液的荧光发射强度(激发波长为470nm,发射波长为535nm)的时间依赖光谱。如图7所示,各种乳酸脱氢酶与双链DNA保护的银纳米簇(Ⅰ)荧光探针的荧光响应非常快速,约2分钟即可响应完毕。同时通过向体系中引入恶性疟原虫乳酸脱氢酶适配子(一段特定序列的DNA,能够与恶性疟原虫乳酸脱氢酶高选择性结合,详见Proc.Natl.Acad.Sci.USA,2013,110,15967–15972,其核苷酸序列如SEQ ID NO.8所示),结果表明只有恶性疟原虫乳酸脱氢酶与双链DNA保护的银纳米簇(Ⅰ)相互作用诱导的荧光增强被大幅度猝灭,而其它体系则不受影响,这主要是因为该适配子可以专一性的与恶性疟原虫乳酸脱氢酶相互作用。因而,通过恶性疟原虫乳酸脱氢酶适配子的引入,本发明中的双链DNA保护的银纳米簇(Ⅰ)实现了对恶性疟原虫乳酸脱氢酶的高选择性识别检测。
实施例8:
将实施例2制备的DNA保护的银纳米簇(Ⅱ)和(Ⅲ)分别用磷酸缓冲溶液稀释,配制成浓度为1.0×10-6mol/L的溶液,分别取1mL作为荧光探针溶液。向每1mL荧光探针溶液中分别加入恶性疟原虫乳酸脱氢酶的母液,使其终浓度为1.0×10-6mol/L,并利用荧光光谱仪检测其对恶性疟原虫乳酸脱氢酶响应的荧光发射光谱(激发波长为470nm)。结果如图8所示,单链DNA保护的银纳米簇(Ⅱ)对恶性疟原虫乳酸脱氢酶(PfLDH)产生了约2倍荧光增强响应,双链DNA保护的银纳米簇(Ⅲ)对恶性疟原虫乳酸脱氢酶(PfLDH)产生了约5倍荧光增强响应,都小于相同条件下双链DNA保护的银纳米簇(Ⅰ)对恶性疟原虫乳酸脱氢酶(PfLDH)产生的约9倍荧光增强响应。结果表明我们利用不同制备路径获得的DNA保护的银纳米簇都能够对恶性疟原虫乳酸脱氢酶(PfLDH)产生荧光增强响应,该方法具有普适性。
还需要说明的是,本发明的具体实施例只是用来示例性说明,并不以任何方式限定本发明的保护范围,本领域的相关技术人员可以根据上述一些说明加以改进或变化,但所有这些改进和变化都应属于本发明权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!