一种免疫传感器对黄曲霉毒素的检测方法与流程
本发明属于医学领域,尤其涉及一种免疫传感器对黄曲霉毒素的检测方法。
背景技术:
电化学免疫传感器的概述
电化学免疫传感器是免疫分析方法中一种常用的分析方法,是通过抗体与抗原之间的特异性结合识别作用,应用电极作为传感的元件,形成具有免疫性复合物负载在电极表面,并对分析物进行定量检测与研究。免疫传感器具备很多优点,它具有检测快速方便、灵敏度高、价格低廉、选择性好、专一性强、适合联机化在线检测,并可实现实际样品的检测。迄今为止,免疫传感器在环境检查、临床医学和食品安全工业等等领域都有重要用途。
黄曲霉毒素的概述
黄曲霉毒素是一种具有较强的毒素,迄今为止,国际癌症研究机构已将黄曲霉毒素列为致癌物质系列。常见的黄曲霉毒素种类有AFB1、AFB2、AFG1、AFG2、AFM1和AFM2等十几种结构相似的化合物,其结构特征为都含有一个双呋喃环和一个氧杂萘邻酮。黄曲霉毒素极易溶解在机溶剂中,如甲醇和氯仿等,不易溶于水。黄曲霉毒素会损害人体的器官,抑制人体的免疫机能,而且黄曲霉毒素中AFB1毒性是最大的,是对人类健康危害造成非常严重的一类霉毒素。
黄曲霉毒素的检测方法
目前黄曲霉的检测方法有薄层层析法、微柱层析法、高效液相色谱法、免疫学方法、电化学免疫检测法。其中薄层层析法对样品处理存在所需时间多,抗干扰能力弱;微柱层析法测定样品是需要对样品组分进行分离;采用高效液相色谱法测定黄曲霉毒素时,根据实验所使用的化学试剂和处理途,对实验结果会造成影响,技术水平要求相对较高;而电化学免疫检测法操作简便,检测灵 敏度好、选择活性性好,更适合用于微量元素的检测。
石墨烯的概述
石墨烯(Graphene,G)是一种新型碳纳米材料,由单层碳原子排列堆积而成单层二维蜂窝状晶体,具有结构稳定,电阻率极低,使得石墨烯具备了优良的导电性。迄今为止,经研究发现石墨烯表面呈惰性,化学稳定性较高,并且石墨烯之间存在较强的范德华力,容易产生聚集,很难溶于水及其他溶剂中。为了充分发挥石墨烯优良的性质,必须要对石墨烯进行表面的改性。通过引入特定官能团,可赋予石墨烯新的性质,进一步拓展它的应用领域。
聚苯胺的概述
聚苯胺(PANI)是近年来一个常用的导电聚合物,根据苯胺单体PANI具有良好的导电性、以及良好的稳定性,能使石墨烯的片层间隙增大,可以阻止石墨烯片层之间的团聚,将其用于电化学免疫传感器领域,有利于构建的传感器的电化学性能的提高。
纳米金概述
金纳米材料具有较高比表面积、高表面反应活性、高催化效率和强吸附能力等许多独特的优点。纳米金还具有很好的生物相容性,将其用于修饰电极制备电化学免疫传感器不但可以提高电极的导电性,还可以有效的降低反应电位,所以有效的提高了电极的灵敏度和选择性。因为纳米金的生物相容性可以为生物分子提供生物适应性的微环境,保持了生物分子的活性,因此金纳米材料修饰的电极不影响蛋白酶的活性。
针对黄曲霉毒素具有较强的毒性,检测要求相对较高,寻找出检测黄曲霉毒素B1最简单,耗费较少的方法。
技术实现要素:
本发明的目的在于提供一种免疫传感器对黄曲霉毒素的检测方法,旨在解决背景技术中存在的问题。
本发明是这样实现的,一种免疫传感器对黄曲霉毒素的检测方法,该免疫传感器对黄曲霉毒素的检测方法包括:
将制备的Au/PANI/GN复合纳米材料修饰在金电极表面,采用交流阻抗法、循环伏安法检测电极的电化学性能;
黄曲霉免疫传感器构建,在金电极表面滴涂Au/PANI/GN纳米杂化物,晾干成膜后孵育anti-AFB1,然后用牛血清蛋白溶液封闭非特异性活性位点,接着孵育一系列不同浓度的AFB1用于和抗体特异性识别,采用方波循环伏安法,对anti-AFB1的浓度和孵育时间进行条件优化、对缓冲溶液的pH和AFB1免疫反应时间进行优化,筛选最佳优化条件;
采用交流阻抗法(EIS)和方波循环伏安法(SWV),对不同浓度的AFB1进行定量分析测定。
Au/PANI/GN制备方法包括:
PANI/GN复合物的制备:
取200μL苯胺溶于200mL CH2Cl2中,转移至600mL反应瓶中作为底部有机层;将6.0mg GN和200mg FeCl3·6H2O均匀分散在200mL HCl溶液中超声分散2h后加入26.5μL H2O2,将超声分散2h后加入26.5μL H2O2的混合溶液缓慢移入有机溶液的上层,建立界面体系;在冰浴条件下反应48h后,收集上层溶液,用二次水离心清洗,最后将产物溶解在二次水中,超声分散20min,即制得分散均匀的PANI/GN复合纳米材料;
不同配比的Au/PANI/GN复合纳米材料的制备:
取10mg PANI/GN加入烧杯中,超声分散均匀,分别加入10mg、40mgHAuCl4.2H2O和14.705mg柠檬酸三钠,加水至20mL,超声分散均匀,逐滴加入冰浴的0.6mL 0.1mol/L NaBH4搅拌12h后,二次蒸馏水离心清洗,分别得到反应原料中PANI/GN与氯金酸质量比为1:1和1:4的Au/PANI/GN纳米杂化物,备用。
黄曲霉毒素免疫传感器的构建方法为:
在金电极表面修饰7μL Au/PANI/GN复合你们材料溶液,室温晾干;用二次蒸馏水清洗,室温下晾干成膜,在电极表面滴涂10μL 150μg/mL anti-AFB1溶液,在37℃下孵育40min;用二次蒸馏水清洗,继续在电极表面滴涂10μL 2.0%牛血清蛋白BSA溶液封闭非特异性活性位点,于37℃下孵育40min,清洗干净;将一系列不同浓度的AFB1抗原用于和抗体的特异性识别,37℃孵育30min,二次蒸馏水清洗干净,于4℃冰箱中存储备用。
对Au/PANI/GN复合纳米材料的表征包括:采用紫外光谱对制备的材料进行表征、采用透射电镜对不同金纳米粒子负载率的Au/PANI/GN复合纳米材料进行形貌表征。
采用交流阻抗法、循环伏安法检测电极的电化学性能方法中,以Fe(CN)63-/4-作为氧化还原探针,采用电化学交流阻抗法和循环伏安法,分析不同材料修饰电极在含有0.1M KCl的10.0mM Fe(CN)63-/4-溶液中的循环伏安行为,扫描速率为100mV/s。
anti-AFB1浓度的优化方法为:
将7μL Au/PANI/GN修饰于金电极上,固载不同浓度的anti-AFB1 10μL 25μg.mL-1、50μg.mL-1、100μg.mL-1、150μg.mL-1、200μg.mL-1将构建的传感器进行孵育,采用方波伏安法检测的电流响应随浓度的变化筛选优化条件,anti-AFB1的最佳浓度为150μg mL-1;
磷酸盐缓冲溶液pH的优化方法为:
首先,固定anti-AFB1的浓度为150μg.mL-1,优化不同pH,根据蛋白质的活性与溶液的pH的有联系原理,底液的pH控制在5.0到8.0之间,测定不同pH溶液下电化学免疫传感器反应的响应电流值,溶液的最佳pH为7.0;
anti-AFB1孵育时间优化方法为:
固定anti-AFB1浓度为150μg mL-1,分别孵育20min、30min、40min、50min、60min,在pH 7.0PBS溶液中进行检测,通过电流响应值与孵育时间的关系,对anti-AFB1孵育时间进行优化anti-AFB1的最佳孵育时间为50min;
AFB1免疫时间的优化方法为:
固定anti-AFB1浓度为150μg mL-1,孵育时间为50min,溶液pH为7.0,AFB1的孵育时间分别为20min、30min、40min、50min、60min,采用上述同样的方法构建电化学免疫传感器,根据方波循环伏安峰电流达到最小值处于相对稳定的平台这一条件筛选最佳免疫反应时间,50min为最佳免疫时间。
黄曲霉毒素的检测方法为:
基于上述最佳条件构建电化学免疫传感器,在金电极表面修饰7μLAu/PANI/GN复合你们材料溶液,室温晾干;用二次蒸馏水清洗,室温下晾干成膜,在上述电极表面滴涂10μL 150μg/mL anti-AFB1溶液,在37℃下孵育40min;用二次蒸馏水清洗,继续在电极表面滴涂10μL 2.0%牛血清蛋白BSA溶液封闭非特异性活性位点,于37℃下孵育40min,清洗干净;将一系列不同浓度的AFB1用于和抗体的特异性识别,37℃孵育30min,二次蒸馏水清洗干净,于4℃冰箱中存储备用。采用交流阻抗法表征构建的免疫传感器,并且采用方波循环伏安法对不同浓度AFB1进行检测,以免疫反应电流响应值为纵坐标,AFB1浓度为横坐标,绘制标准曲线图,检测线性范围为0.05ng/mL-25ng/mL,检出限为0.017ng/mL,线性方程为y=-0.177x+4.28,线性相关系数为R2=0.9916。
本发明对基于Au/PANI/GN构建的不同类型的电化学传感器进行电化学测试,循环伏安和阻抗测试均表面Au/PANI/GN复合纳米材料修饰的电极具有较好的电化学导电性,有利于电化学性能的提高;
对构建电化学免疫传感器的anti-AFB1浓度、磷酸盐缓冲溶液pH、anti-AFB1孵育时间、AFB1免疫反应时间等条件进行优化;
在最佳条件下,构建免疫传感器对AFB1进行检测,检测的线性范围为0.05ng/mL-25ng/mL,检出限为0.017ng/mL;本发明制备的Au/PANI/GN复合纳米材料具有良好的电化学活性及良好的检测能力;
本发明制备的电化学免疫传感器具有很宽的线性范围和很低的检出限,成功实现了对AFB1的检测,可以将该传感器应用于其他粮食作物和食用油中。
附图说明
图1是本发明实施例提供的免疫传感器对AFB1的检测方法流程图;
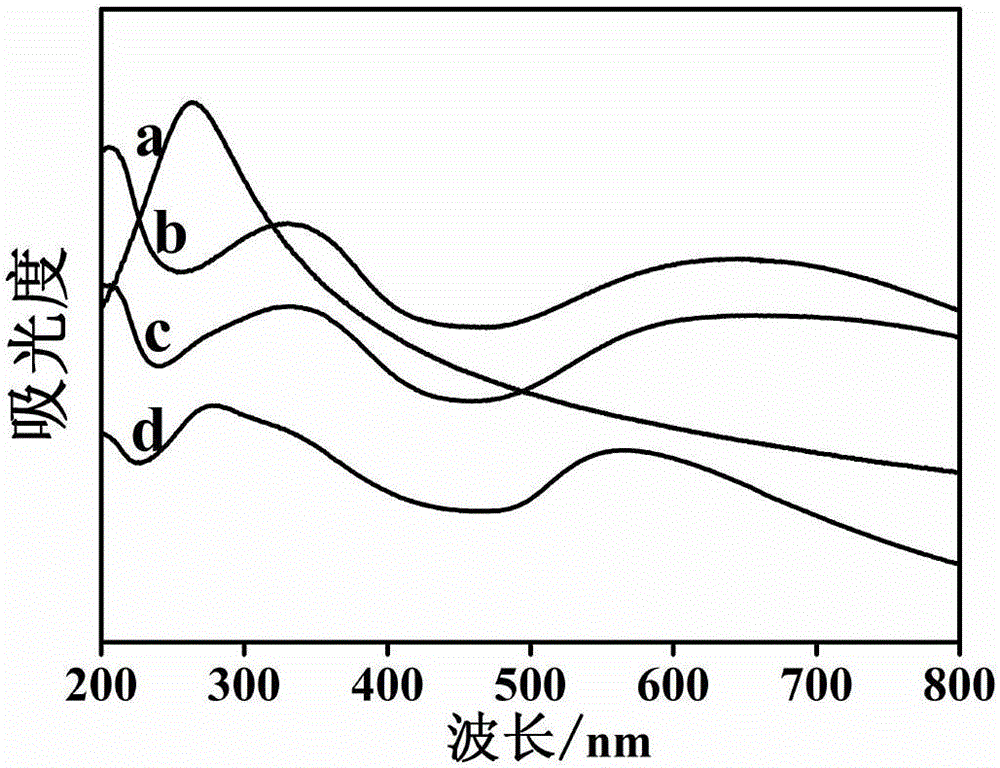
图2是本发明实施例提供的纳米材料的紫外光谱图;
图中:曲线(a)为GN,曲线(b)为PANI/GN,曲线(c)为Au/PANI/GN,曲线(d)为纯PANI的紫外光谱图;
图3是本发明实施例提供的不同金纳米粒子负载率的Au/PANI/GN复合纳米材料透射电镜图;
图4是本发明实施例提供的Au/PANI/GN修饰的金电极(a),anti-AFB1/Au/PANI/GN修饰的金电极(b),BSA/anti-AFB1/Au/PANI/GN修饰的金电极(c),AFB1/BSA/anti-AFB1/Au/PANI/GN修饰的金电极(d),在10.0mMFe(CN)63-/4-溶液中含有0.1M KCl的循环伏安曲线图(A)和电化学交流阻抗图(B);
图5是本发明实施例提供的AFB1/BSA/anti-AFB1/Au/PANI/GN构建的免疫传感器中抗体浓度优化图;
图6是本发明实施例提供的AFB1/BSA/anti-AFB1/Au/PANI/GN构建的免疫传感器中支持电解液的pH与响应电流之间的关系图;
图7是本发明实施例提供的AFB1/BSA/anti-AFB1/Au/PANI/GN构建的免疫传感器中anti-AFB1的固定时间与响应电流之间的关系图;
图8是本发明实施例提供的AFB1/BSA/anti-AFB1/Au/PANI/GN构建的免疫传感器中的抗原与抗体免疫反应时间与响应电流之间的关系图;
图9是本发明实施例提供的一系列不同浓度的AFB1构建的AFB1/BSA/anti-AFB1/Au/PANI/GN免疫传感器在10.0mM Fe(CN)63-/4-溶液中测电化学交流阻抗值响应,频率范围:1Hz~105kHz,电压范围:-0.4—0.8V;
图10是本发明实施例提供的(A)为AFB1/BSA/anti-AFB1/Au/PANI/GN构建的免疫传感器,在pH=7.0PBS溶液中检测不同浓度黄曲霉毒素的方波伏安响应 图,(B)是目标物AFB1的电流响应与AFB1浓度建立的标准曲线;
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下面结合附图及具体实施例对本发明的应用原理作进一步描述。
一种免疫传感器对黄曲霉毒素的检测方法,该免疫传感器对黄曲霉毒素的检测方法包括:
S101:将制备的Au/PANI/GN修饰在金电极表面,采用交流阻抗法、循环伏安法表征电极的电化学性能;
S102:黄曲霉免疫传感器的构建,在金电极表面滴涂Au/PANI/GN复合纳米材料,再孵育anti-AFB1,用牛血清蛋白溶液封闭非特异性活性位点,接着孵育一系列不同浓度的AFB1抗原用于和抗体特异性识别,采用方波循环伏安法,对anti-AFB1浓度和孵育时间进行优化、对缓冲溶液的pH和AFB1抗原免疫反应时间进行优化,筛选最佳优化条件;
S103:采用交流阻抗法(EIS)和方波循环伏安法(SWV),对不同浓度的AFB1进行定量分析测定。
本发明还包括不同配比的Au/PANI/GN复合纳米材料的制备方法:
取10mg PANI/GN加入烧杯中,超声分散,分别加入10mg、40mgHAuCl4·2H2O和14.705mg柠檬酸三钠,加水至20mL,超声分散均匀,逐滴加入冰浴的0.6mL 0.1mol/L NaBH4搅拌12h后,二次蒸馏水离心清洗,即可得到不同金纳米粒子负载率的的Au/PANI/GN复合纳米材料,备用。
本发明的Au/PANI/GN复合纳米材料的表征:
1、紫外光谱表征
采用紫外光谱对制备的材料进行表征,如2所示。从图中可以看出,还原石墨烯在264nm处有最大吸收峰,纯的PANI在338nm、430nm和642nm处 出现了三个吸收峰,PANI/GN在273nm处出现一个新的吸收峰,这个峰较还原石墨烯的紫外吸收红移了9nm,这是由于PANI/GN之间的相互作用力所致。Au/PANI/GN复合纳米材料在460nm处出现了一个新的吸收峰,这个峰是金纳米的紫外吸收峰,且在700nm处出现了一个很宽的拖尾峰,在430nm处的吸收峰较PANI/GN的有所增强,表明所制备的复合纳米材料是高度掺杂的,且PANI/GN与金纳米离子间存在很强的相互作用。紫外表明,实验成功的制备了Au/PANI/GN复合纳米材料,使PANI/GN的导电性增大。
2、透射电子显微镜表征
实验过程中,通过简单的改变反应原料中PANI/GN与HAuCl4·2H2O的质量比可以实现金纳米粒子在PANI/GN复合纳米材料表面的可控负载。采用透射电镜(TEM)对不同金纳米粒子负载率的Au/PANI/GN复合纳米材料进行形貌表征。图3A-C为反应原料中PANI/GN与HAuCl4·2H2O的质量比为1:4制备的Au/PANI/GN复合纳米材料的透射电镜表征,从图中可以看出粒径大小均匀的金纳米粒子均匀的分散在PANI/GN表面,并且金纳米粒子全部原位生长在PANI/GN表面,这可能是由于PANI作为一个良好的保护剂和连接剂有利于金纳米粒子的均匀负载。从放大倍数更大的可以清晰的看出石墨烯的晶格条纹。从高分辨率的透射电镜表征可以看出金纳米粒子的粒径大小为7.2nm。
在反应原料中PANI/GN与HAuCl4·2H2O的质量比为1:1制备的Au/PANI/GN复合纳米材料的透射电镜图如图3D-F所示,从图3D可以看出粒径大小均匀的金纳米粒子均匀的分散在PANI/GN表面,并且金纳米粒子全部原位生长在PANI/GN表面。与图3A相比,金纳米粒子的负载率明显减小,从放大倍数更大的可以清晰的看出石墨烯的晶格条纹。从高分辨率的透射电镜表征(图3F)可以看出金纳米粒子的粒径大小为6.03nm。实验结果表明,采用本文的方法成功的实现了金纳米粒子在PANI/GN面的均匀可控负载。
3、电极的电化学行为
以Fe(CN)63-/4-作为氧化还原探针,采用电化学交流阻抗法和循环伏安法,考 察不同材料修饰电极在含有0.1M KCl的10.0mM Fe(CN)63-/4-溶液中的循环伏安行为,扫描速率为100mV/s。从图4所示,当裸金电极表面被Au/PANI/GN复合纳米材料修饰后,有一对可逆的氧化还原峰,还原峰和氧化峰值电流明显增大,电位差ΔEp为98mV(如图4曲线a),并且从阻抗分析可以看出Au/PANI/GN复合纳米材料修饰的电极的电阻为252.4Ω。结果说明修饰Au/PANI/GN能够提高溶液中Fe(CN)63-/4-在电极表面发生电子的转移,而且,提供了更大的比表面积,孵育anti-AFB1后,因anti-AFB1对Fe(CN)63-/4-的氧化还原无任何催化作用,由于对电极的修饰导致电子的转移受到一定在阻碍,使得anti-AFB1/Au/PANI/GN抗体的峰电流降低,其电位差ΔEp为126mV,(如图4曲线b),并且从阻抗分析可以看出anti-AFB1/Au/PANI/GN复合纳米材料修饰的电极的电阻为282.1Ω,阻抗值增大,表明anti-AFB1成功的固定在了免疫传感器上。当继续修饰牛血清蛋白(BSA)到上述电极后,峰电流值进一步降低,其电位差ΔEp为133mV,(如图4曲线c),并且从阻抗分析可以看出BSA/anti-AFB1/Au/PANI/GN复合纳米材料修饰的电极的电阻为436.9Ω,阻抗值增大,表明BSA成功的固定在了免疫传感器上。继续把AFB1固定在电极上后,峰电流进一步降低,其电位差ΔEp为145mV(如图4曲线d),并且从阻抗分析可以看出AFB1/BSA/anti-AFB1/Au/PANI/GN复合纳米材料修饰的电极的电阻为443.2Ω,阻抗值增大,表明AFB1成功的固定在了免疫传感器上。
4、检测AFB1
在电化学免疫中,电化学信号主要依赖于修饰膜的制备过程,众所周知,蛋白质的活性与抗体浓度、孵育时间,抗原免疫时间与溶液pH密切相关。
anti-AFB1浓度的优化:
为得到更好的测验结果,分析最佳anti-AFB1浓度,如图2所示,将7μLAu/PANI/GN修饰于金电极上,固载不同浓度的anti-AFB1 10μL 25μg.mL-1、50μg.mL-1、100μg.mL-1、150μg.mL-1、200μg.mL-1将构建的传感器进行孵育,采用SWV检测的电流响应随浓度的增加而逐渐减小,并在150μg mL-1最小值随 后处于相对平稳,选择150μg mL-1为anti-AFB1的最佳浓度。
溶液pH的优化:
为了优化免疫反应的条件,首先,固定anti-AFB1的浓度为150μg.mL-1,优化不同pH条件,蛋白质的活性与溶液的pH有着非常重要的联系,优化抗体溶液的pH浓度尤为重要,如图6所示,介质的pH溶液控制在5.0到8.0之间,测定不同酸溶液浓度下电化学免疫传感器反应的响应电流值。结果显示,当介质pH<7时,免疫传感器的响应电流值随着pH浓度的增大而逐渐减小;当pH>7时,免疫传感器的响应电流值随着pH浓度的增大而逐渐增大并趋于稳定状态,电化学免疫传感器的最大响应在pH=7.0处,因此,选择7.0作为本实验的最佳pH。
anti-AFB1孵育时间优化:
孵育时间也是影响AFB1检测有着重要影响的因素,因此考察孵育时间对免疫反应的影响,如图7所示,固定anti-AFB1浓度为150μg mL-1,孵育时间从20min、30min、40min、50min、60min,在pH 7.0PBS溶液中检测,电流响应值随着anti-AFB1固定时间的增加呈降低趋势,并在50min时达到最小值后处于相对稳定的平台,50min被选择为最佳固定时间。
AFB1免疫时间的优化:
为研究最佳AFB1孵育时间,采用同样的方法在上述最佳条件下构建免疫传感器,如图8所示,在pH 7.0PBS溶液中,AFB1免疫时间分别为20min、30min、40min、50min、60min,随着AFB1免疫反应时间的增加峰电流呈下降趋势,并在50min达到最小值后处于相对稳定的平台,50min被选择为最佳免疫时间。
AFB1的检测:
基于上述优化条件构建电化学免疫传感器分别对不同浓度的AFB1(0.025ng/mL、0.05ng/mL、5ng/mL、10ng/mL、15ng/mL、20ng/mL、25ng/mL)进 行检测。首先采用阻抗法对不同浓度的AFB1进行检测,如图9所示随着AFB1浓度的增加,其阻抗值依次增加。接着采用方波伏安法对基于Au/PANI/GN构建的免疫传感器对不同浓度AFB1进行检测,从图10A中看出,随着AFB1浓度增大,峰电流依次减小,以免疫反应电流响应值为纵坐标,AFB1浓度为横坐标,绘制标准曲线图(图10B),可以看出检测线性范围为0.05ng/mL-25ng/mL,检出限为0.017ng/mL。线性方程为y=-0.177x+4.28,线性相关系数为R2=0.9916。实验结果表明,构建的传感器能够成功的对黄曲霉毒素进行检测,并且检测的线性范围较宽,检出限较低。说明Au/PANI/GN复合纳米材料具有良好的电化学活性及良好的检测能力,可以将其拓展到食品科学领域。
本发明采用Au/PANI/GN复合纳米材料构建电化学免疫传感器对AFB1进行检测,对实验过程中的anti-AFB1浓度、溶液pH、anti-AFB1孵育时间、AFB1免疫反应时间等条件进行优化,实验结果表明构建的免疫传感器具有很宽的线性范围和很低的检出限,成功实现了对AFB1的检测,有望将该传感器应用于其他粮食作物和食用油中。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!