一种检测黄曲霉毒素的近红外荧光免疫层析试剂盒及其应用的制作方法
本发明涉及生物技术领域,尤其涉及一种检测黄曲霉毒素的近红外荧光免疫层析试剂盒及其应用。
背景技术:
霉菌毒素是一类由产毒真菌在适宜的环境条件下产生的有毒代谢产物,广泛存在于农作物中。由于其具有致癌性、肾毒性、神经毒性、免疫抑制和类雌激素作用等潜在的毒性作用,因此可对人类和畜禽健康产生严重的危害。目前霉菌毒素在农作物中的污染已成为一个全球性的问题。据联合国粮农组织报告,全球每年约有25%的农作物遭受霉菌毒素的污染,部分农作物因污染严重而失去营养和经济价值,造成的直接和间接经济损失可达数百亿美元。粮食作物中主要的霉菌毒素有黄曲霉毒素、赭曲霉毒素、玉米赤霉烯酮、伏马毒素、T-2毒素和呕吐毒素等,其中危害最为严重的为黄曲霉毒素。建立快速、高灵敏、准确的测定方法,监控粮谷中黄曲霉毒素的污染水平对保障消费者和畜禽健康具有重要意义。
目前国内外用于霉菌毒素检测的分析方法主要分为两大类:仪器分析方法和免疫分析方法。仪器方法主要包括液相色谱法、气相色谱法、毛细管电泳法、液相色谱-质谱法和气相色谱-质谱法等,这些方法具有较高的准确度和精确度,常用于霉菌毒素的定量和确证分析,但是通常需要在实验室环境运行,并且需要昂贵的仪器和配备专业的技术人员,同时在进行仪器分析之前,需要对样品进行繁琐的前处理。因此,仪器分析方法不适合于基层实验室和现场环境霉菌毒素的快速检测。常用的免疫分析方法主要包括酶联免疫吸附测定法、免疫层析法、荧光光度法和荧光偏振免疫测定法等。因其操作简便、快速、检测成本低和不需要昂贵仪器等特点,已广泛用于霉菌毒素的筛查。
在这些免疫分析方法中,免疫层析试纸条法是其中检测速度最快、最简便和分析成本最低的分析手段。大部分的免疫层析方法采用胶体金作为标记物实现定量和定性检测靶分析物。但是,胶体金免疫分析法存在一些弊端。如分析灵敏度有待提高,同时样品基质的颜色可能影响结果判断。作为胶体金标记物的替代物,荧光标记物如量子点、荧光微球和荧光硅纳米颗粒等广泛应用于免疫层析方法,表现出较高的灵敏度。但是,这些荧光标记物的激发和发射波长均在紫外-可见光范围。由于组成试纸条的膜材料、生物基质组分等的光散射和自发荧光等问题,这些荧光免疫层析法常产生非常高的背景荧光信号,从而在一定程度上抵消了这种方法的高灵敏度。与这些紫外-可见光区域的荧光标记物相比,激发和发射波长在近红外区的荧光标记物可克服这些问题。在近红外波长区域,膜材料和生物基质组分的光散射和自发荧光可大大降低,因而近红外荧光检测可显著提高信噪比和灵敏度。近年来,近红外荧光免疫分析已开始用于大分子蛋白如人类表皮生长因子、甲胎蛋白、蛋白G、白介素和C-反应蛋白等的检测。目前没有近红外荧光免疫层析试纸条用于小分子化合物的检测分析的报道。
技术实现要素:
本发明的一个目的是提供一种检测黄曲霉毒素的近红外荧光免疫层析试剂盒。
本发明提供的试剂盒,为如下1)或2):
1)所示的试剂盒包括检测黄曲霉毒素的免疫层析试纸条和单独包装的近红外荧光标记抗黄曲霉毒素抗体;
2)所示的试剂盒包括检测黄曲霉毒素的免疫层析试纸条和装有所述近红外荧光标记抗黄曲霉毒素抗体的容器;
所述检测黄曲霉毒素免疫层析试纸条依次包括设于底板上的样品垫、包被检测线和质控线的反应膜和吸水垫;
所述检测线由黄曲霉毒素全抗原形成;所述黄曲霉毒素全抗原由载体蛋白偶联黄曲霉毒素半抗原形成。
上述试剂盒中,所述近红外荧光标记抗黄曲霉毒素抗体由近红外荧光标记基团标记抗黄曲霉毒素抗体得到;
或所述近红外荧光标记基团为800CW dye。
或所述装有近红外荧光标记抗黄曲霉毒素抗体的容器为装有所述近红外荧光标记抗黄曲霉毒素抗体的酶标板。
上述试剂盒中,所述黄曲霉毒素全抗原中的载体蛋白为BSA;
或所述黄曲霉毒素和所述BSA的偶联比为4:1。
或所述黄曲霉毒素全抗原的结构式如式2所示:
上述试剂盒中,所述质控线由羊抗鼠二抗形成;
或所述黄曲霉毒素为黄曲霉毒素B1。
上述试剂盒中,所述装有近红外荧光标记抗黄曲霉毒素抗体的容器中的所述近红外荧光标记抗黄曲霉毒素抗体以溶液的形式加入,且浓度为0.2μg/mL;
或所述装有近红外荧光标记抗黄曲霉毒素抗体的容器中的所述近红外荧光标记抗黄曲霉毒素抗体的体积为每孔40μL;
或所述黄曲霉毒素全抗原以溶液的形式加入,且浓度为0.8mg/mL;
或所述羊抗鼠二抗以溶液的形式加入,且浓度为0.6mg/mL。
上述的试剂盒中的试纸条也是本发明保护的范围。
上述的试剂盒或上述的试纸条在检测黄曲霉毒素含量中的应用也是本发明保护的范围;
或上述的试剂盒或上述的试纸条在检测待测样品中是否含有黄曲霉毒素中的应用也是本发明保护的范围;
或上述的试剂盒或上述的试纸条在检测待测样品中黄曲霉毒素含量中的应用也是本发明保护的范围。
本发明的另一个目的是提供一种检测待测样品中是否含有黄曲霉毒素的方法。
本发明提供的方法,包括如下步骤:
1)将待测样品加入含有上述近红外荧光标记抗黄曲霉毒素抗体的容器中,混匀,得到待检测样品;
2)用上述试剂盒中的试纸条检测待检测样品,若试纸条的检测线和质控线均显色,则待测样品中不含有或候选不含有黄曲霉毒素;若试纸条的检测线不显色,且质控线显色,则待测样品有或候选含有黄曲霉毒素。
本发明第3个目的是提供一种检测待测样品中黄曲霉毒素含量的方法。
本发明提供的方法,包括如下步骤:
1)将含有不同浓度黄曲霉毒素标准品的样品基质分别加入上述近红外荧光标记抗黄曲霉毒素抗体的容器不同孔中,混匀,得到装有不同浓度标准品的容器;
所述含有不同浓度黄曲霉毒素标准品的样品基质为向以不含有黄曲霉毒素的空白样本中添加不同浓度的黄曲霉毒素标准品得到的;
所述空白样本与所述待测样品均来源于同一类农作物;
2)用上述试剂盒中的试纸条分别检测各孔中各个浓度标准品的检测线和质控线的荧光强度,计算各个浓度标准品检测线的相对荧光强度值;
所述相对荧光强度值为检测线荧光强度与质控线荧光强度的比值;
以标准品各个浓度对数值为横坐标,以标准品各个浓度的相对荧光强度值为纵坐标,绘制标准曲线;
3)将待测样品替换步骤1)-步骤2)中的不同浓度黄曲霉毒素标准品,计算待测样品检测线的相对荧光强度值;将所述待测样品检测线的相对荧光强度值代入步骤2)得到的所述标准曲线中,得到待测样品中黄曲霉毒素含量。
上述空白样品和上述待测样品均采用甲醇-水溶液从农作物中提取获得,提取方法见实施例。
所述中,所述黄曲霉毒素为黄曲霉毒素B1。
本发明的实验证明,本发明发现了一种检测黄曲霉毒素的近红外荧光免疫层析试纸条,可用于样品中黄曲霉毒素的定量和定性检测,具有操作简单、快速、灵敏度高等特点。
附图说明
图1为近红外荧光试纸条检测示意图(A)和结果判定图(B)。
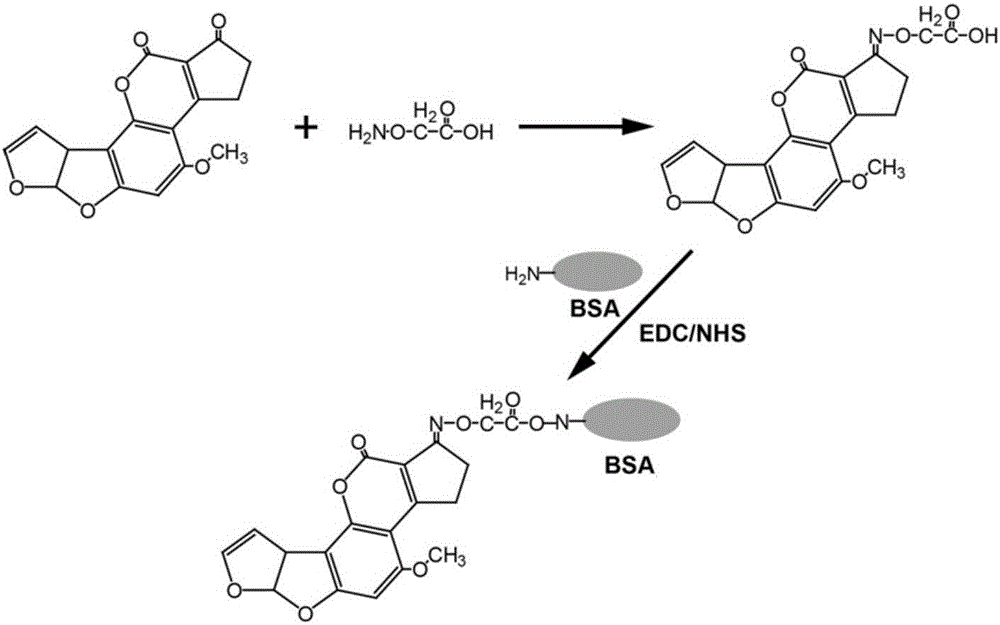
图2为黄曲霉毒素全抗原合成示意图。
图3为典型的黄曲霉毒素标准曲线。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、检测黄曲霉毒素的近红外荧光免疫层析试剂盒
一、装有近红外荧光标记抗体的微孔板的制备
1、近红外荧光标记物-抗体复合物(近红外荧光标记抗体)的制备
磷酸盐缓冲溶液(PBS)配制:取8g NaCl、0.2g KCl、1.44g Na2HPO4、0.24g KH2PO4,溶于蒸馏水定容至1L。
含1%(w/v)BSA,3%(w/v)sucrose和0.5%(v/v)Triton-100的PBS溶液:取1g BSA、3g sucrose和0.5mL Triton-100溶于100mL PBS溶液。
取1mg 800CW dye(货号:929-7002,美国Licor公司)溶于0.5mL二甲基亚砜,使800CW dye的浓度为2mg/mL,得到800CW dye溶液。
将抗黄曲霉毒素抗体(北京中检维康生物科技有限公司提供)用0.01M PBS(pH7.4)稀释至1mg/mL,得到抗黄曲霉毒素抗体溶液。
取0.5mL抗黄曲霉毒素抗体溶液与50μL 800CW dye溶液混合,其中,抗黄曲霉毒素抗体和800CW dye的质量比为5:1;避光孵育2小时,得到800CW-抗体复合物。
用HitrapTM脱盐柱(GE healthcare Bio-Sciences Corp,NJ,USA)将多余的未结合的染料除去,得到纯化的800CW-抗体复合物。
将纯化的800CW-抗体复合物用含1%BSA,3%sucrose和0.5%Triton-100的PBS溶液稀释至0.2μg/mL,得到800CW-抗体复合物溶液,即为近红外荧光标记抗体。
2、装有近红外荧光标记抗体的微孔板的制备
将上述1制备0.2μg/mL的800CW-抗体复合物溶液按照40μL/孔体积加入酶标板(美国Costar公司,货号:2592)的每个孔中,得到装有近红外荧光标记抗体的微孔板。最后整个装有近红外荧光标记抗体的微孔板冻干保存备用。
二、检测黄曲霉毒素试纸条的制备
1、包被抗原的制备
制备流程图如图2所示。
1)半抗原黄曲霉毒素B1-O-CMO的合成
取4mg的黄曲霉毒素B1(德国FERMENTEK公司,货号:AF022)和8mg的羧甲基羟胺半盐酸盐(CMO,美国sigma公司,货号:C13408)溶于4mL的吡啶:甲醇:水(体积比1:4:1)溶液中,回流反应4h。旋转蒸发将溶剂蒸干,加入2mL水,调pH至4左右,得到溶液A;用6mL乙酸乙酯萃取溶液A 2次,合并有机相,旋转蒸干得到黄色油状物质即为半抗原Aflatoxin B1-O-CMO(式1)。
2)全抗原的合成
将半抗原Aflatoxin B1-oxime溶于2mL乙醇水溶液,得到浓度为2mg/mL的半抗原Aflatoxin B1-oxime溶液。
称取5mg牛血清白蛋白(BSA)溶于2mL 0.1M的MES缓冲液(pH5.5,配制:取19.5g MES,溶于800mL水,调pH至5.5,定容至1L)中,得到浓度为2.5mg/mL的BSA溶液。
将1mL浓度为2mg/mL的半抗原Aflatoxin B1-oxime溶液和1mL浓度为2.5mg/mL的BSA溶液等体积混匀,搅拌条件下加入50mg的碳二亚胺(EDC),室温避光搅拌反应8h,得到偶联载体蛋白的全抗原(式2,载体蛋白和半抗原的偶联比为1:4)。
将偶联载体蛋白的全抗原用PBS中透析24h后冷冻保存备用,得到Aflatoxin B1-BSA溶液(浓度为0.8mg/mL,溶剂为PBS,配制:取8g NaCl、0.2g KCl、1.44g Na2HPO4、0.24g KH2PO4,溶于蒸馏水定容至1L)。
2、包被抗原和二抗的固定
取0.8mg/mL的Aflatoxin B1-BSA溶液和0.6mg/mL羊抗鼠二抗(美国SIGMA公司,货号:M4155)分别喷涂于硝酸纤维素膜(美国MILLIPORE公司,货号:HF180)上,作为检测线和质控线,喷涂体积为1μL/cm,得到包被抗原的硝酸纤维素膜,最后,将包被抗原的硝酸纤维素膜置于37℃干燥1h,干燥环境下冷藏备用。
3、黄曲霉毒素试纸条的组装
如图1A所示,近红外荧光试纸条依次包括位于衬板上的4个组件:样品垫、包被抗原的硝酸纤维素膜和吸收垫。
近红外荧光试纸条制备方法如下:
首先将上述2制备的喷涂有包被抗原和二抗的硝酸纤维素膜粘贴于衬板中央;随后将样品垫(上海杰一生物技术公司,货号:GF2-II)粘贴于衬板的一端,覆盖于硝酸纤维素膜上约2cm;再将吸收垫(上海杰一生物技术公司,货号:CH37)粘贴于衬板的另一端,同样与硝酸纤维素膜重叠约2cm;最后将衬板切成4cm宽的试纸条,冷藏干燥保存备用,得到检测黄曲霉毒素的试纸条。
三、检测黄曲霉毒素的近红外荧光免疫层析试剂盒的制备
检测黄曲霉毒素的近红外荧光免疫层析试剂盒包括上述二制备的试纸条和上述一制备的近红外荧光标记抗体;
或检测黄曲霉毒素的近红外荧光免疫层析试剂盒包括上述二制备的试纸条和上述一制备的装有近红外荧光标记抗体的微孔板。
四、检测黄曲霉毒素的近红外荧光免疫层析试剂盒的检测原理和判断标准
检测原理:如图1A和1B所示,将样品溶液加入装有近红外荧光标记抗体的微孔板中,再将试纸条的样品垫端插入微孔板的样品溶液中,当样品溶液中不含有黄曲霉毒素时,样品孔中的近红外标记-抗体复合物将与硝酸纤维素膜上的包被原结合,在近红外荧光检测仪中呈现一条绿色的检测线;当样品溶液中含有黄曲霉毒素时,黄曲霉毒素会与样品孔中的近红外标记-抗体复合物结合,导致未饱和的近红外标记-抗体复合物数量降低,从而当近红外标记-抗体复合物到达检测线位置时,更少的近红外标记-抗体复合物与包被原结合,因此检测线绿色变浅;当样品溶液中含有足够多的黄曲霉毒素时,黄曲霉毒素会饱和样品孔的近红外标记-抗体复合物,从而使近红外标记-抗体复合物不能与检测线上的包被原结合,检测线没有绿色;无论样品中是否含有黄曲霉毒素,正常情况下质控线上的二抗都会与近红外标记-抗体复合物结合,形成绿色质控线。质控线不显色时,表明测定结果不合格。
图1B所示定性分析:当检测线显示为绿色时,表明样品为阴性;当检测线不显绿色时,表明样品为阳性;当质控线不显色时,表明试纸条失效,当质控线显示为绿色时,表明试纸条有效。
定量分析:1)建立黄曲霉毒素标准曲线:用试纸条测定系列稀释的黄曲霉毒素基质加标溶液,采用近红外荧光读数仪(LI-COR Biosciences,Lincoln,USA)测定检测线和质控线荧光强度,计算相对荧光强度值。
以黄曲霉毒素B1浓度的对数值为横坐标,以黄曲霉毒素B1不同浓度的相对荧光强度值为纵坐标,绘制标准曲线。检测未知毒素含量样品时,样品经前处理后用试纸条检测,将检测线的相对荧光强度值代入标准曲线,乘以稀释倍数即可算出样品中含有黄曲霉毒素的量。
实施例2、检测黄曲霉毒素的近红外荧光免疫层析试剂盒的灵敏度和特异性
一、检测黄曲霉毒素的近红外荧光免疫层析试剂盒的临界值和灵敏度
1、样品前处理:
将空白样品(玉米、大米、小麦)粉碎,分别称取5.0g玉米、大米和小麦粉碎样品,加入25mL 70%甲醇水溶液,振摇3min,4000rpm离心5min,取上清,得到玉米提取液、大米提取液和小麦提取液;再用0.01M PBS(pH 7.4)稀释4倍,得到玉米样品稀释液、大米样品稀释液和小麦样品稀释液;
向玉米样品稀释液、大米样品稀释液和小麦样品稀释液中分别添加黄曲霉毒素B1至毒素浓度分别为0、0.00125、0.0025、0.005、0.01、0.02、0.04、0.05、0.06ng/mL,得到含有不同浓度黄曲霉毒素B1的基质加标溶液。
2、定性检测临界值
分别取200μL含有不同浓度黄曲霉毒素B1的基质加标溶液加入实施例1的制备的装有近红外荧光标记抗体的微孔板的孔中,混匀,孵育4分钟,得到加样微孔板;
再将实施例1的二制备的试纸条插入加样微孔板中,室温反应10min后,采用近红外荧光读条仪(LI-COR Biosciences,Lincoln,USA)进行测定。
定性检测的临界值(Cut-off值)定义为使检测线完全消失的最低检测浓度。若试纸条的检测线和质控线均显色(绿色),则待测样品中不含有或含有黄曲霉毒素浓度低于临界值(Cut-off值);若试纸条的检测线不显色,且质控线显色(绿色),则待测样品含有的黄曲霉毒素浓度大于Cut-off值。
经测定,试剂盒检测玉米和大米中黄曲霉毒素的Cut-off值为1μg/kg(样品溶液的消线浓度(ng/mL)乘以样品稀释倍数(20倍));检测小麦中黄曲霉毒素的Cut-off值为1.2μg/kg。
3、定量检测灵敏度
用试纸条测定系列浓度的黄曲霉毒素基质加标溶液,采用近红外荧光读数仪(LI-COR Biosciences,Lincoln,USA)测定检测线和质控线荧光强度,计算相对荧光强度值。
以黄曲霉毒素B1不同浓度对数值为横坐标,以黄曲霉毒素B1不同浓度的相对荧光强度值为纵坐标,绘制标准曲线。以20%的抑制率(80%B/B0)对应的浓度作为检测灵敏度。结果表明试剂盒检测玉米中黄曲霉毒素的灵敏度为0.04μg/kg(样品溶液的灵敏度(ng/mL)乘以样品稀释倍数(20倍);检测大米黄曲霉毒素的灵敏度为0.05μg/kg;用试剂盒检测小麦种黄曲霉毒素的灵敏度为0.07μg/kg。
二、检测黄曲霉毒素的近红外荧光免疫层析试剂盒的特异性
向玉米样品稀释液分别添加黄曲霉毒素B1(德国FERMENTEK Ltd.,SSAF)、玉米赤霉烯酮(德国FERMENTEK Ltd.,SSZ)、呕吐毒素(德国FERMENTEK Ltd.,SSZ)、伏马毒素(德国FERMENTEK Ltd.,SSFB)、赭曲霉毒素(德国FERMENTEK Ltd.,SSOC)、T-2毒素(德国FERMENTEK Ltd.,SST)至终浓度均为10ng/mL,得到不同待测样品溶液。
按照上述一的2的方法检测不同待测样品溶液,结果表明仅含有黄曲霉毒素B1的待测样品溶液测定的试纸条检测线不显绿色,其余毒素溶液均不会使检测线消失或颜色变浅,说明制备的近红外荧光抗体检测试剂盒检测黄曲霉毒素的特异性高。
三、与现有胶体金试纸条的对比
1、样品前处理:
将空白样品(玉米、大米、小麦)粉碎,分别称取5.0g玉米、大米和小麦粉碎样品,加入25mL 70%甲醇水溶液,振摇3min,4000rpm离心5min,取上清,得到玉米提取液、大米提取液和小麦提取液;再用0.01M PBS(pH 7.4)稀释4倍,得到玉米样品稀释液、大米样品稀释液和小麦样品稀释液;
向玉米样品稀释液、大米样品稀释液和小麦样品稀释液中分别添加黄曲霉毒素B1至毒素浓度分别为0、0.04、0.05、0.06、0.08、0.1、0.2、0.25、0.3、0.4ng/mL,得到含有不同浓度黄曲霉毒素B1的基质加标溶液。
2、近红外荧光检测试剂盒检测
分别取200μL含有不同浓度黄曲霉毒素B1的基质加标溶液加入实施例1制备的装有近红外荧光标记抗体的微孔板的孔中,混匀,孵育4分钟,得到加样微孔板;
再将实施例1的二制备的试纸条插入加样微孔板中,室温反应10min后,采用近红外荧光读条仪(LI-COR Biosciences,Lincoln,USA)进行测定。
如实施例2第一项所示(表1),近红外荧光检测试剂盒检测玉米、大米、小麦中黄曲霉毒素的Cut-off值分别为为1μg/kg、1μg/kg和1.2μg/kg(样品溶液的消线浓度(ng/mL)乘以样品稀释倍数(20倍))。
3、现有胶体金试纸条检测
分别取200μL含有不同浓度黄曲霉毒素B1的待测样品溶液,用现有胶体金试纸条(北京中检维康生物科技有限公司提供,AF-001)检测。定性检测的临界值(Cut-off值)定义为使检测线完全消失的最低检测浓度。结果如表1所示,现有的胶体金试纸条检测玉米、大米、小麦等的Cut-off值在4-5ug/kg之间。因近红外荧光检测试剂盒检测玉米、大米、小麦中黄曲霉毒素的Cut-off值为1-1.2μg/kg,表明近红外荧光试纸条灵敏度比胶体金试纸条灵敏度高5倍左右。
表1为近红外荧光免疫层析试剂盒和胶体金试纸条测定的Cut-off值
实施例3、近红外荧光免疫层析试剂盒定量检测黄曲霉毒素的准确度和精密度
一、黄曲霉毒素标准曲线的制备
1、样品前处理:
将已知不含有黄曲霉毒素的空白样品(玉米、大米、小麦)粉碎,分别称取5.0g粉碎样品,加入25mL 70%甲醇水溶液,振摇3min,4000rpm离心5min,取上清,得到玉米提取液、大米提取液和小麦提取液;再用0.01M PBS(pH 7.4)稀释4倍,得到玉米样品稀释液、大米样品稀释液和小麦样品稀释液;
向玉米样品稀释液、大米样品稀释液和小麦样品稀释液中分别添加黄曲霉毒素B1至毒素浓度分别为0、0.00125、0.0025、0.005、0.01、0.02、0.04、0.05、0.06ng/mL,得到含有不同浓度黄曲霉毒素B1的基质加标溶液。
2、检测黄曲霉毒素的近红外荧光免疫层析试剂盒检测
按照实施例2的一的2的方法检测含有不同浓度黄曲霉毒素B1的基质加标溶液,采用近红外荧光读数仪(LI-COR Biosciences,Lincoln,USA)测定检测线和质控线荧光强度,计算相对荧光强度值。
以黄曲霉毒素B1不同浓度对数值为横坐标,以黄曲霉毒素B1不同浓度的相对荧光强度值为纵坐标,绘制标准曲线。
得到的典型标准曲线如图3所示,其中A为黄曲霉毒素标准曲线(玉米),B为黄曲霉毒素标准曲线(大米),C为黄曲霉毒素标准曲线(小麦)。
二、添加回收试验
1、样品前处理
将空白样品(玉米、大米、小麦)粉碎,分别称取5.0g玉米、大米和小麦粉碎样品。分别往空白样品添加高浓度的黄曲霉毒素标准溶液,使玉米、大米和小麦样品中的添加浓度分别为0.1、0.2、0.4μg/kg。每个添加样品中分别加入25mL 70%甲醇水溶液,振摇3min,4000rpm离心5min,取上清,再用0.01M PBS(pH 7.4)稀释4倍,得到不同待测样品溶液。
2、检测黄曲霉毒素的近红外荧光免疫层析试剂盒检测
按照实施例2的一的2的方法检测不同待测样品,采用近红外荧光读数仪(LI-COR Biosciences,Lincoln,USA)测定检测线荧光强度,计算相对荧光强度值。
将各种待测样品的检测线相对荧光强度值代入上述一得到的标准曲线线性方程中,计算得到待测样品中黄曲霉毒素含量。
结果如表2所示,在0.1-0.4μg/kg添加浓度范围内,回收率在82.1%至108.9之间,变异系数小于15.8%(n=4)。表明近红外荧光免疫层析试剂盒检测黄曲霉毒素的准确度和精密度满足定量分析的要求。
表2近红外荧光免疫层析试剂盒测定样品中黄曲霉毒素添加回收试验结果(n=4)
实施例4、近红外荧光免疫层析试剂盒定量检测实际样品中黄曲霉毒素
1、样品前处理
从河南和北京等地农场和超市收集16个玉米、小麦和大米样品,粉碎后,分别称取5.0g粉碎样品,加入25mL 70%甲醇水溶液,振摇3min,4000rpm离心5min,取上清,再用0.01M PBS(pH 7.4)稀释4倍,得到16个待测样品稀释液。
2、检测黄曲霉毒素的近红外荧光免疫层析试剂盒检测
按照实施例2的一的2的方法分别检测16个待测样品稀释液,采用近红外荧光读数仪(LI-COR Biosciences,Lincoln,USA)测定检测线荧光强度,计算相对荧光强度值。
分别将16个待测样品稀释液的检测线相对荧光强度值代入实施例3的一得到的各种标准曲线线性方程中,计算得到待测样本中黄曲霉毒素含量。
3、商品化ELISA试剂盒测定实际样品中黄曲霉毒素
收集的16个实际样品粉碎后,分别称取5.0g粉碎样品,加入1g NaCl,加入25mL70%甲醇水溶液,振摇3min,4000rpm离心5min,取上清。按照商品化试剂盒(意大利Tecna Ltd.,MA220)的操作程序进行测定。取上清50μL,与试剂盒提供的酶标记抗原100μL在微孔塑料孔中充分混匀。移取100μL混合溶液至已包被有抗黄曲霉毒素单抗的微孔中(商品化试剂盒提供),孵育10min,用洗涤液(商品化试剂盒提供)洗涤3次,加入显色试剂(商品化试剂盒提供),显色5min,用酶标仪读取450nm吸收值,代入试剂盒提供的软件中计算样品中黄曲霉毒素的浓度。
近红外荧光免疫层析试剂盒和商品化ELISA试剂盒测定实际样品的结果如表3所示。结果表明,本免疫层析试剂盒测定结果与商品化ELISA试剂盒测定结果基本一致。
表3近红外荧光免疫层析试剂盒和商品化试剂盒测定实际样本的结果对比
- 还没有人留言评论。精彩留言会获得点赞!
- 基于量子点的CA15‑3免疫层析试纸条的制备方法与制造工艺
- 肌红蛋白荧光免疫层析试纸条用活化荧光乳胶微球及应用的制造方法与工艺
- 铁蛋白荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 全程C‑反应蛋白荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 一种微流控芯片上基于荧光量子点磁性富集并分离结核分枝杆菌TB的方法及装置与制造工艺
- 25‑羟基维生素D荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 25‑羟基维生素D3荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 降钙素原荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 一种改变量子点荧光色的方法与制造工艺
- 一种基于荧光免疫层析技术的定量检测计算方法与制造工艺