一种检测蛋白同化激素的量子点标记免疫层析试纸条及其制备方法与流程
本发明涉及一种快速检测动物源性食品中蛋白同化激素的方法,特别是一种检测蛋白同化激素的量子点免疫层析试纸条及其制备方法。
背景技术:
蛋白同化激素,也称合成代谢类固醇(Anabolic–androgenic steroids,AAS),是一种雄性激素,是外源性激素的一种,具有蛋白同化作用,能够在一定的时间内引起摄入者体内蛋白质的沉积。在过去的50年里,由于蛋白同化类激素可以促进动物生长,在一定的饲养期间提高饲料的转化率,又对育种有帮助,因而被广泛应用到肉牛养殖中。但蛋白同化激素的使用会降低男性精子的生成,并造成睾丸萎缩、不孕和不可逆转的乳房女性化发育;合成代谢类固醇的使用会引起女性月经周期紊乱、脱发或体毛增加,阴蒂肥大、乳房萎缩、声音低沉等变化。长期使用类固醇激素还会影响心血管和肝系统,诱发高血压、动脉粥样硬化、肝功能损坏等病症。也有研究表明,蛋白同化激素在人体内的残留会导致细胞病变,增加了人们患上癌症的几率。因此,为了保障消费者健康必须建立灵敏度高、特异性强、简单快速的测定方法对蛋白同化激素残留进行监控。
目前,常用的检测蛋白同化激素的方法有高效液相色谱法(HPLC)、超高液相色谱-质谱联用法(UPLC-MS)、气相色谱-质谱联用法(GC-MS)和免疫检测法等。仪器检测方法法是目前应用最多的检测方法,具有准确度高、灵敏度好等优点。但该方法的缺点是,需要昂贵的仪器及专业的人员进行操作,样品处理步骤繁锁,需要衍生,回收率低等,所以不适合广泛的推广使用。
量子点(Quantum dots,QDs),又称为半导体纳米晶,主要由Ⅱ~Ⅵ族或者Ⅲ~Ⅴ族元素组成,如碲化镉(CdTe)、硒化镉(CdSe)等。与传统荧光材料相比,QDs的优点有:具有量子效应和良好的发光性;具有较宽的激发波长和较窄的发射波长;稳定性好;具有良好的生物兼容性;荧光寿命较长。量子点标记免疫层析技术是在免疫分析技术的基础上,利用荧光量子点作标记物,将量子点与抗体通过化学反应(COOH与NH2)偶联在一起,当抗体与抗原特异性结合时,量子点就标记于待测抗原上,在紫外灯的照射下呈现不同的荧光强度。其中,质控线(C线)颜色的有无决定着试纸条的有效性,而检测线(T线)的有无则表示着目标物的有无。该技术操作简单快速、结果容易判定、安全无污染,具有广泛的应用前景。
技术实现要素:
有鉴于此,本发明创造旨在提出一种检测动物源性食品中5种蛋白同化激素(诺龙,群勃龙,丙酸诺龙,雄诺龙,美雄诺龙)的量子点免疫层析试纸条。
为达到上述目的,本发明创造的技术方案是这样实现的:
一种检测蛋白同化激素的量子点标记免疫层析试纸条,包括样品垫、硝酸纤维素膜、吸水垫和PVC背板,在PVC背板上按顺序依次粘附有样品垫、硝酸纤维素膜、吸水垫;所述的硝酸纤维素膜上分别包被有青霉噻唑酸抗原构成的检测线d和羊抗兔二抗构成的质控线e,两条线间隔距离为5mm。
本发明还公开了上述量子点标记免疫层析试纸条的制备方法,包括如下步骤:
(1)诺龙抗血清纯化,得到被检物多克隆抗体;
(2)制备被检物抗原;
(3)采用活化酯法,制备被检物抗体—量子点标记物;
(4)取适量步骤(3)制备的被检物抗体—量子点标记物,添加于样品溶液中;
(5)将步骤(2)制备的被检物抗原包被在硝酸纤维素膜上构成检测线,并将羊抗兔二抗包被于硝酸纤维素膜上构成质控线;
(6)在PVC背板上按顺序依次粘附样品垫、硝酸纤维素膜、吸水垫,得到所述的量子点标记免疫层析试纸条。
上述材料中,水溶性量子点购自武汉珈源量子点技术开发有限公司,样品垫和硝酸纤维素膜购自美国Millipore公司,吸水垫和PVC背板购自上海金标生物科技公司。
本发明纯化了被检物抗血清,得到了被检物多克隆抗体,备用。制备被检物抗原作为检测线的包被抗原,采用购买的羊抗兔二抗作为质控线的捕获抗体。利用竞争法来检测诺龙、群勃龙、丙酸诺龙、雄诺龙和美雄诺龙5种蛋白同化激素,根据检测线条带的深浅判断待测样品中是否含有目标物。若质控线条带无颜色,则该试纸条失效。
与现有国内外检测蛋白同化激素的方法相比,本发明具有以下突出的优点:1、本发明的量子点标记免疫层析试纸条是利用抗原抗体的特异性反应实现的,因此特异性高,灵敏度好。2、本发明的检测试纸条检测时间快速(15分钟)且不需要任何特殊仪器及设备,检测成本低。3、本发明的检测试纸条操作简便,不需由专业人员操作。
附图说明
构成本发明创造的一部分的附图用来提供对本发明创造的进一步理解,本发明创造的示意性实施例及其说明用于解释本发明创造,并不构成对本发明创造的不当限定。在附图中:
图1为本发明检测试纸条的组装示意图。
图2为诺龙检测限的确定(诺龙的浓度从左到右分别为0、5、10、15、20μg/L)
图3为群勃龙检测限的确定(群勃龙的浓度从左到右分别为0、40、60、80、100μg/L)
图4为丙酸诺龙检测限的确定(丙酸诺龙的浓度从左到右分别为0、60、80、100、120μg/L)
图5为雄诺龙检测限的确定(雄诺龙的浓度从左到右分别为0、100、200、300、400μg/L)
图6为美雄诺龙检测限的确定(美雄诺龙的浓度从左到右分别为0、200、400、600、800μg/L)
图7为添加诺龙的食品样品检测结果。(a)鸡肉样品,(b)猪肉样品,(c)鱼肉样品,每组诺龙的浓度从左到右分别为0、25、50、75、100μg/kg;(d)牛肉样品,诺龙的浓度从左到右分别为0、30、60、90、120μg/kg;(e)牛奶样品,诺龙的浓度从左到右分别为0、35、70、105、140μg/L。
图8为添加群勃龙的食品样品检测结果。(a)鸡肉样品,(b)猪肉样品,(c)鱼肉样品,每组群勃龙的浓度从左到右分别为0、200、300、400、500μg/kg;(d)牛肉样品,群勃龙的浓度从左到右分别为0、240、360、480、600μg/kg;(e)牛奶样品,群勃龙的浓度从左到右分别为0、280、420、560、700μg/L。
图9为添加丙酸诺龙的食品样品检测结果。(a)鸡肉样品,(b)猪肉样品,(c)鱼肉样品,每组丙酸诺龙的浓度从左到右分别为0、300、400、500、600μg/kg;(d)牛肉样品,丙酸诺龙的浓度从左到右分别为0、360、480、600、720μg/kg;(e)牛奶样品,丙酸诺龙的浓度从左到右分别为0、420、560、700、840μg/L。
图10为添加雄诺龙的食品样品检测结果。(a)鸡肉样品,(b)猪肉样品,(c)鱼肉样品,每组雄诺龙的浓度从左到右分别为0、500、1000、1500、2000μg/kg;(d)牛肉样品,雄诺龙的浓度从左到右分别为0、600、1200、1800、2400μg/kg;(e)牛奶样品,雄诺龙的浓度从左到右分别为0、700、1400、2100、2800μg/L。
图11为添加美雄诺龙的食品样品检测结果。(a)鸡肉样品,(b)猪肉样品,(c)鱼肉样品,每组美雄诺龙的浓度从左到右分别为0、1000、2000、3000、4000μg/kg;(d)牛肉样品,美雄诺龙的浓度从左到右分别为0、1200、2400、3600、4800μg/kg;(e)牛奶样品,美雄诺龙的浓度从左到右分别为0、1400、2800、4200、5600μg/L。
图12诺龙半抗原合成反应式。
附图标记说明:
1、样品垫、2、硝酸纤维素膜 3、吸水垫、4、检测线、
5、质控线、6、PVC板
具体实施方式
需要说明的是,在不冲突的情况下,本发明创造中的实施例及实施例中的特征可以相互组合。
下面将参考附图并结合实施例来详细说明本发明创造。
实施例l(制备实施例)
(一)诺龙抗血清的纯化
本实验所用诺龙抗血清由实验室自制,采用Protein A-Sepharose 4B作亲合层析介质纯化诺龙抗血清,可一次性获得接近纯度较高的特异性抗体。具体操作步骤为(1)平衡:用平衡缓冲液(0.2mol/L的磷酸缓冲液)冲洗管路,平衡柱子,至基线平稳。(2)上样:用平衡缓冲液将诺龙特异性抗血清等体积稀释后上柱。(3)洗杂:用平衡缓冲液洗杂至杂蛋白的紫外吸收峰出现后继续冲洗至基线平稳。(4)洗脱收集:用0.1mol/L pH 2.7的甘氨酸缓冲液洗脱特异性IgG抗体。当紫外吸收曲线呈上升趋势,收集特异性抗体。并迅速用Tris-HCl中和抗体至中性。(5)封柱:抗体收集完成后迅速用醋酸缓冲液酸化纯化柱后,用平衡缓冲液中和纯化柱,最后用20%乙醇饱和封柱。将纯化收集的抗体,用pH7.4的磷酸缓冲液4℃透析三天后取出,添加0.1%(w/v)的叠氮钠,用磷酸缓冲液将浓度稀释成1mg/mL,备用。利用该抗体与量子点结合制备诺龙抗体—量子点标记物。
(二)诺龙半抗原的合成
准确称取548.8mg(2mmol)诺龙溶于9.0mL无水四氢呋喃(THF),待其完全溶解后,加入400mg(4mmol)丁二酸酐、0.55mL(4mol)三乙胺和243mg(2mmol)DMAP。将圆底烧瓶在60℃的油浴环境中且要有回流现象的条件下持续反应12小时。反应结束后将溶剂旋蒸至干,得红棕色油状物。然后将其用有机溶剂石油醚/乙酸乙酯(1/1,V/V)以最少的体积复溶,上样到层析柱上,并用石油醚/乙酸乙酯(1/1,V/V)为展开剂,将反应物梯度淋洗下来。将最终确定为目的物的淋洗液旋干后得到17β-NT半抗原,为白色晶体。合成反应式如图13所示。
(三)诺龙抗原(17β-NT-OVA)的制备
采用混和酸酐法制备诺龙抗原。
准确称取0.01mmol(4.16mg)17β-NT半抗原,溶于200μL N-N二甲基甲酰胺(DMF)溶液中。然后加入2.46μL三正丁胺,反应10min后,再加入1.4μL氯甲酸异丁酯,于冰水浴中避光搅拌反应1h,得A液。
称取10.0mg OVA,溶于2.0mL碳酸盐缓冲液(pH=9.6),搅拌下缓慢加入上步所得的A液,4℃反应过夜。反应结束后,在4℃下用磷酸盐缓冲溶液(PBS,pH 7.4)透析三天。透析完,取出反应液,记录体积,粗略计算蛋白的浓度并加入叠氮钠(5μL/mL,V/V)后分装,置于4℃保存备用。
利用该抗原包被硝酸纤维素膜上的检测线。
实施例2(制备实施例)
量子点标记免疫层析试纸条的组装及制备方法
1、试纸条组装:
本发明的试纸条组成如下:样品垫1、硝酸纤维素膜2、吸水垫3和PVC板6,在PVC板6上按顺序依次粘附有样品垫1、硝酸纤维素膜2、吸水垫3;所述的硝酸纤维素膜2上分别包被有诺龙抗原构成的检测线4和羊抗兔二抗构成的质控线5。
2、诺龙抗体—量子点标记物的制备:
使用活化酯法制备量子点-抗体偶联物。
(1)偶联反应。取50μL量子点于离心管中,加入0.6mg诺龙抗体和23μL EDC溶液(10mg/ml),混匀,并用硼酸盐缓冲液将溶液体积补充至400μL。然后用铝箔纸包裹安道管,于摇床避光震摇反应2~4h。
(2)离心纯化。将反应液于4℃条件下,10000rpm离心3min,以除去标记过程中形成的聚沉物;将上清液转移到滤膜中,于4℃条件下,8000rpm离心3min,去除溶液中的盐离子;最后将滤膜倒置在另一个离心管中,4℃条件下,8000rpm离心3min,收集滤膜内的溶液。
(3)过柱纯化。先用去离子水冲柱子,直至柱子上下两端的pH值相同,均为7;然后再用pH 8.3的硼酸盐缓冲液冲洗柱子,直至柱子上下两端的pH值相同;然后将偶联溶液加到柱子上端,待偶联液完全吸附到柱子上后,用硼酸盐缓冲液将偶联物淋洗下来。4℃避光保存备用。
(4)封柱。用20%乙醇溶液冲洗柱子,至上下两端pH值相同后密封柱子。
4硝酸纤维素膜的包被
用上海金标的双维平面划膜仪将制备的诺龙抗原用PBS溶液稀释15倍后包被于硝酸纤维素膜3上作为检测线5,包被量为0.9μL/cm;将购买的羊抗兔二抗(浓度mg/ml)包被于硝酸纤维素膜3上作为质控线6,包被量为0.9μL/cm,37℃烘干,封装备用。
5试纸条的组装
将样品垫1、硝酸纤维素膜2、吸水垫3按图1所示的顺序依次粘附在PVC板6上,切成3.7mm宽的小条,真空封装。
实施例3(应用实施例)
1、量子点标记免疫层析试纸条使用方法
①鸡肉、猪肉、鱼肉样品的预处理
1g肉样切碎后置于50mL离心管中,加入1.0mL 5%的甲醇溶液,高速混匀3min,再于4℃条件下,9000g离心10min,吸取上清液,用硼酸盐缓冲液(pH 8.3)稀释5倍后,直接用于试纸条检测。
②牛肉样品的预处理
1g肉样切碎后置于50mL离心管中,加入1.0mL 5%的甲醇溶液,高速混匀3min,用硼酸盐缓冲液(pH 8.3)稀释6倍后,直接用于试纸条检测。
③牛奶样品的预处理
取1.0mL牛奶于50mL离心管中,添加一定量的标准品,高速混匀3min,然后用硼酸盐缓冲液(pH 8.3)稀释7倍,稀释液直接用于试纸条检测。
2、检测步骤
用移液枪吸取100μL待检样品提取液(含25μL工作液)于安道管中,并加入2μL诺龙抗体—量子点标记物(17β-NT-Ab-QDs),混匀后,滴加到试纸条的加样孔里,15分钟后观察结果。
3、结果判定
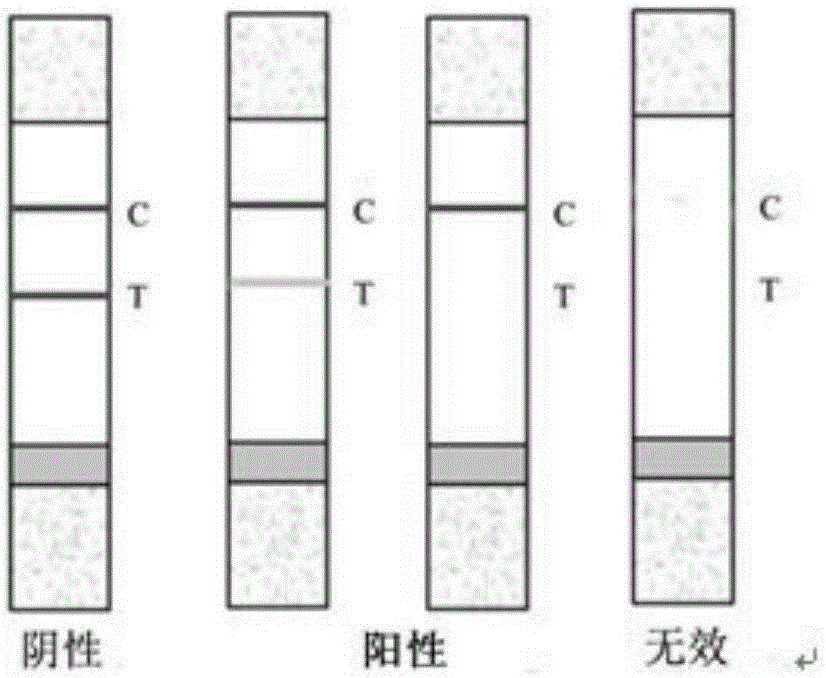
若待测样品试纸条检测线颜色与质控线颜色基本一致,则判断为阴性样品,即不含蛋白同化激素;若待测样品试纸条检测线颜色明显浅于质控线颜色或检测线颜色消失,则判断为阳性样品,即待测样品中含有蛋白同化激素;阳性结果和阴性结果,质控线均显红色条带,若质控线红色条带消失,则试纸条检测失效。
实施例4(应用实施例)
本发明的应用效果举例
本实施例中所指的蛋白同化激素量子点标记免疫层析试纸条检测方法参照实施例3所述的操作步骤,其检测结果如下。
1、灵敏度试验
如图2所示,按实施例3所述方法进行试验。当诺龙标准品浓度低于10μg/L时,试纸条检测线显色结果与质控线颜色目测比较无差别;当诺龙标准品浓度为10μg/L时,试纸条检测线显色结果与质控线颜色目测比较有明显区别;当诺龙标准品浓度继续增大,检测线逐渐变浅;诺龙标准品浓度为20μg/L时,检测线基本消失。因此确定方法的目视检测限为10μg/L。
如图3所示,按实施例3所述方法进行试验。当群勃龙标准品浓度低于60μg/L时,试纸条检测线显色结果与质控线颜色目测比较无差别;当群勃龙标准品浓度为60μg/L时,试纸条检测线显色结果与质控线颜色目测比较有明显区别;当群勃龙标准品浓度继续增大,检测线逐渐变浅;群勃龙标准品浓度为100μg/L时,检测线基本消失。因此确定方法的目视检测限为60μg/L。
如图4所示,按实施例3所述方法进行试验。当丙酸诺龙标准品浓度低于80μg/L时,试纸条检测线显色结果与质控线颜色目测比较无差别;当丙酸诺龙标准品浓度为80μg/L时,试纸条检测线显色结果与质控线颜色目测比较有明显区别;当丙酸诺龙标准品浓度继续增大,检测线逐渐变浅;丙酸诺龙标准品浓度为120μg/L时,检测线基本消失。因此确定方法的目视检测限为80μg/L。
如图5所示,按实施例3所述方法进行试验。当雄诺龙标准品浓度低于200μg/L时,试纸条检测线显色结果与质控线颜色目测比较无差别;当雄诺龙标准品浓度为200μg/L时,试纸条检测线显色结果与质控线颜色目测比较有明显区别;当雄诺龙标准品浓度继续增大,检测线逐渐变浅;雄诺龙标准品浓度为400μg/L时,检测线基本消失。因此确定方法的目视检测限为200μg/L。
如图6所示,按实施例3所述方法进行试验。当美雄诺龙标准品浓度低于400μg/L时,试纸条检测线显色结果与质控线颜色目测比较无差别;当美雄诺龙标准品浓度为400μg/L时,试纸条检测线显色结果与质控线颜色目测比较有明显区别;当美雄诺龙标准品浓度继续增大,检测线逐渐变浅;美雄诺龙标准品浓度为800μg/L时,检测线基本消失。因此确定方法的目视检测限为400μg/L。
2、加标样品的检测
如图7所示,向鸡肉、猪肉、鱼肉阴性样品中添加诺龙标准品,样品中最终浓度为0、25、50、75、100μg/kg,9000rpm离心10min后,取上清液用硼酸盐缓冲液稀释5倍后进行检测。按实施例3所述方法进行实验,检测结果如图7(a)(b)(c);向牛肉阴性样品中添加诺龙标准品,样品中最终浓度为0、30、60、90、120μg/kg,9000rpm离心10min后,取上清液用硼酸盐缓冲液稀释6倍后进行检测。按实施例3所述方法进行实验,检测结果如图7(d);向牛奶阴性样品中添加诺龙标准品,样品中最终浓度为0、35、70、105、140μg/L,9000rpm离心10min后,取上清液用硼酸盐缓冲液稀释7倍后进行检测。按实施例3所述方法进行实验,检测结果如图7(e)。
如图8所示,向鸡肉、猪肉、鱼肉阴性样品中添加群勃龙标准品,样品中最终浓度为0、200、300、400、500μg/kg,9000rpm离心10min后,取上清液用硼酸盐缓冲液稀释5倍后进行检测。按实施例3所述方法进行实验,检测结果如图8(a)(b)(c);向牛肉阴性样品中添加群勃龙标准品,样品中最终浓度为0、240、360、480、600μg/kg,9000rpm离心10min后,取上清液用硼酸盐缓冲液稀释6倍后进行检测。按实施例3所述方法进行实验,检测结果如图8(d);向牛奶阴性样品中添加诺龙标准品,样品中最终浓度为0、280、420、560、700μg/L,取提取液用硼酸盐缓冲液稀释7倍后进行检测。按实施例3所述方法进行实验,检测结果如图8(e)。
如图9所示,向鸡肉、猪肉、鱼肉阴性样品中添加丙酸诺龙标准品,样品中最终浓度为0、300、400、500、600μg/kg,9000rpm离心10min后,取上清液用硼酸盐缓冲液稀释5倍后进行检测。按实施例3所述方法进行实验,检测结果如图9(a)(b)(c);向牛肉阴性样品中添加丙酸诺龙标准品,样品中最终浓度为0、360、480、600、720μg/kg,9000rpm离心10min后,取上清液用硼酸盐缓冲液稀释6倍后进行检测。按实施例3所述方法进行实验,检测结果如图9(d);向牛奶阴性样品中添加丙酸诺龙标准品,样品中最终浓度为0、420、560、700、840μg/L,取提取液液用硼酸盐缓冲液稀释7倍后进行检测。按实施例3所述方法进行实验,检测结果如图9(e)。
如图10所示,向鸡肉、猪肉、鱼肉阴性样品中添加雄诺龙标准品,样品中最终浓度为0、500、1000、1500、2000μg/kg,9000rpm离心10min后,取上清液用硼酸盐缓冲液稀释5倍后进行检测。按实施例3所述方法进行实验,检测结果如图10(a)(b)(c);向牛肉阴性样品中添加雄诺龙标准品,样品中最终浓度为0、600、1200、1800、2400μg/kg,9000rpm离心10min后,取上清液用硼酸盐缓冲液稀释6倍后进行检测。按实施例3所述方法进行实验,检测结果如图10(d);向中牛奶阴性样品中添加雄诺龙标准品,样品中最终浓度为0、700、1400、2100、2800μg/L,取提取液用硼酸盐缓冲液稀释7倍后进行检测。按实施例3所述方法进行实验,检测结果如图10(e)。
如图11所示,向鸡肉、猪肉、鱼肉阴性样品中添加美雄诺龙标准品,样品中最终浓度为0、1000、2000、3000、4000μg/kg,9000rpm离心10min后,取上清液用硼酸盐缓冲液稀释5倍后进行检测。按实施例3所述方法进行实验,检测结果如图11(a)(b)(c);向牛肉阴性样品中添加美雄诺龙标准品,样品中最终浓度为0、1200、2400、3600、4800μg/kg,9000rpm离心10min后,取上清液用硼酸盐缓冲液稀释6倍后进行检测。按实施例3所述方法进行实验,检测结果如图11(d);向中牛奶阴性样品中添加美雄诺龙标准品,样品中最终浓度为0、1400、2800、4200、5600μg/L,取提取液用硼酸盐缓冲液稀释7倍后进行检测。按实施例3所述方法进行实验,检测结果如图11(e)。
按实施例3所述方法进行实验。并与高效液相色谱法(HPLC)检测结果进行比较。
表1高效液相色谱法与试纸条、检测柱测定结果的比较(n=3)
注:ND:未检出;+:阳性结果;-:阴性结果;±:弱阳性结果
实验表明本发明的试纸条准确性好、灵敏度高,而且样品前处理方法简单,整个检测过程不超过20min,适用于大量样品的快速筛选,可作为是蛋白同化激素多残留快速检测的有效筛检手段。
以上所述仅为本发明创造的较佳实施例而已,并不用以限制本发明创造,凡在本发明创造的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明创造的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于量子点标记的结直肠癌细胞的检测方法和试剂盒的制作方法
- 基于磁性分离和量子点标记的人流感嗜血杆菌快速检测方法和试剂盒的制作方法
- 基于磁性分离和量子点标记的人a群链球菌快速检测方法和试剂盒的制作方法
- 基于磁性分离和量子点标记的人肺炎衣原体快速检测方法和试剂盒的制作方法
- 基于磁性分离和量子点标记的人肺炎支原体快速检测方法和试剂盒的制作方法
- 基于磁性分离和多色量子点标记的人流感病毒分型检测的方法和试剂盒的制作方法
- 基于磁性分离和量子点标记的卡他莫拉菌快速检测方法和试剂盒的制作方法
- 一种基于偏振信标跟踪补偿的量子密钥分配装置制造方法
- 抗量子攻击的非确定的公钥密码构造方法
- 掺杂近红外量子点/磁性壳聚糖多功能荧光标记试剂及其制备方法