免疫测定方法、用于鉴定免疫测定的系统和试剂盒与流程
本发明涉及光激化学发光技术领域,具体涉及一种免疫测定方法、一种用于鉴定免疫测定的系统和一种试剂盒;以及另一种免疫测定方法、另一种用于鉴定免疫测定的系统和另一种试剂盒。
背景技术:
免疫学检测是基于抗原抗体特异性反应的原理进行的,由于其可以利用同位素、酶、化学发光物质等对被测物进行显示或信号的放大,因此常被用于检测蛋白质、激素等微量生物活性物质。
化学发光免疫分析则是近年来发展较迅速的非放射性免疫检测技术,其原理是利用化学发光物质进行信号的放大,并借助其发光强度,对免疫结合过程进行直接测定,该法已成为免疫学检测的重要方向之一。
光激化学发光法是化学发光分析技术的常用方法之一,可用于研究生物分子间的相互作用,临床上主要用于疾病的检测。该技术整合了高分子微粒技术、有机合成、蛋白质化学及临床检测等相关领域的研究。它通过感光微粒和发光微粒在一定范围内结合,产生离子氧能量的传递,发出光信号,从而对待测样本进行检测。其中,感光微粒内部填充有感光化合物,而发光微粒内部填充有发光化合物和镧系元素。在红色激光(600~700nm)的激发下,感光微粒释放出高能态的单线态氧离子(4μS),其传播距离约为200nm。当感光微粒和发光微粒的距离足够接近时,感光微粒释放的单线态氧离子能到达发光微粒,并通过一系列的化学反应,发射出520~620nm高能级的光,而被仪器检测到。在本反应体系中,微粒的浓度很低,碰撞几率较小,本底信号微弱。只有在感光微粒和发光微粒通过免疫反应结合以后,才会发射出明显的光,因此系统的灵敏度很高。在疾病诊断中,常用的检测模式包含三到四个组分:包被抗原或抗体的发光微粒、生物素或地高辛标记的抗原或抗体、亲和素或抗地高辛包被的感光微粒,中和抗原或抗体等。以上各组份通过两步以上温育反应与待测抗原或抗体结合,并通过化学发光量的强弱对待测样本进行定性或定量检测。与传统的酶联免疫分析方法相比,它具有均相、灵敏度高和操作简便易于自动化等特点。因此,其应用前景十分广阔。
对于双抗夹心的检测模式中,当待检测物质浓度高到一定浓度时,会因为不能形成双抗夹心复合物从而信号值偏低的现象,称为高剂量-钩状效应(HD-HOOK效应)。也就是说,高剂量-钩状效应是指在双位点夹心免疫实验中,其剂量反应曲线的高剂量区段,线性走向不是呈平台状无限后延,而是向下弯曲状,似一只钩子,导致产生假阴性的现象。
HD-HOOK效应在免疫检测中经常发生,其发生率占阳性样本30%左右。由于HD-HOOK效应的存在导致被检测样本不能被正确区分为是由于其浓度超出检测试剂盒的线性范围还是本身浓度就是该值,以至于实验误诊,尤其是导致假阴性率上升。
具体来说,一方面,在检测高浓度的样本时,高剂量-钩状效应可能导致检测信号偏低,样本也因此被判读为偏低浓度。既往的解决办法是增加试剂的组分,对待测样本进行稀释或进行两步法检测等。
另一方面,因为高剂量-钩状效应,当样本浓度的升高到一定值时,信号并不能持续升高,限制了检测范围。既往主要通过优化抗体或提高抗体来拓宽检测范围。
常规检测流程有以下5个步骤:反应孔中加入待测物及试剂、第一步温育、添加通用液、第二步温育和读数。
本发明的检测方法是基于常规检测流程,在不中断反应的前提下,在反应过程多次读取信号值,通过观察信号的变化来判断样本的真实浓度。
技术实现要素:
针对现有技术中所存在的缺陷,本发明的目的在于提供一种免疫测定方法,该方法通过两次读数来拓宽检测范围,以在检测过程中,通过将两次读数的增幅A与已知的一系列标准物质的两次读数的增幅A的标准曲线的最大值比较,来判断待测样本是否需要稀释后再进行测定。
为了实现上述目的及其他相关目的,本发明采用如下技术方案:
本发明的第一方面提供一种免疫测定方法,其特征在于,所述方法包括如下步骤:(1)对含待测目标抗原(或抗体)的待测样本进行化学发光免疫反应,激发和记录化学发光的第一次和第二次读数,并将第二次和第一次读数之间的差值增幅记为A,(2)根据含待测目标抗原(或抗体)的已知的一系列标准物质的两次读数的增幅A做标准曲线,其中标准物质的浓度低于产生HOOK效应的浓度;(3)如果含待测目标抗原(或抗体)的待测样本的两次读数的增幅A大于所述标准曲线的最大值,则其浓度超过检测上限,需对样品进行稀释测定。
根据本发明一个优选的实施方式,所述方法包括如下步骤:
(1)将含待测目标抗原(或抗体)的待测样本与第一抗体(或抗原)包被的发光微粒、标记物标记的第二抗体(或抗原)混合,温育得混合液;
(2)第一次读数:在步骤(1)的混合液中再加入标记物特异结合物标记的感光微粒,温育后进行激发光照射并检测发射光量,光子计数器读数,计为RLU1;
(3)第二次读数:将步骤(2)中进行第一次读数后的反应溶液进一步温育后,再进行激发光照射并检测发射光量,光子计数器读数,计为RLU2;
(4)计算样本第二次读数所得信号值相对于第一次读数所得信号值的增幅A,A=(RLU2/RLU1-1)x100%;
(5)根据含待测目标抗原(或抗体)的已知的一系列标准物质的两次读数的增幅A做标准曲线,其中标准物质的浓度低于产生HOOK效应的浓度;
(6)如果含待测目标抗原(或抗体)的待测样本的两次读数的增幅A大于所述标准曲线的最大值,则其浓度超过检测上限,需对样品进行稀释测定
根据本发明一个优选的实施方式,所述已知标准物质是阳性对照。
根据本发明一个优选的实施方式,发光微粒是指填充有发光化合物和镧系元素化合物的高分子微粒;所述感光微粒是填充有感光化合物的高分子微粒,在红色激光激发下,可以产生单线态氧离子。
根据本发明一个优选的实施方式,步骤(2)和(3)中,以600~700nm的红色激发光照射,检测反应溶液的发射光量;发射光的检测波长为520~620nm。
根据本发明一个优选的实施方式,所述抗原是指具有免疫原性的物质;所述抗体是指机体产生的能识别特定外来物的免疫球蛋白;所述第一抗体和第二抗体指可特异性结合于所述目标抗原的抗体;所述第一抗原和第二抗原指可特异性结合于所述目标抗体的抗原。
本发明的第二方面是提供一种用于鉴定免疫测定的系统,所述系统包括:
免疫反应装置,其用于实施化学发光免疫反应,
化学发光免疫反应激发和计数装置,其用于激发和记录化学发光的第一次和第二次读数,并将第二次和第一次读数之间的差值增幅记为A,
处理器,其用于根据含待测目标抗原(或抗体)的已知的一系列标准物质的两次读数的增幅A,做标准曲线,其中标准物质的浓度低于产生HOOK效应的浓度;如果含待测目标抗原(或抗体)的待测样本的两次读数的增幅A大于所述标准曲线的最大值,则其浓度超过检测上限,需对样品进行稀释测定
根据本发明一个优选的实施方式,所述系统的使用方法包括如下步骤:
(1)将含待测目标抗原(或抗体)的待测样本与第一抗体(或抗原)包被的发光微粒、标记物标记的第二抗体(或抗原)混合,温育得混合液;
(2)第一次读数:在步骤(1)的混合液中再加入标记物特异结合物标记的感光微粒,温育后进行激发光照射并检测发射光量,光子计数器读数,计为RLU1;
(3)第二次读数:将步骤(2)中进行第一次读数后的反应溶液进一步温育后,再进行激发光照射并检测发射光量,光子计数器读数,计为RLU2;
(4)计算样本第二次读数所得信号值相对于第一次读数所得信号值的增幅A,A=(RLU2/RLU1-1)x100%;
(5)根据含待测目标抗原(或抗体)的已知的一系列标准物质的两次读数的增幅A做标准曲线,其中标准物质的浓度低于产生HOOK效应的浓度;
(6)如果含待测目标抗原(或抗体)的待测样本的两次读数的增幅A大于所述标准曲线的最大值,则其浓度超过检测上限,需对样品进行稀释测定
本发明的第三方面是提供一种试剂盒,包括第一抗体(或抗原)包被的发光微粒、标记物标记的第二抗体(或抗原)、标记物特异结合物标记的感光微粒,其特征在于,所述试剂盒的使用方法包括如下步骤:(1)对含待测目标抗原(或抗体)的待测样本进行化学发光免疫反应,激发和记录化学发光的第一次和第二次读数,并将第二次和第一次读数之间的差值增幅记为A,(2)根据含待测目标抗原(或抗体)的已知的一系列标准物质的两次读数的增幅A做标准曲线,其中标准物质的浓度低于产生HOOK效应的浓度;(3)如果含待测目标抗原(或抗体)的待测样本的两次读数的增幅A大于所述标准曲线的最大值,则其浓度超过检测上限,需对样品进行稀释测定
根据本发明一个优选的实施方式,所述试剂盒的使用方法包括如下步骤:
(1)将含待测目标抗原(或抗体)的待测样本与第一抗体(或抗原)包被的发光微粒、标记物标记的第二抗体(或抗原)混合,温育得混合液;
(2)第一次读数:在步骤(1)的混合液中再加入标记物特异结合物标记的感光微粒,温育后进行激发光照射并检测发射光量,光子计数器读数,计为RLU1;
(3)第二次读数:将步骤(2)中进行第一次读数后的反应溶液进一步温育后,再进行激发光照射并检测发射光量,光子计数器读数,计为RLU2;
(4)计算样本第二次读数所得信号值相对于第一次读数所得信号值的增幅A,A=(RLU2/RLU1-1)x100%;
(5)根据含待测目标抗原(或抗体)的已知的一系列标准物质的两次读数的增幅A做标准曲线,其中标准物质的浓度低于产生HOOK效应的浓度;
(6)如果含待测目标抗原(或抗体)的待测样本的两次读数的增幅A大于所述标准曲线的最大值,则其浓度超过检测上限,需对样品进行稀释测定
本发明的目的还在于提供一种免疫测定方法,其通过两次读数来拓宽检测范围,以在检测过程中,将两次读数的增幅A与临界值作比较,来判断待测样本是否需要稀释后再进行测定。
为了实现上述目的及其他相关目的,本发明采用如下技术方案:
本发明的第四方面提供一种免疫测定方法,其特征在于,所述方法包括如下步骤:(1)对含待测目标抗原(或抗体)的待测样本进行化学发光免疫反应,激发和记录化学发光的第一次和第二次读数,并将第二次和第一次读数之间的差值增幅记为A,(2)根据含待测目标抗原(或抗体)的一个已知标准物质的两次读数增幅A做临界值,(3)将含待测目标抗原(或抗体)的待测样本的两次读数的增幅A与临界值作比较,如果含待测目标抗原(或抗体)的待测样本的两次读数的增幅A大于所述临界值,则判断待测样本的浓度高于所述已知标准物质浓度;若同时所述待测样本的第一次读数低于所述已知标准物质,则需对样品进行稀释后再进行测定。
根据本发明一个优选的实施方式,所述方法包括如下步骤:
(1)将含待测目标抗原(或抗体)的待测样本与第一抗体(或抗原)包被的发光微粒、标记物标记的第二抗体(或抗原)混合,温育得混合液;
(2)第一次读数:在步骤(1)的混合液中再加入标记物特异结合物标记的感光微粒,温育后进行激发光照射并检测发射光量,光子计数器读数,计为RLU1;
(3)第二次读数:将步骤(2)中进行第一次读数后的反应溶液进一步温育后,再进行激发光照射并检测发射光量,光子计数器读数,计为RLU2;
(4)计算样本第二次读数所得信号值相对于第一次读数所得信号值的增幅A,A=(RLU2/RLU1-1)x100%;
(5)根据含待测目标抗原(或抗体)的一个已知标准物质的两次读数增幅A做临界值;
(6)将含待测目标抗原(或抗体)的待测样本的两次读数的增幅A与临界值作比较,如果含待测目标抗原(或抗体)的待测样本的两次读数的增幅A大于所述临界值,则判断待测样本的浓度高于所述已知标准物质浓度;若同时所述待测样本的第一次读数所得信号值低于所述已知标准物质,则需对样品进行稀释后再进行测定。
根据本发明一个优选的实施方式,所述已知标准物质是阳性对照。
根据本发明一个优选的实施方式,发光微粒是指填充有发光化合物和镧系元素化合物的高分子微粒;所述感光微粒是填充有感光化合物的高分子微粒,在红色激光激发下,可以产生单线态氧离子。
根据本发明一个优选的实施方式,步骤(2)和(3)中,以600~700nm的红色激发光照射,检测反应溶液的发射光量;发射光的检测波长为520~620nm。
根据本发明一个优选的实施方式,所述抗原是指具有免疫原性的物质;所述抗体是指机体产生的能识别特定外来物的免疫球蛋白;所述第一抗体和第二抗体指可特异性结合于所述目标抗原的抗体;所述第一抗原和第二抗原指可特异性结合于所述目标抗体的抗原。
本发明的第五方面提供一种用于鉴定免疫测定的系统,所述系统包括:
免疫反应装置,其用于实施化学发光免疫反应,
化学发光免疫反应激发和计数装置,其用于激发和记录化学发光的第一次和第二次读数,并将第二次和第一次读数之间的差值增幅记为A,
处理器,其用于将含待测目标抗原(或抗体)的待测样本的两次读数的增幅A与临界值作比较,如果含待测目标抗原(或抗体)的待测样本的两次读数的增幅A大于所述临界值,则判断待测样本的浓度高于所述已知标准物质的浓度,若同时所述待测样本的第一次读数低于所述已知标准物质,则需对样品进行稀释后再进行测定。
在一个具体的实施方式中,本发明用于鉴定免疫测定的系统包括免疫反应装置,例如盛放溶液的容器;化学发光免疫反应激发和计数装置,例如光子计数模块和发光二极管;以及处理器,例如电脑,对所述读数进行处理和作图等。这种用于鉴定免疫测定的系统可以例如参考本申请人的实用新型专利CN201532646U,其以引用方式引入本申请。
根据一个优选的实施方式,所述系统的使用方法包括如下步骤:
(1)将含待测目标抗原(或抗体)的待测样本与第一抗体(或抗原)包被的发光微粒、标记物标记的第二抗体(或抗原)混合,温育得混合液;
(2)第一次读数:在步骤(1)的混合液中再加入标记物特异结合物标记的感光微粒,温育后进行激发光照射并检测发射光量,光子计数器读数,计为RLU1;
(3)第二次读数:将步骤(2)中进行第一次读数后的反应溶液进一步温育后,再进行激发光照射并检测发射光量,光子计数器读数,计为RLU2;
(4)计算样本第二次读数所得信号值相对于第一次读数所得信号值的增幅A,A=(RLU2/RLU1-1)x100%;
(5)根据含待测目标抗原(或抗体)的一个已知标准物质的两次读数增幅A做临界值;
(6)将含待测目标抗原(或抗体)的待测样本的两次读数的增幅A与临界值作比较,如果含待测目标抗原(或抗体)的待测样本的两次读数的增幅A大于所述临界值,则判断待测样本的浓度高于所述已知标准物质的浓度;若同时所述待测样本的第一次读数所得信号值低于所述已知标准物质,则需对样品进行稀释后再进行测定。
本发明的第六方面提供一种试剂盒,包括第一抗体(或抗原)包被的发光微粒、标记物标记的第二抗体(或抗原)、标记物特异结合物标记的感光微粒,其特征在于,所述试剂盒的使用方法包括如下步骤:(1)对含待测目标抗原(或抗体)的待测样本进行化学发光免疫反应,激发和记录化学发光的第一次和第二次读数,并将第二次和第一次读数之间的差值增幅记为A,(2)根据含待测目标抗原(或抗体)的一个已知标准物质的两次读数增幅A做临界值,(3)将含待测目标抗原(或抗体)的待测样本的两次读数的增幅A与临界值作比较,如果含待测目标抗原(或抗体)的待测样本的两次读数的增幅A大于所述临界值,则判断待测样本的浓度高于所述已知标准物质的浓度;若同时所述待测样本的第一次读数低于所述已知标准物质,则需对样品进行稀释后再进行测定。
根据本发明一个优选的实施方式,所述试剂盒的使用方法包括如下步骤:
(1)将含待测目标抗原(或抗体)的待测样本与第一抗体(或抗原)包被的发光微粒、标记物标记的第二抗体(或抗原)混合,温育得混合液;
(2)第一次读数:在步骤(1)的混合液中再加入标记物特异结合物标记的感光微粒,温育后进行激发光照射并检测发射光量,光子计数器读数,计为RLU1;
(3)第二次读数:将步骤(2)中进行第一次读数后的反应溶液进一步温育后,再进行激发光照射并检测发射光量,光子计数器读数,计为RLU2;
(4)计算样本第二次读数所得信号值相对于第一次读数所得信号值的增幅A,A=(RLU2/RLU1-1)x100%;
(5)根据含待测目标抗原(或抗体)的一个已知标准物质的两次读数增幅A做临界值;
(6)将含待测目标抗原(或抗体)的待测样本的两次读数的增幅A与临界值作比较,如果含待测目标抗原(或抗体)的待测样本的两次读数的增幅A大于所述临界值,则判断待测样本的浓度高于所述已知标准物质的浓度;若同时所述待测样本的第一次读数所得信号值低于所述已知标准物质,则需对样品进行稀释后再进行测定。
在此,需要特别说明的是,上述方法为非疾病诊断目的的方法,所述方法用于在双抗体夹心免疫法或者双抗原夹心免疫法检测过程中,通过两次读数来拓宽检测范围,以在检测过程中,将两次读数的增幅A与临界值作比较,来判断待测样本是否需要稀释后再进行测定。
优选地,所述抗原是指具有免疫原性的物质。例如蛋白质、多肽。代表性的抗原包括(但不限于):细胞因子、肿瘤标志物、金属蛋白类、心血管糖尿病相关蛋白等。
所述抗体是指机体产生的能识别特定外来物的免疫球蛋白。
本发明实施例中,所述抗原或抗体选自HBsAb乙型肝炎病毒表面抗体(HBsAb)、人绒毛膜促性腺激及β亚单位(HCG+β)、乙肝表面抗原(HBsAg)、癌抗原125(CA125)、C肽(CP)、铁蛋白(Ferr)和Anti-HCV。
可用本发明方法检测的样本没有特别限制,可以是任何含有待测目标抗原(或抗体)的样本,代表性的例子可包括血清样本、尿液样本、唾液样本等。本发明优选的样本是血清样本。
优选的,所述第一抗体和第二抗体指可特异性结合于所述抗原的抗体。
对于同一抗原而言,相应的第一抗体和第二抗体可以是相同的也可以是不同的,并且可同时结合于所述的抗原。
所述第一抗原和第二抗原指可特异性结合于所述目标抗体的抗原。
对于同一抗体而言,相应的第一抗原和第二抗原可以是相同的也可以是不同的,并且可同时结合于所述的抗体。
优选的,所述标记物与标记物特异结合物之间能够特异性结合。
更优选的,所述标记物为生物素,所述标记物特异结合物为链霉亲和素。
优选的,所述发光微粒是指填充有发光化合物和镧系元素化合物的高分子微粒。发光化合物可以是Dioxene(二氧杂环己烯)或thioxene(二甲基噻吩)的衍生物等,镧系元素化合物可以是Eu(TTA)3/TOPO或Eu(TTA)3/Phen等,该微粒可由市场上购得。发光微粒的表面官能团可以是任何能联接蛋白质的基团,如羧基,醛基,胺基,环氧乙基或卤代烷基等各种已知的可连接蛋白质的官能团。
优选的,所述感光微粒是填充有感光化合物的高分子微粒,在红色激光激发下,可以产生单线态氧离子。当其与发光微粒距离足够近的情况下,单线氧离子传递到发光微粒,与发光微粒中的发光化合物反应,产生紫外光,紫外光再进一步激发镧系元素化合物,产生一定波长的光子。感光化合物可以是酞菁染料等,该微粒也可由市场上购得。
优选的,步骤(2)和(3)中,以600~700nm的红色激发光照射,检测反应溶液的发射光量。发射光的检测波长为520~620nm。
进一步的,红色激光(600~700nm)照射感光微粒,感光微粒释放的单线态氧离子,一部分单线态氧离子被发光微粒接收,从而发射出520~620nm高能级的光。
在检测范围内,待测目标抗原的浓度表现为双抗体夹心复合物的数量,并与光子数成正比;但当待测目标抗原浓度过高时,部分待测抗原分别与单个抗体结合,导致双抗夹心复合物减少,光信号偏低,不能反映待测目标抗原的真实浓度。
同理,在检测范围内,待测目标抗体的浓度表现为双抗原夹心复合物的数量,并与光子数成正比;但当待测目标抗体浓度过高时,部分待测抗体分别与单个抗原结合,导致双抗原夹心复合物减少,光信号偏低,不能反映待测目标抗体的真实浓度。
本发明的方法,通过两次读数,比较两次读数所得信号值增幅之间的关系,从而可以起到拓宽检测范围和区分HD-HOOK效应样本的作用。两次读数的差异由以下三个方面决定:
第一方面,第一次读数时,感光微粒受红色激光(600~700nm)照射后,释放出单线态氧离子。一部分单线态氧离子传递至发光微粒后,通过一系列的化学反应,发射出520~620nm高能级的光;而一部分单线态氧离子则与未被抗体(或抗原)结合的待测目标抗原(或抗体)反应,使得待测目标抗原(或抗体)的浓度降低。对于低浓度的样本,待测目标抗原(或抗体)浓度下降后,双抗夹心复合物减少,第二次读数信号值会降低;而对于高浓度样本,待测目标抗原(或抗体)浓度降低后,双抗夹心复合物增多,第二次读数信号值反而升高。
第二方面,对于低浓度样本而言,感光微粒在第一次读数过程中受红色激光(600~700nm)照射,释放单线态氧离子后,其能量有所损耗,第二次读数信号会降低。
第三方面,对于HD-HOOK效应而言,第一次读数时,抗原抗体反应尚未达到平衡,在两次读数的间隔时间,反应仍会朝正方向进行,第二次读数信号会增高。
综上所述,本发明在反应未达到平衡时进行第一次读数,感光微粒受激发光照射释放单线态氧,一部分传递到发光微粒,一部分能与未结合的待检测目标抗原或抗体反应,消耗部分待检测目标抗原或抗体,使得反应平衡逆向移动,另一方面感光微粒在激发过一次后,有所损耗,当第二次读数时,待测目标抗原或抗体浓度低的样本的信号值会降低;而浓度高样本的双抗夹心复合物与感光微粒的结合在第一次读数时远未到达平衡,第二次读数时反应会朝正反应方向移动,故而信号会增高,随着待测目标抗原(或抗体)浓度的升高,第二次光激发光的信号值与第一次信号值的增高幅度也增高。信号的增幅与样本浓度正相关,将两次信号的增幅A与临界值作比较,来判断待测样本是否需要稀释后再进行测定。
与现有技术相比,本发明的有益效果为:
(1)本发明基于光激化学发光平台(发光氧通道)的免洗和反应的均一性,能实现对一个反应进行多次信号测量而不中断免疫反应的进行,检测出在不同反应时间的光信号,所述方法不受检测范围限制,有效地拓宽检测范围100倍以上。
(2)本发明的方法能够鉴别双抗夹心法检测中的待测样本是否需要稀释后再进行测定,所述方法能够显著提高双抗体夹心法免疫测定的准确性,并降低双抗体夹心法免疫测定的假阴性率。
(3)本发明的方法操作简单,能够简便有效地鉴别非疾病诊断目的双抗体夹心免疫测定中HD-HOOK效应所导致的报告浓度偏低的样本。
附图说明
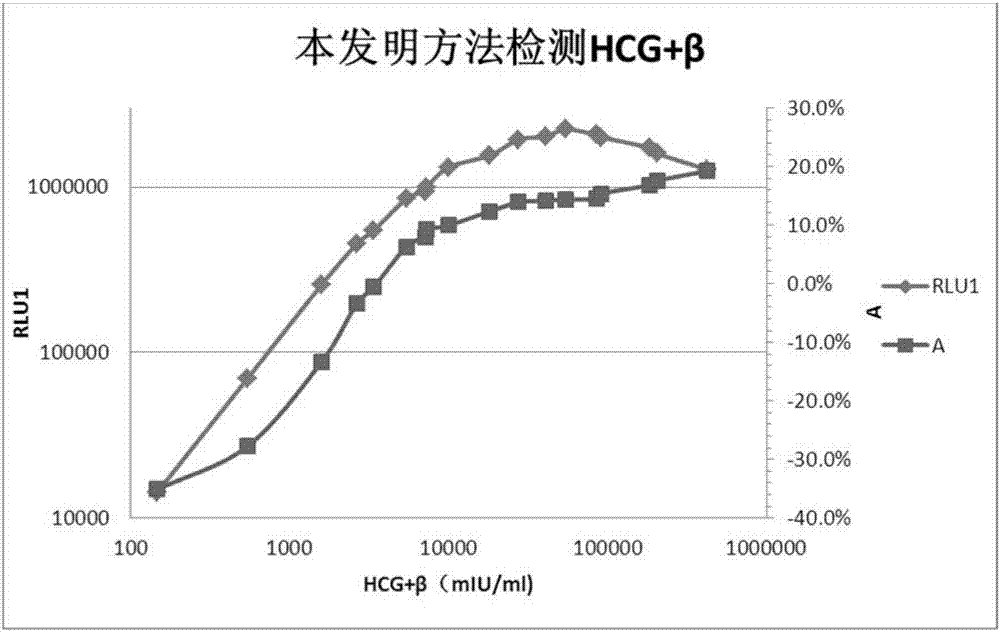
图1:HCG+β采用常规方法所得信号值与样本浓度关系曲线图;
图2:HCG+B采用本发明方法所得信号值和A分别与样本浓度关系曲线图;
图3:Ferr采用常规方法所得信号值与样本浓度关系曲线图;
图4:Ferr采用本发明方法所得信号值和A分别与样本浓度关系曲线图;
图5:C肽采用常规方法所得信号值与样本浓度关系曲线图;
图6:C肽采用本发明方法所得信号值和A分别与样本浓度关系曲线图。
图7:HBsAb采用常规方法所得信号值与样本浓度关系曲线图;
图8:HBsAb采用本发明方法所得信号值和A分别与样本浓度关系曲线图。
具体实施方式
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组DNA技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见Sambrook等MOLECULAR CLONING:A LABORATORY MANUAL,Second edition,Cold Spring Harbor Laboratory Press,1989and Third edition,2001;Ausubel等,CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,John Wiley&Sons,New York,1987and periodic updates;the series METHODS IN ENZYMOLOGY,Academic Press,San Diego;Wolffe,CHROMATIN STRUCTURE AND FUNCTION,Third edition,Academic Press,San Diego,1998;METHODS IN ENZYMOLOGY,Vol.304,Chromatin(P.M.Wassarman and A.P.Wolffe,eds.),Academic Press,San Diego,1999;和METHODSINMOLECULAR BIOLOGY,Vo1.119,Chromatin Protocols(P.B.Becker,ed.)Humana Press,Totowa,1999等。
本发明的发明人经过广泛而深入的研究发现,通过设立两次读数,并将两次读数的增幅A与临界值作比较,可判断待测样本是否需要稀释后再进行测定。
如本发明所述,术语“第一抗体”和“第二抗体”指可特异性结合于某一抗原(如肿瘤标志物)的抗体。对于同一抗原(如肿瘤标志物)而言,相应的第一抗体和第二抗体可以是不同的也可以是相同的,并且可同时结合于所述的抗原。术语“第一抗原”和“第二抗原”指可特异性结合于某一抗体(如乙肝表面抗体)的抗原。对于同一抗体(如乙肝表面抗体)而言,相应的第一抗原和第二抗原可以是不同的也可以是相同的,并且可同时结合于所述的抗体。
如本发明所述,术语“抗原”是指具有免疫原性的物质,例如蛋白质、多肽。代表性的抗原包括(但不限于):细胞因子、肿瘤标志物、金属蛋白类、心血管糖尿病相关蛋白等。
如本发明所述,术语“肿瘤标志物”是指在肿瘤的发生和增殖过程中,由肿瘤细胞本身所产生的或者是由机体对肿瘤细胞反应而产生的,反应肿瘤存在和生长的一类物质。本领域代表性的肿瘤标志物包括(但不限于):甲胎蛋白(AFP)、癌抗原125(CA125)等。
双抗夹心法的基本原理:
双抗体夹心法的基本原理是本领域技术人员所熟知的。常规的做法是将第一抗体固定于固相载体,然后将第一抗体与抗原反应,再与标记的第二抗体反应,最后进行化学发光或酶联显色反应检测信号。
光激化学发光法的基本原理:
光激化学发光法的基本原理是本领域技术人员所熟知的。常规的做法是通过感光微粒和发光微粒在一定范围内结合,产生离子氧能量的传递,发出光信号,从而对待测样本进行检测。其中,感光微粒内部填充有感光化合物,而发光微粒内部填充有发光化合物和镧系元素。在红色激光(600~700nm)的激发下,感光微粒释放出高能态的单线态氧离子(4μS),其传播距离约为200nm。当感光微粒和发光微粒的距离足够接近时,感光微粒释放的单线态氧离子能到达发光微粒,并通过一系列的化学反应,发射出520~620nm高能级的光,而被仪器检测到。
在本发明的一个优选实施例中,充分利用了第一抗体固定在发光微粒上的特点,同时采用生物素标记第二抗体,链霉亲和素包被感光微粒,将血清样本或抗原标准质控品液与第一抗体包被的发光微粒、生物素标记第二抗体依次或同时加入反应容器中,再加入链霉亲和素标记的感光微粒,从而发生以下反应:
(1)发光微粒上的第一抗体与血清样本或抗原标准质控品液中相应的抗原结合,形成“抗原-第一抗体-发光微粒”三元复合物;
(2)第二抗体与血清样本或抗原标准质控品液中相应的抗原结合,最终形成“第二抗体-抗原-第一抗体-发光微粒”双抗夹心复合物;
生物素和链霉亲和素特异性结合,使得双抗夹心复合物与感光微粒结合到一起。
此时,感光微粒和发光微粒之间的距离小于200nm,红色激光(600~700nm)照射感光微粒后,释放的单线态氧能够被发光微粒接收。通过一系列化学反应,发射出520~620nm高能级的光,并通过化学发光量的强弱对待测样本进行定性或定量检测。
在本发明的另一个优选实施例中,充分利用了第一抗原固定在发光微粒上的特点,同时采用生物素标记第二抗原,链霉亲和素包被感光微粒,将血清样本或抗原标准质控品液与第一抗原包被的发光微粒、生物素标记第二抗原依次或同时加入反应容器中,再加入链霉亲和素标记的感光微粒,从而发生以下反应:
(1)发光微粒上的第一抗原与血清样本或抗原标准质控品液中相应的抗体积结合,形成“抗体-第一抗原-发光微粒”三元复合物;
(2)第二抗原与血清样本或抗原标准质控品液中相应的抗体结合,最终形成“第二抗原-抗体-第一抗原-发光微粒”双抗夹心复合物;
生物素和链霉亲和素特异性结合,使得双抗夹心复合物与感光微粒结合到一起。
此时,感光微粒和发光微粒之间的距离小于200nm,红色激光(600~700nm)照射感光微粒后,释放的单线态氧能够被发光微粒接收。通过一系列化学反应,发射出520~620nm高能级的光,并通过化学发光量的强弱对待测样本进行定性或定量检测。
以下,进一步说明本发明的相关操作细节。
(1)第一抗体(或抗原)包被的发光微粒,记为试剂1,可购买于博阳生物科技有限公司。
(2)第二抗体(或抗原)可用各种本领域已知的标记物及其特异结合物系统进行标记。优选地是通过生物素-亲和素系统标记第二抗体(或抗原)。生物素标记的第二抗体(或抗原),记为试剂2,可购买于博阳生物科技有限公司。
(3)链霉亲和素包被的感光微粒,记为通用液,可购买于博阳生物科技有限公司。
(4)标准品:
用待测抗原(或抗体)配置一定浓度范围内(低于HD-HOOK效应浓度)的标准品溶液。将标准品、试剂1、试剂2混匀,温育反应后加入通用液,继续温育反应一段时间后第一次读数(RLU1),再温育一段时间后进行第二次读数(RLU2),计算A=(RLU2/RLU1-1)x100%,根据标准品的RLU1和两次读数的增幅A分别与校准品浓度做标准曲线;
(5)样品的检测:
可用本发明方法检测的样品没有特别限制,可以是任何含有抗原(或抗体)的样品,代表性的例子可包括血清样本、尿液样本、唾液样本等。优选的样品是血清样品。
(6)样品浓度计算:
将待测样本两次读数增幅A值与已知标准品的A比较,若待测样本A大于已知标准品的A,则此样本浓度大于已知标准品的浓度;若同时此样本RLU1小于此标准品的RLU1,则表明此样本的RLU1低是由于HD-HOOK效应导致的,需要稀释检测。
实施例1检测人血清样本中人绒毛膜促性腺激素及β亚单位(HCG+β)验证本发明方法有效性
采用博阳生物科技(上海)有限公司生产的人绒毛膜促性腺激素及β亚单位(HCG+β)检测试剂盒(光激化学发光法)来检测血清样本中人绒毛膜促性腺激素及β亚单位(HCG+β)的含量。所述试剂盒包括校准品1-校准品6、试剂1(发光抗体,亦即,抗体包被的发光微粒)、试剂2(生物素标记抗体,亦即生物素标记的抗体)。
对由Roche检测(超过检测限样本进行稀释检测)得18例HCG+β浓度的病人血清样本,分别进行常规方法及本发明方法检测,
常规检测方法:将待测样本、校准品,试剂1(发光抗体,亦即,鼠单克隆抗体包被的发光微粒)和试剂2(生物素标记抗体,亦即生物素标记的鼠单克隆抗体)分别加入反应杯后,37℃温育15min,加入通用液(链霉亲和素标记的感光微粒),37℃温育10min,光子计数器读数,读取RLU,计算得样本浓度,结果如下表所示。
采用本发明两次读数法:将待测样本、校准品,试剂1(发光抗体,亦即,鼠单克隆抗体包被的发光微粒)和试剂2(生物素标记抗体,亦即生物素标记的鼠单克隆抗体),37℃温育15min,加入通用液(链霉亲和素标记的感光微粒),37℃温育3min,读数RLU1,37℃继续温育7min,读数RLU2,并计算第二次信号值的增幅A=(RLU2/RLU1-1)X100%,结果如下表所示,
表1:
注:HCG+β常规检测的检测范围为0-10000mIU/ml,超出检测上限样本显示浓度为>10000mIU/ml。
Roche检测结果作为真实浓度,由表1和图1可知,常规检测中,浓度上升到54531mIU/ml信号值随浓度升高而增高,浓度继续升高,信号值随HCG+β浓度升高而降低,即浓度大于54531mIU/ml则HD-HOOK,在常规检测中,检测范围为0-10000mIU/ml,超出检测上限样本显示浓度为>10000mIU/ml。当HD-HOOK效应样本浓度持续升高,信号持续下降,就会出现将超高浓度样本报告成偏低浓度情况,如样本18。故而在常规检测中就不能分辨待测样本的检测结果是真实浓度还是超高值样本受HD-HOOK效应影响而报告的偏低浓度。
本发明方法通过两次读数来鉴别HOOK效应导致的报告浓度偏低样本。每个待测样本先后检测到信号值结果RLU1、RLU2,将第二次读数的增幅A=(RLU2/RLU1-1)X100%作为判断样本浓度的指标之一。由表2和图2可知,信号值随浓度续升高到54531mIU/ml,之后信号值开始随浓度升高而下降,但是增幅A却是随浓度持续上升的。故直接比较待测样本的A值与校准品的A值,即可判断待测样本浓度与校准品浓度的大小关系。样本10~18的增幅A均大于校准品6的增幅(11.1%),且A值持续增高,表明样本10~18的HCG+β浓度均大于10000mIU/ml,且浓度持续升高,这与Roche的浓度结果相符,样本18信号值低于校准品6,常规方法检测浓度为8713.02mIU/ml,通过本发明方法能鉴别其为HD-HOOK效应样本,需进行稀释检测。
实施例2:检测样本中铁蛋白(Ferr)验证本发明方法有效性
采用博阳生物科技(上海)有限公司生产的铁蛋白(Ferr)检测试剂盒(化学发光法)来检测样本中铁蛋白(购自Fitzgerald,Catalog No:30-AF10)的含量。所述试剂盒包括校准品1-校准品6、试剂1(发光抗体,亦即,抗体包被的发光微粒)、试剂2(生物素标记抗体,亦即生物素标记的抗体)。
校准品1-校准品6:常规试剂盒中的已知浓度样本,浓度远小于HOOK样本,作标准曲线计算待测物浓度。
另需用到的组分:LiCA通用液(链霉亲和素标记的感光微粒),该产品为博阳生物科技公司生产光激化学发光分析系统的辅助试剂。与仪器及相应的光激化学发光法检测试剂盒配套使用,用于抗原、抗体的检测。
将高浓度的铁蛋白抗原进行梯度稀释,分别采用常规检测方法和本发明检测方法测定含不同浓度铁蛋白的样本的浓度值。
常规检测方法:将校准品1-校准品6、待测样本1-15,试剂1(发光抗体,亦即,鼠单克隆抗体包被的发光微粒)和试剂2(生物素标记抗体,亦即生物素标记的鼠单克隆抗体)加入反应杯后,37℃温育15min,加入LiCA通用液(链霉亲和素标记的感光微粒),37℃温育10min,光子计数器读数,读取RLU,结果如下表所示。
采用本发明两次读数法:将校准品1-校准品6、待测样本1-15,试剂1(发光抗体,亦即,鼠单克隆抗体包被的发光微粒)和试剂2(生物素标记抗体,亦即生物素标记的鼠单克隆抗体),37℃温育15min,加入LiCA通用液(链霉亲和素标记的感光微粒),37℃温育3min,读数RLU1,37℃继续温育7min,读数RLU2,并计算第二次信号值的增幅A=(RLU2/RLU1-1)X100%,结果如下表所示,
表2:
注:铁蛋白常规检测的检测范围为0-2000ng/ml,超出检测上限样本显示浓度为>2000ng/ml。
在常规检测中,由表2和图3可知,浓度上升到51000ng/ml信号值随浓度升高而增高,浓度继续升高,信号值随Ferr浓度升高而降低,常规检测范围为0-2000ng/ml,超出检测上限样本显示浓度为>2000ng/ml。当HD-HOOK效应样本浓度持续升高,当浓度升高到2550000ng/ml,信号下降到校准品6的信号以下,就会出现将超高浓度样本报告成偏低浓度情况,如样本15。故而在常规检测中就不能分辨待测样本的检测结果是真实浓度还是超高值样本受HD-HOOK效应影响而报告的偏低浓度。
本发明方法通过两次读数来鉴别HOOK效应导致的报告浓度偏低样本。每个待测样本先后检测到信号值结果RLU1、RLU2,将第二次读数的增幅A=(RLU2/RLU1-1)X100%作为判断样本浓度的指标之一。由表2和图4可知,信号值随浓度续升高到51000ng/ml,之后信号值开始随浓度升高而下降,但是增幅A却是随浓度持续上升的。故直接比较待测样本的A值与校准品的A值,即可判断待测样本浓度与校准品浓度的大小关系。样本4~15的增幅A均大于校准品6的增幅(-5.5%),表明样本4~15的Ferr浓度均大于2000ng/ml。这与实际浓度相符,样本15信号值低于校准品6,常规方法检测浓度为1860.97ng/ml,通过本发明方法能鉴别其为浓度超过检测范围样本,需进行稀释检测。
实施例3:检测样本中C肽(CP)验证本发明方法有效性
采用博阳生物科技(上海)有限公司生产的C肽(CP)检测试剂盒(化学发光法)来检测样本中C肽(购自Fitzgerald,Catalog No:30-AC96)的含量。所述试剂盒包括校准品1-校准品6、试剂1(发光抗体,亦即,抗体包被的发光微粒)、试剂2(生物素标记抗体,亦即生物素标记的抗体)。
校准品1-校准品6:常规试剂盒中的已知浓度样本,浓度远小于HOOK样本,作标准曲线计算待测物浓度。
将高浓度的C肽抗原进行梯度稀释,分别采用常规检测方法和本发明检测方法测定含不同浓度C肽的样本的浓度值。
常规检测方法:将校准品1-校准品6、待测样本1-15,试剂1(发光抗体,亦即,鼠单克隆抗体包被的发光微粒)和试剂2(生物素标记抗体,亦即生物素标记的鼠单克隆抗体)加入反应杯后,37℃温育15min,加入LiCA通用液(链霉亲和素标记的感光微粒),37℃温育10min,光子计数器读数,读取RLU,结果如下表所示。
采用本发明两次读数法:将校准品1-校准品6、待测样本1-15,试剂1(发光抗体,亦即,鼠单克隆抗体包被的发光微粒)和试剂2(生物素标记抗体,亦即生物素标记的鼠单克隆抗体),37℃温育15min,加入LiCA通用液(链霉亲和素标记的感光微粒),37℃温育3min,读数RLU1,37℃继续温育7min,读数RLU2,并计算第二次信号值的增幅A=(RLU2/RLU1-1)X100%,结果如下表所示,
表3:
注:C肽常规检测的检测范围为0-30nng/ml,超出检测上限样本显示浓度为>30ng/ml。
在常规检测中,由表3和图5可知,浓度上升到10000ng/ml信号值随浓度升高而增高,浓度继续升高,信号值随C肽浓度升高而降低,常规检测范围为0-30ng/ml,超出检测上限样本显示浓度为>30ng/ml。当浓度升高到33500000ng/ml,信号下降到校准品6的信号以下,就会出现将超高浓度样本报告成偏低浓度情况,如样本16、17。故而在常规检测中就不能分辨待测样本的检测结果是真实浓度还是超高值样本受HD-HOOK效应影响而报告的偏低浓度。
本发明方法通过两次读数来鉴别HOOK效应导致的报告浓度偏低样本。每个待测样本先后检测到信号值结果RLU1、RLU2,将第二次读数的增幅A=(RLU2/RLU1-1)X100%作为判断样本浓度的指标之一。由表3和图6可知,信号值随浓度续升高到10000ng/ml,之后信号值开始随浓度升高而下降,但是增幅A却是随浓度持续上升的。故直接比较待测样本的A值与校准品的A值,即可判断待测样本浓度与校准品浓度的大小关系。样本5~17的增幅A均大于校准品6的增幅(-4.9%),表明样本5~17的C肽浓度均大于30ng/ml,超过检测上限。这与实际浓度相符,样本16、17信号值低于校准品6,常规方法检测浓度分别为8.15ng/ml、0.76ng/ml,通过本发明方法能鉴别其为超过检测上限样本,需进行稀释检测。
实施例4:检测人血清样本中乙型肝炎病毒表面抗原(HBsAg)
采用博阳生物科技(上海)有限公司生产的乙型肝炎病毒表面抗原(HBsAg)检测试剂盒(光激化学发光法)检测样本中HBsAg浓度,所述试剂盒包括校准品1-校准品6、试剂1(发光抗体,亦即,抗体包被的发光微粒)、试剂2(生物素标记抗体,亦即生物素标记的抗体)。
校准品1-校准品6:常规试剂盒中的已知浓度样本,浓度远小于HOOK样本,作标准曲线计算待测物浓度。
先用本发明方法检测校准品1-校准品6、待测的血清样本1-15:将待测物,试剂1(抗体包被的发光微粒)和试剂2(生物素标记的抗体)加入反应杯后,37℃温育15min,加入LiCA通用液(链霉亲和素标记的感光微粒),37℃温育3min,读数RLU1,37℃继续温育7min,读数RLU2,并计算第二次信号值的增幅A=(RLU2/RLU1-1)X100%,结果如下表。
表4:
本发明方法得到15个血清样本的浓度如上:上表所示,先通过与校准品6的增幅比较区分出超过检测上限(336.56IU/mL)的样本,即A值大于27%则判断为HOOK效应样本,推荐稀释后检测;而A小于27%则为检测范围内样本,可直接用校准曲线计算出样本浓度。
通过对样本进行梯度稀释后检测浓度变化以验证以上结论的可靠性,将样本1-样本15均进行2被稀释和4倍稀释,同时用常规检测方法检测未稀释的原倍样本、2被稀释样本和4倍稀释样本,通过观察稀释后浓度的变化判断该样本是否有HOOK效应,即若稀释后样本浓度反而升高即为HOOK效应样本。非HOOK效应样本在稀释后浓度会降低。结果如下:
表5:
血清样本1、2、3、5、6、9、12、13、14、15稀释后检测浓度升高,即证明为HD-HOOK效应样本,浓度大于336.56IU/mL,血清样本4、7、8、10、11稀释后浓度降低,证明不是HD-HOOK效应样本。与本发明方法的结果完全相同。
实施例5:检测人血清样本中CA125验证本发明方法有效性
采用博阳生物科技(上海)有限公司生产的糖类抗原125(CA125)检测试剂盒(光激化学发光法)检测样本中CA125浓度,所述试剂盒包括校准品1-校准品6、试剂1(发光抗体,亦即,抗体包被的发光微粒)、试剂2(生物素标记抗体,亦即生物素标记的抗体)。
校准品1-校准品6:常规试剂盒中的已知浓度样本,浓度远小于HOOK样本,作标准曲线计算待测物浓度。
先用本发明方法检测校准品1-校准品6、待测的血清样本1-18:将待测物,试剂1(抗体包被的发光微粒)和试剂2(生物素标记的抗体)加入反应杯后,37℃温育15min,加入LiCA通用液(链霉亲和素标记的感光微粒),37℃温育3min,读数RLU1,37℃继续温育7min,读数RLU2,并计算第二次信号值的增幅A=(RLU2/RLU1-1)X100%,结果如下表。
表6:
本发明方法得到18个血清样本的浓度如上:上表所示,先通过与校准品6的增幅比较区分出超过检测上限的样本,即A值大于7.4%则判断为超过检测上限的样本,推荐稀释后检测;而A小于7.4%则为非HOOK效应样本,可直接用校准曲线计算出样本浓度。
通过对样本进行梯度稀释后检测浓度变化以验证以上结论的可靠性,将样本1-样本18均进行2被稀释和4倍稀释,同时用常规检测方法检测未稀释的原倍样本、2被稀释样本和4倍稀释样本,通过观察稀释后浓度的变化判断该样本是否有HOOK效应,即若稀释后样本浓度反而升高即为HOOK效应样本。非HOOK效应样本在稀释后浓度会降低。结果如下:
表7:
血清样本16、17、18稀释后检测浓度升高,即证明为HD-HOOK效应样本,血清样本1-样本15稀释后浓度降低,证明不是HD-HOOK效应样本。与本发明方法的结果完全相同。不稀释样本的情况下,常规方法检测原倍样本,则会因为HD-HOOK效应将血清样本16、17、18误判为偏低浓度样本。
实施例6:检测样本中乙型肝炎病毒表面抗体(HBsAb)验证本发明方法有效性
采用博阳生物科技(上海)有限公司生产的乙型肝炎病毒表面抗体检测试剂盒HBsAbHBsAb(光激化学发光法)来检测样本中乙型肝炎病毒表面抗体(购自北京中科京达生物技术有限公司,Clone No:M2201)的含量。所述试剂盒包括校准品1-校准品6、试剂1(HBsAg包被的发光微粒)和试剂2(生物素标记的HBsAg)。
校准品1-校准品6:常规试剂盒中的已知浓度样本,浓度远小于HOOK样本,作标准曲线计算待测物浓度。
将高浓度的HBsAb进行梯度稀释,分别采用常规检测方法和本发明检测方法测定含不同浓度HBsAb的样本的浓度值。
常规检测方法:将校准品1-校准品6、待测样本1-14,试剂1(HBsAg包被的发光微粒)和试剂2(生物素标记的HBsAg)加入反应杯后,37℃温育15min,加入LiCA通用液(链霉亲和素标记的感光微粒),37℃温育10min,光子计数器读数,读取RLU,结果如下表所示。
采用本发明两次读数法:将校准品1-校准品6、待测样本1-14,试剂1(HBsAg包被的发光微粒)和试剂2(生物素标记的HBsAg),37℃温育15min,加入LiCA通用液(链霉亲和素标记的感光微粒),37℃温育3min,读数RLU1,37℃继续温育7min,读数RLU2,并计算第二次信号值的增幅A=(RLU2/RLU1-1)X100%,结果如下表所示,
表8:
注:HBsAb常规检测的检测范围为0-1000mIU/ml,超出检测上限样本显示浓度为>1000mIU/ml。
在常规检测中,由表8和图7可知,浓度上升到10000mIU/ml信号值随浓度升高而增高,浓度继续升高,信号值随HBsAb浓度升高而降低,常规检测范围为0-1000mIU/ml,超出检测上限样本显示浓度为>1000mIU/ml。当浓度升高到335000mIU/ml及以上,信号下降到校准品6的信号以下,就会出现将超高浓度样本报告成偏低浓度情况,如样本12、13、14。故而在常规检测中就不能分辨待测样本的检测结果是真实浓度还是超高值样本受HD-HOOK效应影响而报告的偏低浓度。
本发明方法通过两次读数来鉴别HOOK效应导致的报告浓度偏低样本。每个待测样本先后检测到信号值结果RLU1、RLU2,将第二次读数的增幅A=(RLU2/RLU1-1)X100%作为判断样本浓度的指标之一。由表8和图8可知,信号值随浓度续升高到10000mIU/ml,之后信号值开始随浓度升高而下降,但是增幅A却是随浓度持续上升的。故直接比较待测样本的A值与校准品的A值,即可判断待测样本浓度与校准品浓度的大小关系。样本8~14的增幅A均大于校准品6的增幅(35.9%),表明样本8~14的HBsAb浓度均大于1000mIU/ml,超过检测上限。这与实际浓度相符,样本12、13、14。信号值低于校准品6,常规方法检测浓度分别为802.57mIU/ml、352.22mIU/ml、147.9mIU/ml,通过本发明方法能鉴别其为超过检测上限样本,需进行稀释检测。
实施例7:本发明方法在定性试剂盒Anti-HCV中应用
采用博阳生物科技(上海)有限公司生产的丙型肝炎病毒抗体检测试剂盒(化学发光法)来检测样本中Anti-HCV的含量。所述试剂盒包括参考品、阴性对照、阳性对照、试剂1(发光HCV抗原,亦即,HCV抗原包被的发光微粒)和试剂2(生物素标记HCV抗原,亦即生物素标记的HCV抗原)。
参考品、阴性对照、阳性对照:参考品是用作参考以判断待测样本阴阳性的已知浓度标准品;阴性对照、阳性对照是用作判断试验有效性的已知浓度标准品。将高浓度的Anti-HCV进行梯度稀释,分别采用常规检测方法和本发明检测方法测定含不同浓度Anti-HCV样本的信号值。
常规检测方法:将梯度稀释的一系列Anti-HCV样本,试剂1(发光HCV抗原,亦即,HCV抗原包被的发光微粒)和试剂2(生物素标记HCV抗原,亦即生物素标记的HCV抗原)加入反应杯后,37℃温育15min,加入LiCA通用液(链霉亲和素标记的感光微粒),37℃温育10min,光子计数器读数,读取RLU,结果如表8所示。
采用本发明两次读数法:将梯度稀释的一系列Anti-HCV样本,试剂1(发光HCV抗原,亦即,HCV抗原包被的发光微粒)和试剂2(生物素标记HCV抗原,亦即生物素标记的HCV抗原),37℃温育15min,加入LiCA通用液(链霉亲和素标记的感光微粒),37℃温育3min,读数RLU1,37℃继续温育7min,读数RLU2,并计算第二次信号值的增幅A=(RLU2/RLU1-1)X100%,结果如下表所示。
表9:
如上表所示,抗原稀释倍数降低到10000倍后,信号值随浓度升高而降低,出现HOOK效应,浓度继续升高到一定值时(如样本12),RLU下降到参考值cut off以下,常规检测方法下就会误判其结果为阴性,本发明方法则可先观察两次信号的增幅A=(RLU2/RLU1-1)X100%,比较待测样本的A值与阳性对照的A值(-25%),判断出待测样本与阳性参照之间的大小关系,如上表所示,样本12的A值(47%)远高于阳性对照的A值(-25%),表明次样本浓度高于阳性对照,是阳性样本,其信号的不丰富是因为HOOK效应,应该进行稀释验证。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!