基于微流体透镜的流式细胞仪的制作方法
本实用新型涉及集成型光学器件,属于一种流式细胞仪,尤其是应用焦距与焦斑动态可调的微流体透镜的流式细胞仪。
背景技术:
流式细胞仪由于其可移植性、小尺寸、方便处理以及大规模生产潜在的成本控制等有点,在生物医学领域有着巨大的发展潜力。目前流式细胞仪上大多使用光纤或者波导将光束聚焦至检测区域。然而这种做法只有较小的数值孔径,影响检测的准确性,并且这种设计方案在一定程度上影响了“芯片实验室”的集成。J.Godin等人将一个微流体透镜集成在流式细胞仪中(Jessica Godin;Victor Lien;and Yu-Hwa Lo,Demonstration of two-dimensional fluidic lens for integration into microfluidic flow cytometers,APPLIED PHYSICS LETTERS 89,061106(2006);即Jessica Godin;Victor Lien;和Yu-Hwa Lo,用于集成微流体流式细胞仪的二维流体透镜实例,应用物理学报89,061106(2006)),提供了一种简单、紧密、耗费少的片上检测系统。然而该系统以及大部分系统只能提供一个固定大小的焦斑,在对不同种类(大小)细胞检测时,精确度不高。
技术实现要素:
为了克服已有流式细胞仪的动态检测能力较弱、适用性较差的不足,本实用新型提供一种动态检测能力较强、适用性良好的基于微流体透镜的流式细胞仪。
本实用新型解决其技术问题所采用的技术方案是:
一种基于微流体透镜的流式细胞仪,包括细胞通道和波导,所述流式细胞仪还包括微流体透镜,所述细胞通道和波导之间布置所述微流体透镜;所述流体微透镜包括微腔、芯层流道、包层流道和出口流道,所述包层流道和所述微腔的进口的周围一圈均连通,所述芯层流道与芯层入口连通,所述芯层入口的内径比所述微腔的内径小,且所述芯层入口与所述微腔在同一根轴线上,所述芯层入口的出口处与所述包层流道连通且正对所述微腔的进口,所述微腔的出口与所述出口流道连通。
进一步,所述包层流道含2个流道,通过圆角设计将芯层包裹,且所述包层流道与所述微腔的轴线呈相互垂直布置。
再进一步,所述流体微透镜与细胞通道之间的距离为150~250μm,该范围内,焦斑以及焦距都有良好的动态调节能力。
本实用新型的技术构思为:渐变折射率流体微透镜(L-GRIN)基于不同折射率层流的扩散和对流原理工作,而不是依赖于固定的液-液曲面,因此不需要高层流速度,并且微透镜是通过动态调节流体条件,而非改变微透镜表面曲率来实现折射率渐变,因此其光学特性可以实时调节。从原理上,本实用新型能够通过2个包层流道流速以及溶液质量分数的调节,从而对光束的光斑以及焦距在2个维度上实现了动态调节。
本实用新型的有益效果主要表现在:增强流式细胞仪的集成度,根据检测需求动态调整焦距、焦斑,以达到更精确检测目的。
附图说明
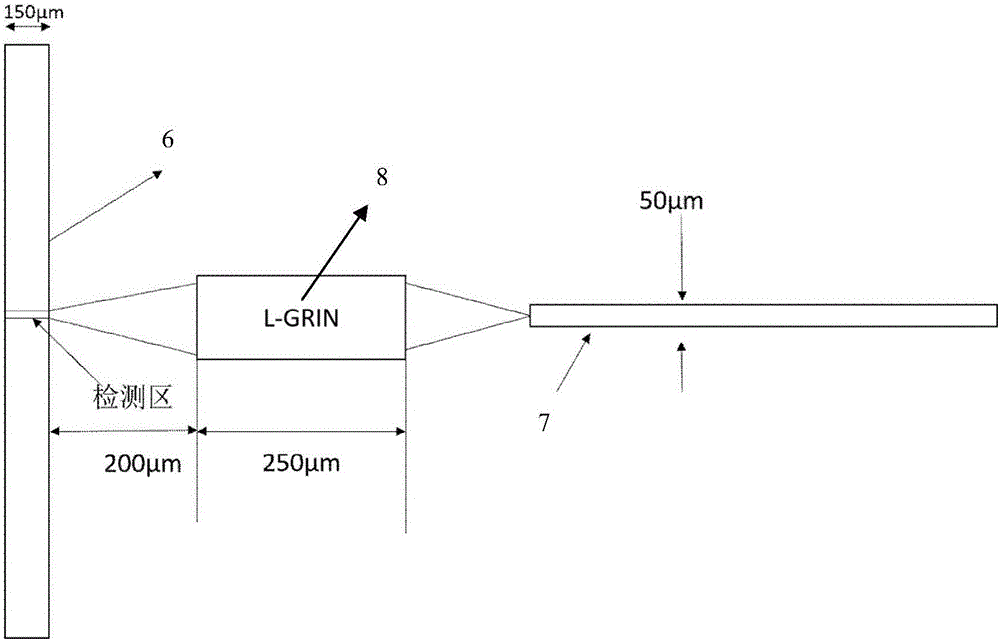
图1是本实用新型将微流体透镜用于流式细胞仪光检测系统的整体结构示意图。
图2即图1中的L-GRIN结构示意图。
图3是本实用新型腔体示意图,图中标识了等效芯层入口以及包层入口。
图4是特定流速下的腔内折射率分布图。
图5是图4下折射率分布的聚焦图。
图6是相同流速条件下,不同溶液质量分数下的聚焦图。
图7是相同溶液质量分数下,不同流速情况焦斑大小图。
图8是不同流速下(即不同焦斑大小时),在200μm处聚焦所对应的溶液质量分数图。
具体实施方式
下面结合附图对本实用新型作进一步描述。
参照图1和图2,一种基于微流体透镜的流式细胞仪,包括细胞通道6和波导7,所述流式细胞仪还包括微流体透镜8,所述细胞通道6和波导7之间布置所述微流体透镜8;所述流体微透镜8包括微腔、芯层流道、包层流道和出口流道,所述包层流道和所述微腔的进口的周围一圈均连通,所述芯层流道与芯层入口连通,所述芯层入口的内径比所述微腔的内径小,且所述芯层入口与所述微腔在同一根轴线上,所述芯层入口的出口处与所述包层流道连通且正对所述微腔的进口,所述微腔的出口与所述出口流道连通。
进一步,所述包层流道含2个流道,通过圆角设计将芯层包裹,且所述包层流道与所述微腔的轴线呈相互垂直布置。
微流体透镜结构如图2所示,其中2,3通道为包层液体入口,1通道为芯层液体入口,4,5通道为混合流体出口。集成方法如图1所示,将流体微透镜固定在细胞通道200μm处;当然,所述流体微透镜与细胞通道之间的距离也可以选择150~250μm范围内的任何其他点值。
所述芯层流道与两个包层流道平行布置。本实施例中,芯层液体从芯层液体入口1注入,包层液体从包层液体入口2,3注入,为了排除流速方向对液体层流的影响,包层入口均采用圆角设计,改变流速矢量方向,混合液体分别通过混合流体出口4,5流出。流体微透镜的主要部分是中间混合腔体,芯层液体与包层液体在其中发生扩散对流效应,形成渐变折射率分布。流体微透镜腔体的等效结构如图3所示,通道1的入口边长为50μm,通道2,3,4,5均为50μm*150μm矩形。
乙二醇溶液(芯层液体)与去离子水(DI,包层液体)同时注入腔体,xoy以及yoz截面上轴对称的渐变折射率分布:近轴折射率最大,沿着腔中心轴线方向和垂直轴线方向的折射率分布逐渐减小。
采用有限元法(FEM)和光迹追踪法来模拟和优化参数。器件的折射率分布可以通过模拟和计算两相流体对流和扩散过程稳定后在腔体中的浓度获得。在腔体内,流体的扩散和对流影响了流体微透镜的折射率分布,对流扩散过程中,U=(Qcore+Qclad)/R2代表腔体的流体速度,Qcore和Qclad分别代表芯层和包层的流速,R为边长。
扩散系数较大的模拟结果沿着横向纵向的扩散效果很明显,相反扩散系数较小的折射率分布渐变效果不明显。这说明,扩散系数是一个非常有效的控制渐变折射率分布的手段,这样也直接影响了微透镜的性能。由于环境温度的变化,对液体扩散系数将产生很大的影响,因此扩散系数的调节可以通过改变液体温度来实现。假设将去离子水和乙二醇分别选为包层和芯层液体,并且假设包层芯层液体流速相同且无相对滑移进行计算。低流速下可以实现有效的焦距调节,高流速下可以实现焦斑大小的调节。
通过调节各个入口的流速,获得不同折射率的分布效果,从而调节焦斑以及焦距。
溶液质量分数的影响:由于溶液的浓度将直接影响扩散系数,扩散系数的变化将直接影响到微透镜的变化。在微腔中扩散对流过程中,沿着流动方向扩散的效果越来越明显。然而,这种扩散导致在不同位置的液体浓度不同,这种浓度的变化将直接反应在每个位置的扩散系数上,因此扩散系数在整个过程中并不是恒定不变的。这种现象在浓溶液中尤为突出。目前为止,该现象的变化规律还没有一个确切的表达式能够描述。因此,为了简化计算的复杂度,采用浓度不是很高的溶液,采用质量分数0.2的乙二醇溶液,在扩散对流的过程中采用恒定的扩散系数D来进行仿真。
由于本实用新型含4个包层入口,可以实现二维面上的折射率动态调节效果,可以应用于更多不同的测试需求。
图4是在四个包层通道以及芯层通道流速均为25*103pL/s的情况下得到的等效折射率分布以及图5则是通过光迹追踪法得到的聚焦示意图。
图6给出了在包层流速为40*103pL/s,调整乙二醇质量分数时折射率分布发生的变化。当增大芯层溶液质量分数时,相应的焦距随之减小,6阶拟合函数为:F(b)=9.03*106*b6-1.30*107*b5+7.65*106*b4-2.36*106*b3+416377.0*b2-42645.0*b+2342.6。其中b为溶液质量分数,F(b)即焦距。通过此性质我们可以调节流体微透镜焦距,使其在不同流速下,仍能聚焦在检测区。
图7给出了包层流速与焦斑大小的关系图,通过对不同包层流速下的仿真,我们可以获得一个5~50μm的可调谐焦斑,细胞大小一般为10~50μm,可满足大部分细胞的精确检测。由于包层流速也会影响光束焦距,在调节焦斑大小后,我们应通过调节溶液质量分数,保持焦距在200μm,聚焦于监测区域。图8给出了在不同包层流速下,聚焦于200μm所对应的溶液质量分数。这种灵活可调的光束调控效果能够在生物医学检测,尤其是流式细胞仪上有重要的应用。
- 还没有人留言评论。精彩留言会获得点赞!