蜕膜淋巴细胞亚型的检测方法、试剂盒及其应用与流程
本发明涉及一种淋巴细胞亚型的检测方法,尤其是一种通过流式细胞术检测蜕膜淋巴细胞亚型的检测方法、采用该方法的试剂盒及该试剂盒在反复自然流产的免疫学检测中的应用。
背景技术:
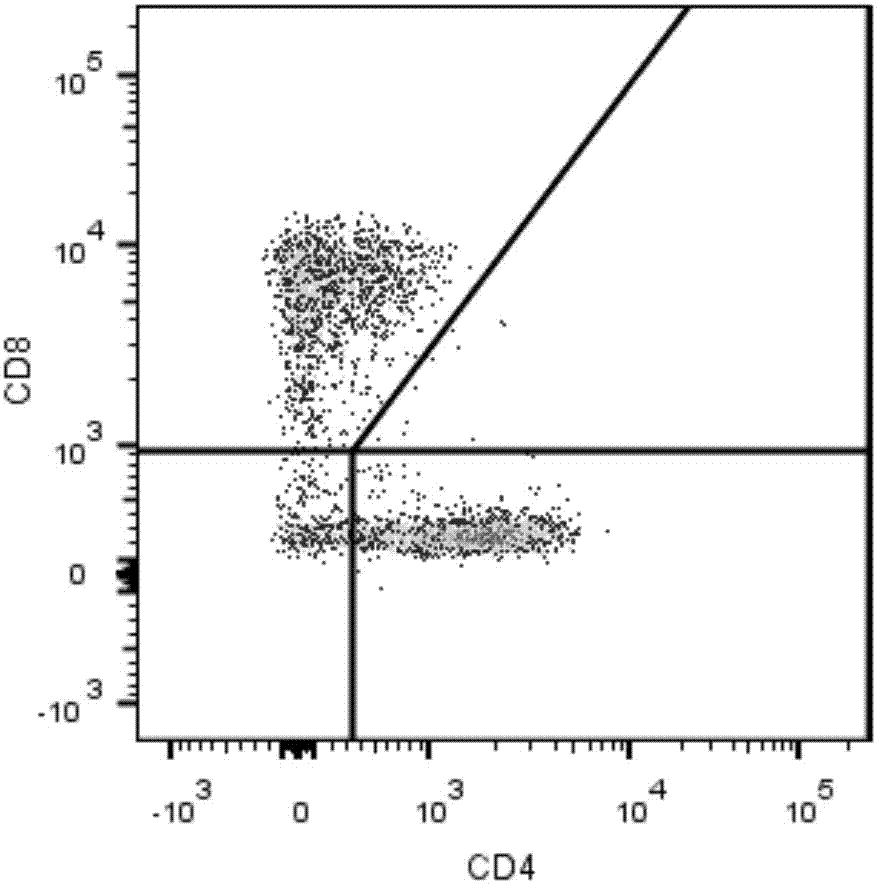
:自然流产是早期妊娠最常见的并发症。反复自然流产(recurrentmiscarriage,rm)是指两次及两次以上的自然流产,发病率占育龄妇女的1%-2%。目前rm的病因主要包括:亲代或子代染色体异常、子宫解剖结构异常、内分泌紊乱、感染以及母体自体免疫,但仍有许多不明原因反复自然流产(unknownrecurrentmiscarriage,urm)的发病原因未知。母胎之间存在免疫耐受现象,这种免疫耐受的破坏被认为是rm的病因之一。免疫治疗改善了一部分rm患者的妊娠结局,但荟萃分析显示已有的免疫治疗方案对于rm患者总体的妊娠结局没有明显的优势。因此如何阐述母胎界面的免疫耐受现象成为提高rm患者妊娠结局的前提。在母胎免疫中,t淋巴细胞亚群失衡以及nk细胞(naturalkillercell,nk)介导的免疫反应被认为是rm的可能机制。成熟的t淋巴细胞表达cd3,并可按功能分为表达cd4的th细胞亚群(thelperlymphocyte,th)和表达cd8的tc细胞亚群(cytotoxictlymphocyte,tc)。th细胞亚群可以按其分泌的细胞因子分为th1、th2功能亚群。抗原和il-12介导th1亚群分化,分化后的th1主要分泌ifn-γ和tnf-α等1型细胞因子促进细胞免疫应答。th2细胞主要分泌il-4、il-5、il-13等2型细胞因子介导体液免疫。蜕膜nk细胞(dnk细胞)也可以分泌1型和2型细胞因子,其中蜕膜nk1细胞(dnk1细胞)主要分泌ifn-γ和tnf-α等1型细胞因子,蜕膜nk2细胞(dnk2细胞)主要分泌il-4、il-5、il-13等2型细胞因子。然而,dnk细胞不表达cd3,高表达cd56,不表达cd16,可以通过这三个表型与t淋巴细胞或外周血nk细胞鉴别。th1/th2和dnk1/dnk2的构成与rm存在相关性,因此可以通过检测这些细胞的构成来反映rm母胎界面真实的免疫反应状况,从而识别免疫病因的存在并指导下一步治疗。目前主要通过流式细胞术的方法来检测rm患者蜕膜淋巴细胞亚型。普通方法多采用三色或四色抗体组合分别检测th和dnk细胞的亚型,一般采用2管4色抗体组合,如利用cd3、cd4、cd8和一个细胞因子的4色组合检测th1和th2亚型,利用cd3、cd56、cd16和一个细胞因子的4色组合检测dnk1和dnk2亚型,若要检测更多亚型,则需要更多抗体组合,因此该方法需要对同一蜕膜组织的多份淋巴细胞样品进行不同抗体组合的染色。这种方法消耗的抗体量较多,操作步骤以及工时多,反复使用多种抗体对患者进行全面的抗原分析,费用较高。同时对待检测蜕膜淋巴细胞样品的需求量较大,需要采集足够量的蜕膜组织才能完成检测,然而患者的蜕膜组织需要在无菌环境中通过手术获取,经过分离得到的淋巴细胞数量有限。这些问题给rm患者蜕膜淋巴细胞亚型检测带来许多不便。技术实现要素:本发明的目的是提供一种蜕膜淋巴细胞亚型的检测方法,其所需蜕膜淋巴细胞样品较少,且操作简单,节省抗体。本发明的另一个目的是提供一种检测蜕膜淋巴细胞亚型的试剂盒,使用其检测蜕膜淋巴细胞亚型时所需蜕膜淋巴细胞样品较少,且操作简单,节省抗体。本发明的还一个目的是提供检测蜕膜淋巴细胞亚型的试剂盒在反复自然流产的免疫学检测中的应用,使用该试剂盒检测蜕膜淋巴细胞亚型时所需蜕膜淋巴细胞样品较少,且操作简单,节省抗体。本发明提供了一种蜕膜淋巴细胞亚型的检测方法,其包括:用荧光标记的抗cd3抗体、荧光标记的抗cd4抗体、荧光标记的抗cd8抗体、荧光标记的抗cd56抗体、荧光标记的抗cd16抗体、荧光标记的抗ifn-γ抗体、荧光标记的抗il-4抗体、和fixableviabilitydye对同一份待检测蜕膜淋巴细胞样品进行荧光染色,得到染色后样品;将染色后样品经流式细胞术检测,得到检测数据;以及分析检测数据。其中,荧光标记的抗cd3抗体、荧光标记的抗cd4抗体、荧光标记的抗cd8抗体、荧光标记的抗cd56抗体、荧光标记的抗cd16抗体、荧光标记的抗ifn-γ抗体、荧光标记的抗il-4抗体、和fixableviabilitydye在流式细胞术检测时,可具有不同的发射光波长。本发明提供的蜕膜淋巴细胞亚型的检测方法,仅需对同一份蜕膜淋巴细胞样品进行针对cd3、cd4、cd8、cd56、cd16、ifn-γ和il-4的荧光染色及fixableviabilitydye染色,即可实现对蜕膜淋巴细胞多个亚型的分析,该方法所需蜕膜淋巴细胞样品较少,节省抗体,且操作简单。在蜕膜淋巴细胞亚型的检测方法的另一种示意性实施方式中,还设置对照组和同型对照组。设置对照组的意义在于排除无关变量的影响,增加实验结果的可信度和说服力;设置同型对照组的意义在于区别抗体染色过程中相同亚型所造成的背景信号影响。在蜕膜淋巴细胞亚型的检测方法的再一种示意性实施方式中,荧光标记的抗cd3抗体、荧光标记的抗cd4抗体、荧光标记的抗cd8抗体、荧光标记的抗cd56抗体、荧光标记的抗cd16抗体、荧光标记的抗ifn-γ抗体、和荧光标记的抗il-4抗体的荧光标记依次为percp、apc、fitc、pe-vio770、vioblue、apc-vio770和pe;fixableviabilitydye为fixableviabilitydyeefluor506。在蜕膜淋巴细胞亚型的检测方法的又一种示意性实施方式中,荧光染色的步骤包括:将待检测蜕膜淋巴细胞样品与荧光标记的抗cd3抗体、荧光标记的抗cd4抗体、荧光标记的抗cd8抗体、荧光标记的抗cd56抗体、荧光标记的抗cd16抗体、和fixableviabilitydye共孵育,得到中间样a;对中间样a进行细胞固定和透膜处理,得到中间样b;以及将中间样b与荧光标记的抗ifn-γ抗体和荧光标记的抗il-4抗体共孵育,得到染色后样品。藉此可有效地对胞内及胞外细胞标志物进行荧光标记。在蜕膜淋巴细胞亚型的检测方法的又一种示意性实施方式中,分析的方法包括:细胞标志cd3-cd56++cd16-ifn-γ+il-4-代表蜕膜nk1细胞亚群,细胞标志cd3-cd56++cd16-ifn-γ-il-4+代表蜕膜nk2细胞亚群,细胞标志cd3+cd56-cd4+cd8-ifn-γ+il-4-代表th1细胞亚群,细胞标志cd3+cd56-cd4+cd8-ifn-γ-il-4+代表th2细胞亚群,细胞标志cd3+cd56-cd4-cd8+ifn-γ+il-4-代表tc1细胞亚群,细胞标志cd3+cd56-cd4-cd8+ifn-γ-il-4+代表tc2细胞亚群,细胞标志cd3+cd56+ifn-γ+il-4-代表nkt1-like细胞亚群,细胞标志cd3+cd56+ifn-γ-il-4+代表nkt2-like细胞亚群。在蜕膜淋巴细胞亚型的检测方法的又一种示意性实施方式中,分析的方法包括:a.建立fsc/fixableviabilitydye密度图,将在伪彩图显示模式下最靠近右下方的细胞群落设门标记为p1;b.对p1内细胞依次通过ssc-h/ssc-w和fsc-h/fsc-w设门去除粘连体;c.对去除粘连体后的细胞群以cd3/cd56十字门设门;d.对cd3-cd56+细胞群以cd56/cd16设门,对cd56++cd16-细胞群经椭圆门设门,所得细胞群为蜕膜nk细胞亚群;e.对cd3+cd56-细胞群以cd4/cd8十字门设门,所得cd4+cd8-细胞群为th细胞亚群,所得cd4-cd8+细胞群为tc细胞亚群;cd3+cd56+细胞群为nkt-like细胞亚群;以及f.对th细胞亚群、tc细胞亚群、蜕膜nk细胞亚群和nkt-like细胞亚群分别以ifn-γ/il-4十字门设门,所得ifn-γ+il-4-细胞群为相应的1型亚群,所得ifn-γ-il-4+细胞群为相应的2型亚群。藉此可提高蜕膜淋巴细胞亚型检测的准确性。本发明还提供了一种采用上述蜕膜淋巴细胞亚型的检测方法检测蜕膜淋巴细胞亚型的试剂盒,其包括:荧光标记的抗cd3抗体、荧光标记的抗cd4抗体、荧光标记的抗cd8抗体、荧光标记的抗cd56抗体、荧光标记的抗cd16抗体、荧光标记的抗ifn-γ抗体、荧光标记的抗il-4抗体、和fixableviabilitydye。其中,荧光标记的抗cd3抗体、荧光标记的抗cd4抗体、荧光标记的抗cd8抗体、荧光标记的抗cd56抗体、荧光标记的抗cd16抗体、荧光标记的抗ifn-γ抗体、荧光标记的抗il-4抗体、和fixableviabilitydye在流式细胞术检测时,可具有不同的发射光波长。使用该试剂盒检测蜕膜淋巴细胞亚型时所需蜕膜淋巴细胞样品较少,且操作简单,节省抗体。在检测蜕膜淋巴细胞亚型的试剂盒的另一种示意性实施方式中,荧光标记的抗cd3抗体、荧光标记的抗cd4抗体、荧光标记的抗cd8抗体、荧光标记的抗cd56抗体、荧光标记的抗cd16抗体、荧光标记的抗ifn-γ抗体、和荧光标记的抗il-4抗体的荧光标记依次为percp、apc、fitc、pe-vio770、vioblue、apc-vio770和pe。在检测蜕膜淋巴细胞亚型的试剂盒的另一种示意性实施方式中,fixableviabilitydye为fixableviabilitydyeefluor506。在检测蜕膜淋巴细胞亚型的试剂盒的另一种示意性实施方式中,试剂盒还包括用于细胞固定和透膜的试剂。本发明还提供了上述的检测蜕膜淋巴细胞亚型的试剂盒在反复自然流产的免疫学检测中的应用,其包括:使用试剂盒检测健康人群及反复自然流产患者的蜕膜淋巴细胞亚型,得到检测结果;比较检测结果中健康人群及该反复自然流产患者的蜕膜淋巴细胞亚型中的细胞亚群的细胞比例;以及若该反复自然流产患者与健康人群的细胞比例存在差异,则判断该反复自然流产患者存在由免疫导致流产的风险。将该试剂盒应用于反复自然流产的免疫学检测时,所需蜕膜淋巴细胞样品较少,且操作简单,节省抗体。在检测蜕膜淋巴细胞亚型的试剂盒在反复自然流产的免疫学检测中的应用的另一种示意性实施方式中,包括:使用试剂盒检测健康人群及反复自然流产患者的蜕膜淋巴细胞亚型,得到检测结果;比较检测结果中健康人群及该反复自然流产患者的蜕膜淋巴细胞亚型中的细胞亚群的细胞比例,细胞亚群为th1细胞亚群、tc1细胞亚群、蜕膜nk1细胞亚群和/或nkt1-like细胞亚群;以及若该反复自然流产患者的细胞亚群的细胞比例高于健康人群的细胞亚群的平均细胞比例,则判断该反复自然流产患者存在由免疫导致流产的风险。藉此提高反复自然流产的免疫学检测在由免疫导致流产的风险评估中的准确性。在本发明中,流式细胞术中所用到的抗体可以为与待测样品同源的抗体或也可以为与待测样品非同源的抗体,只要该抗体能够与待测样品中细胞标志物产生抗原-抗体特异性结合反应即可。在本发明中,“+”代表阳性,即表示该抗原在细胞有表达;“++”代表强阳性,即表示该抗原在细胞高表达;“-”代表阴性,即表示该抗原在细胞不表达。在本发明中,各个荧光标记的抗体中的荧光标记物不受本发明的限制,本领域技术人员可以根据实际情况选择合适的荧光标记物,以及对应的同型对照。在本发明中,本发明提供的检测蜕膜淋巴细胞亚型的试剂盒中,荧光标记的抗体,可以是荧光标记物与抗体单独放置,在使用时将两者偶联获得荧光标记的抗体;也可以是荧光标记的抗体,在使用时,直接使用即可。附图说明以下附图仅对本发明做示意性说明和解释,并不限定本发明的范围。图1显示了fsc/viability密度图的中央型设门。图2显示了fsc/viability密度图的扩大型设门。图3显示了ssc-h/ssc-w密度图设门去除粘连体。图4显示了fsc-h/fsc-w密度图设门去除粘连体。图5显示了cd3/cd56十字门设门。图6显示了cd56/cd16椭圆门设门。图7显示了cd4/cd8十字门设门。图8显示了fsc/ssc密度图的中央型设门。图9显示了fsc/ssc密度图的扩大型设门。图10显示了viability直方图。图11显示了通过不同设门策略进行流式数据分析的流程图。图12显示了通过不同设门策略进行流式数据分析的各细胞标志的荧光强度分布直方图。具体实施方式为了对发明的技术特征、目的和效果有更加清楚的理解,现结合以下实施例说明本发明的具体实施方式。本发明提供的一种蜕膜淋巴细胞亚型的检测方法和检测蜕膜淋巴细胞亚型的试剂盒中所用到的试剂和原料均可由市场购得。本发明中用到的荧光标记percp、apc、fitc、pe-vio770、vioblue、apc-vio770和pe均为常见的荧光标记,可以由市场购得,各个荧光标记的抗体也可以由市场购得。本发明中用到的fixableviabilitydye可由市场购得。第一实施例。一、蜕膜淋巴细胞样品的制备1、蜕膜单个核细胞(dmc)分离1.1、组织块大小约2×1×1cm大小数枚,用刀片将其切割成1×1×1mm大小的块,放入组织研磨器中加入1ml培养液,转动研棒,研至匀浆,5ml培养液冲洗研磨器2次,过细胞滤网,过滤后入10ml离心管,450g离心5min;1.2、用2ml培养液重悬细胞团,铺在2ml的密度梯度分离液上,2000rpm不间断离心15min;1.3、小心吸取界面处的细胞入1ml离心管,2000rpm离心10min,吸除上清液,0.5ml培养液重悬细胞,需充分弹打离心管底部。其中,细胞量不足时可以将研磨后的剩余组织用1mg/ml胶原蛋白酶37℃消化1h后再次分离细胞,可使最终获得的细胞总量加倍。是否增加酶消化步骤得到的细胞对方法结果无影响,仅是细胞数量上的差别。2、细胞计数2.1、70%酒精洗涤细胞计数板与载玻片,完全干燥后将盖玻片盖在计数仓上,轻压盖玻片使之吸附;2.2、吸管吸取0.1ml细胞悬液与0.3ml台盘蓝染液在1ml离心管中混匀,吸取10μl混合液滴在盖玻片的边缘;2.3、待混合液充分吸入计数仓后,在倒置显微镜下计数4个大格的活细胞总数,细胞悬液浓度(/ml)=4个大格活细胞总数×104,细胞活力应>90%;2.4、计算培养液用量,重悬细胞悬液至浓度2×106/ml;2.5、以上操作5min内完成,细胞悬液4℃冷藏。(如计数后标本量充足,分装细胞悬液并冻存)。3、预刺激3.1、解冻活化剂工作液(购自bd,货号550583),培养板孔内加入dmc细胞悬液,0.5ml/孔(浓度2×106/ml),每孔加入分装好的解冻后的活化剂工作液0.5ml,混匀,37℃5%co2培养箱培养6小时;3.2、细胞悬液移入1ml离心管中,300g离心10min,1ml流式缓冲液洗涤1遍,300g离心10min,0.5ml流式缓冲液重悬细胞;3.3、细胞计数,方法同上,pbs重悬细胞悬液至浓度2×106/ml,得到活化的细胞悬液。二、蜕膜淋巴细胞样品的蜕膜淋巴细胞亚型检测1、检测蜕膜淋巴细胞亚型的试剂盒:试剂厂家货号cd8-fitc(fitc标记的抗cd8抗体)miltenyi130-080-601cd56-pe-vio770(pe-vio770标记的抗cd56抗体)miltenyi130-100-676cd16-vioblue(vioblue标记的抗cd16抗体)miltenyi130-099-080cd4-apc(apc标记的抗cd4抗体)miltenyi130-091-232cd3-percp(percp标记的抗cd3抗体)miltenyi130-094-965ifn-γ-apc-vio770(apc-vio770标记的抗ifn-γ抗体)miltenyi130-096-625il-4-pe(pe标记的抗il-4抗体)miltenyi130-091-647fixableviabilitydyeefluor506ebioscience65-0866-14固定和透膜试剂ebioscience88-8824pbs缓冲液//2、操作步骤2.1、荧光染色:a、表面标记:从离心管中取100μl活化的细胞悬液至流式上样管中,取percp标记的抗cd3抗体、apc标记的抗cd4抗体、fitc标记的抗cd8抗体、pe-vio770标记的抗cd56抗体、vioblue标记的抗cd16抗体和fixableviabilitydyeefluor506各5μl混匀后加入上样管中,振荡器混匀,2-8℃避光孵育15min,得到中间样a;b、固定和透膜:向中间样a中加入500μl固定和透膜试剂,室温避光孵育20min,充分弹匀离心管,得到中间样b;c、胞内标记:向中间样b中加入apc-vio770标记的抗ifn-γ抗体和pe标记的抗il-4抗体各5μl,振荡器混匀1-2s,室温避光培育15min;(如标记同型对照,取同型对照5μl,同法标记);加入2mlpbs缓冲液终止孵育,800-850g离心5min,吸除上清液,注意保护细胞团,再加入300μlpbs缓冲液充分弹匀,得到染色后样品。其中,染色后样品如不能当日上机检测,加入0.5ml1%多聚甲醛pbs重悬固定,4℃避光过夜,可次日上机检测。2.2、流式细胞术检测使用bdfacscantoplus流式细胞仪对染色后样品进行检测,得到检测数据。仪器性能在每次检测前都进行检查。光电倍增管(pmt)电压的设定采用未标记的细胞标本,并在整个研究中保持固定。荧光补偿通过单标微球调整然后通过单标细胞标本调整。每次上样收集150000个细胞。各荧光标记的激发光波长和发射光波长如下所示:percp:激发光波长482nm/发射光波长675nm;apc:激发光波长652nm/发射光波长660nm;fitc:激发光波长495nm/发射光波长520nm;pe-vio770:激发光波长565nm/发射光波长775nm;vioblue:激发光波长400nm/发射光波长452nm;apc-vio770:激发光波长650nm/发射光波长774nm;pe:激发光波长565nm/发射光波长578nm;fixableviabilitydyeefluor506nm:激发光波长415/发射光波长506nm。2.3、分析检测数据所有流式数据使用flowjo10.0软件进行分析,其中:细胞标志cd3-cd56++cd16-ifn-γ+il-4-代表蜕膜nk1细胞亚群,细胞标志cd3-cd56++cd16-ifn-γ-il-4+代表蜕膜nk2细胞亚群,细胞标志cd3+cd56-cd4+cd8-ifn-γ+il-4-代表th1细胞亚群,细胞标志cd3+cd56-cd4+cd8-ifn-γ-il-4+代表th2细胞亚群,细胞标志cd3+cd56-cd4-cd8+ifn-γ+il-4-代表tc1细胞亚群,细胞标志cd3+cd56-cd4-cd8+ifn-γ-il-4+代表tc2细胞亚群,细胞标志cd3+cd56+ifn-γ+il-4-代表nkt1-like细胞亚群,细胞标志cd3+cd56+ifn-γ-il-4+代表nkt2-like细胞亚群。分析方法一(以下简称fsc/vt设门方法):a.建立fsc/viability(fixableviabilitydyeefluor506)密度图,采用中央型(参见图1)或扩大型(参见图2)的设门范围在伪彩图显示模式下将最靠近右下方的细胞群落(即fixableviabilitydye染色较低的细胞中fsc较高的细胞群落)设门标记为p1;b.对p1内细胞依次通过ssc-h/ssc-w(参见图3)和fsc-h/fsc-w(参见图4)设门去除粘连体;c.对去除粘连体后的细胞群以cd3/cd56十字门设门(参见图5);d.对cd3-cd56+细胞群以cd56/cd16设门,对cd56++cd16-细胞群经椭圆门设门(参见图6),所得细胞群为蜕膜nk细胞亚群;e.对cd3+cd56-细胞群以cd4/cd8十字门设门(参见图7),所得cd4+cd8-细胞群为th细胞亚群,所得cd4-cd8+细胞群为tc细胞亚群;cd3+cd56+细胞群为nkt-like细胞亚群;f.对th细胞亚群、tc细胞亚群、蜕膜nk细胞亚群和nkt-like细胞亚群分别以ifn-γ/il-4十字门设门,所得ifn-γ+il-4-细胞群为相应的1型亚群(即th1、tc1、dnk1和nkt1-like),所得ifn-γ-il-4+细胞群为相应的2型亚群(即th2、tc2、dnk2和nkt2-like)。分析方法二(以下简称fsc/ssc设门方法):a.建立fsc/ssc密度图,采用中央型(参见图8)或扩大型(参见图9)的设门范围将有核细胞区域设门标记为p1;b.对p1内细胞依次通过ssc-h/ssc-w和fsc-h/fsc-w设门去除粘连体;c.对去除粘连体后的细胞群以viability(fixableviabilitydyeefluor506)直方图设门去除死细胞(参见图10);然后以cd3/cd56十字门设门;d.对cd3-cd56+细胞群以cd56/cd16设门,对cd56++cd16-细胞群经椭圆门设门,所得细胞群为蜕膜nk细胞亚群;e.对cd3+cd56-细胞群以cd4/cd8十字门设门,所得cd4+cd8-细胞群为th细胞亚群,所得cd4-cd8+细胞群为tc细胞亚群;cd3+cd56+细胞群为nkt-like细胞亚群;f.对th细胞亚群、tc细胞亚群、蜕膜nk细胞亚群和nkt-like细胞亚群分别以ifn-γ/il-4十字门设门,所得ifn-γ+il-4-细胞群为相应的1型亚群(即th1、tc1、dnk1和nkt1-like),所得ifn-γ-il-4+细胞群为相应的2型亚群(即th2、tc2、dnk2和nkt2-like)。其中,上述的中央型设门策略的设门范围以伪彩图中最亮部分为标准,扩大型设门策略的设门范围包括了中央门的周围散点,如果伪彩图中中央门周围散点分界不清楚,可在轮廓图显示模式下以最外一条轮廓线为扩大门的设门标准。图11为通过不同设门策略进行流式数据分析的流程图,其中a为fsc/ssc中央型设门策略,b为fsc/vt中央型设门策略,c为fsc/ssc扩大型设门策略,d为fsc/vt扩大型设门策略。该蜕膜淋巴细胞亚型的检测方法,仅需对同一份待检测蜕膜淋巴细胞样品进行针对cd3、cd4、cd8、cd56、cd16、ifn-γ和il-4的荧光染色及fixableviabilitydye染色,即可实现对蜕膜淋巴细胞多个亚型的分析,该方法所需蜕膜淋巴细胞样品较少,节省抗体,且操作简单。下表1是分别用四色流式细胞术和第一实施例的方法检测dnk、nkt-like、t、dnk2、dnk1、tc、th、tc2、tc1、th2、th1、nkt2-like和nkt1-like时,对细胞和抗体的消耗情况及耗时。表1:两种检测方法的比较第二实施例采用第一实施例所述的方法,对收集的31例样本进行蜕膜淋巴细胞亚型检测,样本来自2016年8月-2017年2月在首都医科大学附属北京妇产医院收治的10例urm患者,平均年龄31.6±2.5岁,以及21例同时期行主动人流术的健康女性,平均年龄29.6±2.8岁。不同设门策略检测出的健康女性和urm患者蜕膜淋巴细胞亚型的细胞比例分别见下表2和表3。通过细胞比例可以反映相应的细胞数量。表2:健康女性蜕膜淋巴细胞亚型的细胞比例表3:urm患者蜕膜淋巴细胞亚型的细胞比例对表2和表3中的数据进行2×2析因设计方差分析,结果显示:不论是健康女性或者urm患者,设门方法(fsc/vt设门方法或fsc/ssc设门方法)对dnk、nkt-like、tc、th、th1的细胞数量没有影响,而对th2、dnk2、dnk1、nkt1-like的细胞数量有影响。此外,结果还显示:设门方法对tc1/tc2和dnk1/dnk2比值的影响具有统计学意义,采用fsc/vt设门方法得到的结果均高于采用fsc/ssc设门方法得到的结果。可以看出,在蜕膜淋巴细胞的多色流式细胞术数据分析过程中,设门方法可以影响1型、2型细胞亚群的分析数值。从各细胞标志的荧光强度分布直方图也可以反映出不同设门方法对细胞数量的影响(参见图12)其中,r2为上述fsc/ssc设门方法,r3为上述fsc/vt设门方法,r1为参照外周血淋巴细胞群落的位置的设门方法(即淋巴细胞的fsc/ssc常规设门方法)。图中分别显示了cd3、cd56、cd4、cd8、ifn-γ和il-4的荧光强度-细胞数量关系,可以看出fsc/vt设门方法对于在fsc/ssc设门方法中不能很好显示出分群的样本非常适用。此外,从图中还可以看出按照淋巴细胞的fsc/ssc常规设门位置(r1)不能很好地识别淋巴细胞群落,将该设门调整至细胞比较密集的位置(r2)效果稍好一些,但fsc/vt的细胞群落位置识别起来更加清晰,获得的细胞数量也比调整后的r2更多,说明针对蜕膜淋巴细胞fsc/vt是更合适的初始设门方法。在流式细胞术检测过程中,可通过目标细胞分群是否清楚、目标细胞荧光强度等表示准确性的高低;目标细胞分群清楚、目标细胞荧光强度高,则表示准确性高。可见,在本发明中,相较于fsc/ssc设门方法,fsc/vt设门方法能够提高蜕膜淋巴细胞亚型检测的准确性。根据表2及表3中的分析结果,发现urm患者相较于健康女性存在明显增加的1型细胞,包括th1、tc1、dnk1和nkt1-like细胞,差异具有统计学意义。该结果证明本发明在应用于健康人群或反复自然流产患者的蜕膜淋巴细胞分型是可靠的。第三实施例:检测蜕膜淋巴细胞亚型的试剂盒在反复自然流产的免疫学检测中的应用。方法:a、使用第一实施例中所述的检测蜕膜淋巴细胞亚型的试剂盒,并根据第一实施例中所述的方法检测健康人群及反复自然流产患者的蜕膜淋巴细胞亚型,得到检测结果;b、比较该检测结果中健康人群及该反复自然流产患者的蜕膜淋巴细胞亚型中的th1细胞亚群、tc1细胞亚群、dnk1细胞亚群和/或nkt1-like细胞亚群的细胞比例;以及c、若该反复自然流产患者的th1细胞亚群、tc1细胞亚群、dnk1细胞亚群和/或nkt1-like细胞亚群的细胞比例高于健康人群的细胞亚群的平均细胞比例,则判断该反复自然流产患者存在由免疫导致流产的风险。该应用所需蜕膜淋巴细胞样品较少,且操作简单,节省抗体。发明人发现反复自然流产患者相较于健康女性存在明显增加的1型细胞,包括th1、tc1、dnk1和nkt1-like细胞,差异具有统计学意义。因此通过比较健康人群及反复自然流产患者的蜕膜淋巴细胞亚型中的th1细胞亚群、tc1细胞亚群、dnk1细胞亚群和/或nkt1-like细胞亚群的细胞比例,可使反复自然流产的免疫学检测应用于由免疫导致流产的风险评估时具有较高的准确性。在本文中,“示意性”表示“充当实例、例子或说明”,不应将在本文中被描述为“示意性”的任何实施方式解释为一种更优选的或更具优点的技术方案。在本文中,“相等”、“相同”等并非严格的数学和/或几何学意义上的限制,还包含本领域技术人员可以理解的且生产或使用等允许的误差。除非另有说明,本文中的数值范围不仅包括其两个端点内的整个范围,也包括含于其中的若干子范围。应当理解,虽然本说明书是按照各个实施例描述的,但并非每个实施例仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。上文所列出的一系列的详细说明仅仅是针对本发明的可行性实施例的具体说明,它们并非用以限制本发明的保护范围,凡未脱离本发明技艺精神所作的等效实施方案或变更,如特征的组合、分割或重复,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1