用壳聚糖功能化的金纳米修饰玻碳电极检测酪氨酸的方法与流程
本发明涉及酪氨酸浓度检测领域。更具体地说,本发明涉及一种用壳聚糖功能化的金纳米修饰玻碳电极检测酪氨酸的方法。
背景技术:
酪氨酸(tyrosine,tyr)属于芳香族氧基酸,在体内可由苯丙氨酸经化而来,是人体重要的半必需氨基酸。酪氨酸的代谢斎乱可导致多种遗传性疾病的发生,如酪氨酸血症、尿黑酸症等,而且与肝肾疾病、神经系统变性性疾病、恶性肿瘤等有一定的相关性。酪氨酸是人体不可缺少的一种氨基酸,它是合成神经递质儿茶酚胺的前体,缺乏酪氨酸人体就会出现生长异常,智能低下等现象,因此国内外已普遍开始重视食品中酪氨酸含量的添加。研究发现,酪氨酸及其代谢产物的含量在健康人和遗传性疾病、肝肾疾病以及恶性肿瘤等疾病患者体液中有明显差异。因此,探索酪氨酸及其代谢产物含量的分析新技术并应用于实际样品测定,对某些疾病的诊断、治疗和监测具有十分重要的临床意义。测定酪氨酸的方法主要有氨基酸自动分析仪、分光光度法、高效液相色谱法、质谱法、核磁共振波谱法和毛细管电泳法等,这些技术虽然应用比较广泛,但使用的仪器昂贵、前处理复杂、费时、试剂消耗量大且分析时间较长,混合样品检测不灵敏的缺陷,检测限高不能满足现场快速检测的需求。
金纳米材料具有比表面积大、光学性能优异、生物兼容性良好、导电性强等特性,能有效提高电子传输速率。金纳米棒(aunrs)作为一种一维金纳米材料,由于其长径、短径、长径比及分布范围可调,使它具有了不同于普通金纳米粒子的光学和电化学性质。通过调节金纳米棒的长径比来调控aunrs的局域表面等离子共振吸收峰,可实现从可见光区调节到近红外区,不但提高对周围的介电常数的敏感度,同时也在生物传感领域的信号放大效果增强。这些优越的电学性质使金纳米棒广泛应用于生化分析检测领域,发挥了巨大的应用潜力。
而壳聚糖(cs)是甲壳素脱去部分乙酰基后的产物,是一种重要的天然高分子材料。利用壳聚糖分子中氨基易于质子化的特性,制备复合膜材料。
技术实现要素:
本发明的一个目的是解决至少上述问题,并提供至少后面将说明的优点。
本发明还有一个目的是提供一种操作简单、检测快速且灵敏度高,能进行混合样品溶液中酪氨酸的高灵敏识别。
为了实现根据本发明的这些目的和其它优点,提供了一种用壳聚糖功能化的金纳米修饰玻碳电极检测酪氨酸的方法,包括以下步骤:
步骤一、制备壳聚糖功能化的金纳米修饰玻碳电极:
a、将十六烷基三甲基溴化铵与去离子水混合搅拌均匀,再加入氯金酸溶液搅拌,加入nabh4冰水溶液搅拌,静置后得晶种溶液备用;
b、将十六烷基三甲基溴化铵、油酸钠和水混合搅拌均匀,冷却后加入agno3溶液搅拌,加入氯金酸溶液搅拌,直至溶液由亮黄色变为澄清为止,然后加入浓hcl溶液搅拌,加入抗坏血酸溶液搅拌,以及加入晶种溶液搅拌,放置8~12h后得混合液a备用;
c、将混合液a与质量分数为0.5%wt的壳聚糖溶液按体积比为1:1混合,超声处理后,离心处理取沉淀,以5~8mg:1ml的质量体积比将沉淀分散于水中并超声处理后得微溶液,取该微溶液滴定于玻碳电极表面,晾干即得壳聚糖功能化的金纳米修饰玻碳电极;
步骤二、以步骤一制备的壳聚糖功能化的金纳米修饰玻碳电极作为工作电极,根据酪氨酸的差分脉冲伏安曲线,使用三电极体系差分脉冲伏安法对待测溶液中的酪氨酸的浓度进行检测。
优选的是,步骤一中,a具体为:将十六烷基三甲基溴化铵与去离子水混合,并在30~35℃水浴下搅拌10~20min,然后加入0.01mol/l的氯金酸溶液并搅拌5~10min后,加入质量体积分数为0.455g/l的nabh4冰水溶液,继续搅拌2~5min后静置30min以上即得晶种溶液,其中,十六烷基三甲基溴化铵、去离子水、氯金酸溶液和nabh4冰水溶液的质量体积比为0.7~0.75g:18~20ml:0.5~0.8ml:0.8~1.2ml;
b具体为:将十六烷基三甲基溴化铵、油酸钠和水混合搅拌25~35min,并冷却至25℃以下后,在30~35℃水浴条件下,加入5mmol/l的agno3溶液并搅拌4~6min,然后静置10~20min后,加入0.01mol/l的氯金酸溶液,搅拌直至溶液由亮黄色变为澄清后,加入质量分数为37.5%的浓hcl溶液,继续搅拌15~25min,然后加入0.1mmol/l的抗坏血酸溶液并搅拌1~3min,再加入晶种溶液,继续搅拌1~3min后放置8~12h,即得混合液a;
其中,十六烷基三甲基溴化铵、油酸钠、水、agno3溶液、氯金酸溶液、浓hcl溶液、抗坏血酸溶液、步骤s1制备的晶种溶液的质量体积比为7~7.5g:1.23~1.27g:475~485ml:14~15ml:23~26ml:1.2~1.8ml:0.6~1ml:0.3~0.5ml;
c具体为:将混合液a与质量分数为0.5wt%的壳聚糖溶液按体积比为1:1混合,超声处理混匀,超声频率为100khz,超声时间为5~15min,然后在转速为5000rpm下离心10~15min,离心2~3次,取沉淀,以5~8mg:1ml的质量体积比将沉淀分散于水中并超声处理,超声频率为100khz,超声时间为5~15min,得微溶液,取5~8ml该微溶液滴定于玻碳电极表面,晾干即得壳聚糖功能化的金纳米修饰玻碳电极。
优选的是,步骤二中酪氨酸的差分脉冲伏安曲线的获得具体为:采用所述工作电极搭建三电极体系,利用差分脉冲伏安法,分别测量并记录多份含有不同浓度的酪氨酸的pbs缓冲溶液的差分脉冲伏安曲线,在此过程中记录每份含酪氨酸的pbs缓冲溶液的电流强度峰值;
其中,以上述步骤得到的每份含酪氨酸的pbs缓冲溶液的电流强度峰值与不含酪氨酸的pbs缓冲溶液的电流强度峰值的差值作为纵坐标,以每份酪氨酸的浓度为横坐标,绘制标准曲线并计算线性方程。
优选的是,使用三电极体系通过差分脉冲伏安法对待测溶液中的酪氨酸的浓度进行检测的具体方式为:按照步骤z2测量并记录待检测溶液的差分脉冲伏安曲线,并将该差分脉冲伏安曲线的电流强度峰值与不含酪氨酸的pbs缓冲溶液的电流强度峰值的差值代入到所述线性方程中,即可得到待检测溶液中酪氨酸的浓度。
优选的是,步骤z1中配制的多份含有不同浓度的酪氨酸的pbs缓冲溶液,pbs缓冲溶液的ph均为7.4,其浓度均为0.1mol/l,酪氨酸浓度依次为5.0×10-6mol/l、1×10-5mol/l、1.5×10-5mol/l、2×10-5mol/l、3×10-5mol/l、4×10-5mol/l。
优选的是,所述玻碳电极经过预处理,具体为:
t1、将玻碳电极先用质量分数为5%的葡萄糖溶液浸泡20~30min,再用质量分数为8%的氨水浸泡20~30min,再依次用质量分数为95%的乙醇水溶液、二次蒸馏水分别超声清洗5~10min;
t2、依次用粒径为0.3μm、0.05μm的氧化铝粉末打磨玻碳电极,再依次用质量分数为1%的nacl水溶液、体积比为1:1的hno3水溶液、质量分数为95%的乙醇水溶液、二次蒸馏水分别超声清洗5~10min;
t3、将玻碳电极置于浓度为0.1mol/l,ph为7.4、浓度为0.1mol/l的pbs缓冲溶液中作为工作电极,以铂丝电极为对电极,以ag/agcl电极为参比电极,进行差分脉冲伏安扫描,如果玻碳电极的差分脉冲伏安曲线不平滑,则重复t2的步骤,直至玻碳电极的差分脉冲伏安曲线平滑;
t4、用质量分数为95%的乙醇水溶液、二次蒸馏水分别超声清洗玻碳电极5~10min,最后用氮气吹干备用。
优选的是,还包括对壳聚糖进行预处理,具体为:将壳聚糖和cuso4置于去离子水中并在45~55℃下进行超声处理,超声频率为400khz,超声时间为10~15min,再用红外烘干去除去离子水得到沉淀,其中,壳聚糖和cuso4质量比为1:0.05~0.1。
本发明至少包括以下有益效果:
第一、本发明制备的壳聚糖功能化的金纳米修饰玻碳电极具有电子传递速率快、稳定性好、制备简单、操作方便的优点,采用本发明制备的壳聚糖功能化的金纳米修饰玻碳电极进行酪氨酸的检测,检测过程简单方便、灵敏度高、检测限低,可实现实际样品中酪氨酸的快速检测;
第二、从差分脉冲伏安曲线中可得知待检测溶液对应的电流强度随酪氨酸的浓度的增加而增强,且电流强度与酪氨酸浓度有良好的线性关系,因此,壳聚糖功能化的金纳米修饰玻碳电极可以作为检测酪氨酸的电极,快速并定量检测溶液中酪氨酸的含量,对酪氨酸的检测限可达到5×10-7mol/l;
第三、壳聚糖经cuso4处理后,可以大大提高电极的电化学信号强度,使电子定向传输,消除了其它电子干扰因素,大大提升了灵敏度,检测限可达5×10-8mol/l;
第四、玻碳电极进行壳聚糖功能化修饰前,预先用质量分数为5%的葡萄糖溶液浸泡20~30min,再用质量分数为8%的氨水浸泡20~30min等,预处理方法简单,且得到的壳聚糖功能化的金纳米修饰玻碳电极稳定性更佳、重现性能高,多次测试同一酪氨酸浓度的电流强度峰值偏差极微小。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
图1为本发明的差分脉冲伏安曲线图;
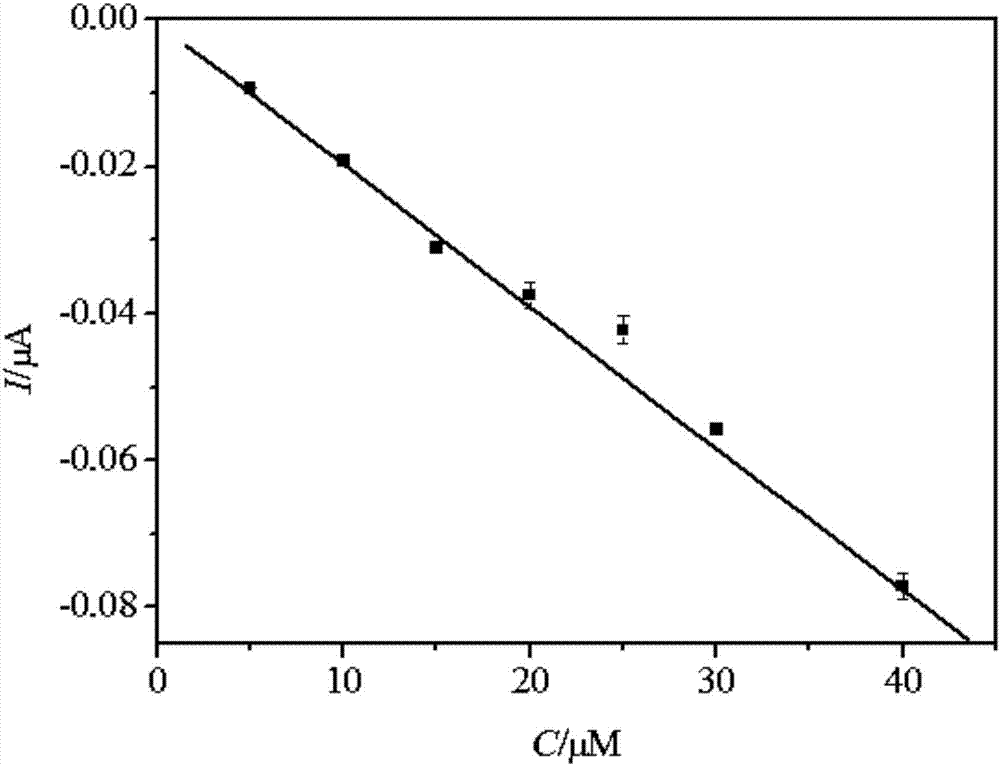
图2为本发明酪氨酸的标准曲线图。
具体实施方式
下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
<实施例1>
一种壳聚糖功能化的金纳米修饰玻碳电极,制备方法包括以下步骤:
a、将十六烷基三甲基溴化铵与去离子水混合,并在30℃水浴下搅拌10min,然后加入0.01mol/l的氯金酸溶液并搅拌5min后,加入质量体积分数为0.455g/l的nabh4冰水溶液,继续搅拌2min后静置30min即得晶种溶液,其中,十六烷基三甲基溴化铵、去离子水、氯金酸溶液和nabh4冰水溶液的质量体积比为0.7g:18ml:0.5ml:0.8ml;
b、将十六烷基三甲基溴化铵、油酸钠和水混合搅拌25min,并冷却至25℃后,在30℃水浴条件下,加入5mmol/l的agno3溶液并搅拌4min,然后静置10min后,加入0.01mol/l的氯金酸溶液,搅拌直至溶液由亮黄色变为澄清后,加入质量分数为37.5%的浓hcl溶液,继续搅拌15min,然后加入0.1mmol/l的抗坏血酸溶液并搅拌1min,再加入晶种溶液,继续搅拌1min后放置8h,即得混合液a;
其中,十六烷基三甲基溴化铵、油酸钠、水、agno3溶液、氯金酸溶液、浓hcl溶液、抗坏血酸溶液、步骤s1制备的晶种溶液的质量体积比为7g:1.23g:475ml:14ml:23ml:1.2ml:0.6ml:0.3ml;
c、将混合液a与质量分数为0.5wt%的壳聚糖溶液按体积比为1:1混合,超声处理混匀,超声频率为100khz,超声时间为5min,然后在转速为5000rpm下离心10min,离心2次,取沉淀,以5mg:1ml的质量体积比将沉淀分散于水中并超声处理,超声频率为100khz,超声时间为5min,得微溶液,取5ml该微溶液滴定于玻碳电极表面,晾干即得壳聚糖功能化的金纳米修饰玻碳电极。
<实施例2>
一种壳聚糖功能化的金纳米修饰玻碳电极,制备方法包括以下步骤:
a、将十六烷基三甲基溴化铵与去离子水混合,并在35℃水浴下搅拌20min,然后加入0.01mol/l的氯金酸溶液并搅拌10min后,加入质量体积分数为0.455g/l的nabh4冰水溶液,继续搅拌5min后静置60min即得晶种溶液,其中,十六烷基三甲基溴化铵、去离子水、氯金酸溶液和nabh4冰水溶液的质量体积比为0.75g:20ml:0.8ml:1.2ml;
b、将十六烷基三甲基溴化铵、油酸钠和水混合搅拌35min,并冷却至20℃后,在35℃水浴条件下,加入5mmol/l的agno3溶液并搅拌6min,然后静置20min后,加入0.01mol/l的氯金酸溶液,搅拌直至溶液由亮黄色变为澄清后,加入质量分数为37.5%的浓hcl溶液,继续搅拌25min,然后加入0.1mmol/l的抗坏血酸溶液并搅拌3min,再加入晶种溶液,继续搅拌3min后放置12h,即得混合液a;
其中,十六烷基三甲基溴化铵、油酸钠、水、agno3溶液、氯金酸溶液、浓hcl溶液、抗坏血酸溶液、步骤s1制备的晶种溶液的质量体积比为7.5g:1.27g:485ml:15ml:26ml:1.8ml:1ml:0.5ml;
c、将混合液a与质量分数为0.5wt%的壳聚糖溶液按体积比为1:1混合,超声处理混匀,超声频率为100khz,超声时间为15min,然后在转速为5000rpm下离心15min,离心3次,取沉淀,以8mg:1ml的质量体积比将沉淀分散于水中并超声处理,超声频率为100khz,超声时间为15min,得微溶液,取8ml该微溶液滴定于玻碳电极表面,晾干即得壳聚糖功能化的金纳米修饰玻碳电极。
<实施例3>
一种壳聚糖功能化的金纳米修饰玻碳电极,制备方法包括以下步骤:
a、将十六烷基三甲基溴化铵与去离子水混合,并在30℃水浴下搅拌15min,然后加入0.01mol/l的氯金酸溶液并搅拌8min后,加入质量体积分数为0.455g/l的nabh4冰水溶液,继续搅拌3min后静置35min即得晶种溶液,其中,十六烷基三甲基溴化铵、去离子水、氯金酸溶液和nabh4冰水溶液的质量体积比为0.73g:18.5ml:0.5ml:1ml;
b、将十六烷基三甲基溴化铵、油酸钠和水混合搅拌30min,并冷却至15℃后,在30℃水浴条件下,加入5mmol/l的agno3溶液并搅拌5min,然后静置15min后,加入0.01mol/l的氯金酸溶液,搅拌直至溶液由亮黄色变为澄清后,加入质量分数为37.5%的浓hcl溶液,继续搅拌20min,然后加入0.1mmol/l的抗坏血酸溶液并搅拌2min,再加入晶种溶液,继续搅拌2min后放置10h,即得混合液a;
其中,十六烷基三甲基溴化铵、油酸钠、水、agno3溶液、氯金酸溶液、浓hcl溶液、抗坏血酸溶液、步骤s1制备的晶种溶液的质量体积比为7g:1.234g:480ml:14.4ml:25ml:1.5ml:0.8ml:0.4ml;
c、将混合液a与质量分数为0.5wt%的壳聚糖溶液按体积比为1:1混合,超声处理混匀,超声频率为100khz,超声时间为10min,然后在转速为5000rpm下离心10min,离心2次,取沉淀,以6mg:1ml的质量体积比将沉淀分散于水中并超声处理,超声频率为100khz,超声时间为10min,得微溶液,取6ml该微溶液滴定于玻碳电极表面,晾干即得壳聚糖功能化的金纳米修饰玻碳电极。
<实施例4>
一种壳聚糖功能化的金纳米修饰玻碳电极,原料及制备方法同实施例3,其中,
所述玻碳电极经过预处理,具体为:
t1、将玻碳电极先用质量分数为5%的葡萄糖溶液浸泡30min,再用质量分数为8%的氨水浸泡30min,再依次用质量分数为95%的乙醇水溶液、二次蒸馏水分别超声清洗10min;
t2、依次用粒径为0.3μm、0.05μm的氧化铝粉末打磨玻碳电极,再依次用质量分数为1%的nacl水溶液、体积比为1:1的hno3水溶液、质量分数为95%的乙醇水溶液、二次蒸馏水分别超声清洗10min;
t3、将玻碳电极置于浓度为0.1mol/l,ph为7.4、浓度为0.1mol/l的pbs缓冲溶液中作为工作电极,以铂丝电极为对电极,以ag/agcl电极为参比电极,进行差分脉冲伏安扫描,如果玻碳电极的差分脉冲伏安曲线不平滑,则重复t2的步骤,直至玻碳电极的差分脉冲伏安曲线平滑;
t4、用质量分数为95%的乙醇水溶液、二次蒸馏水分别超声清洗玻碳电极10min,最后用氮气吹干备用;
对壳聚糖进行预处理,具体为:将壳聚糖和cuso4置于去离子水中并在55℃下进行超声处理,超声频率为400khz,超声时间为15min,再用红外烘干去除去离子水得到沉淀,其中,壳聚糖和cuso4质量比为1:0.1。
测定方法1:
z1、配制的多份含有不同浓度的酪氨酸的pbs缓冲溶液,pbs缓冲溶液的ph均为7.4,其浓度均为0.1mol/l,酪氨酸浓度依次为5.0×10-6mol/l、1×10-5mol/l、1.5×10-5mol/l、2×10-5mol/l、3×10-5mol/l、4×10-5mol/l,采用实施例3制备的壳聚糖功能化的金纳米修饰玻碳电极为工作电极搭建三电极体系,设定初始电位为0.4v,终止电位为1.2v,然后设置如下脉冲参数:电位增量为0.004v,方波频率为50hz,方波幅度为0.05v,等待时间为2s。利用差分脉冲伏安法,分别测量并记录多份含有不同浓度的酪氨酸的pbs缓冲溶液的差分脉冲伏安曲线,在此过程中记录每份含酪氨酸的pbs缓冲溶液的电流强度峰值;z2、以上述步骤z1得到的每份含酪氨酸的pbs缓冲溶液的电流强度峰值与不含酪氨酸的pbs缓冲溶液的电流强度峰值的差值作为纵坐标,以每份酪氨酸的浓度为横坐标,绘制标准曲线并计算线性方程。
如图1为差分脉冲伏安曲线,其中曲线a、b、c、d、e、f、g分别为酪氨酸的标准液浓度为0mol/l、5.0×10-6mol/l、1×10-5mol/l、1.5×10-5mol/l、2×10-5mol/l、3×10-5mol/l和4×10-5mol/l的标准溶液的差分脉冲伏安曲线。用5.0×10-6mol/l、1×10-5mol/l、1.5×10-5mol/l、2×10-5mol/l、3×10-5mol/l和4×10-5mol/l的标准溶液的电流强度峰值分别减去0mol/l标准溶液的电流强度峰值,得到六个电流强度峰值差值。从图1可知待测溶液对应的电流强度峰值随酪氨酸的浓度的增加而增强。
图2为酪氨酸的标准曲线图,图中y为电流强度峰值差值,单位为μa,x为酪氨酸的标准液浓度,单位为μm,电流强度与酪氨酸浓度有良好的线性关系,r2=0.9960。
z3、按照步骤z1测量并记录待检测溶液的差分脉冲伏安曲线,并将该差分脉冲伏安曲线的电流强度峰值与不含酪氨酸的pbs缓冲溶液的电流强度峰值的差值代入到所述线性方程中,从差分脉冲伏安曲线读出电流强度峰值减去0mol/l标准溶液的电流强度峰值,即得到y值,将y值代入线性方程即可解出x,即可得到待检测溶液中酪氨酸的浓度。
测定方法2
原料、设备和方法同测定方法1,其中,将实施例3制备壳聚糖功能化的金纳米修饰玻碳电极换作实施例4制备的壳聚糖功能化的金纳米修饰玻碳电极。得到电流强度与酪氨酸浓度有良好的线性关系,r2=0.9992。
定性检测方法1
s1、配制的多份含有不同浓度的酪氨酸的pbs缓冲溶液,pbs缓冲溶液的ph均为7.4,其浓度均为0.1mol/l,酪氨酸浓度依次为5.0×10-9mol/l、5×10-8mol/l、5×10-7mol/l、5×10-6mol/l,采用实施例3制备的壳聚糖功能化的金纳米修饰玻碳电极为工作电极搭建三电极体系,设定初始电位为0.5v,终止电位为0.8v,然后设置如下脉冲参数:电位增量为0.004v,方波频率为50hz,方波幅度为0.05v,等待时间为10s。利用差分脉冲伏安法,分别测量并记录多份含有不同浓度的酪氨酸的pbs缓冲溶液的差分脉冲伏安曲线,在此过程中记录每份含酪氨酸的pbs缓冲溶液的电流强度峰值;
s2、以上述步骤s1得到的每份含酪氨酸的pbs缓冲溶液的电流强度峰值减去不含酪氨酸的pbs缓冲溶液的电流强度峰值的差值。
当酪氨酸的浓度分别为5.0×10-9mol/l和5×10-8mol/l时,其电流强度峰值与不含酪氨酸的pbs缓冲溶液的电流强度峰值的差值基本为零,当酪氨酸的浓度为5×10-7mol/l和5×10-6mol/l时,其电流强度峰值与不含酪氨酸的pbs缓冲溶液的电流强度峰值的差值均具有显著差异,因此,采用实施例3制备的壳聚糖功能化的金纳米修饰玻碳电极的检测限为5×10-7mol/l,也即当待测溶液中含有酪氨酸浓度不小于5×10-7mol/l,采用此技术方法,可以定性检测出。
定性检测方法2
原料、设备和方法同定检测方法1,其中,将实施例3制备壳聚糖功能化的金纳米修饰玻碳电极换作实施例4制备的壳聚糖功能化的金纳米修饰玻碳电极。
当酪氨酸的浓度分别为5.0×10-9mol/l时,其电流强度峰值与不含酪氨酸的pbs缓冲溶液的电流强度峰值的差值基本为零,当酪氨酸的浓度为5×10-8mol/l、5×10-7mol/l和5×10-6mol/l时,其电流强度峰值与不含酪氨酸的pbs缓冲溶液的电流强度峰值的差值均具有显著差异,因此,采用实施例4制备的壳聚糖功能化的金纳米修饰玻碳电极的检测限为5×10-8mol/l,也即当待测溶液中含有酪氨酸浓度不小于5×10-8mol/l,采用此技术方法,可以定性检测出。
这里说明的设备数量和处理规模是用来简化本发明的说明的。对本发明的应用、修改和变化对本领域的技术人员来说是显而易见的。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
- 还没有人留言评论。精彩留言会获得点赞!