本发明属于生物技术领域,具体而言,涉及用于等离子体金芯片的蛋白点样缓冲液。
背景技术:
等离子体材料通常指的是贵金属(例如金)及其复合物,其在特定波长范围内的光照下具有独特的表面等离子体共振效应。因为具有特定的结构和表面化学性质,这种等离子体材料在近红外区(nir-fe,650-1700nm)具有荧光增强效应,通过微量点样技术在这种材料上固定特定的蛋白(抗体或抗原),可实现生物标志物的检测。
目前,临床领域应用的免疫检测方主要有免疫比浊、免疫层析、酶联免疫(elisa)、化学发光免疫分析(clia),以及近些年发展应用的蛋白芯片-免疫荧光法。由于微量生物活性物质(如抗原或抗体)固定到芯片上后很容易丧失活性,蛋白芯片法都涉及到一项关键的技术,即保持蛋白芯片的稳定性。因此,研究如何保持蛋白芯片的稳定性具有十分重要的意义。
技术实现要素:
本发明旨在至少在一定程度上解决相关技术中的技术问题之一。为此,本发明的一个目的在于提出用于等离子体金芯片的蛋白点样缓冲液,该缓冲液能够在较长时间内保持被固定蛋白的生物活性、缩短点样后的孵育时间、提高蛋白在芯片上的固定能力。
本发明是基于以下发现提出的:目前常用的等离子体金芯片蛋白点样缓冲液是甘油或磷酸盐缓冲液,这类缓冲液只能对芯片上的蛋白质起保湿作用,短时间内防止因过度干燥而引起的蛋白质失活,并不能长期有效地保持其生物活性。保持芯片上蛋白质活性的方法通常是将芯片长期保存在-20℃以下的环境中,并且不能冻融,而在2-8℃冰箱存放一周或37℃破坏一天,其生物活性就损失了50%以上。此外,用常规方法点样时,蛋白质需要孵育12~24h才能固定到芯片上。发明人意外发现,通过采用海藻糖、甘氨酸、异亮氨酸、硫酸铵和柠檬酸钠配置得到的蛋白点样缓冲液,可以有效解决相关技术中存在蛋白质在芯片上的固定能力差,并且被固定的蛋白质容易丧失活性的问题。
由此,根据本发明的一个方面,本发明提出了一种用于等离子体金芯片的蛋白点样缓冲液,所述蛋白点样缓冲液包含海藻糖、甘氨酸、异亮氨酸、硫酸铵和柠檬酸钠。
本发明用于等离子体金芯片的蛋白点样缓冲液包含海藻糖、甘氨酸、异亮氨酸、硫酸铵和柠檬酸钠。该缓冲液与目前常用甘油或磷酸盐缓冲液相比,不仅能使蛋白与芯片基底的结合更牢固,还能减少点样后的孵育时间,并在较长时间内保持被固定蛋白的生物活性。
在本发明的一些实施例中,所述蛋白点样缓冲液中所述海藻糖的浓度为10-20g/l,所述甘氨酸的浓度为5-10g/l,所述异亮氨酸的浓度为5-10g/l,所述硫酸铵的浓度为0.2-1mol/l,所述柠檬酸钠的浓度为0.05-0.2mol/l。由此,可以进一步提高蛋白在芯片上的固定能力、减少点样后的孵育时间并在较长时间内保持被固定蛋白的生物活性。
在本发明的一些实施例中,所述蛋白点样缓冲液中所述海藻糖的浓度为10g/l,所述甘氨酸的浓度为5g/l,所述异亮氨酸的浓度为5g/l,所述硫酸铵的浓度为0.2mol/l,所述柠檬酸钠的浓度为0.05mol/l。由此,可以进一步提高蛋白在芯片上的固定能力、减少点样后的孵育时间并在较长时间内保持被固定蛋白的生物活性。
在本发明的一些实施例中,所述蛋白点样缓冲液的ph值为6.0-7.2。
在本发明的一些实施例中,所述蛋白点样缓冲液的ph值为6.0。
在本发明的一些实施例中,所述蛋白点样缓冲液的ph值是通过加入氢氧化钠溶液和/或盐酸溶液调节获得的。由此,可以有效调节蛋白点样缓冲液的ph。
在本发明的一些实施例中,所述等离子体金芯片由玻璃基底和形成在所述玻璃基底表面的纳米金层组成。由此,可以通过点样技术将特定的蛋白按预定的序列固定到等离子体金芯片上,方便实现生物标志物的检测。
附图说明
图1是根据本发明一个实施例的点样后cea抗体在37℃保存1天、3天、5天、7天后的荧光扫描对比图。
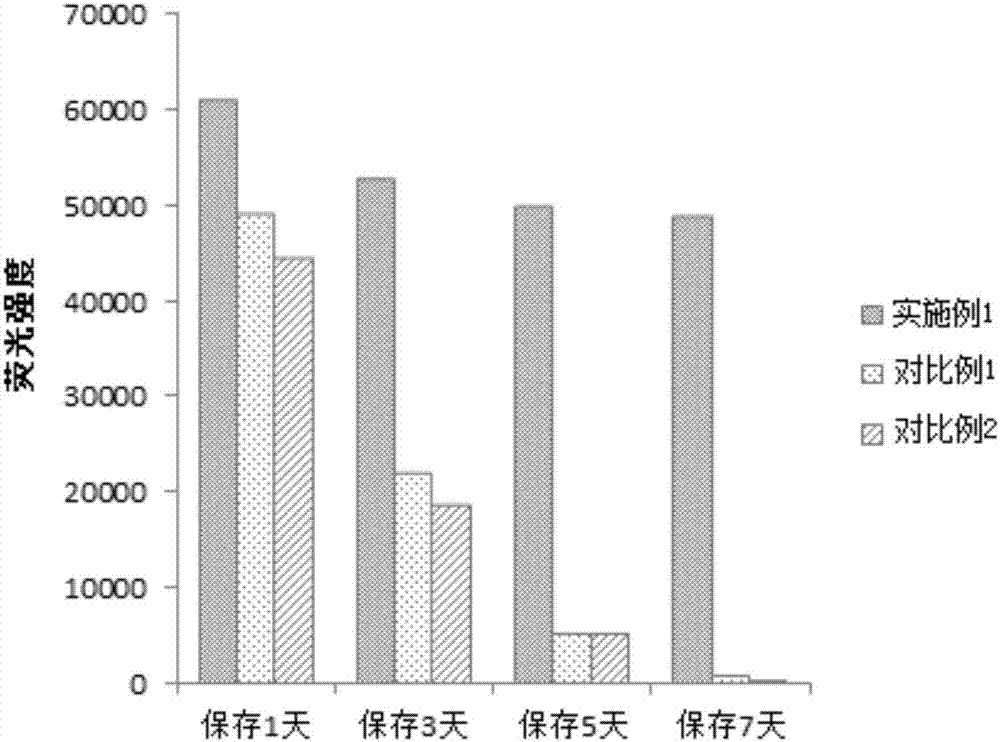
图2是根据本发明一个实施例的点样后cea抗体在37℃保存1天、3天、5天、7天后的荧光强度柱状图。
图3是根据本发明一个实施例的点样后cea抗体在30℃下孵育0.5h、6h和12h后的荧光扫描对比图。
图4是根据本发明一个实施例的点样后cea抗体在30℃下孵育0.5h、6h和12h后的荧光强度柱状图。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
根据本发明的一个方面,本发明提出了一种用于等离子体金芯片的蛋白点样缓冲液,所述蛋白点样缓冲液包含海藻糖、甘氨酸、异亮氨酸、硫酸铵和柠檬酸钠。
本发明用于等离子体金芯片的蛋白点样缓冲液包含海藻糖、甘氨酸、异亮氨酸、硫酸铵和柠檬酸钠。该缓冲液与目前常用甘油或磷酸盐缓冲液相比,可以使蛋白与芯片基底的结合更牢固,还能减少点样后的孵育时间,并在较长时间内保持被固定蛋白的生物活性。
根据本发明的实施例,蛋白点样缓冲液可以由含有海藻糖、甘氨酸、异亮氨酸、硫酸铵和柠檬酸钠的水溶液组成。由此,本发明提出的仅由海藻糖、甘氨酸、异亮氨酸、硫酸铵和柠檬酸钠几种水溶液组成的用于等离子体金芯片的蛋白点样缓冲液与目前常用甘油或磷酸盐缓冲液相比,不仅可以对芯片上的蛋白质起保湿作用,防止因过度干燥而引起的蛋白质失活,还可以使蛋白与芯片基底的结合更牢固、减少点样后的孵育时间,并在较长时间内保持被固定蛋白的生物活性。
根据本发明的具体实施例,所述蛋白点样缓冲液中所述海藻糖的浓度可以为10-20g/l,所述甘氨酸的浓度可以为5-10g/l,所述异亮氨酸的浓度可以为5-10g/l,所述硫酸铵的浓度可以为0.2-1mol/l,所述柠檬酸钠的浓度可以为0.05-0.2mol/l。由此,本发明中通过采用上述配比配置得到的蛋白点样缓冲液,可以进一步提高蛋白在等离子体金芯片上的固定能力、缩短点样后的孵育时间,并在较长时间内保持被固定蛋白的生物活性。
根据本发明的具体实施例,所述蛋白点样缓冲液中所述海藻糖的浓度可以为10g/l,所述甘氨酸的浓度可以为5g/l,所述异亮氨酸的浓度可以为5g/l,所述硫酸铵的浓度可以为0.2mol/l,所述柠檬酸钠的浓度可以为0.05mol/l。由此,本发明中通过采用上述配比配置得到的蛋白点样缓冲液,可以进一步提高蛋白在等离子体金芯片上的固定能力、减少点样后的孵育时间并在较长时间内保持被固定蛋白的生物活性。
根据本发明的具体实施例,所述蛋白点样缓冲液的ph值为6.0-7.2。由此,本发明中通过采用上述ph值的蛋白点样缓冲液,可以进一步在较长时间内保持被固定蛋白的生物活性。
根据本发明的具体实施例,所述蛋白点样缓冲液的ph值可以为6.0。
根据本发明的具体实施例,所述蛋白点样缓冲液的ph值可以通过加入氢氧化钠溶液和/或盐酸溶液调节获得的。由此,本发明可以通过控制加入氢氧化钠溶液和/或盐酸溶液的浓度和加入量来有效调节蛋白点样缓冲液的ph,使本发明用于等离子体金芯片的蛋白点样缓冲液具有合适的ph值。
根据本发明的具体实施例,所述等离子体金芯片可以由玻璃基底和形成在所述玻璃基底表面的纳米金层组成。由此,可以通过点样技术将特定的蛋白按预定的序列固定到等离子体金芯片上,方便实现生物标志物的检测。
根据本发明的具体实施例,通过采用本发明上述实施例的蛋白点样缓冲液能够有效增强特定蛋白在等离子体金芯片的固定能力,具体地,能够将孵育时间缩短至0.5小时。同时,该蛋白点样缓冲液还能有效保持芯片上特定蛋白的活性,具体地,在37℃下保存7天,其特定蛋白的活性依然保持在初始值的80%以上。
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图和具体实施例对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。
实施例1
按照以下组分的终浓度配置蛋白点样缓冲液:10g/l海藻糖、5g/l甘氨酸、5g/l异亮氨酸、0.2mol/l硫酸铵、0.05mol/l柠檬酸钠。用1mol/l氢氧化钠溶液或1mol/l盐酸溶液调节ph值至6.0,2-8℃保存。
对比例1
按照以下组分的终浓度配置蛋白点样缓冲液:5%(v/v)甘油、10mmpbs,用1mol/l氢氧化钠溶液或1mol/l盐酸溶液调节ph值至6.0,2-8℃保存。
对比例2
按照以下组分的终浓度配置蛋白点样缓冲液:10mmpbs,用1mol/l氢氧化钠溶液或1mol/l盐酸溶液调节ph值至7.2,2-8℃保存。
(1)验证实施例1、对比例1和对比例2的点样缓冲液对芯片上cea抗体的活性保护效果:
1)点样方法
将cea捕获抗体分别用实施例1、对比例1和对比例2的点样缓冲液稀释到0.2mg/ml,并通过微量蛋白打印仪gesimnano-plottertm2.1分别将利用实施例1、对比例1和对比例2的点样缓冲液稀释的cea捕获抗体打印到等离子体金芯片上每孔的第一排、第二排和第三排。捕获抗体按照3nl每个点、每个点重复5次打印,最终获得直径约400微米的圆形斑点。
2)检测方法
将点样后的芯片在室温下孵育0.5h,然后37℃真空保存,分别在保存1天、3天、5天、7天后各取一片进行检测。
具体步骤如下:将点样后的芯片在含1%bsa的pbs中摇动1小时封闭,以减少非特异性结合。用150μl/孔的pbst(0.05%吐温20)清洗后,每孔加入100微升的cea抗原(10ng/ml),摇动2小时。芯片用pbst洗涤三次,随后加入荧光染料irdye800标记的检测抗体(4nmol/l)在黑暗中摇动染色半小时,后依次用pbst洗涤三次、纯水清洗一次,离心机甩干。
荧光测量和分析
用midascan扫描仪扫描该芯片,选择800纳米通道、激光强度设置为7.0、分辨率设置为20微米。扫描后获得16位灰度图像。用midascansoftwarev1.0.0或更高版本软件分析该图像。选择栅阵列分析模式测量每个点的强度,点阵的形貌由程序自动识别。每个点的强度通过所选区域总信号强度除以面积获得。图像上平行的5个点的平均荧光强度被定义为测试的强度。cea捕获抗体活性与所获图像上的荧光强度之间存在正相关关系。
检测结果如表1、图1和图2所示。其中,表1是不同点样缓冲液打印的抗体在37℃保存1天、3天、5天、7天后测得的荧光强度表,图1和图2分别是在37℃下保存1天、3天、5天和7天的点样后cea抗体的荧光扫描对比图和荧光强度柱状图。
表1点样缓冲液打印的抗体在37℃保存1天、3天、5天、7天后测得的荧光强度
(2)验证实施例1、对比例1和对比例2的点样缓冲液对芯片上cea抗体的固定能力:
1)点样方法
将cea捕获抗体分别用实施例1、对比例1和对比例2的点样缓冲液稀释到0.2mg/ml,并通过微量蛋白打印仪gesimnano-plottertm2.1分别将利用实施例1、对比例1和对比例2的点样缓冲液稀释的cea捕获抗体打印到等离子体金芯片上每孔的第一排、第二排和第三排。捕获抗体按照3nl每个点、每个点重复5次打印,最终获得直径约400微米的圆形斑点。
2)检测方法
将点样后的芯片在30℃下分别孵育0.5h、6h和12h,各取一片进行检测。
具体步骤如下:将点样后的芯片在30℃下分别孵育0.5h、4h或12h,然后立即在含1%bsa的pbs中摇动1小时封闭,以减少非特异性结合。用150μl/孔的pbst(0.05%吐温20)清洗后,每孔加入100微升的cea抗原(10ng/ml),摇动2小时。芯片用pbst洗涤三次,随后加入荧光染料irdye800标记的检测抗体(4nmol/l)在黑暗中摇动染色半小时,后依次用pbst洗涤三次、纯水清洗一次,离心机甩干。
荧光测量和分析
用midascan扫描仪扫描芯片,选择800纳米通道、激光强度设置为7.0、分辨率设置为20微米。扫描后获得16位灰度图像。用midascansoftwarev1.0.0或更高版本软件分析该图像。选择栅阵列分析模式测量每个点的强度,点阵的形貌由程序自动识别。每个点的强度通过所选区域总信号强度除以面积获得。图像上平行的5个点的平均荧光强度被定义为测试的强度。cea捕获抗体活性与所获图像上的荧光强度之间存在正相关关系。
检测结果如表2、图3和图4所示。其中,表2是不同点样缓冲液打印的抗体在30℃下孵育0.5h、6h和12h后测得的荧光强度表,图3和图4分别是点样后的cea抗体在30℃下孵育0.5h、6h和12h后的荧光扫描对比图和荧光强度柱状图。
表2不同点样缓冲液打印的抗体在30℃下孵育0.5h、6h和12h后测得的荧光强度表
结论:(1)从表1、图1和图2中可以得出以下结论:实施例1的点样缓冲液能有效保持芯片上抗体的活性,在37℃下保存7天,其活性依然能保持在初始值的80%以上,而此时对比例1和对比例2抗体几乎完全失活。(2)从表2、图3和图4中可以得出以下结论:实施例1的点样缓冲液能够有效增强抗体在等离子体金芯片上的固定能力,缩短固定时间。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。