温敏响应高分子阵列的制备方法及其在样品预处理中的应用与流程
本发明涉及温敏响应高分子阵列的制备方法及其在样品预处理中的应用,具体包括直接在氧化铟锡玻片(ito玻片)表面生长高分子聚(n-异丙基丙烯酰胺)(pnipam)来制备可控亲水性阵列,并将其用于样品的预处理。
背景技术:
生物质谱是蛋白质组学研究的重要技术手段,在蛋白样品的处理过程中非挥发性盐的存在会抑制样品的离子化,从而造成检测的灵敏度的降低甚至无法检测,因此,对蛋白质或多肽样品进行除盐往往是质谱分析前必不可少的步骤。
目前,对蛋白质/肽段样品的除盐方法主要是基于固相萃取技术,即蛋白或多肽保留在吸附材料上,盐类不吸附而被除去,然后将保留的蛋白或肽段洗脱下来进行检测,该方法虽然已推广应用,但是由于处理过程中需要多次的样品吸附、洗脱、转移,所以存在步骤复杂、所需时间长、而且会造成样品的损失和潜在的样品污染等缺点。近年来,利用疏水聚合物的表面化技术实现了样品高效靶上原位除盐与富集后直接用于基质辅助激光解吸电离飞行时间质谱(maldi-ms)检测,该方法虽然可避免样品额外的损失以及污染物的引入,但刚性的憎水高分子会在表面形成一层致密的单分子层进而会限制样品与吸附剂的充分接触,所以对样品的表面富集及检测的灵敏度会造成影响。
聚异丙基丙烯酰胺(pnipam)是一种温敏型聚合物,当环境温度低于其最低临界温度lcst(32℃)时,亲水基团与水分子呈现较强的氢键作用,pnipam聚合物可溶于水,聚合物链在水中呈现伸展结构。温度高于lcst时,氢键破坏,异丙基和碳链的疏水作用导致pnipam聚合物链呈现收缩结构。近年来,pnipam修饰的纳米颗粒已被用于温度可控的样品的富集和释放,但由于缺少表面阵列的汇聚效应,所以在样品的富集及检测灵敏度方面仍然存在限制。因此,设计制备一种特殊的高分子阵列、实现样品的简单快速除盐及高灵敏检测势在必行。
技术实现要素:
针对现有技术中存在的缺点与不足,本发明的目的在于提供一种温敏响应高分子阵列的制备方法及其在样品预处理中的应用。本发明制备及操作简单、普适性高、分析时间短、成本低廉,具有一定的生物医学应用价值。
本发明解决其技术问题所采用的技术方案是:
温敏响应高分子阵列的制备方法,利用光影印技术和炔基与巯基的点击化学技术,在氧化铟锡玻片(ito玻片)构建羟基(oh)亲水性微阵列;利用羟基与2-溴异丁酰溴(bibb)间的共价反应形成原位自由基聚合反应的引发剂,再在溴化亚铜(cubr)和2,2’-联吡啶(bpy)的催化下,单体n-异丙基丙烯酰胺(nipam)在ito玻片表面聚合生成所述温敏反应高分子阵列,即高分子聚(n-异丙基丙烯酰胺)(pnipam)的可控亲水性阵列。
进一步地,1-硫代甘油通过光引发剂安息香二乙醚,使巯基(sh)与ito玻片上的炔基共价结合,形成羟基亲水性微阵列。
进一步地,利用表面原位生成的所述引发剂,在常温有机相条件下引发表面原子转移自由基聚合反应。
温敏响应高分子阵列的制备方法制得的高分子阵列的应用,所述温敏反应高分子阵列可通过温度转变自发进行表面除盐及样品富集,并用于对样品的预处理。当低于临界温度时,所述温敏响应高分子阵列的亲水性作用使得样品汇聚在ito玻片表面,而高于临界温度时,样品中蛋白质或肽段通过疏水作用与疏水性的所述温敏响应高分子阵列相吸附,而共存的盐和污染物则被冲走,从而实现样品靶上自除盐和高效富集,即完成对样品的预处理。
对样品的预处理包括如下步骤:
(1)将样品溶液滴在含所述高分子pnipam的可控亲水性阵列的ito玻片上,并在60℃条件下温育30min-1h;
(2)用冲洗液对样品进行2-3次冲洗;将基质溶液滴在样品处,并在4℃下蒸干溶液;
(3)通过基质辅助激光解吸电离飞行时间质谱(maldi-ms)进行信号采集,从质谱图中得到样品蛋白质或肽段信息。
进一步地,所述样品溶液的体积为1μl;冲洗液为60℃超纯水,体积为2μl;基质溶液的配比如下:α-氰基-4-羟基肉桂酸(chca)固体溶解到含有体积百分数分别为50%的乙腈、0.01%的三氟乙酸和49.9%的超纯水的溶剂中,配成最终浓度为10mg/ml的溶液,体积为1μl。
本发明测定目标蛋白质/肽段的原理如下:
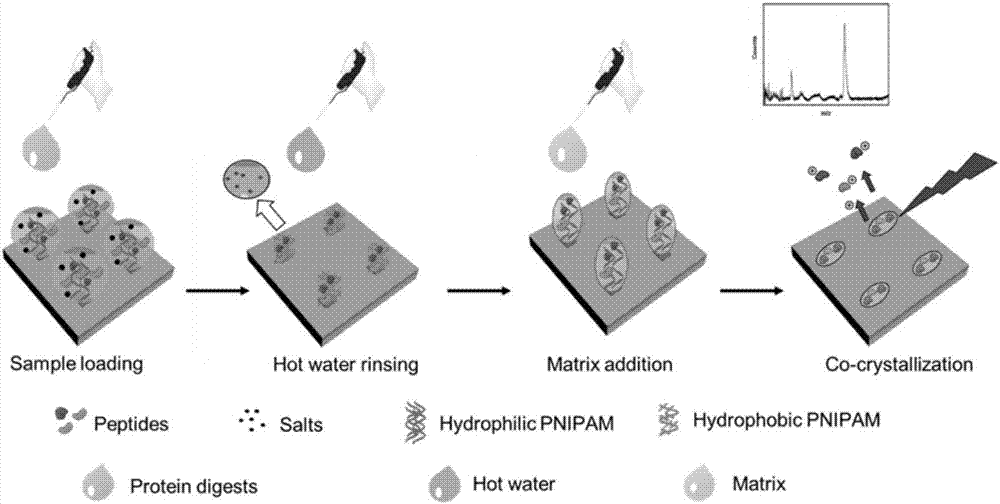
本发明设计的温敏响应高分子阵列的制备方法以及将其用于样品预处理的原理如图1和2所示:通过光影印技术和炔基与巯基的点击化学技术,在ito玻片构建oh亲水性微阵列,进而在亲水微阵列内基于表面引发原子转移自由基聚合生成温敏响应高分子pnipam阵列;当低于临界温度时高分子阵列基于亲水性作用使得样品汇聚在玻片表面,而高于临界温度时蛋白质/肽段通过疏水作用与疏水性的高分子相吸附,而共存的盐和污染物则被热水冲走,实现了样品的预处理(样品靶上自除盐和高效富集),进而通过maldi-ms测得的特征峰,可以实现蛋白质/肽段的快速检测。
本发明通过光影印和点击化学技术在ito玻片构建亲水性微阵列,结合原位自由基聚合反应生成高分子pnipam的可控亲水性阵列,提出一种简单、快速、高灵敏的靶上自除盐方法;相对现有质谱前的除盐方法,本发明具有以下特点:
(1)利用光影印和点击化学技术同时结合原位自由基聚合反应生成高分子的可控亲水性阵列,制备简单、成本低廉、重复性好。
(2)利用温敏型高分子阵列进行高效靶上自除盐,不需要进行样品的转移,可以避免了样品额外的损失以及污染物的引入。
(3)本发明构建了亲疏水微阵列,可以通过强汇聚作用使样品自动富集在较小的亲水区域,可以实现样品高效靶上原位除盐与富集后直接用于maldi-ms检测,免去多次样品转移造成的样品损失和污染,从而提高检测灵敏度,使其更适于低丰度蛋白质的检测。
(4)本发明普适性高、分析时间短、方法非常简便,具有一定的生物医学应用价值。
附图说明
图1为高分子pnipam的可控亲水性阵列的制备方法示意图;
图2为可控亲水性阵列对蛋白质/肽段样品自除盐的示意图。
具体实施方式
实施例1:结合附图1,详述高分子pnipam的可控亲水性阵列的制备过程。
(1)将ito玻片经过聚丙烯胺盐酸盐(pah)和硅酸钠溶液交替喷射,用超纯水冲洗,氮气吹干,在电阻炉中450°煅烧4h。100μl硅烷化试剂(o-(propargyl)-n-(triethoxysilylpropyl)carbamate)和0.5gmgso4·7h2o经过气相沉积反应在ito玻片表面修饰炔基。
(2)在上述ito玻片上滴入50vol%1-硫代甘油和2wt%安息香二乙醚(dmpap)的四氢呋喃溶液,铺上光掩膜在365nm14.4mw·cm-2紫外光下照射20s,依次用四氢呋喃、超纯水冲洗,氮气吹干(即1-硫代甘油通过光引发剂安息香二乙醚,使巯基与ito玻片上的炔基共价结合,形成-oh亲水性微阵列,dmpap是光引发剂,相当于催化剂,可加速紫外光下巯基与炔基的反应);
再滴入5vol%全氟癸硫醇和2wt%dmpap的乙醇溶液,铺上反向光掩膜在365nm150mw·cm-2紫外光下照射60s,依次用乙醇、超纯水冲洗,氮气吹干(全氟癸硫醇使得亲水的羟基阵列周边憎水性更强,这样形成的阵列由于阵列里外的亲憎水性差距更大,使形成的阵列效果更明显)。
(3)将上述ito玻片置于0.08mbibb和0.1m三乙醇胺(tea)的n,n-二甲基甲酰胺(dmf)溶液中,室温下反应30min,dmf冲洗、超纯水冲洗,氮气吹干,可生成原位自由基聚合反应的引发剂。
(4)将步骤(3)中ito玻片置于含2mnipam单体和9mmcubr、18mm2,2’-bipyridine(bpy)的除氧超纯水中,通入氮气,室温下反应30min,超纯水冲洗,氮气吹干,生成高分子pnipam的可控亲水性阵列。
实施例2:结合附图2,以细胞色素c(cyt-c)的酶解液为例,说明该pnipam的可控亲水性阵列在蛋白质/肽段自除盐中的应用。
(1)配制样品液:把1ml含50mmnh4hco3的0.5mg/mlcyt-c溶液与100μl含50mmnh4hco3的0.2mg/ml胰蛋白酶溶液混合,在37°恒温箱中温育24h。用50mmnh4hco3溶液稀释使它们的最终浓度分别为4pmol/μl、400fmol/μl、40fmol/μl。(本实施例的样品是蛋白质的盐溶液,要分析酶解之后的各个肽段,必须先用酶将蛋白酶解成肽段,再进行除盐和富集,质谱分析;如果样品是纯蛋白的盐溶液,那就直接不用利用酶处理,除盐之后质谱分析的是蛋白的质荷比)。
(2)分别滴加1μl上述样品液于含pnipam可控亲水性阵列的ito玻片上,并在60℃条件下温育30min。
(3)用2μl60℃超纯水对样品进行3次冲洗,再将1μl基质溶液(基质溶液的配比:α-氰基-4-羟基肉桂酸(chca)固体溶解到含有体积百分数分别为50%的乙腈、0.01%的三氟乙酸和49.9%的超纯水的溶剂中,配成最终浓度为10mg/ml的溶液;基质溶液作用如下:将被分析物的溶液和某种基质溶液混合,蒸发溶剂,使被分析物与基质成为晶体或半晶体,再用一定波长的脉冲式激光进行照射,基质吸收激光能量后,均匀地传递给待分析物,使待分析物瞬间气化并离子化,离子质量的不同导致其飞行速度不同而分离)滴在样品处,并在4℃下蒸干溶液,通过质谱仪进行质谱信号采集。
(4)从质谱图得到样品蛋白质信息。
现有文献报道过利用磁性纳米材料除盐富集肽段的覆盖率是62%,通过本发明实施例除盐之后测定的cyt-c的酶解液肽段峰的覆盖率是67.5%,不但检测的灵敏度有所提高,而且通过本实施例预处理样品(除盐)的方法非常简便,实用性更强。
- 还没有人留言评论。精彩留言会获得点赞!