一种羊奶及其制品中检测药物的方法与流程
本发明涉及以一种禁限用药物的检测方法,特别是涉及羊奶及其制品中8大类74种禁限用药物检测方法。
背景技术:
奶及奶制品作为消费者膳食组成中不可或缺的部分,其营养组成和质量安全受到越来越多的关注,其中奶源从牛奶也逐步扩展到羊奶及制品,羊奶相比于牛奶,具有脂肪粒和蛋白微粒小、矿物质和维生素丰富,更容易被人体吸收的特点;且羊奶从基础结构到营养配比更接近于人奶,尤其适合婴幼儿食用,同时羊奶中аs-酪蛋白等异体蛋白含量较少,能大大降低过敏反应的发生。随着物质水平的提高,营养价值更高的羊奶及奶制品受到越来越多的追捧。
随着养殖行业规模化发展,为治疗预防动物疾病、缩短生产周期,促进动物生长,兽药的使用极为普遍,目前畜禽养殖行业常用兽药主要有磺胺类、喹喏酮类、大环内酯类、苯并咪唑类、镇静剂类、抗病毒和截短侧耳素类等药物,但由于科学养殖知识的缺乏和经济利益的趋势,超剂量使用现象尤为突出,其次不法兽药生产企业为追求疗效,多种类兽药复方使用,加之不合理的休药期限,导致动物体内同时残留多种兽药;同时为促进动物生长和增重,铤而走险添加违禁药物以谋取私利的现象也时有发生,最终导致动物源性产品中禁限用药物残留超标问题频繁发生,近年来奶及奶制品食品安全事件也接连不断,对消费者身体健康造成潜在威胁,尤其对婴幼儿及体弱人群影响更为严重。
动物源性食品中违禁药物残留的对人体健康危害主要包含以下方面:(1)急慢性毒性反应,当人体长期摄入残留药物超标的动物源性食品,因药物蓄积达到一定量时就会产生急慢性毒性反应,如磺胺类药物能够破坏人体造血机能;大环内酯类可致急性肝毒性;“瘦肉精”类药物可引起血管扩张、血压下降、心跳加快、呼吸加剧从而诱发或加重心脏病人的病情。(2)致畸、致癌、致突变作用,研究表明如果长期食用残留“三致”作用药物食品,最终可能导致人体产生致畸、致癌和致突变作用,如苯丙咪唑类药物具有致畸作用;磺胺二甲嘧啶等磺胺类药物能够诱发啮齿动物甲状腺增生,并具有致肿瘤倾向;喹诺酮类药物的个别品种被发现有致突变作用。(3)耐药性细菌产生,长期的禁限用药物残留暴露条件下,人体内敏感菌株受到选择性的抑制,从而使耐药菌株大量繁殖,此外,抗药性r质粒在菌株间横向转移使很多细菌由单重耐药发展到多重耐药,耐药性细菌的产生使得一些常用药物的疗效下降甚至失去疗效,从而使人体疾病治疗过程中出现效果不佳或无药可用的危险。此外动物源性食品中禁限用药物残留还会导致过敏反应,如青霉素、四环素类、磺胺类等能使部分人群发生过敏反应甚至休克。
为此,许多国家和组织通过对禁限用药物残留进行监测来评估动物源性食品安全风险和制定应对措施,常用的监测方法主要为筛查方法和确证分析方法,筛选方法主要以elisa快速检测为主,确证方法主要有液相色谱、液质联用、气相色谱、气质联用为主,但随着食品质量安全风险形势的发展,现有的检测方法难以满足同一样品多种禁限用药物同时检测要求,主要存在问题有:(1)大多检测方法和标准以检测单一种类药物为主,多种类药物检测时,需分别多次处理样品,极大的浪费了人力、物力及财力(2)检测方法及标准检测基质覆盖不全面,如动物产品检测基质一般为肉和肝脏样品,少有肾脏样品;而奶及奶制品基质大多以牛奶为主,未见羊奶及奶制品样品(3)仪器和方法存在灵敏度低,重现性差、前处理繁琐、溶剂耗费量大等问题。因此为满足对样奶及奶制品质量安全监管,建立更多种类、更多数量兽药同时检测的确证方法尤为迫切。
目前,用于动物源性产品中禁限用药物残留检测的方法主要有elisa法,液相色谱法(hplc)、液质联用法(lc-ms/ms),气相色谱法(gc)、气质联用法(gc-ms/ms),生物传感器和芯片技术。
elisa法以抗原-抗体间特异性结合反应为基础建立的快速筛选和分析方法,具有灵敏度高、特异性强、分析通量大、快速安全可靠等优点,此外因其操作简单,分析时间短是目前应用于现场检测的主要手段。但同时elisa法因其特异性强决定其无法同时检测多种类药物;且因为其原理为抗原抗体特异性反应,导致其对溶剂的适用性要求就高,极易因为基质原因造成一定的假阳性和假阴性问题,此外elisa方法还存在灵敏度不高,稳定性差等缺点,仅能对分析物做半定量分析。
生物传感器和芯片技术将生物活性物质集成于换能器表面,并将分析物与活性物质之间的某种特异性反应所产生的信号转化成可识别信号,进而实现对分析物含量或浓度的测定。此类技术具有操作简单、特异性强、灵敏度高的优势,极大提升了检测通量,此外传感器体积小,便于携带,方便现场实时检测。因此近年来,传感器技术应用于禁限用药物残留分析检测是食品安全的重要研究领域;但生物传感器和芯片技术作为新兴的检测技术,因其保持生物活性物质和集成化的特点,对检测基质的处理要求和现有集成技术较高,因此极易造成结果的不稳定性,且存在造价和使用寿命等问题。
液相色谱(hplc)、液质联用(lc-ms/ms),气相色谱(gc)和气质联用(gc-ms/ms)等仪器分析方法,将色谱技术良好的稳定性和质谱技术较高的灵敏度相结合,充分发挥了仪器分析法准确度高,稳定性好,灵敏度高,选择性好的特点,在动物源性产品中禁限用药物定性定量分析方面优势明显,即使在基质干扰物质复杂情况下也依然能获得准确的测试结果,是目前主要的确证分析手段;但目前现有方法存在检测药物种类单一,药物数量少等缺点,极易造成风险药物的漏检;此外检测基质不够丰富,比如少有方法和标准研究日益受重视的羊奶及奶制品中禁限用药物残留状况,造成食品安全监管环节的盲区和死角,不利于我国食品安全整体水平的提升和出口贸易竞争力的提高。
现有技术cn103760269公开了一种兽药残留的检测方法,其中公开了46种药物的检测方法,在该方法的检测中检测药物的种类十分有限,仅包括四环素类药物、β受体激动剂类药物、喹诺酮类药物和磺胺类药物,而对于其他类药物的没有能检测到。而实际生产中,需要测定更多种,特别是更多的类别的残留药物,因此,开发一种同时检测更多类别更多种的药物的方法,成为本领域亟待解决的问题。
技术实现要素:
本发明针对现有技术检测禁限用药物数量少,种类少的问题,建立了涵盖β-受体激动剂(27种)、磺胺(15种)、喹喏酮(20种)、大环内酯(3种)、苯并咪唑(3种)、镇静剂(2种)、抗病毒(2种)和截短侧耳素类(2种)等8类74种兽药的超高效液相色谱质谱联用法;此外所建立方法针对羊奶及其制品等样品弥补了现有检测方法和标准不够全面的问题。
具体来说,本发明是通过如下技术方案实现的:
一种检测羊奶及其制品中禁用或/和限用药物的方法,所述方法包括如下步骤:
(1)样品的处理:
将待测样品加入酸性有机溶剂提取后进行涡旋震荡提取,离心取上清液,离心得到的沉淀重复涡旋震荡提取一次,合并上清液,经spe柱净化,净化液氮气吹干,使用初始流动相溶解后用于uplc-ms/ms测定;
(2)禁用或/和限用药物的测定:
将步骤(1)得到的样品进行uplc-ms/ms测定,测定条件如下:
色谱条件:色谱柱为watersacquityuplcbehc18柱;流动相为甲醇和甲酸水溶液,洗脱方式为梯度洗脱;
质谱条件:电喷雾离子源(esi+);毛细管电压为3.0-3.5kv;源温为145℃-155℃;脱溶剂温度为500℃-600℃;脱溶剂气流速度为850l·h-1-950l·h-1;锥孔气流速度为45l·h-1-55l·h-1;碰撞气流速:0.13ml·min-1-0.15ml·min-1。
其中,所述禁限用药物包括β-受体激动剂、磺胺、喹喏酮、大环内酯、苯并咪唑、镇静剂、抗病毒和截短侧耳素8类药物。
其中,所述禁限用药物为奥西那林、西马特罗、特布他林、沙丁胺醇、齐帕特罗、西布特罗、吡布特罗、丙卡特罗、瑞普特罗、非诺特罗、羟苄羟麻黄碱、羟甲基克伦特罗、克伦普罗、克仑塞罗、氯丙那林、克仑特罗、妥布特罗、莱克多巴胺、马布特罗、美托洛尔、马喷特罗、溴布特罗、福莫特罗、班布特罗、奥达特罗、喷布特罗、苯乙醇胺a、磺胺醋酰、磺胺二甲恶唑、磺胺嘧啶、磺胺塞唑、磺胺吡啶、磺胺甲嘧啶、磺胺异恶唑、磺胺二甲嘧啶、磺胺甲氧哒嗪、磺胺多辛、磺胺苯酰、磺胺甲恶唑、磺胺地索辛、磺胺间甲氧嘧啶、磺胺喹喔啉、吡哌酸、氧氟沙星、加替沙星、沙拉沙星、奥比沙星、曲伐沙星、加雷沙星、诺氟沙星、环丙沙星、培氟沙星、洛美沙星、达氟沙星、恩诺沙星、吉米沙星、莫西沙星、司帕沙星、二氟沙星、那氟沙星、萘啶酸、氟甲喹、金刚烷胺、金刚乙胺、噻苯咪唑、阿苯达唑砜、奥芬达唑、克林霉素、罗红霉素、替米考星、沃尼妙林、泰妙菌素、氯丙嗪、氮哌酮中的一种、几种或全部。
其中,步骤(2)所述梯度洗脱程序为:
0-0.5min:甲醇的体积比为3.0%保持不变;
0.5-2.0min:甲醇的体积比为3.0%-25.0%;
2.0-3.5min:甲醇的体积比为25.0%保持不变;
3.5-3.6min:甲醇的体积比为25.0%-40.0%;
3.6-4.0min:甲醇的体积比为40.0%保持不变;
4.0-5.5min:甲醇的体积比为40.0%-90.0%;
5.5-8.0min:甲醇的体积比为90.0%保持不变;
8.0-8.1min:甲醇的体积比为90.0%-3.0%;
8.1-10.5min:甲醇的体积比为3.0%保持不变。
其中,步骤(1)所述氮气吹干上清液的温度为35℃-45℃,优选在40℃进行。
其中,步骤(1)所述离心的转速为9000r·min-1-10000r·min-1,离心的时间为3min-7min,优选所述离心转速为9500r·min-1,离心的时间为5min。
其中,步骤(1)所述提取剂体积浓度为0.2%-1.0%甲酸乙腈溶液;优选甲酸体积浓度为0.5%。
其中,步骤(1)所述在spe固相萃取柱净化过程中,液体流速为0.5d·s-1-3d·s-1,优选所述液体流速为1d·s-1。
其中,步骤(2)的甲酸水溶液的体积浓度为0.05%-0.2%,优选体积浓度为0.1%。
其中,步骤(2)所述色谱条件:色谱柱为watersacquityuplcbehc18柱;流动相为甲醇和甲酸水溶液,洗脱方式为梯度洗脱;流速为0.3ml·min-1;柱温为35℃;
质谱条件:电喷雾离子源(esi+);毛细管电压为3.0kv;萃取锥孔电压为3.0v;rf透镜电压为0.5v;源温为150℃;脱溶剂温度为600℃;脱溶剂气流速度为900l·h-1;锥孔气流速度为50l·h-1;碰撞气流速度为0.14ml·min-1;样品采集方式:采用多通道分时段采集模式。
更具体来说,本发明是通过如下技术方案实现的:
一种检测羊奶及其制品中禁用或/和限用药物的方法,其特征在于,所述方法包括如下步骤:
(1)样品前处理:
将待测羊奶样品进行前处理(羊奶粉事先溶解成液态奶,按羊奶前处理方法处理),加入酸性有机溶剂提取后进行涡旋提取,离心取上清液,离心沉淀重复提取一次,合并上清液,经spe柱净化,净化液氮气吹干,使用初始流动相溶解后经测定;
(2)74种待测禁限用药物测定:
将步骤(1)得到的样品进行uplc-ms/ms测定,测定条件如下:
色谱条件:色谱柱为watersacquityuplcbehc18(100mm×2.1mm,1.7μm)柱;流动相为甲醇和甲酸水溶液,洗脱方式为梯度洗脱;
质谱条件:电喷雾离子源(esi+);毛细管电压为3.0-3.5kv;源温为145℃-155℃;脱溶剂温度为500℃-600℃;脱溶剂气流速度为850l·h-1-950l·h-1;锥孔气流速度为45l·h-1-55l·h-1;碰撞气流速:0.13ml·min-1-0.15ml·min-1。
其中,所述禁限用药物包括β-受体激动剂、磺胺、喹喏酮、大环内酯、苯并咪唑、镇静剂、抗病毒和截短侧耳素等8类药物。
其中,所述禁限用药物为奥西那林、西马特罗、特布他林、沙丁胺醇、齐帕特罗、西布特罗、吡布特罗、丙卡特罗、瑞普特罗、非诺特罗、羟苄羟麻黄碱、羟甲基克伦特罗、克伦普罗、克仑塞罗、氯丙那林、克仑特罗、妥布特罗、莱克多巴胺、马布特罗、美托洛尔、马喷特罗、溴布特罗、福莫特罗、班布特罗、奥达特罗、喷布特罗、苯乙醇胺a、磺胺醋酰、磺胺二甲恶唑、磺胺嘧啶、磺胺塞唑、磺胺吡啶、磺胺甲嘧啶、磺胺异恶唑、磺胺二甲嘧啶、磺胺甲氧哒嗪、磺胺多辛、磺胺苯酰、磺胺甲恶唑、磺胺地索辛、磺胺间甲氧嘧啶、磺胺喹喔啉、吡哌酸、氧氟沙星、加替沙星、沙拉沙星、奥比沙星、曲伐沙星、加雷沙星、诺氟沙星、环丙沙星、培氟沙星、洛美沙星、达氟沙星、恩诺沙星、吉米沙星、莫西沙星、司帕沙星、二氟沙星、那氟沙星、萘啶酸、氟甲喹、金刚烷胺、金刚乙胺、噻苯咪唑、阿苯达唑砜、奥芬达唑、克林霉素、罗红霉素、替米考星、沃尼妙林、泰妙菌素、氯丙嗪、氮哌酮中的一种、几种或全部。
其中,步骤(2)所述梯度洗脱程序为:
0-0.5min:甲醇的体积比为3.0%保持不变;
0.5-2.0min:甲醇的体积比为3.0%-25.0%;
2.0-3.5min:甲醇的体积比为25.0%保持不变;
3.5-3.6min:甲醇的体积比为25.0%-40.0%;
3.6-4.0min:甲醇的体积比为40.0%保持不变;
4.0-5.5min:甲醇的体积比为40.0%-90.0%;
5.5-8.0min:甲醇的体积比为90.0%保持不变;
8.0-8.1min:甲醇的体积比为90.0%-3.0%;
8.1-10.5min:甲醇的体积比为3.0%保持不变。
其中,步骤(1)所述氮气吹干上清液的温度为35℃-45℃,优选在40℃
进行。
其中,步骤(1)所述离心的转速为9000r·min-1-10000r·min-1,离心的时间为3min-7min,优选所述离心转速为9500r·min-1,离心的时间为5min。
其中,步骤(1)所述提取剂体积浓度为0.2%-1.0%甲酸乙腈溶液;优选
甲酸体积浓度为0.5%。
其中,步骤(1)所述在spe固相萃取柱净化过程中,液体流速为0.5d·s-1-3d·s-1,优选所述液体流速为1d·s-1
其中,步骤(2)的甲酸水溶液的体积浓度为0.05%-0.2%,优选体积浓度为0.1%。
其中,步骤(2)所述色谱条件:色谱柱为watersacquityuplcbehc18(100mm×2.1mm,1.7μm)柱;流动相为甲醇和甲酸水溶液,洗脱方式为梯度洗脱;流速为0.3ml·min-1;柱温为35℃。
质谱条件:电喷雾离子源(esi+);毛细管电压为3.0kv;萃取锥孔电压为3.0v;rf透镜电压为0.5v;源温为150℃;脱溶剂温度为600℃;脱溶剂气流速度为900l·h-1;锥孔气流速度为50l·h-1;碰撞气流速度为0.14ml·min-1。
本发明的有益技术效果如下:
本发明在uplc稳定性高,检测时间短和ms/ms高灵敏度的基础上,建立的检测方法,充分发挥了二者技术优势,其中uplc是在传统hplc系统基础上开发的新型液相系统。
与传统的高效液相色谱(hplc)相比,uplc具有以下优势:一是高分离度,uplc系统搭载的色谱柱粒径能达到1.7μm,该系统将比传统hplc5μm粒径色谱柱系统效能高70%,比3.5μm高40%;二是高速度,在不影响分离度的情况下,小粒径能提供更高的分析速度,相同时间内,uplc能提供更多的峰容量。相同条件下,1.7μm的uplc系统,相对于5μmhplc系统,分离速度提高了9倍;三是高灵敏度,uplc能提高柱,减少峰宽,从而提高灵敏度,在提高柱效的同时,运用1.7μm的uplc系统比5μm和3.5μm的系统灵敏度分别提高了70%和40%。而uplc与质谱联用技术的结合,体现了色谱和质谱优势的互补,将色谱对复杂样品的高分离能力,与ms具有高选择性、高灵敏度及能够提供相对分子质量与结构信息的优点结合起来,为复杂基质中多种类药物同时准确定性定量分析提供了可能。
本发明采用的spe固相萃取技术,利用待分析物在不同介质中吸附能力差异进行提纯,有效的将待分析物与干扰组分分离,大大增强对待分析物特别是痕量分析物的检出能力,提高了被测样品的回收率,同时也降低了基质背景,提高了检测灵敏度。
实验采用多channels分时段采集模式(多通道数据采集分析系统),同时因为药物种类较多,出峰时间较为集中在2~6min内的现象,实验对不同channel进行时间分段,保证每一种药物具有充足的扫描频率,实验还对每种药物驻留时间在0.005~0.05ms之间进行优化,保证各色谱峰上都能达到10-12个数据采集点,确保每种药物都能得到较高的灵敏度和准确定量。
本发明建立了适用于羊奶及奶制品中针对β-受体激动剂(27种)、磺胺(15种)、喹喏酮(20种)、大环内酯(3种)、苯并咪唑(3种)、镇静剂(2种)、抗病毒(2种)和截短侧耳素类(2种)等8类74种禁限用药物的超高效液相色谱-质谱联用方法。相对于目前现有方法,该方法具有检测药物数量多,种类齐全,检测时间短,灵敏度高、结果准确稳定的优点,同时也弥补了羊奶及奶制品中无多种类、多数量药物同时检测空白,对保证消费者身体健康,提高羊奶及奶制品出口贸易竞争力具有重要意义。
本发明检测方法通过对前处理方法进行了改进,使更多的药物能够提取出而进行进一步检测,同时在液相分离过程中采用了多种有利于多种药物检测的方法,并在结果采集上采用了多通道分时段采集模式,有利于信号的累积。
附图说明
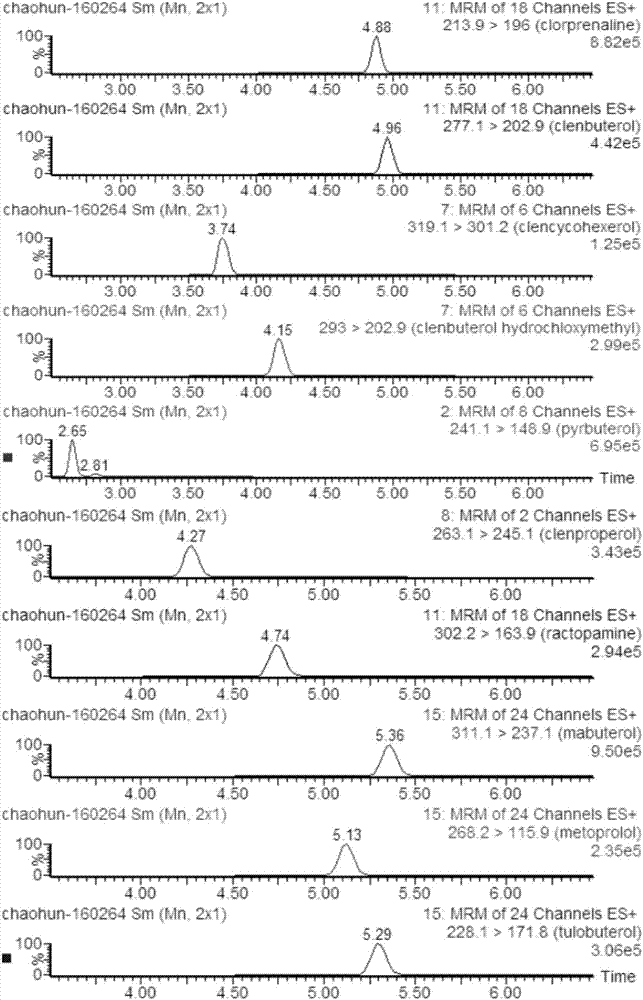
图1:27种β-受体激动剂类药物混合标准溶液的定量离子通道色谱图;
图2:15种磺胺类药物混合标准溶液的定量离子通道色谱图;
图3:20种喹诺酮类药物混合标准溶液的定量离子通道色谱图;
图4:五类禁限用药物(大环内酯3种、苯并咪唑3种、抗病毒2种、镇静剂2种、截短侧耳素2种)混合标准溶液的定量离子通道色谱图;
图5:不同药物基质抑制程度;
上述各图是uplc-ms/ms测定结果的原始图谱,图中的英文翻译如下:
channels:质谱方法中待测物采集通道
orciprenaline:奥西那林,cimaterol:西马特罗,terbutaline:特布他林,salbutamol:沙丁胺醇,zilpaterol:齐帕特罗,cimbuterol:西布特罗,pyrbuterol:吡布特罗,ritodrine:羟苄羟麻黄碱,procaterol:丙卡特罗,fenoterol:非诺特罗,reproterol:瑞普特罗,hydroxymethylclenbuterol:羟甲基克伦特罗,clencyclohexerol:克仑塞罗,clenproperol:克伦普罗,clorprenaline:氯丙那林,clenbuterol:克仑特罗,ractopamine:莱克多巴胺,tulobuterol:妥布特罗,metoprolol:美托洛尔,mabuterol:马布特罗,mapenterol:马喷特罗,formoterol:福莫特罗,brombuterol:溴布特罗,bambuterol:班布特罗,olodaterol:奥达特罗,penbutolol:喷布特罗,phenyleaa:苯乙醇胺a。
sulfadiazine:磺胺嘧啶,sulfathiazole:磺胺塞唑,sulfacetamide:磺胺醋酰,sulfapyridine:磺胺吡啶,sulfamerazine:磺胺甲嘧啶,sulfisoxazole:磺胺异恶唑,sulfamoxol:磺胺二甲恶唑,sulfamethazine:磺胺二甲嘧啶,sulfamethoxypyridazine:磺胺甲氧哒嗪,sulfadoxine:磺胺多辛,sulfabenzamide:磺胺苯酰,sulfaquinoxaline:磺胺喹喔啉,sulfamethoxazole:磺胺甲恶唑,sulfadimethoxine:磺胺地索辛,sulfamonomethoxine:磺胺间甲氧嘧啶。
pipemidicacid:吡哌酸,ofloxacin:氧氟沙星,gatifloxacin:加替沙星,sarafloxacin:沙拉沙星,orbifloxacin/;奥比沙星,trovafloxacin:曲伐沙星,garenoxacin:加雷沙星,norfloxacin:诺氟沙星,ciprofloxacin:环丙沙星,pefloxacin:培氟沙星,lomefloxacin:洛美沙星,danofloxacin:达氟沙星,enrofloxacin:恩诺沙星,gemifloxacin:吉米沙星,moxifloxacin:莫西沙星,sparfloxacinspara:司帕沙星,difloxacin:二氟沙星,nadifloxacin:那氟沙星,nalidixicacid:萘啶酸,flumequine:氟甲喹。
thiabendazole:噻苯咪唑,albendazolesulfone:阿苯达唑砜,oxfendazole:奥芬达唑。
clindamycin:克林霉素,roxithromycin:罗红霉素,tilmicosin:替米考星。
taimulin:泰妙菌素,valnemulin:沃尼妙林。
amantadine:金刚烷胺,rimantadine:金刚乙胺。
chlorpromazine:氯丙嗪,azaperone:氮哌酮。
具体实施方式
本发明提供了一种禁限用药物检测方法,所述方法包括如下步骤:
1)样品前处理:
将待测羊奶样品进行前处理(羊奶粉事先溶解成液态奶,按羊奶前处理方法处理),加入酸性有机溶剂提取后进行涡旋提取,离心取上清液,离心沉淀重复提取一次,合并上清液,经spe柱净化,净化液氮气吹干,使用初始流动相溶解后经uplc-ms/ms测定;
所述检测样品为羊奶,当样本为奶粉样品时,须事先定量溶解成液态奶。
所述提取溶剂为体积浓度为0.2%-1.0%甲酸乙腈溶液;优选甲酸体积浓度为0.5%。提取溶剂的选择是基于更好的去除蛋白和增加药物溶解性的综合考虑。
所述重复提取两次及离心两次,是基于对待分析物的充分提取,并使沉淀充分去除的考虑,从而更好地降低噪声干扰和提高待分析物的灵敏度。
优选地,所述氮气吹干上清液的温度为35℃-45℃,优选在40℃进行。
优选地,所述离心的转速为9000r·min-1-10000r·min-1,离心的时间为3min-7min,优选所述离心转速为9500r·min-1,离心的时间为5min。
优选地,所述在spe固相萃取柱净化过程中,液体流速为0.5d·s-1-3d·s-1,
优选所述液体流速为1d·s-1。
在前处理的过程中,涡旋震荡提取相对于超声波提取优势在于基质分散更为充分,涡旋过程中羊奶基质能和提取溶剂更全面的接触,从而使目标药物的提取更充分。
其中使用的提取剂是酸性有机溶剂,具体为体积浓度为0.2%-1.0%甲酸乙腈溶液;优选甲酸体积浓度为0.5%,酸性有机溶剂的用途:基于更好的去除蛋白和增加药物溶解性的综合考虑;实验选择甲酸酸化乙腈代替三氟乙酸乙腈溶液,优点在于三氟乙酸刺激性更大,毒性更强,具有致畸致突变的作用,在操作过程中对操作者危害较大,且提取过程中残存的三氟乙酸对质谱仪器也有一定程度的损害;而采用甲酸作为酸化剂,具有毒性小,对操作者相对安全,且在一定程度上可以改善提高待测物灵敏度,改善待测物峰型的作用。
spe柱净化相对于仅仅通过微孔滤膜过滤,spe柱净化可以更为彻底的去处提取溶液中杂质,尤其对动物组织中普遍存在磷脂类杂质的去除效果明显,尤其在多种类药物同时检测过程中,使用spe柱净化的前处理方法能显著降低样本的背景干扰,提高待测药物的灵敏度和检测结果的准确度。
同时使用初始流动相溶解后经测定;
通过上述多个前处理的参数的不同,最终将在现有技术中不能检测到的药物而检测到,从而实现了本发明方法同时检测更多个的更多种类的药物的目的,本发明相对于之前的现有技术取得明显的技术进步。
综上所述,相对于现有技术,本方法具有同时检测药物种类更多,同类别药物覆盖面更广,前处理过程对操作者更安全,结果更准确可靠;填补羊奶及奶制品中无多种类多数量残留药物检测方法的空缺。
考虑到本发明检测方法检测的药物种类和数量更多而对其前处理方法进行改进,以使各种不同种类的药物都能够被提取出进而检测出,这也是本发明相对于现有技术未解决的技术问题提供的一个技术方案。
在前处理过程中各类药物的性质各异,比较专一性的检测方法不太适合多种药物同时检测,因此一般采用通用型的提取溶剂,在确保结果准确、背景干扰少的前提下同时追求前处理过程的简单,这是现有技术中没有做到的并且期望解决的。
(2)74种待测禁限用药物测定:
将步骤(1)得到的样品进行uplc-ms/ms测定,测定条件如下:
色谱条件:色谱柱为watersacquityuplcbehc18(100mm×2.1mm,1.7μm)柱;流动相为甲醇和甲酸水溶液,洗脱方式为梯度洗脱;
优选地,所述梯度洗脱程序为:
0-0.5min:甲醇的体积比为3.0%保持不变;
0.5-2.0min:甲醇的体积比为3.0%-25.0%;
2.0-3.5min:甲醇的体积比为25.0%保持不变;
3.5-3.6min:甲醇的体积比为25.0%-40.0%;
3.6-4.0min:甲醇的体积比为40.0%保持不变;
4.0-5.5min:甲醇的体积比为40.0%-90.0%;
5.5-8.0min:甲醇的体积比为90.0%保持不变;
8.0-8.1min:甲醇的体积比为90.0%-3.0%;
8.1-10.5min:甲醇的体积比为3.0%保持不变。
所述梯度洗脱的流动相配比和洗脱程序可以保证各种禁限用药物良好的分离效果。
本发明采用的梯度洗脱洗脱时间更短,溶剂变换梯度较多,导致分离效果更好,所述梯度洗脱的流动相配比和洗脱程序可以保证各种禁限用药物良好的分离效果,洗脱梯度相对于现有技术梯度变化更快,转变更细微,主要是基于该方法中涵盖药物数量较多,药物极性差异较大,梯度从高水相比例到高有机相比例再到高水相比例全范围变化,从而保证极性不同的各类药物都能在色谱柱中更好地洗脱;而洗脱梯度的快速切换主要是为了保证极性相近的药物能更好地分离和定量,并最终保证检测结果的准确可靠。
质谱条件:电喷雾离子源(esi+);毛细管电压为3.0kv;源温为150℃;脱溶剂温度为600℃;脱溶剂气流速度为900l·h-1;锥孔气流速度为50l·h-1;碰撞气流速:0.14ml·min-1。
该色谱条件与之前的“源温为105℃-115℃;脱溶剂温度为340℃-360℃;脱溶剂气流速度为600l·h-1-700l·h-1”的变化,主要是基于哪些因素的考虑,进行适当的说明。
本发明采用质谱条件相对于现有技术中的“源温为105℃-115℃;脱溶剂温度为340℃-360℃;脱溶剂气流速度为600l·h-1-700l·h-1”的质谱条件,检测灵敏度更高(100倍左右),重现型更好。
优选地,所述的8大类74种禁限用药物检测方法,其中所述禁限用药物包括β-受体激动剂、磺胺、喹喏酮、大环内酯、苯并咪唑、镇静剂、抗病毒和截短侧耳素等8类药物。
大环内酯类药物的分子量较大,结构极为复杂,且极性较高,在液相分析中一般需要衍生化处理,而本发明采用lc-ms技术,大环内酯类药物不用衍生化。因此在检测过程中常常很难同其他的药物同时检测获得,而在实际生产中,大环内酯类抗生素的使用和残留是较为普遍的,因此,通过同一分析系统将其同其他药物同时检测到成为农药残留检测领域的一个难题。
优选地,所述禁限用药物为奥西那林、西马特罗、特布他林、沙丁胺醇、齐帕特罗、西布特罗、吡布特罗、丙卡特罗、瑞普特罗、非诺特罗、羟苄羟麻黄碱、羟甲基克伦特罗、克伦普罗、克仑塞罗、氯丙那林、克仑特罗、妥布特罗、莱克多巴胺、马布特罗、美托洛尔、马喷特罗、溴布特罗、福莫特罗、班布特罗、奥达特罗、喷布特罗、苯乙醇胺a、磺胺醋酰、磺胺二甲恶唑、磺胺嘧啶、磺胺塞唑、磺胺吡啶、磺胺甲嘧啶、磺胺异恶唑、磺胺二甲嘧啶、磺胺甲氧哒嗪、磺胺多辛、磺胺苯酰、磺胺甲恶唑、磺胺地索辛、磺胺间甲氧嘧啶、磺胺喹喔啉、吡哌酸、氧氟沙星、加替沙星、沙拉沙星、奥比沙星、曲伐沙星、加雷沙星、诺氟沙星、环丙沙星、培氟沙星、洛美沙星、达氟沙星、恩诺沙星、吉米沙星、莫西沙星、司帕沙星、二氟沙星、那氟沙星、萘啶酸、氟甲喹、金刚烷胺、金刚乙胺、噻苯咪唑、阿苯达唑砜、奥芬达唑、克林霉素、罗红霉素、替米考星、沃尼妙林、泰妙菌素、氯丙嗪、氮哌酮中的一种、几种或全部。
所述8大类74种药物涵盖药物种类广,基本覆盖畜牧养殖过程中常用药物,对防范动物产品,尤其是羊奶及奶制品中违禁药物残留风险意义重大。
其中,多通道采集模式,主要针对于解决同一方法中检测药物数量多,同一通道检测药物数量受仪器本身条件限制的难题而提出的,而分时段采集模式主要解决全时段信号采集过程待测药物采集点数不够而造成灵敏度和准确度不够的问题,分时段采集模式保证该时段药物在能保证更充分的扫描点数,在保证准确度的同时大大提高了检测的灵敏度。因此该方法采用多通道分时段模式进行待测药物数据采集。
在一种优选的实施方式中,本发明兽药残留的检测方法包括如下步骤:
(1)样品前处理:羊奶样品提取:准确称取2g(精确到0.01g)羊奶于50ml离心管中,加入10ml0.5%甲酸乙腈,涡旋混合5min,9500r·min-1离心5min,取上清液于一50ml离心管中,重复提取一次,合并提取液,待过净化柱。
奶粉样品提取:准确称取5g(精确到0.01g)奶粉样品,加入适量水溶解,并最终定容于20ml,充分混匀后,准确称取2ml羊奶于50ml离心管中,后加入8ml0.5%甲酸乙腈,涡旋混合5min,9500r·min-1离心5min取上清液于一50ml离心管中,重复提取一次,合并提取液,待过净化柱。
净化:将全部提取液转移至事先用85%乙腈水活化的spe柱中,保持流速1d·s-1,收集全部滤过液,40℃氮气吹至近干,用初始流动相定容至1ml,9500r·min-1离心5min,上液层使用0.22μm滤膜过滤,待上机测定。
(2)74种禁限用药物的测定
液相条件:色谱柱:acquityuplcbehc18(100mm×2.1mm,1.7μm);流速:0.3ml·min-1;柱温:35℃;流动相a:甲醇,b:0.1%甲酸水溶液,0~0.5min,3%a保持不变,0.5~2.0min,3%a线性变化至25%;2.0~3.5min,25%a保持不变,3.5~3.6min,25%a线性变化至40%;3.6~4.0min,40%a保持不变;4.0~5.5min,40%a线性变化至90%;5.5~8.0min,90%a保持不变;8.0~8.1min,90%a线性变化至3%,8.1~10.5min,3%a保持不变。
质谱条件:电离模式:esi+;毛细管电压:3.0kv;萃取锥孔电压:3.0v;rf透镜电压:0.5v;源温:150℃;脱溶剂温度:600℃;锥孔气流速:50l·h-1;脱溶剂气流速:900l·h-1;碰撞气流速:0.14ml·min-1;采集模式:多channels多时段mrm采集。
实施例
实施例1
1仪器与材料
1.1仪器
超高效液相色谱仪(h-classuplc,waters公司);三重四极杆质谱仪(xevotq-xs,waters公司);masslynxv4.1数据处理软件(waters公司);3k15型离心机(sigma公司);milli-q纯水仪(millipore公司);氮吹仪(organomation公司)。
1.2材料
甲醇、乙腈、甲酸等有机溶剂均为色谱纯(fisher公司);spe柱(60mg,3cc,waters公司);色谱柱:acquityuplcbehc18(100mm×2.1mm,1.7μm,waters公司)。
β-受体激动剂、磺胺、喹喏酮、大环内酯、苯并咪唑、镇静剂、抗病毒和截短侧耳素类等8类74种兽药购于德国dr.ehrenstorfer公司和百灵威公司,纯度均在97%以上。
羊奶及奶粉样品购于电商超市,选择经lc-ms/ms分析确认为不含所述74种药物任一种的阴性样本作为基质添加样品
样品如为羊奶:准确称取2g(精确到0.01g)空白羊奶于50ml离心管中,定量加入所述74种禁限用药物,加入10ml0.5%甲酸乙腈,涡旋混合5min,9500r·min-1离心5min,取上清液于一50ml离心管中,重复提取一次,合并提取液,待过净化柱。
样品如为羊奶粉:准确称取5g(精确到0.01g)奶粉样品,加入适量水溶解,并最终定容于20ml,充分混匀后,准确称取2ml羊奶于50ml离心管中,后加入10ml0.5%甲酸乙腈,涡旋混合5min,9500r·min-1离心5min取上清液于一50ml离心管中,重复提取一次,合并提取液,待过净化柱。
净化:将全部提取液转移至事先用85%乙腈水活化的spe柱中,保持流速1d·s-1,收集全部滤过液,40℃氮气吹至近干,用初始流动相定容至1ml,9500r·min-1离心5min,上液层使用0.22μm滤膜过滤,待上机测定。
2方法与结果
2.1方法
2.1.1色谱条件
色谱柱:acquityuplcbehc18(100mm×2.1mm,1.7μm);流速:0.3ml·min-1;柱温:35℃;流动相a:甲醇,b:0.1%甲酸水溶液,0~0.5min,3%a保持不变,0.5~2.0min,3%a线性变化至25%;2.0~3.5min,25%a保持不变,3.5~3.6min,25%a线性变化至40%;3.6~4.0min,40%a保持不变;4.0~5.5min,40%a线性变化至90%;5.5~8.0min,90%a保持不变;8.0~8.1min,90%a线性变化至3%,8.1~10.5min,3%a保持不变。
2.1.2质谱条件:
电离模式:esi+;毛细管电压:3.0kv;萃取锥孔电压:3.0v;rf透镜电压:0.5v;源温:150℃;脱溶剂温度:600℃;锥孔气流速:50l·h-1;脱溶剂气流速:900l·h-1;碰撞气流速:0.14ml·min-1;采集模式:多channels多时段mrm采集。
2.2质谱条件优化
β-受体激动剂、磺胺、喹喏酮、大环内酯、苯并咪唑、镇静剂、抗病毒和截短侧耳素类等8类药物结构中均含有氨基结构,因此选用正离子模式采集数据,msscan模式下进行一级质谱分析,得到[m+h]+峰,并优化各自聚焦电压使其准分子离子峰响应最佳,然后在daughterscan模式下针对各自[m+h]+峰进行二级质谱扫描,获得丰富的碎片离子信息。实验选择各自准分子离子和两对强度较高的子离子以满足欧盟2002/957/ec决议中关于质谱分析法定性定量不少于4分的要求,并优化碰撞电压使其响应强度最佳。
受仪器条件所限,单一通道无法一次性进行全部74种药物的同时扫描,因此实验采用多channels模式,同时因为药物种类较多,出峰时间较为集中在2~6min内的现象,实验对不同channel进行时间分段,保证每一种药物具有充足的扫描频率,实验还对每种药物驻留时间在0.005~0.05ms之间进行优化,保证各色谱峰上都能达到10-12个数据采集点,确保每种药物都能得到较高的灵敏度和准确定量,8大类74种药物优化质谱参数及保留时间见表1。
表1.8大类74种禁限用药物的定性/定量离子(*)对及其对应质谱参数及保留时间
2.3基质效应考察:
动物源性基质采用质谱进行定量分析时会存在不同程度和来源的基质效应,为评估基质效应的影响,一般会设计基质效应对照实验。实验结果发现8大类药物在羊奶基质中均有不同程度的基质效应存在,其中β-受体激动剂me在0.56~1.08之间、磺胺me在0.39~0.93之间、喹喏酮me在0.57~1.06之间、大环内酯、苯并咪唑、镇静剂、抗病毒和截短侧耳素类在0.32~1.06之间,因此在检测过程中应采用基质加标溶液,消除基质效应的影响。不同药物基质抑制程度见图5。
2.4方法验证
2.4.1专属性实验
空白羊奶样品添加β-受体激动剂(27种)、磺胺(15种)、喹喏酮(20种)、大环内酯(3种)、苯并咪唑(3种)、镇静剂(2种)、抗病毒(2种)和截短侧耳素类(2种)等8类74种禁限用药物,并与空白样品色谱图进行比较,结果发现74种药物均能在10.5分钟内,均能分离良好,且空白样品色谱图不存在干扰,74种禁限用药物色谱图见图1-4。
2.4.2线性关系和检测限
实验采用空白羊奶样品经前处理,在1.0~80.0μg·l-1浓度范围内分别添加74种混标溶液,配制1.0、5.0、10.0、20.0、80.0μg·l-1基质加标溶液,依次进样,以色谱峰面积为纵坐标,化合物浓度为横坐标做标准曲线;将处理好的空白羊奶样品逐级稀释标准溶液,按10倍信噪比确定方法的定量限(loq)。
表6羊奶中8大类74种药物线性范围、相关系数及定量限值
实验结果表明β-受体激动剂、磺胺、喹喏酮等3类药物在1.0~40.0μg·l-1范围内线性良好,相关系数在0.991-0.999之间,大环内酯、苯并咪唑、镇静剂、抗病毒和截短侧耳素等5类药物在1.0~80.0μg·l-1范围内线性良好,相关系数在0.992-0.998之间,74种药物定量限均小于1.0μg·kg-1,具体见表2。
2.4.3回收率和精密度试验
取空白羊奶样品,添加浓度为1.0、10.0、20.0μg·kg-1三个水平混标溶液,按照1.2的样品前处理方法项下处理样品,每个浓度批内6次平行,不同时间重复测定3个批次,进行添加回收和精密度实验结果见表3。
表3羊奶中8大类74种药物添加回收率及变异系数
通过表3可以看出,本发明方法平均回收率在70.1%~119.7%,批内变异系数为1.1%~17.6%,批间变异系数为2.1%~18.5%,方法的准确度及精密度满足羊奶及奶制品种检测技术要求。
实施例2
2g空白阴性羊奶样品加入20.0μl所述的27种β-受体激动剂类药物混合物(浓度为500ng/ml)。加入10ml0.5%甲酸乙腈,涡旋混合5min,9500r·min-1离心5min,取上清液于一50ml离心管中,重复提取一次,合并提取液,待过净化柱。
净化:将全部提取液转移至事先用85%乙腈水活化的spe柱中,保持流速1d·s-1,收集全部滤过液,40℃氮气吹至近干,用初始流动相定容至1ml,9500r·min-1离心5min,上液层使用0.22μm滤膜过滤,待上机测定。
色谱条件
色谱柱:acquityuplcbehc18(100mm×2.1mm,1.7μm);流速:0.3ml·min-1;柱温:35℃;流动相a:甲醇,b:0.1%甲酸水溶液,0~0.5min,3%a保持不变,0.5~2.0min,3%a线性变化至25%;2.0~3.5min,25%a保持不变,3.5~3.6min,25%a线性变化至40%;3.6~4.0min,40%a保持不变;4.0~5.5min,40%a线性变化至90%;5.5~8.0min,90%a保持不变;8.0~8.1min,90%a线性变化至3%,8.1~10.5min,3%a保持不变。
质谱条件:电离模式:esi+;毛细管电压:3.0kv;萃取锥孔电压:3.0v;rf透镜电压:0.5v;源温:150℃;脱溶剂温度:600℃;锥孔气流速:50l·h-1;脱溶剂气流速:900l·h-1;碰撞气流速:0.14ml·min-1;采集模式:多channels多时段mrm采集。
测定得到的谱图与图1的色谱图形态相同,说明样品中含有27种β-受体激动剂类药物,同时计算各物质的含量在3.67ng/g-5.23ng/g之间,回收率在73.4%-104.6之间,表明准确度较高。
实施例3
2g空白阴性羊奶样品加入20.0μl所述的15种磺胺类药物混合物(浓度为500ng/ml)。加入10ml0.5%甲酸乙腈,涡旋混合5min,9500r·min-1离心5min,取上清液于一50ml离心管中,重复提取一次,合并提取液,待过净化柱。
净化:将全部提取液转移至事先用85%乙腈水活化的spe柱中,保持流速1d·s-1,收集全部滤过液,40℃氮气吹至近干,用初始流动相定容至1ml,9500r·min-1离心5min,上液层使用0.22μm滤膜过滤,待上机测定。
色谱条件
色谱柱:acquityuplcbehc18(100mm×2.1mm,1.7μm);流速:0.3ml·min-1;柱温:35℃;流动相a:甲醇,b:0.1%甲酸水溶液,0~0.5min,3%a保持不变,0.5~2.0min,3%a线性变化至25%;2.0~3.5min,25%a保持不变,3.5~3.6min,25%a线性变化至40%;3.6~4.0min,40%a保持不变;4.0~5.5min,40%a线性变化至90%;5.5~8.0min,90%a保持不变;8.0~8.1min,90%a线性变化至3%,8.1~10.5min,3%a保持不变。
质谱条件:电离模式:esi+;毛细管电压:3.0kv;萃取锥孔电压:3.0v;rf透镜电压:0.5v;源温:150℃;脱溶剂温度:600℃;锥孔气流速:50l·h-1;脱溶剂气流速:900l·h-1;碰撞气流速:0.14ml·min-1;采集模式:多channels多时段mrm采集。
测定得到的谱图与图2的色谱图形态相同,说明样品中含有15种磺胺类药物,同时计算各物质的含量在3.55ng/g-4.38ng/g之间,回收率在71.0%-87.6%之间,表明准确度较高。
实施例4
2g空白阴性羊奶样品加入20.0μl所述的20种喹喏酮类药物混合物(浓度为500ng/ml)。加入10ml0.5%甲酸乙腈,涡旋混合5min,9500r·min-1离心5min,取上清液于一50ml离心管中,重复提取一次,合并提取液,待过净化柱。
净化:将全部提取液转移至事先用85%乙腈水活化的spe柱中,保持流速1d·s-1,收集全部滤过液,40℃氮气吹至近干,用初始流动相定容至1ml,9500r·min-1离心5min,上液层使用0.22μm滤膜过滤,待上机测定。
色谱条件
色谱柱:acquityuplcbehc18(100mm×2.1mm,1.7μm);流速:0.3ml·min-1;柱温:35℃;流动相a:甲醇,b:0.1%甲酸水溶液,0~0.5min,3%a保持不变,0.5~2.0min,3%a线性变化至25%;2.0~3.5min,25%a保持不变,3.5~3.6min,25%a线性变化至40%;3.6~4.0min,40%a保持不变;4.0~5.5min,40%a线性变化至90%;5.5~8.0min,90%a保持不变;8.0~8.1min,90%a线性变化至3%,8.1~10.5min,3%a保持不变。
质谱条件:电离模式:esi+;毛细管电压:3.0kv;萃取锥孔电压:3.0v;rf透镜电压:0.5v;源温:150℃;脱溶剂温度:600℃;锥孔气流速:50l·h-1;脱溶剂气流速:900l·h-1;碰撞气流速:0.14ml·min-1;采集模式:多channels多时段mrm采集。
测定得到的谱图与图3的色谱图形态相同,说明样品中含有20种喹喏酮类药物,同时计算各物质的含量3.72ng/g-5.08ng/g之间,回收率在74.4%-101.6%之间,表明准确度较高。
实施例5
2g空白阴性羊奶样品加入20.0μl所述的克林霉素、罗红霉素和替米考星3种大环内酯类药物混合物(浓度为500ng/ml)。加入10ml0.5%甲酸乙腈,涡旋混合5min,9500r·min-1离心5min,取上清液于一50ml离心管中,重复提取一次,合并提取液,待过净化柱。
净化:将全部提取液转移至事先用85%乙腈水活化的spe柱中,保持流速1d·s-1,收集全部滤过液,40℃氮气吹至近干,用初始流动相定容至1ml,9500r·min-1离心5min,上液层使用0.22μm滤膜过滤,待上机测定。
色谱条件
色谱柱:acquityuplcbehc18(100mm×2.1mm,1.7μm);流速:0.3ml·min-1;柱温:35℃;流动相a:甲醇,b:0.1%甲酸水溶液,0~0.5min,3%a保持不变,0.5~2.0min,3%a线性变化至25%;2.0~3.5min,25%a保持不变,3.5~3.6min,25%a线性变化至40%;3.6~4.0min,40%a保持不变;4.0~5.5min,40%a线性变化至90%;5.5~8.0min,90%a保持不变;8.0~8.1min,90%a线性变化至3%,8.1~10.5min,3%a保持不变。
质谱条件:电离模式:esi+;毛细管电压:3.0kv;萃取锥孔电压:3.0v;rf透镜电压:0.5v;源温:150℃;脱溶剂温度:600℃;锥孔气流速:50l·h-1;脱溶剂气流速:900l·h-1;碰撞气流速:0.14ml·min-1;采集模式:多channels多时段mrm采集。
测定得到的谱图与图4的相对应色谱图形态相同,说明样品中含有克林霉素、罗红霉素和替米考星3种大环内酯类药物,同时计算各物质的含量分别为3.86ng/g、3.69ng/g和5.34ng/g,回收率在73.8%-106.8%之间,表明准确度较高。
实施例6
2g空白阴性羊奶样品加入20.0μl所述的噻苯咪唑、阿苯达唑砜和奥芬达唑3种苯丙咪唑类药物混合物(浓度为500ng/ml)。加入10ml0.5%甲酸乙腈,涡旋混合5min,9500r·min-1离心5min,取上清液于一50ml离心管中,重复提取一次,合并提取液,待过净化柱。
净化:将全部提取液转移至事先用85%乙腈水活化的spe柱中,保持流速1d·s-1,收集全部滤过液,40℃氮气吹至近干,用初始流动相定容至1ml,9500r·min-1离心5min,上液层使用0.22μm滤膜过滤,待上机测定。
色谱条件
色谱柱:acquityuplcbehc18(100mm×2.1mm,1.7μm);流速:0.3ml·min-1;柱温:35℃;流动相a:甲醇,b:0.1%甲酸水溶液,0~0.5min,3%a保持不变,0.5~2.0min,3%a线性变化至25%;2.0~3.5min,25%a保持不变,3.5~3.6min,25%a线性变化至40%;3.6~4.0min,40%a保持不变;4.0~5.5min,40%a线性变化至90%;5.5~8.0min,90%a保持不变;8.0~8.1min,90%a线性变化至3%,8.1~10.5min,3%a保持不变。
质谱条件:电离模式:esi+;毛细管电压:3.0kv;萃取锥孔电压:3.0v;rf透镜电压:0.5v;源温:150℃;脱溶剂温度:600℃;锥孔气流速:50l·h-1;脱溶剂气流速:900l·h-1;碰撞气流速:0.14ml·min-1;采集模式:多channels多时段mrm采集。
测定得到的谱图与图4的相对应色谱图形态相同,说明样品中含有噻苯咪唑、阿苯达唑砜和奥芬达唑3种苯丙咪唑类药物,同时计算各物质的含量分别为3.87ng/g、4.89ng/g和4.05ng/g,回收率在77.4%-97.8%之间,表明准确度较高。
实施例7
2g空白阴性羊奶样品加入20.0μl所述的金刚烷胺和金刚乙胺2种抗病毒类混合物(浓度为500ng/ml)。加入10ml0.5%甲酸乙腈,涡旋混合5min,9500r·min-1离心5min,取上清液于一50ml离心管中,重复提取一次,合并提取液,待过净化柱。
净化:将全部提取液转移至事先用85%乙腈水活化的spe柱中,保持流速1d·s-1,收集全部滤过液,40℃氮气吹至近干,用初始流动相定容至1ml,9500r·min-1离心5min,上液层使用0.22μm滤膜过滤,待上机测定。
色谱条件
色谱柱:acquityuplcbehc18(100mm×2.1mm,1.7μm);流速:0.3ml·min-1;柱温:35℃;流动相a:甲醇,b:0.1%甲酸水溶液,0~0.5min,3%a保持不变,0.5~2.0min,3%a线性变化至25%;2.0~3.5min,25%a保持不变,3.5~3.6min,25%a线性变化至40%;3.6~4.0min,40%a保持不变;4.0~5.5min,40%a线性变化至90%;5.5~8.0min,90%a保持不变;8.0~8.1min,90%a线性变化至3%,8.1~10.5min,3%a保持不变。
质谱条件:电离模式:esi+;毛细管电压:3.0kv;萃取锥孔电压:3.0v;rf透镜电压:0.5v;源温:150℃;脱溶剂温度:600℃;锥孔气流速:50l·h-1;脱溶剂气流速:900l·h-1;碰撞气流速:0.14ml·min-1;采集模式:多channels多时段mrm采集。
测定得到的谱图与图4的相对应色谱图形态相同,说明样品中含有金刚烷胺和金刚乙胺2种抗病毒类药物,同时计算各物质的含量分别为4.43ng/g和4.12ng/g,回收率分别为88.6%和82.4%,表明准确度较高。
实施例8
2g空白阴性羊奶样品加入20.0μl所述的氯丙嗪和氮哌酮2种镇静剂类混合物(浓度为500ng/ml)。加入10ml0.5%甲酸乙腈,涡旋混合5min,9500r·min-1离心5min,取上清液于一50ml离心管中,重复提取一次,合并提取液,待过净化柱。
净化:将全部提取液转移至事先用85%乙腈水活化的spe柱中,保持流速1d·s-1,收集全部滤过液,40℃氮气吹至近干,用初始流动相定容至1ml,9500r·min-1离心5min,上液层使用0.22μm滤膜过滤,待上机测定。
色谱条件
色谱柱:acquityuplcbehc18(100mm×2.1mm,1.7μm);流速:0.3ml·min-1;柱温:35℃;流动相a:甲醇,b:0.1%甲酸水溶液,0~0.5min,3%a保持不变,0.5~2.0min,3%a线性变化至25%;2.0~3.5min,25%a保持不变,3.5~3.6min,25%a线性变化至40%;3.6~4.0min,40%a保持不变;4.0~5.5min,40%a线性变化至90%;5.5~8.0min,90%a保持不变;8.0~8.1min,90%a线性变化至3%,8.1~10.5min,3%a保持不变。
质谱条件:电离模式:esi+;毛细管电压:3.0kv;萃取锥孔电压:3.0v;rf透镜电压:0.5v;源温:150℃;脱溶剂温度:600℃;锥孔气流速:50l·h-1;脱溶剂气流速:900l·h-1;碰撞气流速:0.14ml·min-1;采集模式:多channels多时段mrm采集。
测定得到的谱图与图4的相对应色谱图形态相同,说明样品中含有氯丙嗪和氮哌酮2种镇静剂类药物,同时计算各物质的含量分别为3.72ng/g和4.29ng/g,回收率分别为74.4%和85.8%,表明准确度较高。
实施例9
2g空白阴性羊奶样品加入20.0μl所述的泰妙菌素和沃尼妙林2种截短侧耳素类混合物(浓度为500ng/ml)。加入10ml0.5%甲酸乙腈,涡旋混合5min,9500r·min-1离心5min,取上清液于一50ml离心管中,重复提取一次,合并提取液,待过净化柱。
净化:将全部提取液转移至事先用85%乙腈水活化的spe柱中,保持流速1d·s-1,收集全部滤过液,40℃氮气吹至近干,用初始流动相定容至1ml,9500r·min-1离心5min,上液层使用0.22μm滤膜过滤,待上机测定。
色谱条件
色谱柱:acquityuplcbehc18(100mm×2.1mm,1.7μm);流速:0.3ml·min-1;柱温:35℃;流动相a:甲醇,b:0.1%甲酸水溶液,0~0.5min,3%a保持不变,0.5~2.0min,3%a线性变化至25%;2.0~3.5min,25%a保持不变,3.5~3.6min,25%a线性变化至40%;3.6~4.0min,40%a保持不变;4.0~5.5min,40%a线性变化至90%;5.5~8.0min,90%a保持不变;8.0~8.1min,90%a线性变化至3%,8.1~10.5min,3%a保持不变。
质谱条件:电离模式:esi+;毛细管电压:3.0kv;萃取锥孔电压:3.0v;rf透镜电压:0.5v;源温:150℃;脱溶剂温度:600℃;锥孔气流速:50l·h-1;脱溶剂气流速:900l·h-1;碰撞气流速:0.14ml·min-1;采集模式:多channels多时段mrm采集。
测定得到的谱图与图4的相对应色谱图形态相同,说明样品中含有泰妙菌素和沃尼妙林2种截短侧耳素类药物,同时计算各物质的含量分别为3.67ng/g和4.15ng/g,回收率分别为73.4%和83.0%,表明准确度较高。
实施例10
2g空白阴性羊奶样品加入20.0μl所述的8大类74种药物的混合物(浓度为500ng/ml)。加入10ml0.5%甲酸乙腈,涡旋混合5min,9500r·min-1离心5min,取上清液于一50ml离心管中,重复提取一次,合并提取液,待过净化柱。
净化:将全部提取液转移至事先用85%乙腈水活化的spe柱中,保持流速1d·s-1,收集全部滤过液,40℃氮气吹至近干,用初始流动相定容至1ml,9500r·min-1离心5min,上液层使用0.22μm滤膜过滤,待上机测定。
色谱条件
色谱柱:acquityuplcbehc18(100mm×2.1mm,1.7μm);流速:0.3ml·min-1;柱温:35℃;流动相a:甲醇,b:0.1%甲酸水溶液,0~0.5min,3%a保持不变,0.5~2.0min,3%a线性变化至25%;2.0~3.5min,25%a保持不变,3.5~3.6min,25%a线性变化至40%;3.6~4.0min,40%a保持不变;4.0~5.5min,40%a线性变化至90%;5.5~8.0min,90%a保持不变;8.0~8.1min,90%a线性变化至3%,8.1~10.5min,3%a保持不变。
质谱条件:电离模式:esi+;毛细管电压:3.0kv;萃取锥孔电压:3.0v;rf透镜电压:0.5v;源温:150℃;脱溶剂温度:600℃;锥孔气流速:50l·h-1;脱溶剂气流速:900l·h-1;碰撞气流速:0.14ml·min-1;采集模式:多channels多时段mrm采集。
测定得到的谱图与图1-图4的相对应色谱图形态相同,说明样品中含有上述74种药物,同时计算各物质的含量分别在3.52ng/g-5.68ng/g之间,回收率在70.4%-113.6%之间,表明准确度较高。
- 还没有人留言评论。精彩留言会获得点赞!