一种测定抗Jo-1抗体的试剂盒及检测方法与流程
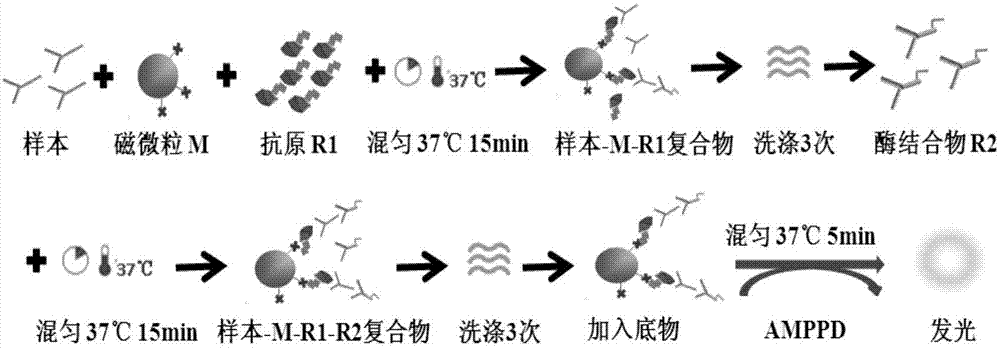
本发明属于磁微粒化学发光免疫诊断
技术领域:
,具体涉及一种测定抗jo-1抗体的试剂盒及检测方法。
背景技术:
组氨酰-trna合成酶(histidyl-trnasynthetase;jo-1)是一种分子量为50kda的细胞浆磷蛋白,它能将胞浆中游离的组氨酸连接到相应的trna上,并以mrna为模板形成多肽中发挥了重要作用。同时我们发现一些jo-1抗体阳性的患者血清能够与trna发生反应。抗jo-1抗体常见于多发性肌炎(polymyositis;pm),阳性检出率可达40%-50%,在pm/dm(皮肌炎)患者的阳性检出率为25%,单独dm中的检出率不足10%,在其他自身免疫性疾病中抗jo-1抗体为阴性,因而抗jo-1抗体对诊断pm具有特异性。pm与硬皮病重叠的患者,抗jo-1抗体的阳性率检出率可高达85%,进行性系统性硬化(pss)/pm中为25%,pm伴肺间质纤维化者抗jo-1抗体阳性率可达60%。目前对于抗jo-1抗体的检测方法已有报道,对于此病的检测方法主要为间接免疫荧光法和酶联免疫吸附法,但这些方法都存在着不足之处;一、间接免疫荧光法该法的基本原理是血清样本中的特异性抗体与切片中的抗原特异性结合后,继用间接荧光抗体,与抗原抗体复合物结合,形成抗原抗体荧光复合物。在荧光显微镜下,根据复合物的发光情况来确定所检测的结果。该方法评价:由于结合在抗原抗体复合物上的荧光素抗体增多,发出的荧光亮度强,因而其敏感性强。但是其不足也是明显的:(1)运用此法是可能出现假阳性。(2)在分析结果时无法根据分子量的大小区分非特异性反应。(3)操作相对复杂,需要价格较昂贵的荧光显微镜,在很多基层医院难以推广,同时,不适用于样本量较大的实验室和诊断医院。(4)荧光测定中的本底较高,荧光免疫技术用于定量测定有一定困难。(5)结果判定需要有经验的专业人员,分析结果的客观性不足。二、酶联免疫吸附法elisa检测抗jo-1抗体,简便易行,特异性高,与间接免疫荧光法联合检测,可为临床对pm的诊断和治疗提供更为客观的实验依据。但与其他生物检测或免疫检测比较,这种elisa检测方法、技术、工具或产品仍有较多的不足而使其应用受限,这些不足主要包括以下几个方面:(1)检测试剂在检测过程中为开放方式,不但容易受外界环境的影响,而且容易引起各种试剂之间的交叉污染而影响检测结果;(2)elisa检测范围和灵敏度都比较低。(3)elisa方法的检测时间较长,完成一个测试一般需要2个小时以上,不能完全满足临床上的快速诊断的需求。(4)elisa方法不能随机进样检测,检测结果存在滞后性。cn105466913a公开了一种使用磁微粒化学发光定量检测抗jo-1抗体igg的试剂盒,所述试剂盒包括anti-jo-1igg校准品、anti-jo-1igg试剂1号、anti-jo-1igg试剂2号、anti-jo-1igg磁分离试剂、anti-jo-1igg质控品和清洗液,所述anti-jo-1igg试剂1号为1个含有生物素标记的jo-1抗原和牛血清白蛋白的tris缓冲液的瓶;所述anti-jo-1igg试剂2号为含有碱性磷酸酶标记的羊抗人多克隆抗体和牛血清白蛋白的tris缓冲液的瓶。该专利中仅采用生物素标记的jo-1抗原,从而使得抗jo-1抗体的检测灵敏度较低。技术实现要素:本发明所要解决的技术问题是提供一种检测灵敏度高的测定抗jo-1抗体的试剂盒及检测方法。为解决以上技术问题,本发明采取如下技术方案:本发明的一个目的是提供一种测定抗jo-1抗体的试剂盒,所述的试剂盒包括第一试剂,所述的第一试剂包括trna以及偶联有生物素的jo-1抗原。本发明中,由于jo-1抗原具有酶活性,能够与trna结合并连接组氨酸,因而,我们在抗原中加入一定量的trna,通过trna以及trna与jo-1抗原结合形成的复合物,增加jo-1抗体的检测灵敏度。优选地,所述的trna为组氨酸trna。优选地,所述的第一试剂中所述的偶联有生物素的jo-1抗原的浓度为0.5~1ug/ml。优选地,所述的第一试剂中所述的trna的浓度为0.3~0.6ug/ml。优选地,所述的第一试剂还包括rna酶抑制剂,所述的rna酶抑制剂在所述的第一试剂中的质量浓度为0.005~0.02%。优选地,所述的偶联有生物素的jo-1抗原中,所述的生物素和所述的jo-1抗原的投料质量比为1:3~5。优选地,所述的试剂盒还包括第二试剂、磁微粒试剂、化学发光底物、校准品、质控品和清洗液,其中,所述的第二试剂包括偶联有碱性磷酸酶的抗人igg抗体。进一步优选地,所述的第二试剂中所述的偶联有碱性磷酸酶的抗人igg抗体的浓度为0.5~1ug/ml,所述的偶联有碱性磷酸酶的抗人igg抗体中所述的碱性磷酸酶和所述的抗人igg抗体的投料质量比为1:0.9~1.1。本发明中采用的化学发光底物为申请号为cn201510359183.0公开的一种碱性磷酸酶的酶促化学发光底物。本发明的化学发光底物具有强度高、灵敏度高、持续时间长、稳定性好等优点。由于amppd可以起到共表面活性剂的作用,能使该化学发光底物更好的结合到化学发光缓冲体系中,从而大幅度提高化学发光效率,在碱性磷酸酶的催化下释放光子。本发明中的磁微粒试剂为本领域常用的磁微粒试剂,可市购获得。本发明的另一个目的是提供一种所述的试剂盒的制备方法,所述的第一试剂的制备方法包括如下步骤:步骤1:将jo-1抗原与经n-羟基琥珀酰亚胺活化的生物素混合,在20~30℃下混匀反应20~40min;步骤2:加入物质的量浓度为0.04~0.06mol/l的三羟甲基氨基甲烷缓冲液,在25~35℃下混匀反应20~40min,再加入甘油,获得生物素化的jo-1抗原;步骤3:用ph为7~8、物质的量浓度为0.01~0.02mol/l的磷酸盐缓冲液将所述的生物素化的jo-1抗原稀释成浓度为0.5~1ug/ml的混合溶液。步骤4:在步骤3的混合溶液中加入组氨酸trna至终浓度为0.3~0.6ug/ml以及加入rna酶抑制剂至终质量浓度为0.005~0.02%,即得所述的第一试剂。优选地,第二试剂的制备方法包括如下步骤:步骤1:将抗人igg抗体加入到浓度为9~11mg/ml的2-亚胺基硫烷盐酸盐偶联剂中,在15~25℃下静置10~30min;步骤2:加入0.07~0.09mol/l甘氨酸溶液,在15~25℃下静置3~5min,用g-25凝胶柱除盐,收集活化后的抗人igg抗体;步骤3:将碱性磷酸酶加入到3~5mg/ml的4-(n-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯溶液中,在20~30℃下静置20~40min,用g-25凝胶柱除盐,收集活化后的碱性磷酸酶;步骤4:将活化后的抗人igg抗体和活化后的碱性磷酸酶混合,在4~6℃下静置15~25h,用supperdex200凝胶纯化柱纯化,获得连接物浓溶液;步骤5:将步骤4中的连接物浓溶液用含质量比为1%的牛血清白蛋白、ph为7.8~8.0、物质的量浓度为0.04~0.06mol/l的三羟甲基氨基甲烷缓冲液稀释到偶联有碱性磷酸酶的抗人igg抗体的浓度为0.5~1ug/ml,即得所述的第二试剂。优选地,校准品的制备方法包括如下步骤:将抗jo-1抗体用ph为7~7.5、物质的量浓度为5~10mmol/l的磷酸盐缓冲液稀释成浓度分别为20ru/ml的第一校准品与200ru/ml的第二校准品。优选地,质控品的制备方法包括如下步骤:将抗jo-1抗体用ph为7~7.5、物质的量浓度为5~10mmol/l的磷酸盐缓冲液稀释成浓度分别为10ru/ml的第一质控品与80ru/ml的第二质控品。本发明的第三个目的是提供一种所述的试剂盒的检测方法,包括如下步骤:(1)在检测管中依次加入磁微粒试剂与第一试剂,然后加入待测样本,混匀,在36~38℃下温育10~25min,再用清洗液在磁场作用下清洗,其中所述磁微粒试剂、所述第一试剂和所述待测样本的投料体积比为1:0.5~2:0.2~0.5;(2)去除磁场,然后加入第二试剂,混匀,在36~38℃下温育10~25min,再用清洗液在磁场作用下清洗,其中所述待测样本与所述第二试剂的投料体积比为1:4~8;(3)去除磁场,然后加入化学发光底物,充分混悬后在36~38℃下温育5~10min,检测相对发光强度值。由于以上技术方案的实施,本发明与现有技术相比具有如下优点:本发明的试剂盒及检测方法具有稳定性好,灵敏度高,重复性好等优点,该检测体系能够随机上样,任意组合,连续检测,同时大大缩短了检测时间,1小时能完成120个测试,而且操作简单方便,真正实现了检测全自动化,避免了认为操作带来的结果偏差。本发明的检测结果与传统方法相比,符合性一致,且jo-1抗体阳性在皮肌炎/多肌炎中的的检出率提高至35%~40%,同时阳性信号值提高了10%~20%。附图说明附图1为检测原理图;附图2为实施例1的试剂盒的线性回归曲线。具体实施方式下面结合具体实施例对本发明做进一步详细的说明,但本发明并不限于以下实施例。实施例中采用的实施条件可以根据具体使用的不同要求做进一步调整,未注明的实施条件为本行业中的常规条件,本发明中的试剂均可市购获得。实施例1:(一)第一试剂的制备1、材料与仪器:材料:jo-1抗原、n-羟基琥珀酰亚胺活化的生物素、三羟甲基氨基甲烷缓冲液、甘油、磷酸盐缓冲液;仪器:试剂低温保存箱、生化培养箱。2、制备步骤:步骤1:将2mg的jo-1抗原与0.5mg经n-羟基琥珀酰亚胺活化的生物素混合,在25℃下混匀反应30min;步骤2:加入20ul的物质的量浓度为0.05mol/l的三羟甲基氨基甲烷缓冲液,在30℃下混匀反应30min,再加入600ul甘油,获得生物素化的jo-1抗原,在-20℃保存备用;步骤3:用ph为7.5、物质的量浓度为0.01mol/l的磷酸盐缓冲液将生物素化的jo-1抗原稀释成浓度为1ug/ml的混合溶液。步骤4:在步骤3中混合溶液中加入终浓度为0.6ug/ml的组氨酸trna以及终质量浓度为0.01%的rna酶抑制剂,即得第一试剂。(二)第二试剂的制备1、材料与仪器:材料:抗人igg抗体、碱性磷酸酶、偶联剂2-亚胺基硫烷盐酸盐、甘氨酸、三羟甲基氨基甲烷缓冲液;仪器:g-25凝胶柱、试剂低温保存箱、supperdex200凝胶纯化柱、分析天平、生化培养箱;2、制备步骤:步骤1:将3mg抗人igg抗体加入到40ml浓度为10mg/ml的2-亚胺基硫烷盐酸盐偶联剂中,在20℃下静置20min;步骤2:加入2ml的0.08mol/l甘氨酸溶液,在20℃下静置4min,用g-25凝胶柱除盐,收集活化后抗人igg抗体,5℃保存备用;步骤3:将3mg碱性磷酸酶加入到4mg/ml的4-(n-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯溶液中,在25℃下静置30min,用g-25凝胶柱除盐,收集活化后碱性磷酸酶,5℃保存备用;步骤4:将活化后的抗人igg抗体和活化后的碱性磷酸酶混合,在5℃下静置20h,用supperdex200凝胶纯化柱纯化,获得连接物浓溶液,在5℃保存备用;步骤5:将步骤4中的连接物浓溶液用含质量比为1%的牛血清白蛋白、ph为7.8-8.0、物质的量浓度为0.05mol/l的三羟甲基氨基甲烷缓冲液稀释到含碱性磷酸酶标记的抗人igg抗体的浓度为1ug/ml,即得第二试剂。(三)校准品的制备1、材料与仪器:材料:抗jo-1抗体、磷酸盐缓冲液、标准品;2、制备步骤:将抗jo-1抗体用ph为7~7.5、物质的量浓度为10mmol/l的磷酸盐缓冲液稀释成浓度分别为20ru/ml的第一校准品与200ru/ml的第二校准品。(四)质控品的制备1、材料与仪器:材料:抗jo-1抗体、磷酸盐缓冲液、标准品;2、制备步骤:将抗jo-1抗体用ph为7~7.5、物质的量浓度为10mmol/l的磷酸盐缓冲液稀释成浓度分别为10ru/ml的第一质控品与80ru/ml的第二质控品。(五)清洗液的制备1、材料与仪器:材料:磷酸盐缓冲液、吐温-20;2、制备步骤:在物质的量浓度为10mmol/l的磷酸盐缓冲液中加入终浓度为0.05%的吐温-20,即得清洗液。(六)化学放光底物化学发光底物为申请号为cn201510359183.0公开的一种碱性磷酸酶的酶促化学发光底物中的表1.2apsh-1的配方二所示,即对比例1与实施例1基本相同,不同之处在于:第一试剂仅包括偶联有生物素的jo-1抗原。实施例2:全自动化学发光测定仪测试步骤全自动化学发光测定仪测试依次进行以下步骤:步骤1:检测试剂盒需与本公司全自动化学发光测定仪配套使用,将试剂盒放入全自动化学发光测定仪试剂仓相应位置,试剂盒信息通过条形码扫描仪输入仪器系统或通过仪器配套软件设定。步骤2:将校准品置于仪器样本仓。通过条形码扫描仪识别校准品信息,并在仪器系统中分配校准品位置。步骤3:将质控物/待测样本置于仪器样本仓,通过仪器配套软件编辑相应检测信息。步骤4:启动运行程序,所有校准品/质控物/待测样本处理步骤将自动执行。其中,以设备检测待测样本为例,设备自动执行时的步骤为:步骤1:在检测管中依次加入50μl磁微粒分离试剂与50μl第一试剂,然后加入20μl待测样本,混匀,在37℃下温育20min;步骤2:添加磁场,使步骤1温育后的体系在磁场中沉降,去除上清液,加入500μl清洗液进行3-5次清洗后;步骤3:去除磁场,然后向步骤2清洗后的体系中加入100μl第二试剂,混匀,在37℃下温育15min;步骤4:添加磁场,使步骤3温育后的体系在磁场中沉降,去除上清液,加入500μl清洗液进行3-5次清洗后,去除磁场,震荡使磁微粒充分混悬;步骤5:添加磁场重复步骤4进行再次清洗,使混悬后的磁微粒在磁场中沉降,去除上清液,去除磁场,然后加入150μl化学发光底物,去除磁场,充分混悬后在37℃下温育5min检测相对发光强度值。当检测试剂盒配合全自动化学发光测定仪配套使用时,从稀释、加样、孵育、清洗以及检测步骤均实现了全自动化,可以无人值守流水操作。全自动封闭操作系统,不仅操作简易方便、可靠性高、稳定性好、检测结果重复性好,避免了人为操作带来的结果偏差,同时有效的提高了检测效率及节省人力成本。实施例1的试剂盒的性能评估:1、本发明试剂盒(1)样本比对阴、阳性符合率:本发明试剂盒检测317例临床血清抗jo-1抗体的含量,并与国外知名公司同类产品进行临床比对表1。结果表明,本发明抗jo-1抗体试剂盒阴性符合率100.00%(217/217),阳性符合率100.00%(100/100),说明本试剂盒临床符合率高。表1(2)最低检测限:用零浓度校准品(浩欧博主校准品s0),按试剂盒说明书操作步骤重复测定20次,得出20次测定结果的rlu值,计算其平均值m和标准差sd,得出(m+2sd)所对应的rlu值。根据零浓度校准品与相邻校准品之间的浓度-rlu值结果进行两点回归拟合得出一次方程,将(m+2sd)所对应的rlu值带入上述方程中,计算得出对应的浓度,即为最低检测限。实施例1的试剂盒的最低检测限为0.112ru/ml,而酶联免疫法的灵敏度为2ru/ml。(3)线性:用零浓度校准品(企业主校准品s0)将接近测定范围上限(400.00ru/ml)的企业线性高值参考品按照1/2、1/4、1/8、1/16、1/40、1/80、1/200、1/400的比例稀释,其中低值浓度的样本接近测定范围的下限。按试剂盒说明书操作步骤进行测定,对每一浓度的样本均重复测定3次,计算其平均值,将结果的平均值和对应理论浓度用线性回归进行拟合计算。用实施例1的试剂盒检测稀释样本,将理论浓度与实际检测浓度做线性回归,结果见图2。(4)准确度:通过加样回收评估其准确度。以一份高值血清或中值血清血清按照1:9添加到基础血清中,计算其浓度。添加回收实验:加样回收率=添加后样本值/(0.1*样本a+0.9样本b)*100%,其中,样本a为高值血清、中值血清;样本b为基础血清。实施例1的试剂盒的血清加样回收率在85%-115%之间。具体数据见表2:表2高值/中值血清基础血清混合血清加样回收率ru/mlru/mlru/ml%354.321.1335.1296.35%154.210.9517.03104.63%(5)精密度:对三种不同浓度的质控品进行检测,每天两次,分上下午检测,每次进行4个重复,共检测10天,每种浓度共测定80次,计算变异系数。结果表明实施例1的试剂盒的变异系数在10%以内。具体数据见表3。表3(6)稳定性:将实施例1的试剂盒37℃放置7天后,测定高、中、低3个浓度的质控,要求偏差小于±15%。结果表明3种质控的检测浓度均在质控的浓度范围内(偏差小于±15%)。表明实施例1的试剂盒稳定性好,符合临床要求。具体数据见表4。表4(7)干扰:对高、中、低不同浓度值的样本添加不同浓度的胆红素、血红蛋白、类风湿因子、脂、rf、hama检测结果显示,添加物质对实施例1的试剂盒的检测结果没有影响。具体数据见表5。表5干扰物添加浓度信号值偏差(%)胆红素20mg/dl2.8血红蛋白1000mg/dl1.9甘油三酯2000mg/dl3.4人抗小鼠抗体hama2000ng/ml2.9类风湿因子rf1000iu/ml4.6对比例1的试剂盒的样本比对:阴、阳性符合率:对比例1的试剂盒检测317例临床血清抗jo-1抗体的含量,并与国外知名公司同类产品进行临床比对,结果见表6。结果表明,对比例1抗jo-1抗体试剂盒阴性符合率100.00%(217/217),阳性符合率83%(83/100)。表6以上对本发明做了详尽的描述,其目的在于让熟悉此领域技术的人士能够了解本发明的内容并加以实施,并不能以此限制本发明的保护范围,凡根据本发明的精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1