血清中25-羟基维生素D液相色谱串联质谱联用检测方法及试剂盒与流程
本发明属于25-羟基维生素d检测
技术领域:
,尤其是涉及一种可以同时检测25-羟基维生素d2和25-羟基维生素d3的方法和试剂盒。
背景技术:
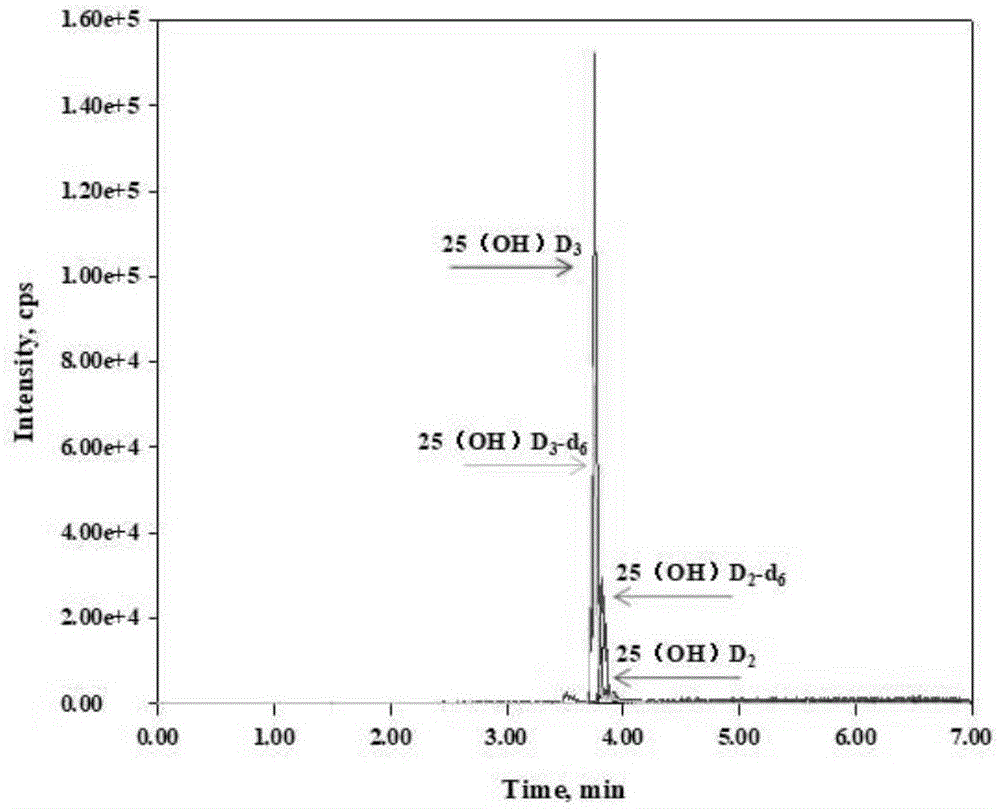
:维生素d有调节钙磷代谢的经典作用和影响细胞增殖分化等非经典作用,是维持人体健康必不可少的一种类固醇激素。维生素d的缺乏时可导致儿童佝偻病和成年人软骨症。近年来,深入的研究表明维生素d缺乏会增加罹患肿瘤、心血管疾病、自发免疫性疾病和精神疾病等常见多发疾患的风险。基于维生素d对于人体健康的重要性和针对目前中国人群维生素d水平偏低的现状,有必要在中国人群中普及维生素d水平检测以及对重点人群进行筛查。25-羟基维生素d(分为25-羟基维生素d2和25-羟基维生素d3)水平被定义为维生素d营养状态的功能指标,已经成为国际上公认的衡量维生素d的最佳指标。目前常用的检测25(oh)d含量的方法有竞争性蛋白结合法(cpba)、放射免疫法(ria)、酶联免疫吸附法(elisa)、化学发光免疫测定法(clia)、高效液相色谱法(hplc)等。有的方法耗时、步骤冗杂,无法满足临床简便、高通量的要求;有的方法具有放射性污染的潜在风险,对实验人员和环境都有损害;有的方法容易与其他非目标化合物发生交叉反应,导致方法特异性不足,hplc相对于免疫法可以区分开25(oh)d2和25(oh)d3,但是25(oh)d2浓度太低,液相色谱法检测限达不到要求。随着检测技术及精度的发展,hplc逐步被液相色谱-串联质谱法(lc-ms/ms)所替代。lc-ms/ms是色谱法中最为常用的25(oh)d检测方法,样品经处理后采用液相色谱分离,检测器为串联质谱仪,在多反应监测扫描模式下,可同时检测25(oh)d2和25(oh)d3,具有非常高的灵敏度、特异性和准确性,被国际公认为25(oh)d检测的金标准。体内维生素d浓度的准确定量是诊断维生素d缺乏相关疾病诊断和治疗反馈效果的重要指标。现有的基于液相色谱和串联质谱联用的检测方法大多数为实验室自建方法,缺乏标准化。由于不同的实验室采用的试剂、标准品和样品的处理方法不同,常导致不同实验室之间的检测结果差异大,且在前处理上也会消耗大量的时间。因此,采用包含校准品、萃取试剂、质控品等检测所需试剂的试剂盒进行检测是解决这一问题的重要途径。技术实现要素:有鉴于此,本发明旨在提出一种血清中25-羟基维生素d液相色谱串联质谱联用检测方法,以克服现有技术的缺陷,在高准确度、精密度的前提下进一步的缩短前处理时间,提高工作效率。为达到上述目的,本发明的技术方案是这样实现的:血清中25-羟基维生素d液相色谱串联质谱联用检测方法,包括以下步骤:(1)取血清样品于样品管中;(2)向每个样品中加入含有内标混合液的沉淀剂,涡旋混匀;(3)向每个样品中再加入萃取剂,涡旋混匀;(4)样品静置后取上清液于进样管中;(5)室温下氮气吹干后加入复溶液,涡旋后采用液相色谱串联质谱法进行检测,并通过比较25-羟基维生素d和25-羟基维生素d的内标峰面积来得出待测血清中25-羟基维生素d的含量。应当说明的是,本发明中的液相色谱串联质谱法采用液相色谱串联质谱联用仪。优选的,步骤(2)中,内标混合液包括25-羟基维生素d2内标和25-羟基维生素d3内标。优选的,步骤(1)中,血清的选用量为90-200μl;步骤(2)中,含有内标混合液的沉淀剂的用量为300-600μl,其中内标混合液与沉淀剂的体积比为1:(10-30),涡旋混匀时间为30-90s;步骤(3)中,萃取剂的用量为800-1000μl,涡旋混匀时间为60-120s;步骤(4)中,样品静置时间为30-90s,加入进样管的上清液体积为750-900μl;步骤(5)中,复溶液的用量为100-200μl,涡旋时间为30-60s;进一步优选的,步骤(1)中,血清的选用量为100μl;步骤(2)中,含有内标混合液的沉淀剂的用量为310μl,其中内标混合液与沉淀剂的体积比为1:(10-30),涡旋混匀时间为60s;步骤(3)中,萃取剂的用量为900μl,涡旋混匀时间为120s;步骤(4)中,样品静置时间为60s,加入进样管的上清液体积为800μl;步骤(5)中,复溶液的用量为100μl,涡旋时间为30s。优选的,步骤(2)中,沉淀剂为甲醇和乙腈按体积比1:1混合的混合溶液;步骤(3)中,萃取剂为hplc级正己烷;步骤(5)中,复溶液为40-60v/v%的甲醇水溶液,洗针液为50~80v/v%的甲醇水溶液;优选的,步骤(5)中,复溶液为50v/v%的甲醇水溶液,洗针液为50v/v%的甲醇水溶液。应当说明的是,洗针液的作用在于平衡测定前后流动相、辅助测定、清洗探针、以及避免前样本对后样本测定的影响。优选的,步骤(5)中,液相色谱串联质谱法检测时的色谱条件如下:采用梯度洗脱程序,0.05~0.3v/v%的甲酸水溶液作为流动相a,0.05~0.3v/v%的甲酸甲醇溶液作为流动相b;优选的,梯度洗脱程序中流动相a采用0.1v/v%的甲酸水溶液,流动相b采用0.1v/v%的甲酸甲醇溶液。优选的,步骤(5)中,梯度洗脱的参数如下:时间流动相a的体积比流动相b的体积比0-2min25→275→982-5min98985-5.5min2→2598→755.5-7min2575优选的,步骤(5)中,液相色谱串联质谱法检测时的色谱条件还包括:色谱柱:c182.1×100mm,3μm;色谱参数:流动相流速0.4-1.0ml/min,柱温35-60℃,检测时间4-10min,进样量10-50μl;优选的,流动相流速为0.5ml/min,柱温40℃;检测时间7min,进样量30μl。优选的,步骤(5)中,液相色谱串联质谱法检测时的质谱条件包括:。优选的,步骤(5)中,液相色谱串联质谱法检测时的质谱条件还包括以下离子源参数:电离源为esi源,采用正离子模式,其他参数如下:优选的,其他参数如下:气帘气cur(psi)16喷雾器gs1(psi)20辅助加热气gs2(psi)50温度tem(℃)500接口加热iheon碰撞气cad(psi)4本发明的另一目的在于提出一种用于如上所述的血清中25-羟基维生素d液相色谱串联质谱联用检测方法的试剂盒,以将其用于上述血清中25-羟基维生素d液相色谱串联质谱联用检测方法,检测血清中25-羟基维生素d。为达到上述目的,本发明的技术方案是这样实现的:一种用于如上所述血清中25-羟基维生素d液相色谱串联质谱联用检测方法的试剂盒,包括以下溶液:(1)校准品:5-40ng/ml的25(oh)d2和5-120ng/ml的25(oh)d3;(2)质控品:5.4-23.5ng/ml的25(oh)d2和4.8-64.6ng/ml的25(oh)d3;(3)内标混合液:200ng/ml的25-羟基维生素d2内标和500ng/ml的25-羟基维生素d3内标;(4)沉淀剂:甲醇和乙腈按体积比1:1混合的混合溶液;(5)萃取剂:hplc级正己烷;(6)复溶液:40~60v/v%的甲醇水溶液;优选的,复溶液为甲醇与水按体积比1:1的混合溶液;(7)流动相:流动相a采用0.05~0.3v/v%的甲酸水溶液,流动相b采用0.05~0.3v/v%的甲酸甲醇溶液;优选的,流动相a采用0.1v/v%的甲酸水溶液,流动相b采用0.1v/v%的甲酸甲醇溶液;(8)洗针液:50~80v/v%的甲醇水溶液;优选的,洗针液为50v/v%的甲醇水溶液。相对于现有技术,本发明所述的血清中25-羟基维生素d液相色谱串联质谱联用检测方法具有以下优势:(1)本发明所述的血清中25-羟基维生素d液相色谱串联质谱联用检测方法,在试剂盒组分与前处理方式的修改下,不再需要单独添加微量内标,避免造成实验误差;不再需要离心这一冗杂耗时的操作步骤,大大缩短了前处理所需要的时间,并简化了整个检测过程,同时也保证了检测的高准确度、高精密度,以及高检测通量。(2)本发明所述的血清中25-羟基维生素d液相色谱串联质谱联用检测方法,通过电压将25-羟基维生素d分子裂解成不同质荷比的子离子,扫描不同质荷比的子离子数量,参考已知25-羟基维生素d内标的浓度,计算出待测25-羟基维生素d浓度,采用本发明的方法和试剂盒检测25-羟基维生素d,精密度和准确度更高。(3)本发明所述的血清中25-羟基维生素d液相色谱串联质谱联用检测方法,可从血清中将25-羟基维生素d提取出来,利用串联质谱仪对标本中25-羟基维生素d进行定量,通过分析可以对人体内25-羟基维生素d水平进行评价和监测,从而对维生素相关疾病进行诊断和治疗效果评估,检测周期显著缩短。所述一种用于如上所述血清中25-羟基维生素d液相色谱串联质谱联用检测方法的试剂盒与上述血清中25-羟基维生素d液相色谱串联质谱联用检测方法相对于现有技术所具有的优势相同,在此不再赘述。附图说明图1为实施例1标准品色谱图;图2为实施例1实测样品色谱图;图3为实施例125-羟基维生素d2的工作曲线图;图4为实施例125-羟基维生素d3的工作曲线图。具体实施方式除有定义外,以下实施例中所用的技术术语具有与本发明所属领域技术人员普遍理解的相同含义。以下实施例中所用的试验试剂,如无特殊说明,均为常规生化试剂;所述实验方法,如无特殊说明,均为常规方法。下面结合实施例及附图来详细说明本发明。实施例1本实施例为血清中25-羟基维生素d液相色谱串联质谱联用检测方法:一、主要实验步骤:(1)准备内标工作液:采用加拿大多伦多研究化学(trc)公司提供的25-羟基维生素d2-d6,medicalisotopes公司提供的25-羟基维生素d3-d6;依据当次实验标本量计算内标标准工作溶液的量。将上述内标混合得到高浓度内标混合液,使用时,用甲醇稀释高浓度内标混合液,充分混匀即可得到内标工作液。上述内标混合液的具体配制方法为:1)根据不同的包装规格,先将两种内标储备液稀释至20μg/ml,分别记为issd2-d6及issd3-d6;2)取100μlissd2-d6,加900μl甲醇,得到浓度为2μg/ml,记为iss1d2-d6;取250μlissd3-d6,加750μl甲醇,得到浓度为5μg/ml,记为iss1d3-d6;3)取500μl的2μg/mliss1d2-d6,500μl的5μg/mliss1d3-d6,加4ml的甲醇,得到内标混合液,即25(oh)d2-d6浓度为200ng/ml,25(oh)d3-d6浓度为500ng/ml,记为isw。(2)分析过程:1、取100μl血清样品于样品管中;2、向每个样品中加入310μl含有内标的沉淀剂,涡旋混匀60s;3、向每个样品中再加入900μl萃取剂,涡旋混匀120s;4、样品静置60s后取800μl上清液于进样管中;5、室温下氮气吹干后加入100μl复溶液,涡旋30s后进样检测。上述分析过程中:内标混合液包括25-羟基维生素d2内标和25-羟基维生素d3内标;沉淀剂为甲醇和乙腈按体积比1:1混合的混合溶液;萃取剂为hplc级正己烷;复溶液为50v/v%的甲醇水溶液;洗针液为50v/v%的甲醇水溶液。(3)结果计算:串联质谱系统中软件可以将检测结果通过比较检测物和对应内标的峰面积来进行计算,给出检测物的浓度并生成数据报告。(4)注意事项:1、同位素标准品用完之后应立即放入-20℃冰箱保存;2、如果试剂已经从试剂瓶倒出,不能再次使用。二、主要试剂:1、本发明的检测方法中,流动相中水、甲酸及甲醇的比例可在相应范围内调节,同时须在质谱仪上进行相应参数的调整,这样所检测的维生素含量结果的准确度和精密度不受影响;2、所有试剂均选用色谱级别;3、配置所用水选用三蒸水或纯水机过滤的超纯水,其电阻≥18mω或电导<5us/cm,ph值为7.0±0.2。三、质谱参数:在串联质谱仪器absciex公司api4000的设置参考用质谱条件见表1:表1质谱相关参数设置需要注意的是,上述参数母离子固定,针对不同的机器或同一品牌机器质谱参数变化时,子离子有可能会发生变化。其中,色谱条件如下:色谱柱:c182.1×100mm,3μm色谱参数:流动相流速0.5ml/min,柱温40℃,检测时间7min,进样量30μl;采用梯度洗脱方式,洗脱参数见表2:表2梯度洗脱条件上述梯度洗脱程序中流动相a采用0.1v/v%的甲酸水溶液,流动相b采用0.1v/v%的甲酸甲醇溶液。质谱检测条件如下:离子源参数:esi源,正离子模式表3质谱检测条件气帘气cur(psi)16喷雾器gs1(psi)20辅助加热气gs2(psi)50温度tem(℃)500接口加热iheon碰撞气cad4需要注意的是,由于每台机器在装机调试时,机器的精密度等不同,以上参数仅供参考,具体调试参数由工程师做少许改动。如图1所示的通过本实施例的方法所得的标品色谱图,图2所示的通过本实施例的方法所得的实际样品色谱图,横坐标代表时间,纵坐标代表离子强度,该图表示不同的检测物在特定时间内的出峰情况,通过图1、图2可以看出检测物的峰型呈正态分布曲线图形,且与干扰物能明显区分开来,又图2实际样品的色谱图中被测目标物质的质量色谱峰保留时间与图1标品色谱图中对应物质的质量色谱峰保留时间一致,进而可以判断检测物出峰达到检测要求。如图3、图4所示的通过本实施例的方法所得的检测物的工作曲线图,横坐标代表检测物浓度,纵坐标代表检测物的峰面积,可以看出呈良好的线性关系,25(oh)d2的线性关系为y=0.0522x+0.0235,线性系数r=0.9983;25(oh)d3的线性关系y=0.0296x+0.0154,线性系数r=0.9996。通过该图中的线性关系可以计算待测物浓度。经计算,实际样品中,25(oh)d2的浓度为11.34ng/ml;25(oh)d3的浓度为9.75ng/ml。实施例2本实施例为血清中25-羟基维生素d液相色谱串联质谱联用检测的试剂盒:本实施的试剂盒可以同时检测25(oh)d2和25(oh)d3。本实施例的试剂盒包括:校准品、质控品、内标混合液、沉淀剂、萃取剂、复溶液、流动相,具体见表4。内标混合液中包括内标品,内标品采用加拿大多伦多研究化学(trc)公司提供的25-羟基维生素d2-d6,medicalisotopes公司提供的25-羟基维生素d3-d6。表4试剂盒的组成(1)含有内标混合液的沉淀剂的使用:将试剂盒中的内标混入到沉淀剂中,并涡旋混匀。。(2)流动相采用的配方:流动相a采用0.1v/v%的甲酸水溶液,流动相b采用0.1v/v%的甲酸甲醇溶液。(3)洗针液:50v/v%的甲醇水溶液。实施例1的方法配合国内常用的串联质谱仪(美国ab公司)以及实施例2的试剂盒,能通过一次实验同时检测血清中25(oh)d2和25(oh)d3,25(oh)d2和25(oh)d3检测的批内不精密度和批间不精密度见表5,25(oh)d2和25(oh)d3检测的加样回收率见表6。由表5和表6可见,检测结果具有很高的精确度和准确度。表525(oh)d2和25(oh)d3检测的批内不精密度和批间不精密度表625(oh)d2和25(oh)d3检测的加样回收率以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1