1α,25-二羟基维生素D高效液相色谱质谱联用法检测试剂盒的制作方法
本发明属于检测领域,具体涉及1α,25-二羟基维生素d高效液相色谱质谱联用法检测试剂盒以及检测方法。
背景技术:
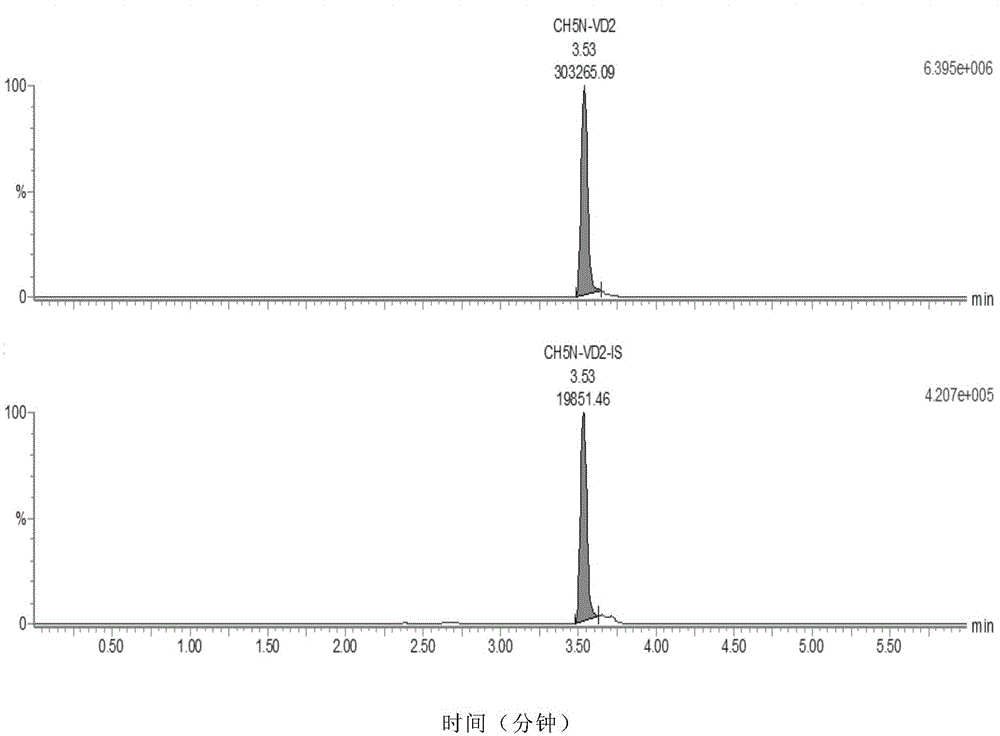
:维生素d为固醇类衍生物,麦角甾醇、麦角骨化醇,具有抗佝偻病作用,又称抗佝偻病维生素。维生素d家族成员包括维生素d1、d2、d3、d4和d5,对健康关系较密切的是d2(麦角钙化醇)和d3(胆固化醇)。它不仅仅只是一种脂溶性维生素,本质上是具多种生理活性的一种激素,具有广泛的生理代谢活性。维生素d缺乏会引起佝偻病、手足抽搐、软骨病等疾病,但是长期摄入过多的维生素d,将引起血管和器官钙化。因此定期检测人体内维生素d的水平,对于衡量人体维生素d补充效果,及维持人体健康具有重要的意义。维生素d可以通过皮肤合成或者食物摄取来产生。维生素d半衰期约3小时,并与维生素d结合蛋白在一起;1α,25-(oh)2维生素d2/d3半衰期约24小时,在血中含量极低;25-羟基维生素d是血中被检测的标志物,因为它半衰期约为3周,较为稳定,又是人体内维生素d的主要储存形式,通过检测它可以确定总体维生素d的情况。维生素d是维持骨骼健康的主要元素。儿童期维生素d的严重缺乏将导致骨骼畸形,即佝偻病。维生素d缺乏是继发性甲状旁腺机能亢进症的常见病因。近年来发现维生素d与癌症、心血管疾病、糖尿病等都有相关性,足量的体内维生素d水平对癌症、多发性硬化症、糖尿病等有一定预防作用。维生素d缺乏的人群可以通过食物、阳光及维生素补充剂提高体内维生素d含量,食物来源包括蛋黄,三文鱼,金枪鱼,鱼肝油,牛肝,人造奶油,酸奶,奶酪等;补充剂提供的维生素d包含两种形式:d2和d3。两种形式都有效,每一种都可以保证充足的维生素d水平。但是2和3是不等同的。d3是人体产生的形式,最近有研究表明d3在快速提高维生素d水平上可高达3倍,而且能维持更加长久。补充剂量取决于年龄和危险因素。推荐的膳食标准是70岁老人为600iu/天,71及以上为800iu/天。一些研究人员提出,维生素d含量高可带来多种健康益处,但是太多会造成伤害。根据美国医学研究所,超过4000iu/天,危害的风险会增加。lα,25(oh)2d常被应用于慢性肾功能损伤、甲状旁腺功能减退以及高钙血症等疾病的治疗,准确定量血清lα,25(oh)2d水平对疾病的诊断及预后监测具有重要作用,然而传统的免疫学检测方法不能区别检测lα,25(oh)2d2和lα,25(oh)2d3,同时受到同分异构体及维生素d结合蛋白等的影响而缺乏足够的检测准确度、特异性。综上所述,本领域迫切需要开发一种分析时间短、灵敏、准确且能够同时定量检测1α,25-二羟基维生素d2和1α,25-二羟基维生素d3的的检测试剂盒及检测方法。技术实现要素:本发明的目的就是一种分析时间短、灵敏、准确且能够同时定量检测1α,25-二羟基维生素d2和1α,25-二羟基维生素d3的的检测试剂盒及检测方法。在本发明的第一方面,提供了一种高效液相色谱质谱联用法检测试剂盒,包括:(1)质控品,所述质控品含1α,25-二羟基维生素d2和1α,25-二羟基维生素d3;(2)同位素内标提取液,所述同位素内标提取液含有1α,25-二羟基维生素d2-d6和1α,25-二羟基维生素d3-d6;(3)稀释液,所述稀释液为饱和一元醇;(4)转化液,所述转化液含有4-苯基-1,2,4-三唑啉-3,5-二酮(ptad);(5)复溶液,所述复溶液为水;(6)流动相添加剂a,所述流动相添加剂a为饱和一元羧酸;以及(7)流动相添加剂b,所述流动相添加剂b为c1-c3胺化合物。在另一优选例中,同位素内标提取液中,1α,25-二羟基维生素d2-d6的浓度为0.5~2ng/ml和1α,25-二羟基维生素d3-d6的浓度为0.5~2ng/ml。在另一优选例中,同位素内标提取液中,1α,25-二羟基维生素d2-d6的浓度和1α,25-二羟基维生素d3-d6的浓度相同。在另一优选例中,同位素内标提取液中含1ng/ml的1α,25-二羟基维生素d2-d6和1ng/ml的1α,25-二羟基维生素d3-d6。在另一优选例中,在所述转化液中,4-苯基-1,2,4-三唑啉-3,5-二酮的浓度为0.01mg/g-10mg/g。在另一优选例中,所述检测试剂盒还包括(8)对照品,所述对照品含1α,25-二羟基维生素d2和1α,25-二羟基维生素d3。在另一优选例中,所述流动相添加剂b选自下组:甲胺、乙胺、丙胺,或其组合。在另一优选例中,所述流动相添加剂b为甲胺。在另一优选例中,所述饱和一元羧酸选自下组:甲酸、乙酸、丙酸、丁酸或其组合。在另一优选例中,所述饱和一元羧酸为甲酸。在另一优选例中,所述饱和一元醇选自下组:甲醇、乙醇或其组合。在另一优选例中,所述饱和一元醇为甲醇。在本发明的第二方面,提供了一种通过高效液相色谱质谱联用法测定所取的生物样品中一种或多种二羟基维生素d代谢物的量的方法,包括:(i)通过电喷雾离子源(esi)对所述一种或多种二羟基维生素d代谢物和内标进行电离,分别产生所述一种或多种二羟基维生素d代谢物和所述内标的至少一种前体离子;(ii)分别产生所述一种或多种二羟基维生素d代谢物和所述内标的所述前体离子的一种或多种碎片离子;和(iii)比较步骤(i)或(ii)或两者中产生的所述一种或多种二羟基维生素d代谢物和所述内标的一种或多种所述离子的量以确定所述生物样品中的所述一种或多种二羟基维生素d代谢物的量;其中,色谱检测过程中的流动相中加入c1-c3胺化合物。在另一优选例中,色谱检测过程中的流动相中加入甲胺。在另一优选例中,所述质谱为串联质谱。在另一优选例中,所述一种或多种二羟基维生素d代谢物包括1α,25-二羟基维生素d2,且其中所述1α,25-二羟基维生素d2的所述母离子的质/荷比为635.4±0.5;和/或所述一种或多种二羟基维生素d代谢物包括1α,25-二羟基维生素d3,且其中所述1α,25-二羟基维生素d3的所述母离子的质/荷比为623.4±0.5。在另一优选例中,其中所述一种或多种碎片离子包括选自质/荷比为314.4±0.5的离子的一种或多种离子。在另一优选例中,所述方法还包括:在通过电喷雾离子源(esi)对所述一种或多种二羟基维生素d代谢物和内标进行电离前,用转化液对一种或多种二羟基维生素d代谢物和内标进行衍生处理。在另一优选例中,色谱检测过程中,所述液相色谱具有下述一个或多色谱条件:(i)流动相包括流动相a和流动相b;其中,流动相a为含流动相添加剂a和流动相添加剂b的水;流动相b为含流动相添加剂a的甲醇;(ii)色谱柱柱温为30~50℃;(iii)流速为0.2~1.0ml/min。在另一优选例中,色谱检测过程中,梯度为:0-0.5min:流动相b为10%-50%,其余为流动相a;0.5-3min:流动相b为50%-95%,其余为流动相a;3.0-4.5min:流动相b为95%,其余为流动相a;4.5-5.0min:流动相b为95%-10%,其余为流动相a;5.0-6.0min:流动相b为10%,其余为流动相a。在另一优选例中,所述流动相添加剂a为饱和一元羧酸;和所述流动相添加剂b为c1-c3胺化合物。在另一优选例中,流动相a中,流动相添加剂a:流动相添加剂b:水的体积比为(0.5~2):(0.5~2):1000;优选地,为1:1:1000。在另一优选例中,流动相a中,流动相添加剂a:甲醇的体积比为(0.5~2):1000;优选地,为1:1000。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1为1α,25-二羟基维生素d2标准品色谱图(上图)和1α,25-二羟基维生素d2-d6同位素内标色谱图(下图)。图2为1α,25-二羟基维生素d3标准品色谱图(上图)和1α,25-二羟基维生素d3-d6同位素内标色谱图(上图)。图3为1α,25-二羟基维生素d2标准曲线图。图4为1α,25-二羟基维生素d3标准曲线图。具体实施方式本发明人经过广泛而深入的研究。通过大量筛选,例如对于稀释剂、复溶液、等的筛选,首次开发了一种能够在一次检测中同时对1a,25-二羟基维生素d2和1a,25-二羟基维生素d3进行定量检测的高效液相色谱质谱联用检测方法。且该检测方法分析时间短、检测结果灵敏度高、准确,且结果重现率高。此外,本发明相比其他检测方法大大提高了对1α,25-二羟基维生素d2的检测灵敏度。基于此完成了本发明。术语如本文所用,术语“1α,25-二羟基维生素d2-d6”和“1α,25-二羟基维生素d2-2h”可互换使用,是指1α,25-二羟基维生素d2中h被同位素氘所取代后形成的氘代物,在本发明中,它可被用作1α,25-二羟基维生素d2质谱检测的内标。如本文所用,术语“1α,25-二羟基维生素d3-d6”和“1α,25-二羟基维生素d3-2h”可互换使用,是指1α,25-二羟基维生素d3中h被同位素氘所取代后形成的氘代物在本发明中,它可被用作1α,25-二羟基维生素d3质谱检测的内标。如本文所用,术语“1α,25-二羟基维生素d2”、“1α,25-(oh)2-vd2”和“1α,25-(oh)2维生素d2”可互换使用。如本文所用,术语“1α,25-二羟基维生素d3”、“1α,25-(oh)2-vd3”和“1α,25-(oh)2维生素d3”可互换使用。如本文所用,术语“前体离子”和“母离子”可以互换使用,是指可进一步发生分解反应产生碎片离子的离子。如本文所用,术语“碎片离子”和“子离子”可以互换使用,是指由分子离子或较大碎片离子的单分子裂解反应产生的。如本文所用,术语“流动相a”、“a相”或“水流动相”可以互换使用是指液相条件中按1:1000的比例分别将流动相添加剂a、流动相添加剂b加入到超纯水后得到的流动相。如本文所用,术语“流动相b”、“b相”或“有机流动相”可以互换使用是指液相条件中按1:1000的比例将流动相添加剂a加入到甲醇中得到的流动相。如本文所用,“液相层析”(lc)是指当流体均一地通过细微分开的物质的柱或者通过毛细管道过滤时流体溶液的一种或多种组分选择性延迟的方法延迟是由于当该流体相对于固定相(或多个)移动时混合物的组分在一个或多个固定相和本体流体(bulkfluid)(即流动相)之间的分布“液相层析”包括反相液相层析(rplc)、高效液相层析(hplc)和高湍流液相层析(htlc)。如本文所用,术语“hplc”或“高效液相层析”是指这样的液相层析,其中分离程度是通过使流动相在压力下穿过固定相通常为紧密填充柱而增加的。如本文所用,“质谱法”(ms)是指通过它们的质量鉴定化合物的分析技术ms技术一般包括(1)使化合物电离以形成带电化合物;和(2)检测带电化合物的分子量并计算质荷比(m/z)化合物可通过任何合适的方式电离并检测“质谱仪”一般包括电离器和离子检测器。术语“电子电离”如本文所用是指这样的方法,其中气态或蒸汽相中的感兴趣分析物与电子流相互作用电子与分析物的相互作用产生分析物离子,其然后可用于质谱法技术。术语“化学电离”如本文所用是指这样的方法,其中试剂气体(例如氨)用于电子碰撞,并且分析物离子通过试剂气体离子与分析物分子相互作用而形成。术语“电离”如本文所用是指产生具有等于一个或多个电子单位的净电荷的分析物离子的过程负离子是具有一个或多个电子单位的净负电荷的离子,而正离子是具有一个或多个电子单位的净正电荷的离子。术语“大约”如本文所用在提及定量测量时是指所示值加上或减去10%。试剂盒本发明提供了一种1α,25-二羟基维生素d液相色谱质谱联用法(即液质联用法)检测试剂盒,该检测试剂盒包括质控品、同位素内标提取液、稀释液、转化液、复溶液、流动相添加剂a、流动相添加剂b。优选地,所述检测试剂盒还包括对照品、96孔反应板、96孔过滤板、说明书等。本发明的试剂盒可用于检测1α,25-二羟基维生素d,具体地,可用于检测同时检测1α,25-二羟基维生素d2和1α,25-二羟基维生素d3的含量。具体地,在本发明的试剂盒中,对照品和/或质控品含有1α,25-二羟基维生素d2和1α,25-二羟基维生素d3,同位素内标提取液中含有1α,25-二羟基维生素d2-d6和1α,25-二羟基维生素d3-d6,稀释液为饱和一元醇(如甲醇),转化液为4-苯基-1,2,4-三唑啉-3,5-二酮(ptad),复溶液为超纯水,流动相添加剂a为饱和一元羧酸(如甲酸、乙酸、丙酸、丁酸或其组合),流动相添加剂b为c1-c3胺化合物(如甲胺)。本试剂盒保存于2~8℃。检测方法本发明还提供了一种检测方法,用于检测以1α,25-二羟基维生素d为代表的二羟基维生素d代谢物。通常,本发明方法包括步骤:(i)通过电喷雾离子源(esi)对所述一种或多种二羟基维生素d代谢物和内标进行电离,分别产生所述一种或多种二羟基维生素d代谢物和所述内标的至少一种前体离子;(ii)分别产生所述一种或多种二羟基维生素d代谢物和所述内标的所述前体离子的一种或多种碎片离子;和(iii)比较步骤(i)或(ii)或两者中产生的所述一种或多种二羟基维生素d代谢物和所述内标的一种或多种所述离子的量以确定所述生物样品中的所述一种或多种二羟基维生素d代谢物的量;其中,色谱检测过程中的流动相中加入c1-c3胺化合物。本发明方法特别适合检测1α,25-二羟基维生素d2,尤其是可以非常灵敏地检测1α,25-二羟基维生素d2。此外,本发明方法还适合用于检测1α,25-二羟基维生素d3。在一个实施例中,一种更具体地的检测方法包括如下步骤:(1)待检测的样品的准备(1.1)同位素内标提取液准备:依据本次试验标本量计算所需同位素内标提取工作液的量,按1:100将浓缩的同位素内标提取液用稀释液进行稀释,注意充分混匀。(1.2)提取取400μl的样本(如人血清样本)加入到2ml的ep管中,加入50μl稀释后的内标提取液混匀20秒,加入1ml稀释液,充分混匀后离心,取900μl上清至于2ml的96孔深孔板中,剩余样本再加入600μl稀释液充分混匀后离心,取500μl上清至于2ml的96孔深孔板中与第一次上清合并,然后进行氮气吹。(1.3)衍生向吹干的96孔反应板中加入100μl的转化液,充分混匀后,室温衍生0.5小时。(1.4)复溶加入50μl的复溶液,充分混匀后,将血清样本转移至96孔蛋白过滤板中(蛋白过滤板下面放置一块1ml的96孔深孔板),放置离心机中进行离心,将带有样品的1ml的96孔深孔板中,盖上盖垫待用。(2)液相条件流动相准备a相:按1:1000的比例分别将流动相添加剂a、流动相添加剂b加入到超纯水中。b相:按1:1000的比例将流动相添加剂a加入到甲醇中。其中,流动相添加剂a为饱和一元羧酸,较佳地为甲酸、乙酸、丙酸、丁酸或其组合,如甲酸;流动相添加剂b为c1-c3胺化合物,如甲胺。色谱柱:八烷基硅烷键合硅胶为填充剂或相当者。色谱柱柱温:40℃。进样量:5μl。流速:0.4ml/min。梯度:0-0.5min:流动相b为10%-50%;0.5-3min:流动相b为50%-95%;3.0-4.5min:流动相b为95%;4.5-5.0min:流动相b为95%-10%;5.0-6.0min:流动相b为10%。(3)质谱条件多反应监测离子对(mrm)及相应的电压参数其他质谱参数离子源:电喷雾(esi)离子源。毛细管电压:3.0kv。锥孔电压:30v。离子源温度:150℃。脱溶剂气体温度:500℃。脱溶剂气体流速:1000l/hr。(4)上机检测取处理好的对照品、质控品和检测样本溶液注入高效液相色谱-串联质谱仪进行检测,并记录色谱图与检测样本1α,25-二羟基维生素d2、1α,25-羟基维生素d3的峰面积和同位素内标1α,25-二羟基维生素d2-d6、1a,25-二羟基维生素d3-d6峰面积。(5)定量分析标准曲线的绘制方法:以3~10个(较佳地4~7个)对照品的标示浓度为横坐标(x),以7个对照品的实际检测峰面积与各自内标峰面积的比值为纵坐标(y),绘制标准曲线。标准曲线方程的拟合:以3~10个(较佳地4~7个)对照品的峰面积比值(y)对标示浓度(x)进行线性回归。可获得回归方程:y=a+bx,其中y为纵坐标,x为横坐标,a为截距,b为斜率。检测样本结果的计算:将检测样本的实际峰面积与内标峰面积的比值代入上述标准曲线方程,计算检测样本中待测化合物的浓度。本发明的主要优点包括:(a)本测试试剂盒可以分别检测1α,25-二羟基维生素d2和1α,25-二羟基维生素d3,操作中不需萃取,故过程简便、用时短,且1α,25-二羟基维生素d2的母离子的质/荷比为635.4±0.5,1α,25-二羟基维生素d3的母离子的质/荷比为623.4±0.5,故检测灵敏度高。(b)本试剂盒检测1α,25-二羟基维生素d2和1α,25-二羟基维生素d3的标准曲线线性相关性高,故检测结果准确度高(c)使用本发明的试剂盒进行检测时,采用了水作为复溶液,其能够完全终止衍生反应,使得测量重复性好,精密度高。(d)本发明的试剂盒具有优异的1α,25-二羟基维生素d2的检测灵敏度。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。实施例1通过标准曲线进行1α,25-二羟基维生素1α,25-二羟基维生素d3的检测。待检测的样品的准备内标提取液准备取10μl同位素内标提取液用990μlml稀释液进行稀释,充分混匀。提取分别取400μl的人血清样本加入到2ml的ep管中,加入50μl稀释后的内标提取液混匀20秒,加入1ml稀释液,充分混匀后离心,取900μl上清至于2ml的96孔深孔板中,剩余样本再加入600μl稀释液充分混匀后离心,取500μll上清至于2ml的96孔深孔板中与第一次上清合并,然后进行氮气吹。衍生向吹干的96孔反应板中加入100μl的转化液,充分混匀后,室温衍生0.5小时。复溶加入50μl的复溶液,充分混匀后,将血清样本转移至96孔蛋白过滤板中(蛋白过滤板下面放置一块1ml的96孔深孔板),放置离心机中进行离心,将带有样品的1ml的96孔深孔板中,盖上盖垫待用。液相条件流动相准备a相:按1:1000的比例分别将流动相添加剂a、流动相添加剂b加入到超纯水中。b相:按1:1000的比例将流动相添加剂a加入到甲醇中。其中,流动相添加剂a为甲酸;流动相添加剂b为甲胺。色谱柱:八烷基硅烷键合硅胶为填充剂或相当者。色谱柱柱温:40℃。进样量:5μl。流速:0.4ml/min。梯度:0-0.5min:流动相b为10%-50%;0.5-3min:流动相b为50%-95%;3.0-4.5min:流动相b为95%;4.5-5.0min:流动相b为95%-10%;5.0-6.0min:流动相b为10%。质谱条件多反应监测离子对(mrm)及相应的电压参数其他质谱参数离子源:电喷雾(esi)离子源。毛细管电压:3.0kv。锥孔电压:30v。离子源温度:150℃。脱溶剂气体温度:500℃。脱溶剂气体流速:1000l/hr。上机检测根据色谱条件和质谱条件设置液质联用仪参数,将处理好的对照品、质控品和待检测样本溶液注入仪器进行检测,并记录色谱图与检测样本1α,25-二羟基维生素d2、1α,25-二羟基维生素d3的峰面积和同位素内标1α,25-二羟基维生素d2-d6、1α,25-二羟基维生素d3-d6峰面积(如图1、图2所示)。定量分析标准曲线的绘制方法:以4~7个对照品的标示浓度为横坐标(x),以4~7个对照品的实际检测峰面积与各自内标峰面积的比值为纵坐标(y),绘制标准曲线,如图3和图4所示。标准曲线方程的拟合:以4~7个对照品的峰面积比值(y)对标示浓度(x)进行线性回归。可获得回归方程:y=a+bx,其中y为纵坐标,x为横坐标,a为截距,b为斜率。本例中1α,25-二羟基维生素d2的回归方程为y=1.522x+-0.00364,如图3所示;1α,25-二羟基维生素d3的回归方程为y=0.223x+-0.0152,如图4所示。检测样本结果的计算:将检测样本的实际峰面积与内标峰面积的比值代入上述标准曲线方程,计算检测样本中待测化合物的浓度,见表1-1,1-2。表1-11α,25-二羟基维生素d2表1-21α,25-二羟基维生素d3化合物名称检测灵敏度检测时间1α,25-二羟基维生素d30.1ng/ml3.48min1α,25-二羟基维生素d20.01ng/ml3.53min实验结果表明,在此条件下,1α,25-(oh)2-vd2的线性关系优异,定量下限达到0.01ng/ml。在现有技术中已知的其他检测方法中难以检测1α,25-(oh)2-vd2,通常的检测灵敏度为约1ng/ml,而本发明方法出乎意料地以极高的检测灵敏度检测1α,25-二羟基维生素d2,检测灵敏度下限达到0.01ng/ml。此外,本发明方法还适合同时检测1α,25-(oh)2-vd3,检测灵敏度也很高,达到0.1ng/ml。在已有的检测方法中,通常1α,25-二羟基维生素d3的检测的灵敏度下限低于1α,25-二羟基维生素d2的检测灵敏度下限。与之相反,本发明方法中,1α,25-二羟基维生素d2的检测的灵敏度下限远远低于1α,25-二羟基维生素d3的检测灵敏度下限。这表明,本发明非常适合用于检测极低含量的1α,25-二羟基维生素d2。实施例2检测条件基本同实施例1,除了流动相的流速为0.5ml/min。从实验结果中看出,与实施例1检测时的情况基本相同,流动相流速对检测基本无影响。对比例1以甲醇作为复溶液,其他检测条件基本与实施例1相同。从实验结果发现,当复溶液为甲醇时,检测结果的重现性差,信噪比较低,色谱图谱基线较高,发现甲醇无法完全终止衍生反应。对比例2考察了有机动相(即流动相b)采用meoh(甲醇)和acn(乙腈)对实验结果的影响,发现有机相采用meoh时峰形更好。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1