检测SOAT1蛋白表达水平的试剂盒在制备筛查肝细胞癌产品中的应用的制作方法
本发明属于生物医药领域,涉及一种检测soat1蛋白表达水平的试剂盒在制备筛查肝细胞癌产品中的应用。
背景技术:
肝细胞癌(hepatocellularcarcinoma,hcc)是世界范围内的恶性肿瘤之一,有较高的发病率和死亡率,且其发病率有增高的趋势。全世界每年新发和死亡的肝癌患者55%发生在我国,肝癌疾病负担重,5年生存率仅10%左右。肝细胞癌的发生情况是一个多因素,多阶段,复杂的过程,乙型肝炎病毒(hepatitisbvirus,hbv)慢性感染是重要的高危因素。肿瘤抑制、肝脏切除和移植是现阶段肝癌的主要治疗方法,但约60%到100%的患者会术后复发。即使是小于3cm的小肝癌,有的患者可生存达10年或20年之久,有些则在一年内死亡,数月内复发。因此,在高危人群特别是肝硬化(livercirrhosis,lc)患者中筛查早期肝癌患者,在早期患者中筛查恶性度较高的患者及时采取治疗措施,可提高肝癌患者的生存率和生活质量。
寻找敏感的肝癌生物标记物,对于早期诊断肝细胞癌并指导后续的诊疗非常重要。基于肝癌患者组织芯片及血清中具有标志性变化的蛋白质建立一种检测并提示肝癌预后及后续诊疗的检测方法,有助于肝癌的临床诊断。
soat1(胆固醇酯化酶)作为细胞内催化游离胆固醇与长链脂肪酸形成胆固醇酯的酶,存在于人体内的所有组织细胞,其合成的胆固醇酯进入细胞内脂滴贮存,维持细胞内的胆固醇、脂肪酸等脂质代谢平衡。胆固醇是细胞脂质代谢中的重要成分。它具有调节胞膜表面的信号传递、组成脂伐等相关功能区域、影响细胞膜流动性等重要作用。soat1可能通过胞内及质膜的胆固醇水平影响跨膜的肿瘤相关信号的传递。但尚无应用于肝细胞癌诊断及预后的报道。
技术实现要素:
本发明的目的是提供一种检测胆固醇酯化酶蛋白含量或活性的系统以及检测胆固醇酯化酶基因含量或表达量的系统的新用途。
本发明所提供的检测胆固醇酯化酶(soat1)蛋白含量或活性的系统以及检测胆固醇酯化酶基因含量或表达量的系统的新用途具体为在下述至少一方面的应用:1)制备筛查或辅助诊断癌症的产品;2)制备预测癌症预后的产品;3)制备癌症治疗的伴随诊断产品。
本发明还保护检测胆固醇酯化酶蛋白含量或活性的系统和其联合检测甲胎蛋白含量或活性的系统在下述至少一方面的应用:1)制备筛查或辅助诊断癌症的产品;2)制备预测癌症预后的产品;3)制备癌症治疗的伴随诊断产品。
本发明还保护检测胆固醇酯化酶基因含量或表达量的系统和其联合检测甲胎蛋白基因含量或表达量的系统在下述至少一方面的应用:1)制备筛查或辅助诊断癌症的产品;2)制备预测癌症预后的产品;3)制备癌症治疗的伴随诊断产品。
上述应用中,所述检测胆固醇酯化酶(soat1)蛋白含量或活性的系统包括检测胆固醇酯化酶(soat1)蛋白含量或活性所需的试剂和/或仪器。
所述检测胆固醇酯化酶(soat1)基因含量或表达量的系统包括检测胆固醇酯化酶(soat1)基因含量或表达量所需的试剂和/或仪器。
所述检测胆固醇酯化酶(soat1)基因含量或表达量所需的试剂包括:特异性扩增胆固醇酯化酶(soat1)的引物,或特异性检测胆固醇酯化酶(soat1)的抗体。
上述应用中,所述检测甲胎蛋白蛋白含量或活性的系统包括检测甲胎蛋白含量或活性所需的试剂和仪器。
在本发明的一个实施例中,检测血清或血浆中甲胎蛋白含量所需的试剂为afp化学发光法试剂盒,仪器为罗氏全自动电化学发光免疫分析仪。
所述检测甲胎蛋白蛋白级基因含量或表达量的系统包括检测甲胎蛋白基因含量或表达量所需的试剂和仪器。
上述应用中,所述检测所采用的样本为健康人或肝硬化(lc)患者或肝癌患者的血(如血液、血清、血浆)或组织(如肝组织)。
以血为检测样本时,通常可采用酶联免疫吸附法(elisa)检测血中soat1浓度。
以组织为检测样本时,通常可采用免疫组化检测检测组织中soat1的表达量。
上述应用中,所述产品可为系统,所述系统可包括试剂和/或仪器。所述试剂包括芯片、制剂、试剂盒或核酸膜条。所述试剂盒可为荧光定量pcr试剂盒、或elisa试剂盒、或免疫组化试剂盒或其它。
本发明还保护一种筛查或辅助诊断癌症或预测癌症预后的产品。
本发明所提供的产品,其包括上述的检测胆固醇酯化酶(soat1)蛋白含量或活性的系统,或检测胆固醇酯化酶基因含量或表达量的系统。
其中,待测样本包括(但不限于)血液、血清、血浆及组织活检物。
在本实施例中,所述用于检测soat1蛋白浓度的物质为soat1蛋白抗体,具体为免疫组化、免疫印迹所用soat1抗体(merckmillipore公司,货号:abn66)或elisa所用soat1试剂盒(mybiosource公司,货号:mbs9304160)。当然,也可以为其它类型的抗体或是其他可用于检测soat1蛋白浓度的物质。
本发明还保护另一种筛查或辅助诊断癌症或预测癌症预后或作为癌症治疗的伴随诊断的产品。
本发明所提供的产品,其包括上述检测胆固醇酯化酶蛋白含量或活性的系统和检测甲胎蛋白含量或活性的系统;
或,上述检测胆固醇酯化酶基因含量或表达量的系统和检测甲胎蛋白基因含量或表达量的系统。
所述产品可为系统;所述系统可包括试剂和/或仪器。所述试剂包括芯片、制剂、试剂盒或核酸膜条。所述试剂盒可为荧光定量pcr试剂盒、或elisa试剂盒、或免疫组化试剂盒或或其它。
以胆固醇酯化酶(soat1)作为标志物的系统在制备筛查或辅助诊断癌症产品中的应用或在制备预测癌症预后产品中的应用或在制备癌症治疗伴随诊断产品中的应用也属于本发明的保护范围。
以胆固醇酯化酶(soat1)作为标志物的系统和以甲胎蛋白作为标志物的系统在制备筛查或辅助诊断癌症产品中的应用或在制备预测癌症预后产品中的应用或在制备癌症治疗伴随诊断产品中的应用也同样属于本发明的保护范围。
上述应用中,所述产品可为系统;所述系统可包括试剂和/或仪器。所述试剂包括芯片、制剂、试剂盒或核酸膜条。所述试剂盒可为荧光定量pcr试剂盒、或elisa试剂盒、或免疫组化试剂盒或其它。
以胆固醇酯化酶(soat1)作为标志物的系统在筛查或辅助诊断癌症中的应用或在预测癌症预后中的应用或在癌症治疗伴随诊断中的应用也属于本发明的保护范围。
以胆固醇酯化酶(soat1)作为标志物的系统和以甲胎蛋白作为标志物的系统在筛查或辅助诊断癌症中的应用或在预测癌症预后中的应用或在癌症治疗伴随诊断中的应用也同样属于本发明的保护范围。
在本发明中,所述产品的筛查或诊断对象是健康人或肝硬化(lc)或肝癌患者。
本发明还保护一种筛查或辅助诊断肝细胞癌或预测肝细胞癌预后或作为癌症治疗伴随诊断的方法。
所述方法包括:检测待测者样本中胆固醇酯化酶(soat1)的含量或表达量,根据所述含量或表达量进行诊断或辅助诊断癌症或预测癌症预后。其中,样本包括(但不限于)血液、血清、血浆及组织活检物。
本发明还保护另一种筛查或辅助诊断癌症或预测癌症预后或作为癌症治疗伴随诊断的方法。
所述方法包括:检测待测者样本中胆固醇酯化酶(soat1)和甲胎蛋白的含量或表达量,根据所述含量或表达量进行筛查或辅助诊断癌症或预测癌症预后或作为癌症治疗伴随诊断。
其中,样本包括(但不限于)血液、血清、血浆及组织活检物(如肝组织活检物)。
所述soat1蛋白为人soat1蛋白。
在上述应用、产品或方法中,所述的癌症包括肝细胞癌、宫颈癌、结肠癌、非小细胞肺癌、乳腺癌、食管癌、白血病;更佳地为肝细胞癌。
以肝细胞癌为例,实验证明,soat1蛋白可作为肝细胞癌(hcc)的肿瘤标志物。基于68对肝癌的转录组数据及包括85个肝癌患者癌及癌旁的组织芯片数据,soat1转录本及蛋白丰度在肝癌中的表达显著高于癌旁。在肝癌患者血清中,soat1的丰度(均值89.11ng/ml)显著高于健康对照组(均值12.02ng/ml)和肝硬化组(均值4.75ng/ml)(p=0.001)。当以健康人作为筛查对象时,判定为hcc患者的阈值为血清soat1蛋白浓度>21.20ng/ml,此时,其灵敏度为65.63%、特异度为84.38%。soat1单独作为hcc筛查标志物的曲线下面积(auc)是0.73,与afp单独作为hcc筛查标志物的auc(0.74)接近;当两者联合作为hcc筛查标志物时,auc可达到0.90,说明soat1与afp有良好的互补性,二者联合诊断可提高hcc的筛查准确率。当以肝硬化患者作为筛查对象时,判定为hcc患者的阈值为血清soat蛋白浓度>12.69ng/ml,此时敏感度为78.13%,特异性为81.82%,auc为0.76。说明soat1可用于肝细胞癌和肝硬化患者判别诊断的潜在标志物。
实验也证明,soat1蛋白可作为肝细胞癌(hcc)预后评估的标志物。soat1与肝癌的不良预后密切正相关,丰度越高,患者预后越差(p=0.002)。
实验还证明,soat1的敲低和抑制剂(阿伐麦布)均可显著抑制肝癌细胞的增殖和迁移。并且对soat1丰度较高的肝细胞(plc/prf/5)的抑制效果要强于soat1丰度较低的细胞系(hepg2),这提示靶向soat1可以为soat1为标志物筛选的恶性度较高的肝癌亚型提供潜在的精准治疗方式。说明soat1作为肝癌筛选和预后评估的标志物首先筛选出恶性度较高的肝癌患者,然后用靶向soat1的抑制剂进行精准治疗。soat1丰度同时具有筛查或辅助诊断癌症或预测癌症预后或作为癌症治疗的伴随诊断的作用。
本发明所提供的应用,利用在肝细胞癌患者组织和血清中均上调表达的蛋白质soat1作为诊断标志物试剂盒的制备或者直接作为诊断肝细胞癌的试剂盒,也可以独立或联合其他蛋白作为肝癌诊断试剂盒的制备或预后试剂盒的制备或者肝癌治疗伴随诊断试剂盒的制备。适用于在生物学、医学和药学领域中对肝细胞癌进行临床检测研究和发病机制研究,具有广泛的实用性。用途包括但不限于:在生物学、医学和药学等领域进行各种肝细胞癌相关检测和研究。
附图说明
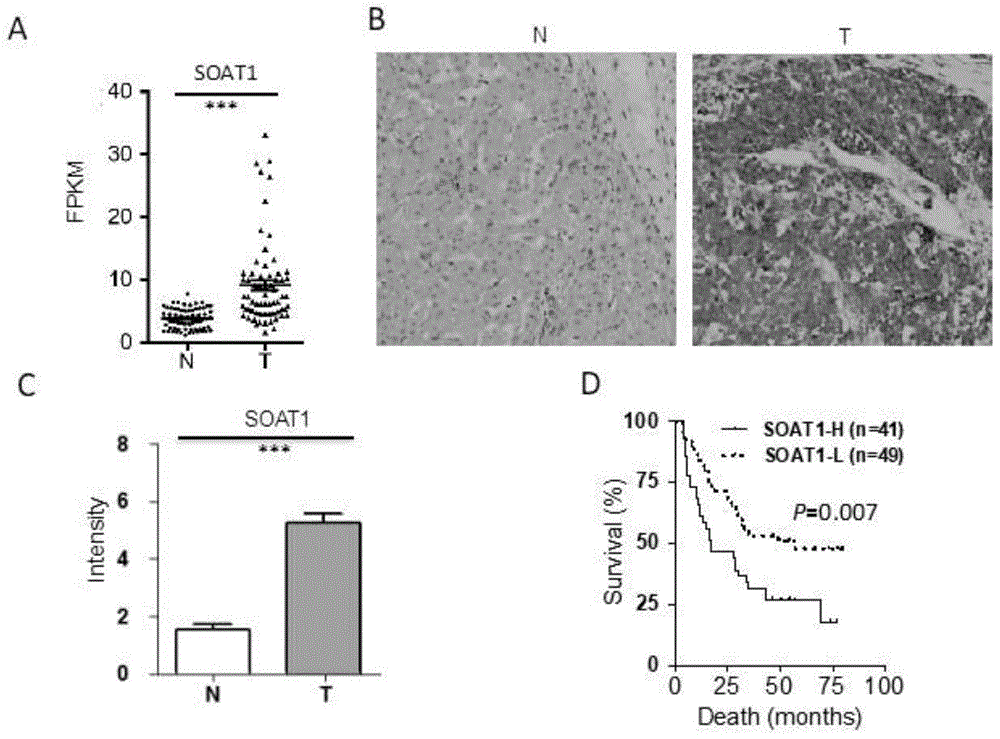
图1.soat1的表达与肝癌的发生及预后密切相关。图1a,基于68对肝癌及配对癌旁的转录组数据及组织芯片(包括95例hcc及85例癌旁样本)数据(图1b),发现soat1的转录本及蛋白在肝癌的表达均显著高于其配对癌旁的表达水平(图1b,c)。图1d,对组织芯片中高表达soat1及低表达soat1患者进行生存分析。结果表明soat1蛋白高表达患者总生存期明显低于soat1低表达患者。非配对mann-whitney检验(图1a,c),log-rank检验(图1d)。*p<0.05,**p<0.01,***p<0.001
图2.为基于质谱法测定25对肝癌及对应癌旁组织中的胆固醇酯含量。图2a,soat1在细胞内主要的催化底物ce18:1的浓度在hcc中的量明显高于配对癌旁组织。采用非配对mann-whitney检验。*p<0.05;图2b,soat1的催化产物胆固醇酯(6种)在人肝癌(t)里较癌旁组织(nt)的表达差异。结果表明soat1的催化产物胆固醇酯在hcc的量明显高于配对癌旁组织,辅助证明其催化酶soat1在肝癌中的表达量明显高于配对癌旁组织。
图3.基于elisa试剂盒测定soat1在健康人、肝硬化及肝癌患者血清中的表达。结果表明soat1在肝癌患者血清中显著升高(图3a)。提示soat1可作为从健康人、肝硬化人群筛选肝癌的诊断标志物。hcc与健康组人群(图3b)及肝硬化人群(图3c)血清soat1蛋白水平的roc曲线分析,结果表明soat1可作为从健康人群(auc=0.77)和肝硬化人群(auc=0.73)筛查肝癌的潜在标志物,与afp联合使用后,从健康人及肝硬化人群筛选肝癌的auc可分别达到0.92和0.90,说明soat1与afp有良好的互补性,可联合用于肝癌筛查。
图4.为soat1特异敲低可显著抑制肝癌细胞增殖和迁移。结果表明soat1shrna只特异敲低soat1,对soat2的丰度没有影响(图4a)。图4b,soat1在plc细胞的表达高于hepg2细胞。图4c,soat1特异敲低可以显著抑制肝癌细胞的增殖(图4c,d)和迁移(图4e,f),且对soat1丰度较高的plc细胞(图4c,e)的抑制效果显著高于hepg2细胞(图4d,f)。非配对mann-whitney检验(图4c-f),*p<0.05,**p<0.01,***p<0.001
图5.为soat1抑制剂avasimibe对肝癌细胞系增殖及迁移的影响检测。图5a,结果表明avasimibe对plc/prf/5,hepg2,huh7和mhcc97h的ic50值分别是6.9,11.6,6.8和25.2μm,可显著抑制肝癌细胞系的增殖。图5b,avasimibe可以显著降低plc/prf/5及hepg2肝癌细胞系的迁移。提示用soat1筛选出来的恶性度较高的肝癌患者可以靶向soat1进行精准治疗。非配对mann-whitney检验(图5b)。*p<0.05,**p<0.01,***p<0.001。
具体实施方式
下面的实施例将对本发明作进一步的解释,但是本发明并不仅仅局限于这些实施例,这些实施例不以任何方式限制本发明的范围。下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和生物材料,如无特殊说明,均可从商业途径获得。
本发明中的术语:
soat1
如本文所用,术语“soat1”、“soat1蛋白”、“soat1蛋白”或“胆固醇酯化酶”可以互换使用。soat1在肝癌患者的组织及血清样本中均显著升高,并且,丰度越高患者预后越差,可以作为肝癌,特别是早期肝癌)的诊断标志物,并提示患者预后。检测soat1的方法包括但不局限于荧光定量pcr试剂盒、或elisa试剂盒、或抗体。
soat1抑制剂
如本文所用,术语“soat1抑制剂”指的具有抑制效果的化合物,如阿伐麦布(avasimibe)、或具有相同效应的阿伐麦布衍生物与类似物等。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。
材料和方法
试剂:
soat1抗体(abn66)购自merckmillipore公司;
兔二抗(cw0103s)购自北京康为世纪生物科技有限公司;
saot1抑制剂avasimibe购自sigma公司;
肝癌组织芯片(hliv-hcc180sur-05):生存期肝细胞癌95例:癌95例/癌旁85例。手术时间2006.8-2009.11,随访时间2013.9。随访4-7年。购自上海芯超生物科技有限公司;
soat1elisa试剂(mbs9304160)购自mybiosource公司
胆固醇酯标准品(ce18:1)购自sigma公司;
细胞培养基(dmem)和胎牛血清购自invitrogen公司;
细胞株和组织样本:
hepg2,plc/prf/5购自协和细胞库(中国协和医科大学基础医学研究所细胞中心);用于胆固醇酯测定的肝癌和癌旁组织由上海市中山医院提供,取自进行外科手术治疗的肝癌病人,所有病人都签署了知情同意声明。
用于血清elisa测定的75例血清样本均来自于上海市中山医院。其中肝癌血清样本32例,体检正常人血清样本32例,肝硬化血清11例。所有研究对象在抽血前均禁食8h以上,采集空腹静脉血约5ml,室温静置30分钟后以3000r/min离心10分钟,收集血清,-20℃冻存用于soat1浓度监测。
方法:
一、68对肝癌及癌旁的转录组数据
肝组织样本采用trizol试剂盒提取总rna。用带有oligo(dt)的磁珠富集mrna,向得到的mrna中加入fragmentationbuffer使其片断成为短片段,再以片断后的mrna为模板,用六碱基随机引物(randomhexamers)合成cdna第一链,并加入缓冲液、dntps、rnaseh和dnapolymerasei合成cdna第二链,经过qiaquickpcr试剂盒纯化并加eb缓冲液洗脱经末端修复、加碱基a,加测序接头,再经琼脂糖凝胶电泳回收目的大小片段,并进行pcr扩增,从而完成整个文库制备工作,构建好的文库用illuminahiseq2500进行测序。整个实验过程由由诺禾致源公司负责并产出数据。
二、通过免疫组化检测soat1在95例hcc及85例癌旁样本的表达差异:
1)烘片:将组织芯片放入烘箱中,温度调至63度,烘蜡一小时。
2)脱蜡:片子烘烤完成后,从烘箱内取出,放入全自动染色机中,进行脱蜡;脱蜡过程如下:
二甲苯两缸,每缸15分钟(按仪器设置时间);
无水乙醇两缸,每缸7分钟(按仪器设置时间);
90%酒精1缸,5分钟(按仪器设置时间);
80%酒精1缸,5分钟(按仪器设置时间);
3)70%酒精1缸,5分钟(按仪器设置时间);
4)抗原修复:从染色机中取出片子,用纯水冲洗3次,每次不少于1分钟。冲洗过程中将柠檬酸修复液或者edta修复液放至电磁炉上开始加热;
5)阻断:使用商品化的即用阻断剂,将阻断剂滴在片子上,计时10-15分钟。
6)按1:2000加入soat1一抗(即soat1抗体):取出片子,用pbs缓冲液冲洗3次,一次1分钟;冰箱中取出一抗,放入离心机里7200转离心不少于30秒;取出一抗,按1:2000抗体稀释液稀释滴加一抗,室温孵育,计时30分钟;
7)加兔二抗:将片子用pbs缓冲液冲洗3次,一次1分钟;滴加二抗即用工作液,室温孵育,计时30分钟;时间到后用pbs冲洗3次,每次不少于1分钟。
8)dab显色:从冰箱里取出dab试剂盒,按1mldab稀释液+1滴dab色原进行配制;在片子上滴加稀释后的dab,观察显色强度,最长显色5分钟,到时后自来水冲洗5分钟。
苏木素复染、封片:在片子上滴加哈氏苏木素(sigma)1分钟,时间到后在0.25%的盐酸酒精中浸没不少于2秒,用自来水冲洗大于2分钟,室温晾干后封片。
三、基于esi-ms检测25对肝癌及癌旁组织的胆固醇酯含量
1)样本处理:组织非极性脂质代谢组前处理:称取100mg左右组织,匀浆,加入1ml氯仿:甲醇=3:1(v/v),超声提取1h。4℃13200r/min,离心10分钟,取下层氯仿200ul,离心冷冻浓缩干燥。用400ul异丙醇和乙腈混合液(1:1,v/v)复溶。液质进样检测。
2)色谱分离:采用thermoscientific的u3000快速液相色谱使用反相色谱组织样本进行分析。色谱柱:watersuplccshc18(1.7um2.1mm*100mm);流动相:a(乙腈/水4:6,0.1%甲酸,10mm乙酸铵)和b(乙腈/异丙醇9:1,v/v,0.1%甲酸,10mm乙酸铵);流速:0.3ml/min;进样量为1.0μl;柱温:45℃。
3)质谱分析采用装备了热电喷雾离子源的四极杆轨道离子阱质谱仪(qexactivetm)。正负离子离子源电压分别为3.7kv和3.5kv。毛细管加热温度320℃。翘气压力30psi,辅助气压力10psi。容积加热蒸发温度300℃。翘气和辅助气均为氮气。碰撞气为氮气,压力为1.5mtorr。一级全扫描参数为:分辨率70000,自动增益控制目标为1×106,最大隔离时间50ms,质荷比扫描范围150–1500。质谱质量轴校准采用外标法,质量误差为5ppm。校准质量正离子选择74.09643,83.06037,195.08465,262.63612,524.26496和1022.00341。负离子选择91.00368,96.96010,112.98559,265.14790,514.28440和1080.00999。代谢物鉴定采用dd-ms2扫描模式(数据依赖扫描模式)。具体参数为:分辨率17500,自动增益控制目标为1×105,最大隔离时间50ms,最大10个离子扫描二级碎片,动态排除。质量分离窗口2,碰撞能30v。强度限定1×105。液质系统由xcalibur2.2sp1.48软件控制,数据采集和靶向代谢物定量处理均由该软件操作。
4)代谢组数据处理:采用progenesisqi软件处理,依次为导入原始数据、峰对齐、峰提取、归一化处理,最终形成保留时间、质荷比和峰强度的表格。反相色谱和亲水色谱提取峰的时间依次为0.5至19和0.5至9分钟。峰提取的强度限定为模式5。各种添加剂离子如加氢和加钠等均去卷积到每一个离子特征。代谢物鉴定采用人类代谢组数据库和脂质数据库进行一级分子量匹配。为了评价样品采集过程中系统的稳定性和重复性,我们使用质控样本。质控样本是所有样本均移取固定体积混合均匀后得到的。指控样本的前处理方法和其他样品一样。为了得到可信赖的且可重复性的代谢物,本次实验首先采用5个空白样本平衡色谱柱,再采用3个质控样本平衡柱条件。然后每间隔6-8个样本插入1个质控样本用于监测整个液质系统的稳定性和重复性。同时计算质控样本中提取的代谢特征的变异系数值,变异系数超过15%的代谢特征被删除。本实验中,ce18:1标准品作为外标用于评估样本中胆固醇酯的绝对浓度。
四、采用酶联免疫吸附法(elisa)检测血清中soat1浓度
采用酶联免疫吸附法(elisa)检测血清样品中soat1的浓度,每组血清样本设置3个重复,使用多功能酶标仪中检测od值,以3个重复的均值作为此组样本的最终od值。分别比较肝癌组与正常组及肝硬化组的soat1表达水平。
五、检测血清中afp浓度
使用罗氏全自动电化学发光免疫分析仪,利用afp化学发光法试剂盒检测,详细步骤参照仪器说明书。
六、soat1敲低
敲低用载体:plko.1-trc;shrna的序列:5'-ccggtggtccatgactggctatattctcgagaatatagccagtcatggaccattttttg-3'(如序列表序列1所示)。
1)第一天,接种plc/prf/5或hepg2细胞于6孔板。
2)第二天,细胞融合度约40-50%,加入soat1-sh或soat1-对照慢病毒200μl/孔,进行病毒感染。
3)第三天,感染病毒的plc/prf/5或hepg2细胞,加入嘌呤霉素(puromycin)至终浓度2μg/ml进行筛选。
4)第六天,按照常规方法收集细胞一部分做cck8实验,一部分裂解蛋白做westernbolt检测。
七、cck8实验
1)第一天,60mm培养皿中细胞常规胰酶消化计数后,5000个细胞/孔,接种4个96孔板。
2)第二天,大约培养24小时后,细胞生长处于对数期,更换新的加入不同浓度soat1抑制剂的培养液,100μl/孔,分别设10μm20μm浓度组及对照组,对照组为1‰的dmso,每组设3个重复孔。取一个96孔板加入10%的cck8,100μl/孔,1小时后450nm波长测0小时的od值,无细胞孔为空白背景。
3)第三天,取一个96孔板加入10%cck8,1小时后450nm波长测24小时的od值。
4)第四天,取一个96孔板加入10%cck8,1小时后450nm波长测48小时的od值。
5)第五天,最后一个96孔板加入10%cck8,1小时后450nm波长测72小时的od值。
6)汇总所有时间点od值,绘制生长曲线。
八、细胞迁移实验
第一天:
(1)饥饿细胞:撤全培养基,pbs洗2遍,更换为无血清的dmem。
(2)transwell下室加入2.5%血清的dmem,600ul/孔。37℃培养箱中平衡过夜。
transwell小室为corning公司的3422。
第二天:
(3)昨天饥饿的细胞,加入胰酶消化(室温约30-50秒),迅速小心将胰酶吸干净,加入全培养基1ml,1.5ml离心管收集;
(4)4分钟,800rpm离心;
弃上清,加入无血清dmem,洗一遍;
再次4分钟,800rpm离心;
弃上清,加入0.5%fbs的dmem;
(5)细胞计数,用含avsimibe的0.5%的dmem调整细胞浓度,约400000细胞/ml,avasimibe浓度10μm;对照组不含avasimibe,其余同。100μl/孔加入tanswell上室。第三天(20-24小时后):
(6)弃培养液;
(7)无水甲醇固定20分钟;
(8)膜风干;
(9)捏平棉签棉花,旋转擦净上室细胞,用棉球裹在镊子上轻轻擦去边缘细胞。
(10)0.5%结晶紫染色;
(11)清水缓慢冲洗;
(12)倒置显微镜下观察拍照,
九、免疫印迹检测
用常规方法即可。
十、统计分析
所有分析均使用graphpadprism软件完成。p<0.05认为有显著性差异。
实施例1、soat1在肝癌的高表达与肝癌的发生及预后密切相关
为了证实soat1在肝癌高表达的现象,发明人比较了68对肝癌及配对癌旁的转录组数据(图1a)及组织芯片(包括95例hcc及85例癌旁样本)的癌及癌旁数据(图1b,c),发现soat1在hcc显著高表达,soat1高表达患者总生存期显著低于soat1低表达患者(图1d)。
实施例2、soat1的催化产物胆固醇酯在人肝癌组织明显高表达
为了证实soat1在肝癌高表达的现象,发明人利用质谱法测定25对肝癌及对应癌旁组织中的soat1催化产物胆固醇酯含量。结果显示,soat1在细胞内主要的催化底物胆固醇酯标准品(ce18:1)的浓度在hcc中的量明显高于配对癌旁组织(图2a);soat1的催化产物胆固醇酯(6种)在人肝癌(t)里较癌旁组织(n)的表达差异(图2b)。进一步辅助证明其催化酶soat1在肝癌中的表达量明显高于配对癌旁组织。
实施例3、soat1在肝癌血清样本中显著升高
为了证实soat1在肝癌高表达的现象,发明人利用人血清样本基于elisa试剂盒检测soat1在不同人群的表达(图3)。
soat1蛋白表达水平在正常组、肝硬化患者组、肝癌患者组的血清样本中的elisa检测结果:正常组soat1蛋白的浓度平均值为12.02ng/ml,肝硬化患者组为4.75ng/ml,肝癌患者组为89.11ng/ml。对各组样本中soat1蛋白含量进行统计学分析(非配对mann-whitney检验),发现血清soat1蛋白在正常组和肝癌患者组(p<0.001)以及肝硬化患者组和肝癌患者组(p<0.001)均有显著性差异(图3a)。提示soat1可作为从健康人、肝硬化人群筛选肝癌的诊断标志物。
以正常组为对照组,肝癌患者组为疾病组,对血清中soat1蛋白水平进行roc曲线分析(如图3b所示),曲线下面积auc=0.77,灵敏度为66.7%、特异度为100%。以肝硬化患者为对照组,肝癌患者组为疾病组,对血清中soat1蛋白水平进行roc曲线分析(如图3c所示),曲线下面积auc=0.73,灵敏度为66.7%、特异度为100%。结果表明soat1可作为从健康及肝硬化人群筛查肝癌的潜在标志物。
进行正常人和hcc患者的判别诊断时,若待测人血清中soat1蛋白浓度大于37.4ng/ml(表1,该浓度为约登指数最大时对应的浓度值。灵敏度为66.7%、特异度为100%),则该待测人为或候选为hcc患者。
进行肝硬化患者和hcc患者的判别诊断时,若待测人血清中soat1蛋白浓度大于28.7ng/ml(表2,该浓度为约登指数最大时对应的浓度值。敏感度为66.7%,特异性为81.82%),则该待测人为或候选为hcc患者。
上述两个判别诊断的浓度阈值为roc曲线的最大约登指数对应的阈值,正常人/肝硬化患者和hcc患者的判别诊断的约登指数及对应阈值详见表1及表2(最大约登指数及对应阈值粗体标注)。
表1以正常组为对照组的阈值、灵敏度、特异度及约登指数
表2以肝硬化组为对照组的阈值、灵敏度、特异度及约登指数
实施例4、soat1蛋白和afp蛋白在检测hcc患者中的应用
正常组afp蛋白的血清浓度均小于20ng/ml,肝硬化患者组为6.34ng/ml,hcc患者组为375.5ng/ml。soat1蛋白浓度在正常组、lc患者组、hcc患者组的血清样本中的elisa检测结果:正常组soat1蛋白的浓度平均值为12.02ng/ml,肝硬化患者组为4.75ng/ml,肝癌患者组为89.11ng/ml。对各组样本中soat1蛋白和afp蛋白浓度进行统计学分析(非配对mann-whitney检验),发现血清soat1蛋白和afp蛋白浓度在正常组和hcc患者组(p<0.001)以及肝硬化患者组和hcc患者组(p<0.001)均有显著性差异。
共同判断soat1蛋白和afp蛋白的标准依据二元logistic回归计算结果,区分hcc与正常组具体计算公式为:p=1/(1+e-(-4.585+0.407*afp+0.082*soat1)),当p大于0.57时,判断为hcc;区分hcc与lc的计算公式为:p=1/(1+e-(-1.945+0.077*afp+0.068*soat1)),当p大于0.67时,判断为hcc。
用spss19.0软件分别对正常人(n)和肝细胞癌患者(hcc)、肝硬化(lc)和肝细胞癌患者(hcc)进行afp与soat1联合使用诊断hcc的roc曲线分析。
以正常组为对照组,hcc患者组为疾病组,血清soat1蛋白与afp蛋白联合使用判别诊断hcc患者的曲线下面积auc=0.92(如图3b所示),灵敏度为88.9%、特异度为100%;以lc患者组为对照组,hcc患者组为疾病组(如图3c所示),两者联合使用判别诊断hcc患者的auc=0.90,灵敏度为83.3%、特异度为100%。
由上述结果可知,血清中soat1蛋白和afp蛋白可用作正常人与hcc患者、以及lc与hcc患者进行判别诊断的潜在标志物。
上述结果汇总于表3和表4,展示了soat1蛋白、afp蛋白及其联合应用用于肝细胞癌患者与正常人或lc患者鉴别诊断的效果。
表3soat1蛋白和afp蛋白判别诊断正常人和肝细胞癌患者效果比较(soat1或soat1与afp联合使用效果优于afp)
表4soat1蛋白和afp蛋白判别诊断肝硬化和肝细胞癌患者效果比较(soat1或soat1与afp联合使用效果优于afp)
由上述结果可知,soat1与afp有良好的互补性,可联合用于肝癌筛查。
实施例5、soat1敲低能抑制肝癌细胞的增殖和迁移
在本实施例中,发明人研究了soat1特异敲低对肝癌细胞增殖和迁移的抑制作用。结果表明soat1shrna只特异敲低soat1,对soat2的丰度没有影响(图4a)。soat1特异敲低可以显著抑制肝癌细胞的增殖(图4c,d)和迁移(图4e,f),提示soat1可能作为肝癌治疗的一个靶点。
实施例6、soat1抑制剂能抑制肝癌细胞的生长
在本实施例中,发明人研究了soat1抑制剂在抑制肝癌细胞生长中的作用。结果表明soat1非特异抑制剂avasimibe可显著抑制肝癌细胞(plc/prf/5,hepg2,huh7和mhcc97h)的增殖(图5a)和迁移(图5b)。提示用soat1筛选出来的恶性度较高的肝癌患者可以靶向soat1进行精准治疗。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!