用于检测样品中的生物治疗物质的聚集体的方法与流程
本发明涉及用于检测样品中的生物治疗物质的聚集体的方法。
背景技术:
生物制药产品分为生物制剂及其仿制-制剂生物仿制药,是在活体中制备的治疗剂的那些类别。这些产品此外包括重组蛋白质和抗体。这些产品在各种疾病如糖尿病、各种癌症和炎性疾病的治疗中起关键作用。
生物制药产品从医学角度来看是最具吸引力的治疗剂,因为蛋白质和抗体就其效果而言具有出色的活性和特异性。然而,由于这些高分子量物质相对于传统的低分子量药物的结构复杂性造成的,最大的挑战在于物理和化学稳定性方面。这些蛋白质的错误折叠和随后聚集,可以在这种治疗剂的产品周期的每个单独的阶段期间发生。这些阶段包括产品的表达、折叠、纯化、灭菌、运输、储存和交付。
蛋白质聚集的后果是一方面活性降低,并且特别不利的是产品的免疫原性增加。当免疫系统将活性物质识别为抗原并形成针对该活性物质的抗体时,这导致其降解或者甚至导致变应性反应。这使得治疗无效甚至可能危险。
将任何自缔合的蛋白物种定义为均质蛋白聚集体,其中单体为最小天然存在的单位或亚单位。将聚集体按五个特征来划分:尺寸、可逆性(解离)、构象、化学修饰和形态[1]。
最小的聚集体单位对应于两个单体(二聚体),其中单体的数目此外向上不设置限制[1]。不利地,即使对于生物制药的蛋白质产品的最小聚集体单位,也已经发现了免疫应答[2]。
除了均质蛋白质聚集体之外,也存在异质聚集体,其中蛋白质单体可以与一种或多种其它蛋白质物种或者有机或无机杂质缔合。
可以由聚集体引起或增强免疫应答的受影响的机理是不同的。这些包括a)b细胞受体的增加的交联,这可引起它们的活化[3],b)增加的抗原摄取、加工和呈递,以及随后的免疫刺激信号的触发[4]。这种机制可以激发t细胞以产生抗体。由聚集体引起的免疫应答的最大临床风险取决于聚集体中单体表位的维持或变性。在维持表位的情况下,最初仅针对聚集体的抗体也可以结合单体并降低或中和它们的效果。在变性的情况下,抗体仅针对聚集体,而天然蛋白质的活性物质活性不受不利影响。在这两种情况下,免疫应答可能直至导致过敏反应,这对于患者来说可能是危险的。
目前(gegenwertig)还没有用于分析生物制药制剂中的杂质、聚集体部分及其尺寸的标准化方法。将聚集体按尺寸划分成两类并且建议了合适的测量方法。
聚集体>1μm:为了确定大的聚集体和杂质,典型地使用光学方法,例如光衰减(lo)、动态成像颗粒分析(dipa)和微流成像(mfi)以及库伦计数器(cc)的电化学方法。对于这些方法的成熟形式,也可以确定存在的聚集体的数目、尺寸和形状。
在0.1μm-1μm之间的聚集体:在该尺寸范围内使用用于检测小的聚集体的复杂体系。这些包括尺寸排阻色谱(sec)、分析超速离心(auc)和非对称场流分级(af4)。为了提高这些仪器的灵敏度,经常将它们与质谱仪耦合。虽然这些技术允许聚集体的定量和分布。不利的是确定组成,并且这些方法仅有限制地适合于高通量应用。
需要关于聚集体-类型和聚集体数量的信息,以确定从哪个聚集体部分开始对治疗蛋白质发生免疫应答
尽管0.1-10μm范围内的颗粒和聚集体也能够潜在地起免疫原作用的这一认识缓慢地获得承认,但是现在所使用的方法缺少确定其的精度[5]。
发明目的
本发明的目的是提供用于检测样品中的生物治疗物质的聚集体的高灵敏度方法。
本发明的另一个目的是提供用于实施该方法的试剂盒。
对此的其它目的和解决方案由本发明的说明书以及从属权利要求中获悉。
所述目的的解决方案
所述目的用根据专利权利要求1的方法和根据副权利要求的试剂盒得以实现。对此的有利的实施方案各自由与其相关(hieraufrückbezogenen)的专利权利要求获悉。
技术实现要素:
所述目的通过用于检测样品中的生物治疗物质的聚集体的方法得以实现,该方法包括以下步骤:
a.将样品施加在基底上,
b.添加适合于检测的探针,所述探针通过特异性结合至生物治疗物质的聚集体上来标记它们,和
c.检测经标记的生物治疗物质的聚集体,其中步骤b)可以在步骤a)之前实施。
因此,也可以首先将探针,然后将样品添加至基底。
所述用于检测和尤其是用于定量和/或定性测定均质和异质聚集体的方法的特征在于,生物制药产品的聚集体和生物制药产品中的聚集体包含至少一个用于探针的结合位点。
任选地,该聚集体也包含至少一个用于捕获剂分子的结合位点。
该方法因此包括以下步骤:
a)将捕获剂分子固定在基底上,
b)使具有生物制药产品的样品在溶液中与捕获剂分子接触,
c)通过结合至捕获剂分子,将存在于生物制药产品的溶液中的一种或多种分子的单体和/或聚集体固定在基底上,
d)使探针与所述单体和/或聚集体接触,
e)将探针结合至所述单体和/或聚集体上,
其中,所述探针能够产生给定的信号,并且步骤b)和d)能够同时进行,或者步骤d)能够在步骤b)之前进行。
如果步骤b)和d)同时进行,则因此步骤c)和e)也同时实施。
在另一变体中,其中步骤d)在步骤b)之前实施,因此在步骤c)中将用探针标记的单体和聚集体固定到基底上。因此也就是步骤e)在步骤b)和c)之前进行。
在本发明的意义上,"定量测定"首先意味着测定聚集体的浓度,因此也就意味着确定其存在和/或不存在。
优选地,定量测定也意味着选择性地定量聚集体组成。这种定量可以通过相应的探针进行。
在本发明的意义上,"定性测定"意味着表征聚集体组成。
用一个或多个可用于检测的探针标记聚集体。所述探针包含识别并且结合至聚集体或其单体的结合位点的亲和分子。
此外,所述探针包含至少一种检测分子或分子部分,其结合至亲和分子或分子部分上,并且可借助于化学或物理方法检测和/或测量。
在一个替代方案中,探针可以具有相同的亲和分子或分子部分与不同的检测分子(或部分)。在另一替代方案中,不同的亲和分子或分子部分可以与不同的检测分子或部分组合,或者替代地,不同的亲和分子或部分可以与相同的检测分子或部分组合。也可以使用不同的探针的混合物。
与不同的检测分子或分子部分偶联的多个不同的探针的使用,一方面增加了信号(相关信号)的特异性,另一方面使得在其组成方面不同的聚集体的识别成为可能。这使得聚集体的选择性定量和表征成为可能。
在一个实施方案中,位置分辨地(ortsaufgelöst)确定探针信号,即位置分辨地检测由探针发射的信号。因此,在本发明的这个实施方案中,排除了基于非位置分辨信号的方法,如elisa或三明治-elisa。
在检测时,高的位置分辨率是有利的但并非必需的。在根据本发明的方法的一个实施方案中,在这种情况下收集如此多的数据点,以允许先于背景信号检测聚集体,所述背景信号例如由仪器特异性噪声、其它非特异性信号或非特异性结合的探针造成。以这种方式,读取了与存在的位置分辨事件例如像素一样多的值(读出值)。通过位置分辨,先于各自的背景确定每个事件,因此相对于没有位置分辨信号的elisa方法是一个优点。
在一个实施方案中,探针信号的位置分辨的确定基于与样品体积相比小体积元素的研究,在几飞升至1飞升以下的范围内,或者在高度为500nm,优选300nm,特别优选250nm,特别是200nm,但是也为150nm和90nm的捕获剂分子的接触表面以上的体积范围的。
在本发明的意义上,聚集体是由至少两个相同的单体单元组成的均质聚集体,或者由至少两个不同的单体单元组成的异质聚集体。在异质聚集体的情况下,两种单体也可以在它们的初级序列方面是相同的,但是在它们的构象方面是不同的。
在一个实施方案中,基底的材料选自包含塑料、硅和二氧化硅的组或由其组成的组。在一个优选的替代方案中,使用玻璃作为基底。
在本发明的另一个实施方案中,捕获剂分子是共价结合至基底上的。
为此,在一个替代方案中使用具有亲水性表面的基底。在一个替代方案中,这通过,在步骤a)之前,在基底上施加亲水性层来实现。因此,捕获剂分子共价结合至基底上或至用其加载基底的亲水性层上。
亲水性层是生物分子排斥层,由此使生物分子非特异性结合至基底上最小化。在该层上,将捕获剂分子任选固定,优选共价固定。这些对单体或其聚集体的特征亲和。捕获剂分子可以全部相同,或者可以是不同捕获剂分子的混合物。
在一个替代方案中,使用相同的分子作为捕获剂分子和探针,优选地,捕获剂分子不包含检测分子或分子部分。
在一个实施方案中,亲水性层选自包含peg、聚-赖氨酸,优选聚-d-赖氨酸,和糊精或其衍生物,优选羧甲基糊精(cmd)的组或由其组成的组。在本发明的意义上的衍生物是在一些取代基上不同于母体化合物的化合物,其中所述取代基对于根据本发明的方法是惰性的。
在一个实施方案中,在施加亲水性层之前,首先将基底的表面羟基化,然后用合适的化学基团,优选氨基,官能化。在一个替代方案中,所述用氨基官能化通过使基底与氨基硅烷,优选aptes(3-氨基丙基三乙氧基硅烷)或与乙醇胺接触来进行。
为了使基底对涂层有准备,可以实施以下步骤中的一个或多个:
●在超声波浴或等离子清洁器中洗涤由玻璃或玻璃载体构成的基底,替代于此在5mnaoh中孵育至少3小时,
●用水冲洗,然后在氮气下或者在真空下干燥,
●浸入比例为3∶1的浓硫酸和过氧化氢的溶液中以活化羟基,
●用水冲洗,直至中性ph,随后用乙醇冲洗并在氮气气氛下干燥,
●浸入具有3-氨基丙基三乙氧基硅烷(aptes)(1-7%),优选在干燥甲苯中的溶液或乙醇胺的溶液中,
●用丙酮或dmso和水冲洗并在氮气气氛下干燥。
在一个替代方案中,使基底与氨基硅烷,优选aptes在气相中接触;因此,将任选预处理的基底用氨基硅烷蒸镀。
对于具有糊精、优选羧甲基-糊精(cmd)的涂层,将基底用cmd水溶液(浓度为10mg/ml或20mg/ml)和用于共价偶联的催化剂,任选n-乙基-n-(3-二甲基氨基丙基)碳二亚胺(edc)、(200mm)和n-羟基琥珀酰亚胺(nhs)、(50mm)孵育并随后洗涤。
在一个变体中,羧甲基-糊精是共价结合至玻璃表面上的,所述玻璃表面首先被羟基化,然后用胺基团官能化,如上所述。
作为基底可以使用微量滴定板,优选具有玻璃底部。因为在使用聚苯乙烯框架时不能使用浓硫酸,所以在本发明的一个实施方案变体中玻璃表面的活化类似地进行。
在该亲水性层上,优选共价地,固定捕获剂分子,其对聚集体的特征(例如蛋白质)亲和。捕获剂分子可以全部相同或者是不同的捕获剂分子的混合物。
在本发明的一个实施方案中,任选在活化用cmd涂覆的载体之后,通过edc/nhs的混合物,优选200或50mm,将捕获剂分子,优选针对聚集体的单体的抗体,固定在基底上。
没有捕获剂分子结合至其上的残留的羧酸酯端基可以被失活。使用乙醇胺用于使cmd间隔物上的这些羧酸酯端基失活。在施加样品之前,任选用缓冲液冲洗基底或载体。
在本发明的一个实施方案中,在施加样品之前,将基底用包含蛋白质或肽的溶液封闭,并用缓冲液洗涤。
使待测量的样品与如此制备的基底接触,并且任选地孵育。作为待研究的样品,可以使用生物制药产品、细胞上清液和培养介质中的产品的不同的配制的溶液或者内生的液体。在本发明的一个实施方案中,样品选自:脑脊液(csf)、血液、血浆和尿液。样品可以经历本领域技术人员已知的不同的后处理步骤。
在本发明的一个实施方案中,样品的施加直接在基底(未涂覆的基底)上进行,任选地通过在任选活化的基底表面上共价结合。
在本发明的一个变体中,样品的预处理根据一个或多个下述方法进行:
-加热样品,
-一个或多个冻融循环,
-机械分解(aufschluss),
-样品的均质化,
-用水或缓冲液稀释,
-用酶处理,例如核酸酶、脂肪酶,
-离心,
-用探针竞争,以排挤掉可能存在的抗体。
优选地,使样品直接与基底接触和/或在没有预处理的情况下与基底接触。
非特异性结合的物质可以通过洗涤步骤除去。
在另一个步骤中,用一个或多个用于进一步检测的探针标记被固定的聚集体。如上所述,各个步骤也可以以另一顺序根据本发明地来实施。
通过合适的洗涤步骤,除去未结合至聚集体的过量探针。
在一个替代方案中,这些过量的探针没有被除去。由此,取消了最后的洗涤步骤并且也没有发生在聚集体-探针-复合物或-化合物的解离方向上的平衡移动。通过位置分辨检测,在评估时没有包括过量的探针并且没有不利影响测量。
在一个变体中,样品-捕获剂分子-复合物被化学固定。
在一个替代方案中,将检测探针-样品-捕获剂分子-复合物化学固定,因此样品-捕获剂分子-复合物也化学固定。
在该方法的一个特别的实施方案中,聚集体的结合位点是表位,且捕获剂分子和探针是抗体。在本发明的一个变体中,捕获剂分子和探针可以是相同的。
在本发明的一个实施方案中,捕获剂分子和探针不同。因此,可以使用例如不同的抗体作为捕获剂分子和作为探针。
在本发明的另一实施方案中,使用除可能的(染料)标记之外彼此相同的捕获剂分子和探针。
在本发明的另一替代方案中,使用不同的探针,这些探针除了可能的(染料)标记之外是彼此相同的。
在本发明的另一替代方案中,使用至少两种或更多种不同的捕获剂分子和/或探针,其包含不同的抗体,并且任选地还具有不同的染料标记。
在本发明的一个替代方案中,用相应的染料标记两个或更多个探针,使得发生fret,所谓的福斯特共振能量转移,其中一种染料被激发而位于附近的另一种被发射,其中这两种染料是不同的分子。
为了检测,如此标记探针,使得它们发出可光学检测的信号,该信号选自荧光-、磷光、生物发光-、化学发光和电致发光-发射以及吸收。
在一个替代方案中,探针因此是用荧光染料标记的。作为荧光染料,可以使用本领域技术人员已知的染料。替代地,也可以使用荧光生物分子,优选gfp(绿色荧光蛋白)、其缀合物和/或融合蛋白,以及荧光纳米颗粒,优选量子点。
为了事后的表面品质控制,例如具有捕获剂分子的涂层的均匀性,可以使用用荧光染料标记的捕获剂分子。为此,优选使用不被检测干扰的染料。由此,结构的事后控制以及测量结果的标准化变得可行。
被固定的且标记的聚集体的检测借助于表面的成像(例如激光显微术)来进行。尽可能高的位置分辨率确定了大量的像点,由此可以增加该测定的灵敏度以及选择性,因为可以一起成像和分析结构特征。因此,特异性信号先于背景信号(例如,非特异性结合的探针)增加。
该检测优选用共焦荧光显微术、荧光相关光谱法(fcs),尤其结合交叉相关和激光扫描显微镜(lsm)进行。
在本发明的一个替代方案中,该检测(detektion)或检测(nachweis)用共焦激光扫描显微镜来实施。
在本发明的一个实施方案中,为此使用激光聚焦(例如其在激光-扫描-显微术中被使用)或fcs(荧光相关光谱系统),以及相应的超分辨变体例如sted、palm或sim。
在另一实施方案中,该检测(detektion)或检测(nachweis)可以借助于位置分辨的荧光显微术,优选通过tirf显微镜进行,以及其相应的超分辨变体,例如storm、dstorm。
与elisa不同,通过这些方法产生了与存在的位置分辨事件(例如,像素)一样多的读出值。取决于不同探针的数目,甚至有利地将信息倍增。该倍增对于每个检测事件都是有效的,并且导致信息增益(informationsgewinn),因为它公开了关于聚集体的进一步特性(例如第二特征)。通过这样的结构,可以针对每个事件增加信号的特异性。
可以如此选择探针,使得在异质聚集体的情况下,各个成分或构象的存在不影响测量结果。可以如此选择探针,使得可以在一个测量中确定均质和异质聚集体和不同的异质聚集体。
为了评估,考虑所有使用的和检测的探针的位置分辨信息(例如荧光-强度),以确定例如聚集体的数目、其大小及其特征。在此,例如也可以应用背景最小化的算法和/或强度-阈值用于进一步评估以及模式识别。进一步的图像分析-选择可能性包含例如寻找局部强度最大值,以从图像信息中获得所检测的聚集体数。
为了使测试结果在距离、时间和实验者方面彼此可比较,可以使用标准物,例如内部和/或外部标准物。这些标准物也可以用于校准测量,以确定生物制药产品的聚集体的尺寸分布、数量和/或组成。
本发明的另一个主题是提供具有窄的尺寸分布并且由两个或更多个相同或不同的多肽序列组成的标准物。所述多肽序列也可以是生物制药活性物质的天然单体形式。
在一个变体中,所述标准物由不同尺寸分布的混合物组成。
在一个变体中,所述标准物被标记。
在一个变体中,所述标准物由两个或更多个单体组成,它们彼此共价连接。
在一个变体中,所述标准物由两个或更多个单体或多肽序列共价结合在其表面上的纳米颗粒组成,并且所述多肽序列在部分区域中与生物治疗物质的单体的序列是相同的。
本发明的主题也是试剂盒,其包含一种或多种以下组元:
基底,任选具有亲水性表面,捕获剂分子,探针,标准物,具有捕获剂分子的基底,溶液,缓冲液。
本发明的试剂盒的化合物和/或组元可以包装在多个容器中,任选地与缓冲液和/或溶液一起/在缓冲液和/或溶液中。替代地,一些组元可以被包装在同一容器中。另外地或替代于此地,所述组元中的一种或多种可以被吸收在固体载体,例如玻璃板、芯片或尼龙膜上,或吸收在微量滴定板的孔上。此外,所述试剂盒可以包含用于所述实施方案中的任意一种的试剂盒的使用说明书。
在试剂盒的另一变体中,将上述捕获剂分子固定在基底上。另外,试剂盒可以包含溶液和/或缓冲液。为了保护生物分子排斥表面(例如右旋糖酐表面)和/或固定在其上的捕获剂分子,可以用溶液或缓冲剂将它们覆盖。在一个替代方案中,所述溶液包含一种或多种杀生物剂,其提高表面的耐久性。
本发明的另一主题是根据本发明的方法在检测任意样品中的生物制药产品的和在生物制药产品中的同质和异质的聚集体中、在定量(滴定测定)生物制药产品的和在生物药物产品中的同质和异质的聚集体中,直接和/或绝对地定量颗粒数的用途。
本发明的另一主题是根据本发明的方法在生产生物制药活性物质和/或最终产品的品质测定期间用于优化和监控工艺步骤中的用途。
本发明的另一主题是根据本发明的方法用于在临床测试、研究中以及在治疗监测中检测生物制药产品的同质和异质聚集体的用途。为此,按照根据本发明的方法测量样品并比较结果。
实施例:
此外,参考实施例和附图说明本发明,而并非因此限制于该具体实施例。
其中:
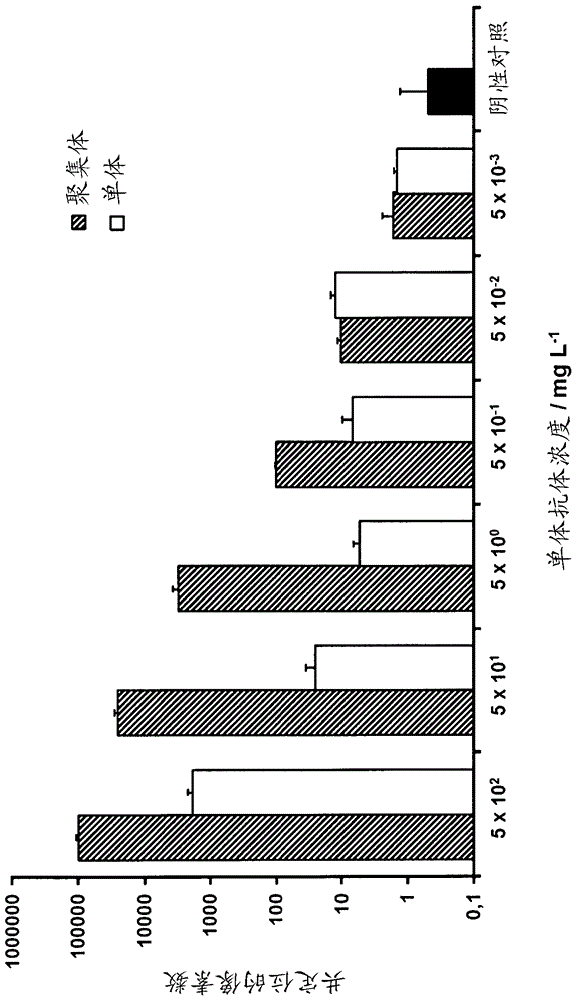
图1示出了作为样品的人igg抗体的聚集体(阴影条)和单体(白色条)。
图1示出了以对数(dekadischen)稀释系列的人igg抗体(同种型对照,thermofisherscietific,rf237824)的聚集体(阴影条)和单体(白色条)。
作为单体,使用抗体,如同其存在的那样,并在磷酸盐盐水缓冲液(pbs)中在ph7.4下稀释。为制备聚集体,将样品(5mg/ml)在70℃下加热10分钟,并在达到25℃后对数稀释。
结果示出了在6个log级上在浓度和测量信号之间的线性相互关系。相反,单体在宽范围上显示出低得多的测量信号。不能排除即使在单体溶液中也存在小量的聚集体,其对高浓度下的值负责。作为阴性对照(黑条),使用稀释缓冲液。
具体实施例
对于该实验,使用具有384个反应室(rk)和玻璃底部的商用微量滴定板(greinerbio-one;sensoplateplus)作为基底。
首先,建立或官能化微量滴定板的表面。为此,将板放置在干燥器中,其中一个具有5%的aptes的甲苯皿位于其中。将干燥器充满氩气并孵育1小时。然后,将皿移除,并将板在真空中干燥2小时。向干燥的板的反应室中注入用于亲水性涂层的20μl的sc-peg-cm(mw3400;laysanbio)在去离子h2o中的2mm溶液,并孵育4小时。孵育后,用水洗涤反应室三次,然后用每种20μl的200mmedc水溶液(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺;sigma)和用50mmnhs(n-羟基琥珀酰亚胺;sigma)孵育30分钟。由此,具有peg的亲水性涂层获得用于偶联生物分子的官能团(funktionalität)。
将该板再次用去离子水洗涤板三次。然后,将反应室用克隆8a4(thermo-fischer)涂覆(20μl,在pbs中10μg/ml,1小时),克隆8a4是一种作为捕获剂分子的单克隆抗体,其在人抗体的fc部分中特异性结合ch2域。随后,用洗涤程序用具有0.1%tween-20和tbs的tbs处理反应室,所述洗涤程序由各三次洗涤和空抽吸(leersaugen)组成。
在下一步骤中,将反应室用50μlsmartblock(candorbiosciencegmbh)涂覆,在室温(rt)下过夜,并且在该时间到期之后再次用盐水三(羟甲基)氨基甲烷(tbs;ph=7.4)洗涤三次。
将样品依次在具有染料赫斯特染色(hoechststain)(1µgml-1)的三(羟甲基)氨基甲烷(tris)缓冲液中稀释,并孵育一小时。然后,一式三份地将每20μl样品施加到反应室中,并在室温下孵育1小时。在孵育之后,将反应室用tbs洗涤3次,并掺入20μl检测抗体。将检测抗体各自用一种荧光染料标记:分别地,8a4(thermofisherscientific,ma1-81864)用荧光染料cf488和用cf633标记。将这些探针抗体或检测抗体在tbs中一起稀释至每种抗体的最终浓度为1.25ng/ml。它们特异性结合生物治疗物质的单体的表位和聚集体。
每个反应室施加20μl抗体溶液并在室温下孵育1小时。在该时间到期之后,将板用tbs洗涤三次,并用膜密封该板。
为了检测聚集体,实施了位置分辨显微术。在具有100倍油浸物镜的tirf显微镜(leica)中进行测量。为此,用浸油大量涂抹微量滴定板的玻璃底部,并将该板引入到显微镜的自动载物台中。然后,每个反应室在两个荧光通道(ex/em=633/715nm和488/525nm)中的5x5位置相继地拍摄一张图像(1000x100像素),以得到如此多的数据点,从而能够先于背景信号检测各个聚集体。选择最大激光功率(100%)、500ms的曝光时间和800的增益值。然后评估图像数据。针对每个通道,将强度阈值确定为对应通道中的平均阴性对照的0.0001%灰度级处。在评估步骤中,首先将强度阈值应用于每个通道中的每个图像,并且随后将两个值中的相同位置的图像相互比较。仅对每个图像的那些像素进行计数,其中在两个通道中,该像素都位于通道的强度阈值上方的完全相同的位置处。最后,对每个rk中所有图像上的像素数取平均值,然后确定复本值(replikatwerte)的平均像素数的平均值并且给出标准偏差。
这些值在图1中示出。
然后,该校准系列可以在生物治疗物质的更复杂的检测方法中充当入口(einstieg),在igg的具体情况下,igg可以作为生物治疗物质存在于作为样品的药物制剂的溶液中,并应研究聚集体。在此,荧光探针-抗体不能结合至捕获剂分子结合的单体上,因为其结合位点被捕获剂分子占据。取而代之地,它仅结合至聚集体的单体表位上。因此,这可以以所示的方式定量。
参考文献:
[1]narhi,l.o.,j.schmit,等人(2012)."classificationofproteinaggregates."jpharmsci101(2):493-498.
[2]gamble,c.n.(1966)."theroleofsolubleaggregatesintheprimaryimmuneresponseofmicetohumangammaglobulin."intarchallergyapplimmunol30(5):446-455.
[3]bachmann,m.f.,u.h.rohrer,等人(1993)."theinfluenceofantigenorganizationonbcellresponsiveness."science262(5138):1448-1451.
[4]seong,s.y.andp.matzinger(2004)."hydrophobicity:anancientdamage-associatedmolecularpatternthatinitiatesinnateimmuneresponses."natrevimmunol4(6):469-478.
[5]denengelsman,j.,garidel,p.,等人(2011).strategiesfortheassessmentofproteinaggregatesinpharmaceuticalbiotechproductdevelopment.pharm.res.28:920–933。
- 还没有人留言评论。精彩留言会获得点赞!