用于癌症诊断的肿瘤来源的外泌体的免疫应答谱分析的制作方法
相关申请
本申请要求2017年12月6日提交的新加坡临时申请第10201710131x号的权益,其全部内容通过援引加入合并于此。
本发明具体涉及检测受试者中癌症或癌症类型的方法,所述方法包括体外测量肿瘤来源的外泌体对免疫细胞的功能影响以创建癌症特异性应答谱的步骤,其中所述癌症特异性应答谱指示所述受试者中的癌症或癌症类型。本发明还涉及癌症管理的方法以及用于检测或监测癌症或癌症类型的测试、分析测定和试剂盒。
背景技术:
与常规组织活检相比,液体活检具有较小的侵入性并且允许早期检测和治疗监测,因此对于癌症诊断而言是很有希望的手段。循环肿瘤细胞(ctc),循环肿瘤dna/rna和肿瘤来源的外泌体(texs)是血液中的三种肿瘤标志1,2,3。其中,循环肿瘤dna(ctdna)的研究最为广泛。然而,ctdna可能不代表实际的活肿瘤细胞,因为它们是从死亡或将死的肿瘤细胞中释放出来的,并且易于在血液中降解4,5。另一方面,ctc的应用受限于其数量稀少、异质性的限制和方法上的差异6,7。
texs是细胞外囊泡,其包含或结合细胞特异性生物分子,诸如蛋白质,rna或dna。这些从实际的活肿瘤细胞释放的生物分子受到脂质双层的保护并且可用作癌症的生物标志物和治疗剂8,9,10,11。在skog等显示从患者血液中的texs提取的rna可用于诊断胶质母细胞瘤12以后,byron等人开发了第一个可商购的基于外泌体rna的肺癌诊断试剂盒,用于检测eml4-alk突变13。texs中的microrna也已成为卵巢癌的生物标志物14。texs中的蛋白质也已在诊断结直肠癌15和胰腺癌16等方面显示了成功。
到目前为止,就本发明人所知,所有基于外泌体的癌症诊断技术都依赖于内容谱分析,这意味着他们寻找癌症类型特异性生物标记。然而,在健康细胞发出的噪音海中寻找生物标志物仍然是最大的挑战之一。另外,肿瘤在dna,rna和表观遗传水平上具有很大异质性。癌细胞与肿瘤微环境中免疫系统之间的患者特异性相互作用进一步加剧了进化和突变方面的变异17,18,19。因此,鉴定出一组对癌症类型高度敏感和特异的蛋白质或核酸生物标记在技术上具有挑战性且成本很高。这就是为什么尽管出现了关于癌症液体活检的成功案例,但在临床环境中,只有很有限数量的经验证的癌症生物标志物可用于一些癌症类型20,21,22,23。此外,不同类型癌症的生物标志物列表并不详尽。潜在的癌症患者可能需要针对数百种生物标志物进行诊断,以确定其不患有特定的一系列癌症。这可能会增加诊断成本,并需要抽取患者过多量的血液。因此,需要能够同时检测多种类型的癌症并且不依赖于癌症生物标志物的更广谱的癌症诊断测试。
texs不仅包含指示其亲代癌细胞身份的生物标志物,它们而且还具有由肿瘤细胞部署的功能性信使分子以影响其他细胞,特别是免疫系统中的细胞9,24,25,26。texs已被证明具有免疫抑制作用。它们包含或表达多种免疫调节分子的组合,例如il-10,tgf-β,pd-1,pdl-1,trail,fasl,cd39和cd73,以抑制t细胞的功能,削弱t细胞对刺激物的反应,促进调节性t细胞的扩增或诱导细胞毒性t细胞凋亡。同时,texs由于其浓缩的肿瘤抗原和热休克蛋白也可以具有免疫刺激性27,25,26,28,29,30,31,32。
具体实施方案
本发明人现在已经发现,除了texs中的癌症特异性遗传和蛋白质信息以外,texs对免疫细胞的异质性功能影响还可以用作另一种身份签名。
根据本发明的第一个实施方案,提供了检测受试者中癌症或癌症类型的方法,所述方法包括以下步骤;使用基于肿瘤来源的外泌体对免疫细胞的功能影响的体外测量而创建的癌症特异性应答谱,鉴定所述受试者中的癌症或癌症类型,其中所述肿瘤来源的外泌体是从所述受试者中分离的。
根据本发明的第二个实施方案,提供了一种在受试者中同时测试检测或区分多种类型的癌症的方法,所述方法包括以下步骤:使用基于肿瘤来源的外泌体对免疫细胞的功能影响的体外测量而创建的癌症特异性应答谱,鉴定所述受试者中的癌症或癌症类型,其中所述肿瘤来源的外泌体是从所述受试者中分离的。
根据本发明的第三个实施方案,提供了一种筛选受试者中一种或多种癌症类型的患病率的方法,所述方法包括以下步骤:使用针对每个受试者创建的癌症特异性应答谱,基于肿瘤来源的外泌体对免疫细胞的功能影响的体外测量,鉴定每个所述受试者中的癌症或癌症类型,其中所述肿瘤来源的外泌体是从所述受试者中分离的。
根据本发明的第四个实施方案,提供了一种管理患有癌症类型的受试者的方法,所述方法包括以下步骤:
(1)使用基于肿瘤来源的外泌体对免疫细胞的功能影响的体外测量而创建的癌症特异性应答谱,鉴定所述受试者中的癌症类型,其中所述肿瘤来源的外泌体是从所述受试者中分离的;和
(2)如果已经发现所述受试者患有所述癌症类型,则管理该受试者。
根据本发明的第五个实施方案,提供了一种鉴定患有癌症类型的受试者是否对该癌症类型的管理有响应的方法,所述方法包括以下步骤:
(1)使用基于肿瘤来源的外泌体对免疫细胞的功能影响的体外测量而创建的癌症特异性应答谱,鉴定所述受试者中的癌症类型,其中所述肿瘤来源的外泌体是从所述受试者中分离的;和
(2)比较在所述癌症类型的管理之前、期间和/或之后创建的各个癌症特异性应答谱,其中所述癌症特异性应答谱的变化将受试者鉴定为对所述癌症类型的管理有响应。
根据本发明的第六个实施方案,提供了一种基于肿瘤来源的外泌体对免疫细胞的功能影响的体外测量而创建的肿瘤来源的外泌体诱导的免疫应答或癌症特异性应答谱,其用于或可用于检测或诊断受试者中的癌症或癌症类型。
根据本发明的第七个实施方案,提供了一种肿瘤来源的外泌体诱导的免疫应答,用于或可用于创建体外测量肿瘤来源的外泌体对免疫细胞的功能影响的癌症特异性应答谱。
根据本发明的第八个实施方案,提供了肿瘤来源的外泌体诱导的免疫应答在产生癌症特异性应答谱中的用途,所述癌症特异性应答谱体外测量肿瘤来源的外泌体对免疫细胞的功能影响,其中所述肿瘤来源的外泌体是从患有癌症的受试者分离的,并且所述癌症特异性应答谱指示所述受试者中的癌症类型。
根据本发明的第九个实施方案,提供了一种产生针对癌症类型的特异性应答谱的方法,所述方法包括以下步骤:
(1)体外测量肿瘤来源的外泌体对免疫细胞的功能影响,其中所述肿瘤来源的外泌体是从患有特定癌症类型的受试者中分离的;和
(2)基于针对所述癌症类型的特异性功能影响创建癌症特异性应答谱。
根据本发明的第十个实施方案,提供了用于或可用于检测或诊断受试者的癌症或癌症类型的测试、分析测定、试剂盒、装置或设备,如一个或多个其他实施方案中所述。
根据本发明的第十一个实施方案,提供了一种测试、分析测定、试剂盒,装置或设备,其用于或可用于同时测试或区分受试者的多种类型的癌症,如一个或多个其他实施方案中所述。
根据本发明的第十二个实施方案,提供了一种检测、分析测定、试剂盒、设备或装置,其用于或可用于检测或测量肿瘤来源的外泌体诱导的免疫应答,如一个或多个其他实施方案中所述。
根据本发明的第十三个实施方案,提供了一种或多种数学算法,其用于或可用于测量或定量至少一种肿瘤来源的外泌体诱导的癌症类型特异性免疫应答和/或基于所述癌症类型特异性免疫应答创建癌症特异性应答谱,如一个或多个其他实施方案中所述。
根据本发明的第十四个实施方案,提供了参比癌症特异性应答谱的预建数据库,其用于或可用于鉴定受试者中的癌症类型或区分受试者中的多种癌症。
所述受试者可以是人或不同类型的哺乳动物,包括:农场动物,诸如猪、牛、马、绵羊或山羊;以及伴侣动物,例如狗或猫;或实验动物,例如兔、小鼠或大鼠。
可以使用任何合适类型的免疫细胞。例如,免疫细胞可以包含t细胞,自然杀伤(nk细胞)和b细胞中的一种或多种。优选地,免疫细胞是t细胞。可以使用任何合适类型的t细胞。合适的t细胞的例子包括cd8t细胞和cd4t细胞。特别优选的免疫细胞包括原初cd8+t细胞,原初cd4+t细胞,活化的(act)cd8+t细胞和actcd4+t细胞。
t细胞可源自任何合适的器官,例如,包括小鼠脾脏或人外周血单核细胞(pbmc)。
所述方法可以包括以下步骤:体外测量肿瘤来源的外泌体对免疫细胞的功能影响,以创建癌症特异性应答谱和/或参比癌症特异性应答谱。这可以通过任何合适的方式来实现。
创建癌症特异性应答谱/功能影响可包括测量以下一或多项:抑制免疫细胞的功能;削弱免疫细胞对刺激物的应答;促进调节性免疫细胞的扩增;诱导细胞毒免疫细胞的凋亡;或免疫刺激。
创建癌症特异性应答谱/功能影响可包括测量以下一或多项:抑制t细胞功能;削弱t细胞对刺激物的应答;促进调节性t细胞的扩增;诱导细胞毒t细胞凋亡;或免疫刺激。
创建癌症特异性应答谱/功能影响可包括测量由于以下一种或多种免疫调节分子引起的免疫抑制:il-10,tgf-β,pd-1,pdl-1,trail,fasl,cd39和cd73。
创建癌症特异性应答谱/功能影响可包括测量由于以下一种或多种分子引起的免疫刺激作用:肿瘤抗原和热休克蛋白。
免疫调节分子(免疫抑制性或免疫刺激性)的优选实例包括il-10,tgf-β,pd-1,pdl-1,trail,fasl,cd69,cd25,pstat5,cd39,cd73,ki67,tim3,粒酶b,ifnγ,ctla4,肿瘤抗原和热休克蛋白以及参考文献中描述的那些27,25,26,28,29,30,31,32,其各自通过交叉引用的方式整体并入本文。
创建癌症特异性应答谱/功能影响可包括测量免疫细胞上和/或免疫细胞中的至少一种标志物表达水平。可以使用任何合适类型的一或多种免疫细胞表面标志物和/或细胞内标志物。例如,可以使用任何合适类型的一或多种t细胞表面标志物和/或一或多种细胞内标志物。
所述标志物可以是例如免疫细胞活化标志物,免疫细胞增殖标志物,免疫细胞耗竭标志物,免疫细胞细胞毒标志物,免疫细胞细胞毒和凋亡标志物,或免疫细胞抑制标志物。
在一些实施方案中,所述活化标志物可以是cd69,cd25或pstat5。
在一些实施方案中,所述增殖标志物可以是ki67。
在一些实施方案中,所述耗竭标志物可以是tim3。
在一些实施方案中,所述细胞毒标志物可以是粒酶b或ifnγ。
在一些实施方案中,所述细胞毒和凋亡标志物可以是fasl。
在一些实施方案中,所述抑制标志物可以是pd-1或ctla4。
优选地,在蛋白质水平上测量一种以上类型的免疫标志物,以产生癌症特异性应答谱。
癌症可以是任何合适类型的癌症。例如,癌症可以是肾癌、结直肠癌(结肠癌和/或直肠癌)、皮肤癌(包括基底细胞癌、细胞癌、鳞状细胞癌和黑色素瘤)、白血病、淋巴瘤、中枢神经系统肿瘤、乳腺癌、前列腺癌、宫颈癌、子宫癌、肺癌、卵巢癌、睾丸癌、甲状腺癌、星形细胞瘤、胶质瘤、胰腺癌、间皮瘤、胃癌、肝癌、肾的癌症包括肾母细胞瘤、膀胱癌、食道癌、喉癌、腮腺癌、胆管癌、子宫内膜癌、腺癌、小细胞癌、神经母细胞瘤、肾上腺皮质癌、上皮癌、硬纤维瘤、纤维增生性小圆细胞瘤、内分泌肿瘤、尤文氏肉瘤家族肿瘤、生殖细胞瘤、肝母细胞瘤、肝细胞癌、非横纹肌肉瘤软组织肉瘤、骨肉瘤、外周原始神经外胚层肿瘤、视网膜母细胞瘤和横纹肌肉瘤。
所述方法可以包括将受试者的创建的癌症特异性应答谱与一个或多个先前创建的参比癌症特异性应答谱进行比较的步骤,其中每个所述参比谱是基于诊断为患有特定类型癌症的受试者而创建的。
在一些实施方案中,所述方法可以包括将受试者的创建的癌症特异性应答谱与预先建立的参比癌症特异性应答谱的数据库进行比较,其中所述受试者的应答谱和参比谱匹配或接近匹配指示该受试者患有的癌症的类型。例如,预先建立的参比谱数据库可以具有针对以下一种或多种类型的癌症的至少一种参比谱:肾癌、结直肠癌(结肠癌和/或直肠癌)、皮肤癌(包括基底细胞癌、细胞癌、鳞状细胞癌和黑色素瘤)、白血病、淋巴瘤、中枢神经系统肿瘤、乳腺癌、前列腺癌、宫颈癌、子宫癌、肺癌、卵巢癌、睾丸癌、甲状腺癌、星形细胞瘤、胶质瘤、胰腺癌、间皮瘤、胃癌、肝癌、肾的癌症包括肾母细胞瘤、膀胱癌、食道癌、喉癌、腮腺癌、胆管癌、子宫内膜癌、腺癌、小细胞癌、神经母细胞瘤、肾上腺皮质癌、上皮癌、硬纤维瘤、纤维增生性小圆细胞瘤、内分泌肿瘤、尤文氏肉瘤家族肿瘤、生殖细胞瘤、肝母细胞瘤、肝细胞癌、非横纹肌肉瘤软组织肉瘤、骨肉瘤、外周原始神经外胚层肿瘤、视网膜母细胞瘤和横纹肌肉瘤。
测量肿瘤来源的外泌体对免疫细胞的功能影响以产生癌症特异性应答谱或参比应答谱的步骤可以涉及一个或多个数学步骤或数学算法。可以使用任何适当类型的数学步骤或数学算法。
优选地,使用多种不同的功能影响类型来创建癌症特异性应答谱或参比谱。例如,不同的功能影响类型可以与免疫细胞上或免疫细胞中的多种标志物的不同表达水平相关。
在一些实施方案中,测量肿瘤来源的外泌体对免疫细胞的每种类型的功能影响以创建癌症特异性应答谱(或参比谱)可以包括量化功能影响的步骤。例如,这可以包括定量免疫细胞上或免疫细胞中一种或多种不同标志物的表达水平。
在一些实施方案中,测量肿瘤来源的外泌体对免疫细胞的功能影响以创建癌症特异性应答谱(或参比谱)可包括基于相对于对照归一化的功能影响计算第一“参数”得分的步骤。所述第一参数得分可以通过将功能影响的几何平均值除以对照的平均几何平均值,然后进行log-2转换以获得该功能影响的第一参数得分。
可以根据以下计算第一参数得分:
其中,gmfii是所述功能影响的几何平均值。
例如,这可以包括基于相对于对照免疫细胞上的标志物的表达水平归一化的免疫细胞上的标志物的表达水平来计算第一参数得分。
可以根据以下计算第一参数得分:
其中gmfii是所述免疫细胞上标志物表达水平的几何平均荧光强度(gmfi)。
在一些实施方案中,测量肿瘤来源的外泌体对免疫细胞的功能影响以产生癌症特异性应答谱(或参比谱)可包括基于第一参数得分的平均绝对值计算第二(“exo”)得分的步骤。。
第二exo得分可以根据以下计算:
其中,mi是第一参数得分,并且n是参数得分的数量。
在一些实施方案中,测量肿瘤来源的外泌体对免疫细胞的功能影响以产生癌症特异性应答谱(或参比谱)可包括基于第一参数得分的平均归一化偏差的绝对值的平均值计算第三“偏差”得分的步骤。。
可以根据以下计算第三偏差得分:
其中所述npd包括根据以下计算的归一化参数偏差:
并且其中,x是功能影响i的测试样品的参数得分且m是该功能影响的识别的参数得分。
例如,在第一参数得分基于免疫细胞标志物的表达水平的情况下,所述第三得分可以包括根据以下计算的偏差得分:
其中,npd包括根据以下计算的归一化参数偏差:
并且其中x是标志物i的测试样品的参数得分,且m是该标志物的识别参数得分。
优选地,小于0.1的第三偏差得分表示与数据库中的癌症类型匹配。
在一些实施方案中,可以在对第一参数得分数据进行线性回归和斯皮尔曼等级顺序相关性检验之后,选择功能影响以包括在应答谱中。具体地,可以通过对第一参数得分相对于剂量进行线性回归和斯皮尔曼等级顺序相关性检验,选择功能影响(例如,表达标记)包含在应答谱中。如果参数的相关系数ρ和确定系数r2满足以下条件之一并通过视觉检查,则可以选择该参数:
参数选择:
|ρ|>0.3且r2>0.2
|ρ|>0.4且r2>0.1
|ρ|>0.2且r2>0.3
在一些实施方案中,可以进行学生t检验,并且可以计算健康组和肿瘤组的平均值之间的差异的量级。在以下情况下可以选择参数:
在一些实施方案中,第一参数得分,第二exo得分和/或第三偏差得分可用于创建癌症特异性应答谱。
在一些实施方案中,第一参数得分,第二exo得分和/或第三偏差得分可用于从已知患有癌症的受试者中创建参比谱。
在一些实施方案中,当将受试者的癌症特异性应答谱与参比谱进行比较时,可以使用第一参数得分,第二exo得分和/或第三偏差得分。
在一些实施方案中,所述第二exo得分可用于给出受试者是否存在癌症的总体“是”或“否”答案。
在一些实施方案中,所述第三偏差得分可用于确定受试者中存在的癌症的类型,因为它反映了为受试者创建的应答谱与参比应答谱的接近度。
在一些实施方案中,所述受试者的癌症特异性应答谱和参比谱可以各自为免疫应答签名条形码(immuneresponsesignaturebarcode)的形式。
在一些实施方案中,关于在免疫细胞上或在免疫细胞中表达的标志物(即代表功能影响的类型),该方法可包括:
(a)基于用对照免疫细胞上的标志物的表达水平归一化的免疫细胞上的标志物的表达水平,计算第一参数得分;
(b)根据第一参数得分的平均绝对值计算第二exo得分;
(c)基于第一参数得分的平均归一化偏差的绝对值的平均值来计算第三偏差得分;和
(d)将受试者应答谱的第一参数得分,第二exo得分和/或第三偏差得分与从已知患有癌症的受试者制备的参比谱的组进行比较。
用于或可用于检测或诊断对象中的癌症或癌症类型的测试、分析测定、试剂盒、装置或设备可包含用于培养肿瘤来源的外泌体的试剂和免疫细胞;和用于检测免疫细胞上或免疫细胞中至少一种标志物表达水平的试剂。
可以使用可检测标记来测量标志物的表达水平。可以使用任何合适的标签。例如,所述标记可以是可检测的抗体。
可以使用配置为检测和测量可检测标记的装置来测量标志物的表达水平。
该设备或装置可以是流式细胞仪(flowcytometer)/流式细胞术(flowcytometry)和/或实时pcr(聚合酶链反应)。
优选地,该装置是流式细胞仪。
对照免疫细胞可以是用未患病的外泌体或不暴露于外泌体培养的免疫细胞。
未患病的外泌体可以是(健康的)未患病的外泌体。
对照可以是没有外泌体如单独用缓冲液或培养基培养的免疫细胞。
外泌体可从所述受试者的细胞外液例如血液中分离。
外泌体可包含肿瘤来源的外泌体。
测试、分析测定、试剂盒、装置或设备可以进一步包括用于检测免疫细胞上至少一种标志物的表达水平的工具。
用于检测免疫细胞上至少一种标志物的表达水平的工具可以是流式细胞仪/流式细胞术。
可以以任何合适的方式来管理受试者。如本文所用,术语“管理”(或“治疗”)受试者或“管理”是指癌症被治愈、痊愈、减轻、缓解、改变、补救、好转或改善。管理可以包括手术和/或以有效减轻、缓解、改变、补救、好转、改善或影响疾病或疾病症状的量给予一种或多种治疗化合物。给药可以包括但不限于口服,舌下,肠胃外(例如静脉内,皮下,皮内,肌肉内,关节内,动脉内,滑膜内,胸骨内,鞘内,病变内或颅内注射),经皮、经局部、经颊、经直肠、经阴道、经鼻、经眼、经吸入和植入。
所述方法可以包括从受试者分离肿瘤来源的外泌体的步骤。肿瘤来源的外泌体可以任何合适的方式从受试者中分离。优选地,它们经由液体活检分离。
所述方法可以包括在免疫细胞存在下培养肿瘤来源的外泌体的步骤,并且这可以任何合适的方式实现。如果在存在t细胞的情况下进行培养,则可能需要存在t细胞支持分子。
所述方法可以包括从受试者获得肿瘤来源的外泌体的步骤。这可以包括在无外泌体的培养基中培养由受试者的肿瘤细胞分泌的细胞外囊泡形式的外泌体的步骤。细胞外囊泡/外泌体的大小可以为约20nm至约150nm,或约50nm至约140nm,或约80nm至约130nm,或约110nm至约120nm,或110+/-6nm至120+/-6nm。
所述方法可以包括测试肿瘤来源的外泌体的外泌体标志物,例如通常与外泌体膜相关的标志物的步骤。可以测试任何合适类型的标志物。例如,可以测试四跨膜蛋白,例如cd63和/或cd9。
所述方法可以包括测试外泌体的大小和外泌体标志物的存在二者的步骤,以适用于分析功能影响或创建癌症特异性应答谱。
所述方法可以包括直接从血液中收获肿瘤来源的外泌体的步骤,而不需要进一步的外泌体纯化步骤。
根据本发明的第十五个实施方案,提供了一种测量与外泌体接触的免疫细胞上标志物的表达水平的方法,其中该方法包括:(a)在免疫细胞存在下培养分离自受试者的外泌体;和(b)测量所述标志物在所述免疫细胞上的表达水平。
根据本发明的第十六个实施方案,提供了一种在有此需要的受试者中诊断癌症的方法,其中,所述方法包括:
(a)在免疫细胞的存在下培养从所述受试者分离的外泌体;
(b)测量标志物在免疫细胞上的表达水平;
(c)基于用对照免疫细胞上所述标志物的表达水平归一化的免疫细胞上所述标志物的表达水平计算第一得分;
(d)基于第一得分的平均绝对值计算第二得分;
(e)基于第一得分的平均归一化偏差的绝对值的平均值来计算第三得分;和
(f)将受试者的第一得分,第二得分和第三得分与从已知患有癌症的受试者分离的一组免疫细胞谱进行比较。
根据本发明的第十七个实施方案,提供了一种量化受试者中外泌体量的方法,其中,该方法包括:
(a)在免疫细胞的存在下培养从所述受试者分离的外泌体;
(b)测量标志物在免疫细胞上的表达水平;
(c)基于用对照免疫细胞上所述标志物的表达水平归一化的免疫细胞上所述标志物的表达水平计算第一得分;和,
(d)基于第一得分的平均绝对值计算第二得分,其中第二得分提供对存在的外泌体的量的定量评估。
根据本发明的第十八个实施方案,提供了被配置为执行第十五个或第十六个实施方案的方法的装置或设备。
根据本发明的第十九个实施方案,提供了一种试剂盒,其包含用于培养外泌体和免疫细胞的试剂;以及用于检测免疫细胞上至少一种标志物的表达水平的试剂。
第十五个实施方案的方法可以进一步包括:(c)基于用对照免疫细胞上所述标志物的表达水平归一化的免疫细胞上所述标志物的表达水平计算第一得分;(d)根据第一得分的平均绝对值计算第二得分;(e)基于第一得分的平均归一化偏差的绝对值的平均值计算第三得分,其中第一得分,第二得分和第三得分是针对癌症的免疫细胞谱的组。
第十五个实施方案的方法可以进一步包括:一个或多个第一方执行步骤(a)和(b)并将步骤(b)的表达水平测量结果提供给第二方,第二方维护包括为多种癌症类型选择的多种免疫细胞谱的数据库;第二方执行步骤(c),(d)和(e)进行表达水平测量;和第二方提供根据表达水平测量结果计算的免疫细胞谱的组和根据数据库确定的与该免疫细胞谱的组相关的癌细胞类型。
所述方法可以进一步包括以下步骤:针对多种癌症重复步骤(a)至(e),从而针对多种癌症类型具有多种免疫细胞谱,根据预定的标准限制为所述多种癌症类型选择多种免疫细胞谱。
所述方法可以进一步包括以下步骤:响应于多种癌症的第一得分,产生免疫应答签名条形码,以识别指示多种癌症类型的免疫细胞上标志物表达水平的独特谱。
优选地,预定标准限制包括免疫细胞表达与健康对照免疫细胞表达之间的第一得分的平均值相差超过百分之二十,或第三得分相差低于百分之五。
参数选择
|ρ|>0.3和r2>0.2
|ρ|>0.4和r2>0.1
|ρ|>0.2和r2>0.3
如果符合以下情况则选择参数:
可以使用可检测标记来测量所述标志物的表达水平。
可以使用配置为检测和测量可检测标记的设备来测量所述标志物的表达水平。
所述设备可以是流式细胞仪/流式细胞术和/或实时pcr(聚合酶链反应)。
优选地,所述设备是流式细胞仪。
第一得分可以包括根据以下各项计算的参数得分:
其中gmfii是免疫细胞上所述标志物表达水平的几何平均荧光强度(gmfi)。
第二得分可以包括根据以下计算的得分:
其中,mi是第一得分,n是参数得分的数量。
第三得分可以包括根据
其中npd包括根据以下计算的归一化参数偏差:
并且其中x是标志物i的测试样品的参数得分,m是该标志物的识别参数得分。
对照免疫细胞可以是用未患病的外泌体或不暴露于外泌体培养的免疫细胞。
未患病的外泌体可以是(健康的)未患病的外泌体。
对照可以是没有外泌体如单独用缓冲液或培养基培养的免疫细胞。
外泌体可以从受试者的细胞外液例如血液中分离。
外泌体可包括肿瘤来源的外泌体。
肿瘤来源的外泌体的直径可以为约20nm至约150nm,或约50nm至约140nm,或约80nm至约130nm,或约110nm至约120nm,或110+/-6nm至120+/-6nm。
外泌体可以表达外泌体膜标志物。外泌体膜标志物可以是cd63或cd9。
所述免疫细胞可以是cd8t细胞,cd4t细胞,nk细胞或b细胞。优选地,免疫细胞是cd8t细胞或cd4t细胞。
所述标志物可以选自免疫细胞活化标志物,免疫细胞增殖标志物,免疫细胞消耗标志物,免疫细胞细胞毒标志物,免疫细胞细胞毒和凋亡标志物,或免疫细胞抑制标志物。
所述激活标志物可以是cd69,cd25或pstat5。
所述增殖标志物可以是ki67。
所述消耗标志物可以是tim3。
所述细胞毒标志物可以是粒酶b或ifnγ。
所述细胞毒和凋亡标志物可以是fasl。
所述抑制标志物可以是pd-1或ctla4。
所述癌症可以是肾癌、结直肠癌(结肠癌和/或直肠癌)、皮肤癌(包括基底细胞癌、细胞癌、鳞状细胞癌和黑色素瘤)、白血病、淋巴瘤、中枢神经系统肿瘤、乳腺癌、前列腺癌、宫颈癌、子宫癌、肺癌、卵巢癌、睾丸癌、甲状腺癌、星形细胞瘤、胶质瘤、胰腺癌、间皮瘤、胃癌、肝癌、肾的癌症包括肾母细胞瘤、膀胱癌、食道癌、喉癌、腮腺癌、胆管癌、子宫内膜癌、腺癌、小细胞癌、神经母细胞瘤、肾上腺皮质癌、上皮癌、硬纤维瘤、纤维增生性小圆细胞瘤、内分泌肿瘤、尤文氏肉瘤家族肿瘤、生殖细胞瘤、肝母细胞瘤、肝细胞癌、非横纹肌肉瘤软组织肉瘤、骨肉瘤、外周原始神经外胚层肿瘤、视网膜母细胞瘤和横纹肌肉瘤。
所述试剂盒可以进一步包含用于检测免疫细胞上至少一种标志物表达水平的工具。
用于检测免疫细胞上至少一种标志物的表达水平的工具可以是流式细胞仪/流式细胞术。
上下文允许上述任何一或多个特征可以与上述任何一个或多个实施方案组合使用。
上下文允许,上述任何一个实施方案的一或多个特征可以与上述任何其他实施方案组合使用。
实施方案的描述
本部分涉及本发明的优选特征,实施方案和变体,其为本领域技术人员提供了执行本发明的足够信息。本部分不应被视为以任何方式限制前一部分的范围。
附图简述
将参考以下附图描述本发明的各种实施方案。
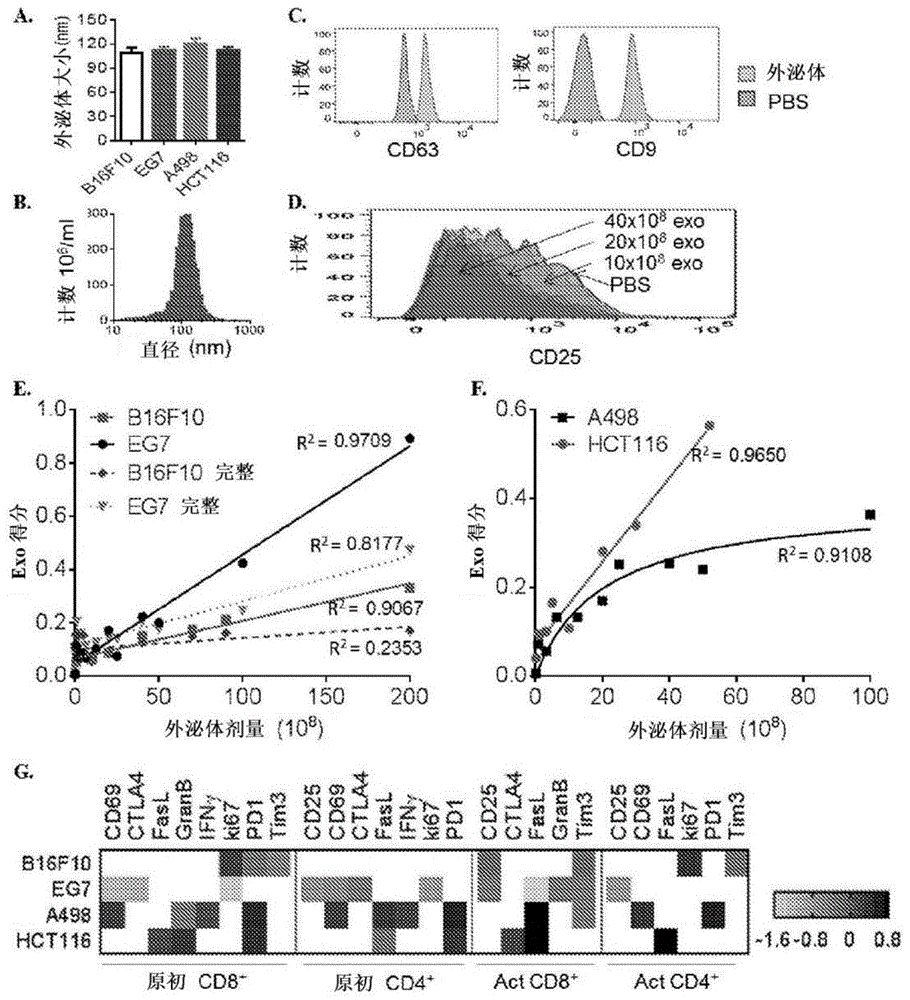
图1:癌细胞培养物中产生的texs的表征和定量检测。(a)通过zetaview测量从不同癌细胞的培养基收获的外泌体的颗粒大小。数据代表平均值±标准偏差(sd)(n=10/组)。(b)b16f10tex颗粒大小分布的样本直方图。(c)将外泌体与醛/硫酸盐乳胶珠连接,然后用抗小鼠cd63和抗小鼠cd9染色。显示了b16f10texs包被的珠子和空白珠子上cd63和cd9的荧光强度的流式细胞术分析。(d)用40×108,20×108,10×108和0eg7-ovatex处理2天后,活化的cd4+t细胞上cd25表达的样品直方图。(e-g)在支持信号存在下,将t细胞与来自不同癌细胞的不同剂量的tex共孵育2天,然后进行标志物染色和流式细胞术分析。计算每个标志物的参数得分,并且在有或没有参数选择的情况下计算exo得分。(e)b16f10tex和eg7的exo得分的剂量滴定曲线表示为具有(实线)或不具有(虚线)参数选择。(f)在参数选择后显示a498和hct116tex的exo得分的剂量滴定曲线。(g)b16f10,eg7-ova,a498和hct116tex的参数得分的不同模式。从每种癌症类型的至少三次独立实验显示汇总结果。act=活化的。
图2:t-tex诊断tex受血液中hex干扰。在分成等份之前合并从c57bl/6小鼠获得的血液。将来自b16f10和eg7-ova癌细胞的pbs或不同剂量的tex掺入(spikein)等份的血液中。在与t细胞共培养2天之前,将掺入的tex与血液中的hex一起重新收获。将t细胞标志物染色并通过流式细胞术分析。计算每个标志物的参数得分,并在参数选择后计算exo得分。数据代表平均值±sd。从每种癌症类型的至少两次独立实验显示汇总结果。(a)b16f10texs/hexs混合物和eg7texs/hexs混合物的exo得分的剂量滴定曲线。(b)血液中hexs背景中b16f10和eg7-ovatex的参数得分的不同模式。
图3:t-tex同时针对三种类型的肿瘤对荷瘤小鼠进行诊断并确定其癌症类型。静脉内(i.v.)注射b16f10黑素瘤细胞(1×106)以在c57bl/6小鼠中诱导肺转移10天(n=14)。将eg7-ova细胞(1×106)皮下注射到c57bl/6小鼠中,使肿瘤建立10天(n=7)。将a498肾癌细胞(4×106)与
除其他内容外,本发明人首次描述了通过测量/分析其tex对t细胞的功能影响来同时诊断多种类型癌症的方法,以产生癌症特异性应答谱。本发明人开发了一种诊断分析测定法t-tex(以测定中的两个关键组分命名),以捕获tex诱导的免疫应答,设计的算法用于量化应答并产生免疫应答谱的癌症特异性数据库(参比癌症特异性谱)。发明人还创建了exo得分以给出癌症诊断的总体是或否答案,以及偏差得分以反映测试样本与数据库中条形码模式的接近程度,从而仔细检查癌症的类型。本发明人已经检测、区分和量化了由四种不同的癌细胞培养物产生的tex。本发明人还同时针对三种类型的肿瘤对荷瘤小鼠进行诊断,其中对每种肿瘤的敏感性超过89%。
由于t-tex利用血液中肿瘤签名的功能影响,它可以规避当前癌症生物标志物开发的局限性。它还可以使用预先建立的数据库同时检测多种类型的癌症,并作为现有技术的一线互补测试或独立测试,以避免潜在的患者/受试者进行重复测试。
材料和方法
材料
热灭活的胎牛血清(fbs)和live/deadaqua可固定死细胞染色试剂盒获自lifetechnologies(ca,usa)。伴刀豆球蛋白avi型(cona)获自sigma-aldrich(st.louis,mo)。重组小鼠白细胞介素-2(il-2)和白细胞介素-7(il-7)获自ebioscience(ma,usa)。ficoll-pagueplus来自gehealthcare(waukesha,wi)。人外周血单个核细胞(pbmc),人白细胞介素2(il-2),人白细胞介素7(il-7),用于小鼠和人的easyseptmcd4+或cd8+t细胞富集试剂盒购自stemcelltechnologies(vancouver,canada)。小鼠和人抗cd3/cd28dynabeads和醛/硫酸盐乳胶珠购自thermofisherscientific(ma,usa)。
accucountrainbow荧光计数珠(10.1μm)购自spherotech(lakeforest,il)。抗人ki67percp-vio700来自miltenyibiotec(bg,germany)。抗小鼠cd16/32,抗小鼠cd8aapc,抗小鼠pd-1apcefluor780,抗小鼠tim3pe-cy7,抗小鼠cd25-fitc抗小鼠granzymebpe,抗小鼠cd4efluor780,抗小鼠ctla4pe,抗小鼠faslpercpefluor710,抗小鼠cd69fitc,抗小鼠ki67pe-cy7,抗小鼠ifnγapc,抗人cd4apcefluor780,抗人cd8aapcefluor780,抗人cd69apc,抗人pd-1pe-cy7,抗人cd25fitc,抗人粒酶bpe,抗人ctla4pe,抗人tim3apc,抗人ifnγfitc,抗小鼠cd16/32,人fc受体结合抑制剂单克隆抗体和细胞内固定和透化缓冲液组购自ebiosceince(sandiego,ca)。除非另有说明,否则所有试剂均按收到时的原样使用。
动物和细胞系
实验方案经新加坡科学技术研究机构生物资源中心机构动物护理和使用委员会(a*star)批准。6至8周龄的雌性c57bl/6小鼠和ncr裸鼠来自singaporeinvivos。
从美国典型培养物保藏中心(manassas,va,usa)获得b16f10小鼠黑素瘤细胞,eg7-ova小鼠淋巴瘤细胞,a498人肾癌细胞,hct116人结直肠癌细胞和金黄色葡萄球菌。
t细胞分离和活化
将来自c57bl/6小鼠的脾脏通过70-μm细胞过滤器研磨,并通过与ack裂解缓冲液(每个脾脏1ml)在25℃温育3分钟除去红细胞。使用easyseptm小鼠cd4+或cd8+t细胞富集试剂盒通过磁阴性选择直接从脾细胞中分离原初cd4+或cd8+t细胞。对于活化的cd8+和cd4+t细胞,ack裂解后的脾细胞用冰冷的pbs洗涤,然后在含有终浓度为2μg/ml的cona和1ng/ml的鼠il-7的t细胞培养基中培养,在37℃活化。孵育2天后,用ficoll-pagueplus梯度分离法去除死细胞,分别用easyseptm小鼠cd8+或cd4+t细胞富集试剂盒分离cd8+或cd4+t细胞。将纯化的cd8+或cd4+t细胞以0.75×106/ml重悬于含有10ng/ml重组鼠il-2的t细胞培养基中。48小时后,将细胞在pbs中洗涤并重悬于t细胞培养基中进行测定。
人pbmc在t细胞培养基中于37℃用cona(2μg/ml)和人il-7(1ng/ml)活化2天。通过ficoll-pagueplus梯度分离去除死细胞后,分别通过easyseptm人cd8+或cd4+t细胞富集试剂盒分离人cd8+和cd4+t细胞。将纯化的cd8+或cd4+人t细胞以1×106/ml重悬于含有20ng/ml重组人il-2的t细胞培养基中。10天后,将细胞在pbs中洗涤并重悬于t细胞培养基中进行测定。
从癌细胞培养物中生产texs
将fbs在4℃以110000g旋转3小时以除去外泌体。b16f10,a498和hct116癌细胞在肿瘤培养基(补充有10%无外泌体fbs和50u/ml青霉素-链霉素的rpmi1640培养基)中培养,而eg7-ova淋巴瘤细胞在t细胞培养基中培养(肿瘤培养基补充有非必需氨基酸,β-巯基乙醇和丙酮酸)。肿瘤细胞生长至汇合后,收集肿瘤细胞培养基并在4℃以1000g离心5分钟。收集上清液并在4℃以10000xg离心30分钟。收集上清液并通过超速离心(beckmancoulter,ca,usa)在4℃以110,000g离心70分钟,将外泌体沉淀重悬于200μlpbs中,通过zetaview(particlemetrixgmbham,meerbusch,germany)定量并储存在-80℃冰箱中。
血液中texs的产生和收获
texs掺入血液
通过心脏穿刺获得6至8周龄健康雌性c57bl/6小鼠的血液。将b16f10或eg7-ova细胞产生的不同量的tex掺入血液中,并通过连续离心与hex一起重新收获。假设texs和hexs混合物中的texs量与加入血液中的texs量相同而没有损失。还从健康小鼠血液中收获单独的hex,没有掺入tex作为对照。
来自荷瘤小鼠的texs
将b16f10黑素瘤细胞以每200μlpbs1×106个细胞悬浮,并静脉内注射以诱导c57bl/6小鼠中的肺转移10天。对于s.c.肿瘤模型,将100μlpbs中的eg7-ova细胞(1×106)皮下注射到c57bl/6小鼠中,使肿瘤建立10天(100±45cm2)。在人肿瘤异种移植模型中,将100μlpbs中的a498肾癌细胞(4×106)与100μlmatrigel一起皮下接种到ncr裸鼠中。10周后,肿瘤大小为~114±67cm2。在放血前监测肿瘤大小,并将肿瘤面积计算为2个测量的正交直径(d1×d2)的乘积。在各个时间点通过心脏穿刺将健康和荷瘤小鼠放血(800-1000μl),以在存在背景hexs的情况下收获hexs和texs。
从血液收获texs
将鼠或人血液在4℃以3000g离心5分钟以获得血浆,将其在4℃以10000g进一步离心30分钟。然后将上清液在4℃以110,000g离心70分钟。将外泌体沉淀重悬于100μlpbs中并储存在-80℃冰箱中。
免疫应答测定
小鼠原初cd8+t细胞(5×104),原初cd4+t细胞(5×104),活化cd8+t细胞(5×104)和活化cd4+t细胞(5×104)分别为用pbs或等体积的由b16f10和eg7-ova癌细胞体外产生的不同剂量的tex(在pbs中)处理。使用从相同体积的小鼠血液收获的hexs和texs/hexs混合物代替pbs中的pbs和texs用于测定以检测掺入的texs,b16f10肺转移,b16f10和eg7s.c.肿瘤。原初cd8+和原初cd4+t细胞补充1μl抗小鼠cd3/cd28dynabeads,而为活化的cd8+和cd4+t细胞供应终浓度为8ng/ml的鼠il-2。每孔总体积用t细胞培养基补足至120μl。在流式细胞术分析之前,在支持信号存在下将t细胞与外泌体在37℃共培养2天。
对于来自a498和hct116细胞系的外泌体的测定,使用携带a498异种移植肿瘤的小鼠和肺癌患者的血液,人t细胞,人il-2(16ng/ml)和抗人cd3/cd28dynabeads而其余设置保持不变。
流式细胞术分析
与外泌体共孵育2天后,向t细胞中加入计数珠,离心分离并用冰冷的pbs洗涤2次,然后进行aqualive/dead染色。然后将t细胞在facs缓冲液中洗涤1次并用抗小鼠cd16/cd32或抗人fcr结合抑制剂单克隆抗体封闭,然后分成两半用于cd8,cd4,cd25,tim3,ctla4,pd-1,fasl,cd69和pstat5的表面染色。在facs缓冲液中洗涤2次后,将样品固定并在ebioscience细胞内固定和透化缓冲液组中透化,然后针对ki67,粒酶b和ifnγ染色。细胞内染色后,将细胞在facs缓冲液中洗涤1次并重悬于facs缓冲液中,然后在bdlsrii或celesta流式细胞仪上分析。所有数据均使用flowjo软件处理。
数据分析
参数得分处理每个样品的流式细胞术数据以计算每个染色标志物的几何平均荧光强度(gmfi)。如果tex来自体外癌细胞培养,则将所有gmfi值相对于pbs对照的平均值归一化;如果tex来自血液,则将所有gmfi值相对于hexs对照归一化。然后对归一化的gmfi值进行log-2转换以获得该标记的参数得分(m)。
参数选择
对于剂量滴定和掺入(spiked-in)实验,对剂量和参数得得分据进行斯皮尔曼等级顺序相关性检验和线性回归。如果参数的相关系数ρ和确定系数r2满足以下条件之一并通过目视检查,则选择参数:
1.|ρ|>0.3和r2>0.2
2.|ρ|>0.4和r2>0.1
3.|ρ|>0.2和r2>0.3
对于小鼠肿瘤模型和人类癌症患者的in测定,进行学生t-检验并计算健康组和肿瘤组的平均值之间差异的大小。满足如下条件时选择参数
p<0.05或
exo得分
exo得分是n个参数得分的平均绝对值。
偏差得分
归一化参数偏差定义如下,其中x是标志物i的测试样本的参数得分,而m是该标志物的识别参数得分。
偏差得分是平均npd绝对值的平均值,
flowjo用于计算所有gmfi值。使用rstudio(版本1.0.153)和graphpadprism软件进行数据处理和统计分析。除非另有说明,否则所有值和误差线均为平均值±sd。
结果与讨论
设计用于检测tex诱导的免疫应答的诊断分析测定t-tex
培养b16f10小鼠皮肤黑素瘤细胞,a498人肾癌细胞和hct116人结肠直肠癌细胞以产生来自不同肿瘤类型和物种的代表性tex。由于本发明人的诊断分析测定依赖于tex诱导的免疫应答,因此还包括eg7-ova小鼠淋巴瘤细胞,一种源自免疫系统本身的癌细胞,以评估t-tex是否也适用于免疫系统癌症。
对于免疫应答筛选,本发明人使用原初cd8+t细胞,原初cd4+t细胞,活化(act)cd8+t细胞或actcd4+t细胞在t细胞支持分子存在下与tex共培养。对于来自b16f10和eg7-ova细胞的tex,使用来自小鼠脾脏的t细胞,而对于来自a498和hct116细胞的tex,使用来自人外周血单核细胞(pbmc)的t细胞。共培养2天后,将各种t细胞表面和细胞内标志物染色并通过流式细胞术分析以提供关于tex的见解。筛选的标志物包括活化标志物(cd69,cd25,pstat5),增殖标志物(ki67),耗竭标志物(tim3),细胞毒标志物(粒酶b),对细胞毒和免疫细胞凋亡至关重要的蛋白质(fasl)33和参与免疫检查点抑制信号通路的那些(pd-1,ctla4)。
t-tex检测癌细胞培养中产生的tex的剂量依赖性免疫应答
通过连续离心从培养基中收获在无外泌体培养基中培养的肿瘤细胞分泌的细胞外囊泡(ev)。对于不同类型的癌细胞,产生的囊泡的平均大小范围为110±6nm至120±6nm(图1a),落入外泌体的大小范围内。来自b16f10的ev的大小分布的典型直方图显示在图1b中。此外,收获的b16f10ev测试为四跨膜蛋白cd63和cd9阳性(图1c),其是与外泌体膜34相关的外泌体生物标志物。这些组合表明癌细胞培养产生的ev可用作诊断测定的tex。
在t-tex结束时,发明人获得设计面板中标记的荧光强度作为输出。显示了用不同剂量的tex处理后t细胞上cd25的荧光强度的样品直方图(图1d)。通过计算其几何平均荧光强度(gmfi)来量化cd25表达,并将其相对于pbs对照的平均gmfi归一化,使得cd25表达可以与其他标志物相当地进行比较,而不管其默认表达水平如何。然后将归一化的cd25表达进行log-2转化以给出cd25的参数得分。在计算不同剂量tex下所有标志物的参数得分后,发明人通过对参数得分相对于剂量进行线性回归和斯皮尔曼等级顺序相关性检验来选择标志物。对于定量的诊断测定,显示更强的线性剂量依赖性反应的标志物将是有利的(线性回归中的大r2值)。然而,一些标志物反应可能在一定剂量后平稳,因此产生较差的线性拟合。这些参数仍然可以提高在低浓度tex下测定的灵敏度,这对于早期癌症检测是有用的。由于斯皮尔曼等级顺序相关性检验中的相关系数较高,因此可以招募这些参数。
然后发明人计算exo得分,即所选标记的参数得分的绝对值的平均值,以证明处理样品的每个参数远离对照的平均偏差幅度。在没有参数选择的情况下,exo得分的剂量滴定曲线表现出差的线性拟合,因为对于b16f10和eg7-ovatex,r2分别为0.2353和0.8117(图1e虚线)。参数选择将r2值明显提高至0.9067和0.9069,并通过将变化幅度(更陡的斜率)加倍来提高测定的灵敏度(图1e)。本发明人还设法从hct116(线性拟合中r2=0.9650)和a498细胞(michaelis-menten拟合中r2=0.9108)获得tex的单向剂量依赖性exo得分(图1f)。因此,exo得分不仅可以检测不同类型癌细胞产生的tex的存在,还可以定量评估存在的tex的量。此外,所选标记的模式及其相应的参数得分在所有四种类型的tex中都是不同的(图1g),证明了使用参数得分模式来区分癌症类型的可能性。
t-tex在血液中健康细胞来源的外泌体的背景中鉴定tex
健康细胞分泌的外泌体大量存在于血液中22,35,36,它们可能影响t-tex中免疫细胞的功能。为了更好地模拟真实的临床环境,本发明人试图评估exo得分和参数得分是否可以在来自血液的健康细胞来源的外泌体(hex)的背景中检测tex。将不同剂量的b16f10和eg7-ovatex掺入健康小鼠血液中。通过连续离心将添加的tex与最初在血液中的hex一起重新收获,并通过发明人的分析测定检测tex和hex的混合物。从没有掺入tex的等体积血液中收获的hex用作对照以相对其归一化。eg7-ovatexs的exo得分仍与剂量呈线性关系(r2=0.9772),而b16f10texs的exo得分更适合michaelis-menten模型(r2=0.8758),因为exo得分在30×108剂量后稳定(图2a)。由于连续离心步骤中外泌体的损失,所述分析测定中使用的tex的实际量应小于指定的掺入量,并且exo得分曲线可代表较低剂量范围内的响应。尽管如此,exo得分仍然检测到texs受到血液中hexs干扰。它表明t-tex可以通过使用直接从血液中收获的外泌体来诊断癌症,而无需分离texs。
正如预期的那样,由于所述分析测定中hex对t细胞的干扰,所选标志物的模式及其相应的参数得分与最后的部分(图1g,图2b)中获得的结果明显不同。然而,所述模式在b16f10和eg7-ovatex之间仍然明显不同(图2b)。因此,参数得分仍可用于区分两种癌细胞分泌的tex。
t-tex诊断荷瘤小鼠并确定其各自的癌症类型
本发明人接下来在荷瘤小鼠的诊断中评估了t-tex。本发明人在三种肿瘤模型,b16f10鼠肺转移模型,eg7-ova鼠皮下(s.c.)肿瘤模型和免疫缺陷小鼠中的a498人肿瘤异种移植物中检测了本发明的分析测定法,以代表来自不同来源、位置和物种的肿瘤。来自健康小鼠的血液用作对照。
由于难以定量小鼠中tex的量,本发明人将其参数选择标准更改为以下内容:1)健康小鼠和荷瘤小鼠之间的平均参数得分差异大于0.2以提高测定的灵敏度;2)学生t检验中的p值小于0.05,以增加健康组和肿瘤组之间的差异并非偶然的可能性。
与健康小鼠相比,荷瘤小鼠的exo得分均明显更高(图3a–c)。对于b6f10和eg7-ova肿瘤,t-tex的敏感性分别为93%和100%,截止值比健康对照的平均值高3sd。对两种类型肿瘤的敏感性均提高至100%,截止值比健康对照平均值高2sd。在异种移植模型中,本发明的分析测定法对人癌细胞a498的测定的灵敏度为93%(1sd),89%(2sd)或78%(3sd)(图3c)。异种移植模型中较低的灵敏度可能是由于放血时肿瘤大小的较大变化。此外,三种肿瘤模型都有自己独特的合格参数和参数得分模式(图3d)。
尽管exo得分对于确定不同癌症类型的参数模式至关重要,并且可以对诊断给出总体是或否的答案,但在实际诊断阶段可能无法区分癌症类型。例如,当具有a498异种移植物的小鼠被诊断为针对b16f10和eg7-ova时,超过70%的小鼠被测试为阳性,因为根据b16f10和eg7-ova的模式计算的exo得分高于相应截止值3个sd(图3e)。因此,发明人需要另一个指标来告知他们关于特定类型的癌症。仔细观察数据显示,荷a498肿瘤的小鼠与a498模式的归一化参数偏差是随机的(图3f)。另一方面,与eg7-ova模式相比,荷a498肿瘤的小鼠的测试数据表现出强烈的方向性变化(图3g)。偏差得分,平均参数偏差的绝对值的平均值,旨在捕获测试样品与任何已知癌症模式的偏差。相对于b16f10和eg7模式,荷a498肿瘤的小鼠显示偏差得分大于1,而相对于a498模式偏差得分仅0.1,表明肿瘤是a498(图3h)。类似地,当针对其他类型的肿瘤进行测试时,携带b16f10和eg7-ova肿瘤的小鼠具有高偏差得分,但相对于它们所具有的肿瘤并非如此(图3h)。这些结果表明exo得分和偏差得分可以一起工作来鉴定荷瘤小鼠以及确定癌症的类型。
结论
本发明人已经举例说明了癌症诊断测试t-tex,其可以通过描绘其tex对t细胞的功能影响的谱来同时检测多种类型的癌症。发明人创建exo得分以给出诊断的总体是或否答案,以及偏差得分以反映测试样品与数据库中应答模式的一致性,从而仔细检查癌症的类型。t-tex检测和量化来自四种不同癌细胞系的tex,并同时针对三种类型肿瘤对小鼠进行诊断,对于每种肿瘤的灵敏度均超过89%。将来,该分析测定法可以扩展到将其他类型的免疫细胞例如自然杀伤(nk)细胞和b细胞用于癌症。
总体而言,由于t-tex利用功能影响而不是血液中肿瘤签名的内容,它将规避当前癌症生物标志物开发中涉及的限制。通过预先建立的数据库,它还可以同时检测多种类型的癌症,从而作为现有技术的一线补充测试或独立测试,以最小化重复测试的负担。
参考文献
1siravegna,g.,marsoni,s.,siena,s.&bardelli,a.integratingliquidbiopsiesintothemanagementofcancer.natrevclinoncol14,531-548(2017).
2crowley,e.,dinicolantonio,f.,loupakis,f.&bardelli,a.liquidbiopsy:monitoringcancer-geneticsintheblood.natrevclinoncol10,472-484(2013).
3karachaliou,n.,mayo-de-las-casas,c.,molina-vila,m.a.&rosell,r.real-timeliquidbiopsiesbecomearealityincancertreatment.anntranslmed3,36(2015).
4haber,d.a.&velculescu,v.e.blood-basedanalysesofcancer:circulatingtumorcellsandcirculatingtumordna.cancerdiscovery4,650-661(2014).
5pantel,k.blood-basedanalysisofcirculatingcell-freednaandtumorcellsforearlycancerdetection.plosmed13,e1002205(2016).
6ilie,m.etal.currentchallengesfordetectionofcirculatingtumorcellsandcell-freecirculatingnucleicacids,andtheircharacterizationinnon-smallcelllungcarcinomapatients.whatisthebestbloodsubstrateforpersonalizedmedicine?anntranslmed2,107(2014).
7hong,b.&zu,y.detectingcirculatingtumorcells:currentchallengesandnewtrends.theranostics3,377-394(2013).
8simons,m.&raposo,g.exosomes–vesicularcarriersforintercellularcommunication.curropincellbiol21,575-581(2009).
9el-andaloussi,s.,mager,i.,breakefield,x.o.&wood,m.j.extracellularvesicles:biologyandemergingtherapeuticopportunities.natrevdrugdiscov12,347-357(2013).
10raposo,g.&stoorvogel,w.extracellularvesicles:exosomes,microvesicles,andfriends.jcellbiol200,373-383(2013).
11kahlert,c.etal.identificationofdoublestrandedgenomicdnaspanningallchromosomeswithmutatedkrasandp53dnaintheserumexosomesofpatientswithpancreaticcancer.jbiolchem289,3869-3875(2014).
12skog,j.etal.glioblastomamicrovesiclestransportrnaandproteinsthatpromotetumourgrowthandprovidediagnosticbiomarkers.natcellbiol10,1470-1476(2008).
13byron,s.a.,vankeuren-jensen,k.r.,engelthaler,d.m.,carpten,j.d.&craig,d.w.translatingrnasequencingintoclinicaldiagnostics:opportunitiesandchallenges.natrevgenet17,257-271(2016).
14taylor,d.d.&gercel-taylor,c.micrornasignaturesoftumor-derivedexosomesasdiagnosticbiomarkersofovariancancer.gynecoloncol110,13-21(2008).
15yoshioka,y.etal.ultra-sensitiveliquidbiopsyofcirculatingextracellularvesiclesusingexoscreen.natcommun5,3591(2014).
16melo,s.a.etal.glypican-1identifiescancerexosomesanddetectsearlypancreaticcancer.nature523,177-182(2015).
17cancergenomeatlasresearchnetwork,weinstein,j.n.etal.thecancergenomeatlaspan-canceranalysisproject.natgenet45,1113-1120(2013).
18aravanis,a.m.,lee,m.&klausner,r.d.next-generationsequencingofcirculatingtumordnaforearlycancerdetection.cell168,571-574(2017).
19meacham,c.e.&morrison,s.j.tumorheterogeneityandcancercellplasticity.nature501,328-337(2013).
20wan,j.c.m.etal.liquidbiopsiescomeofage:towardsimplementationofcirculatingtumourdna.natrevcancer17,223-238(2017).
21heitzer,e.,ulz,p.&geigl,j.b.circulatingtumordnaasaliquidbiopsyforcancer.clinchem61,112-123(2015).
22li,m.etal.analysisofthernacontentoftheexosomesderivedfrombloodserumandurineanditspotentialasbiomarkers.philostransrsoclondbbiolsci369,20130502(2014).
23goossens,n.,nakagawa,s.,sun,x.&hoshida,y.cancerbiomarkerdiscoveryandvalidation.translcancerres4,256-269(2015).
24munson,p.&shukla,a.exosomes:potentialincancerdiagnosisandtherapy.medicines(basel)2,310-327(2015).
25kunigelis,k.e.&graner,m.w.thedichotomyoftumorexosomes(tex)incancerimmunity:isitallinthecontext?vaccines(basel)3,1019-1051(2015).
26robbins,p.d.&morelli,a.e.regulationofimmuneresponsesbyextracellularvesicles.natrevimmunol14,195-208(2014).
27whiteside,t.l.tumor-derivedexosomesandtheirroleintumor-inducedimmunesuppression.vaccines4,35(2016).
28valenti,r.etal.tumor-releasedmicrovesiclesasvehiclesofimmunosuppression.cancerres67,2912-2915(2007).
29abusamra,a.j.etal.tumorexosomesexpressingfasligandmediatecd8+t-cellapoptosis.bloodcellsmoldis35,169-173(2005).
30clayton,a.,mitchell,j.p.,court,j.,mason,m.d.&tabi,z.humantumor-derivedexosomesselectivelyimpairlymphocyteresponsestointerleukin-2.cancerres67,7458-7466(2007).
31clayton,a.,al-taei,s.,webber,j.,mason,m.d.&tabi,z.cancerexosomesexpresscd39andcd73,whichsuppresstcellsthroughadenosineproduction.jimmunol187,676-683(2011).
32muller,l.,mitsuhashi,m.,simms,p.,gooding,w.e.&whiteside,t.l.tumor-derivedexosomesregulateexpressionofimmunefunction-relatedgenesinhumantcellsubsets.scirep6,20254(2016).
33nguyen,t.&russell,j.theregulationoffaslexpressionduringactivation-inducedcelldeath(aicd).immunology103,426-434(2001).
34andreu,z.&yanez-mo,m.tetraspaninsinextracellularvesicleformationandfunction.frontimmunol5,442(2014).
35vlassov,a.v.,magdaleno,s.,setterquist,r.&conrad,r.exosomes:currentknowledgeoftheircomposition,biologicalfunctions,anddiagnosticandtherapeuticpotentials.biochimbiophysacta1820,940-948(2012).
36caby,m.p.,lankar,d.,vincendeau-scherrer,c.,raposo,g.&bonnerot,c.exosomal-likevesiclesarepresentinhumanbloodplasma.intlimmunol17,879-887(2005).
- 还没有人留言评论。精彩留言会获得点赞!