快速定量检测组织细胞蛋白的测试片的制作方法
本发明涉及检测领域,具体地,涉及一种快速定量检测组织细胞蛋白的测试片。
背景技术:
以往的肿瘤治疗,特别是化疗,因为药物作用范围广泛,在杀死肿瘤细胞的同时,也杀死了大量的正常细胞,导致了难以忍受的毒副作用。随着医学研究的快速进展,科学家们逐渐开发出了针对性强、毒副作用小的肿瘤靶向治疗药物。目前,这种靶向治疗由于治疗效果好、毒副作用小越来越成为肿瘤治疗的发展趋势。
手术或活检会加速肿瘤细胞的浸润和扩散,医疗界一致公认及时、有效的治疗是防止其扩散的必要手段。然而如何能够在临床中快速、准确的判断患者肿瘤的分子类型,进而确定该患者是否适用于某种靶向治疗方案仍是目前医学界急需解决的一个难题。
因此,本领域亟需开发一种能够快速定量检测组织细胞蛋白水平尤其是与肿瘤细胞相关的细胞蛋白水平的方法,为疾病的治疗提供指导。
技术实现要素:
本发明的目的在于提供一种能够快速定量检测组织细胞蛋白尤其是与肿瘤细胞相关的细胞蛋白的测试片。
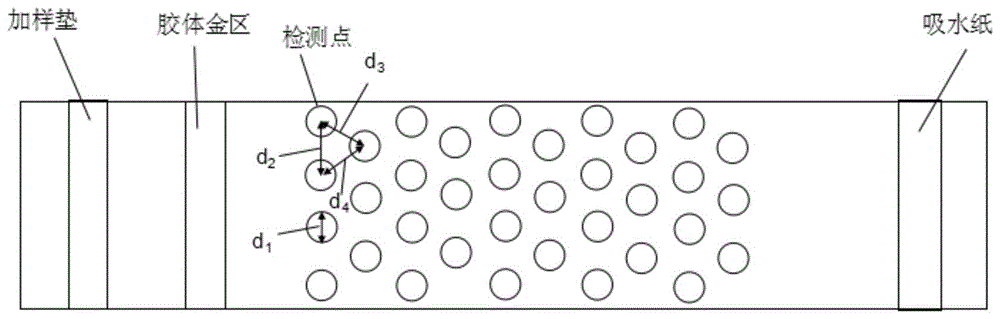
本发明的第一方面,提供一种用于检测组织细胞蛋白的测试片,所述的测试片包括一基片,从所述基片的一端到另一端方向,依次设有位于基片上的加样区、胶体金区、蛋白检测区和吸水区;
所述的蛋白检测区包括多个检测点,所述的检测点排成多列,每列检测点的圆心之间相互连接形成一直线,所述直线与待测样品流动前进方向垂直;
蛋白检测区上的检测点呈现交替阵列。
在另一优选例中,所述的检测点排成n+1列,其中n=3-30,较佳地3-20,更佳地3-15,更佳地5-12,n为正整数(如1、2、3、4、9、15或30等)。
在另一优选例中,各个检测点的形状相同或不同。
在另一优选例中,所述的检测点的形状为圆形。
在另一优选例中,所述的检测点的内径相同或不同。
在另一优选例中,每列相邻两个检测点的圆心距离相同。
在另一优选例中,每列含有的检测点的个数为2-30个,较佳地2-20,更加地2-10个,最佳地2-6个。
在另一优选例中,每列检测点的个数相差1-2个。
在另一优选例中,每列检测点的圆心之间相互连接形成的直线相互平行。
在另一优选例中,相邻两列之间的垂直距离为1.0-1.8mm,较佳地1.2-1.6mm,更佳地1.3-1.5mm。在另一优选例中,一列相邻的两个检测点与其之间的间隙对应的相邻另一列的一个检测点之间的圆心之间的距离相等或不等。
在另一优选例中,一列相邻的两个检测点与该列相邻的两个检测点之间的间隙对应的相邻另一列的一个检测点之间的圆心之间的距离分别为1.3-2.1mm,较佳地1.4-1.8mm,更佳地1.6-1.8mm。
在另一优选例中,一列相邻的两个检测点与该相邻的两个检测点之间的间隙对应的相邻另一列的一个检测点之间圆心之间的距离相等或不等。
在另一优选例中,一列相邻的两个检测点d1、d2,d1和d2之间间隙对应的相邻另一列的一个检测点d3,其中,d1和d3两个检测点的圆心之间的距离1.3-2.1mm,较佳地1.4-1.8mm,更佳地1.6-1.8mm;d2和d3两个检测点的圆心之间的距离1.3-2.1mm,较佳地1.4-1.8mm,更佳地1.6-1.8mm。
在另一优选例中,一列相邻的两个检测点与该列相邻的两个检测点之间的间隙对应的相邻另一列的一个检测点之间形成一个等边三角形。
在另一优选例中,各个检测点的内径为0.5-1.2mm,较佳地0.6-1.0mm,更佳地0.7-0.9mm。
在另一优选例中,每列相邻两个检测点的圆心之间的距离为1.3-2.1mm,较佳地1.4-1.8mm,更佳地1.6-1.8mm。
在另一优选例中,一列相邻的两个检测点与其之间的间隙对应的相邻另一列的一个检测点之间的圆心之间的距离分别为1.3-2.1mm,较佳地1.4-1.8mm,更佳地1.6-1.8mm。
在另一优选例中,所述的测试片还包括位于基片上的质控区。
在另一优选例中,所述的质控区位于蛋白检测区和吸水区之间。
在另一优选例中,所述的胶体金区负载一种或多种选自下组的复合物:胶体金抗体复合物、胶体银抗体复合物;
所述的胶体金抗体复合物为胶体金与选自下组的抗体偶联形成:待检测组织细胞蛋白的单抗、待检测组织细胞蛋白的多抗,或其组合;
所述的胶体银抗体复合物为胶体银与选自下组的抗体偶联形成:待检测组织细胞蛋白的单抗、待检测组织细胞蛋白的多抗,或其组合。
在另一优选例中,所述的胶体金区设有玻璃纤维,所述的复合物包被在玻璃纤维上。
在另一优选例中,所述的待检组织细胞蛋白为her2蛋白。
在另一优选例中,所述的胶体金区还负载igg胶体金复合物、igg胶体银复合物,或其组合。
在另一优选例中,所述的蛋白检测区的检测点负载一种或多种选自下组的抗体:抗待测组织蛋白的单抗、抗待测组织蛋白的多抗。
在另一优选例中,所述的胶体金区包括负载her2抗体的胶体金复合物,所述的检测点包括抗her2抗体。
在另一优选例中,所述的蛋白检测区设有硝酸纤维素膜,所述的抗待测组织蛋白的单抗或抗待测组织蛋白的多抗包被在玻璃纤维上。
在另一优选例中,所述的her2抗体胶体金复合物中her2抗体为兔源性抗人her2抗体。
在另一优选例中,所述的加样区包括加样垫。
在另一优选例中,所述的吸水区包括吸水纸。
本发明第二方面,提供一种用于检测组织细胞蛋白的的试剂盒,所述的试剂盒包括:
(i)如本发明第一方面所述的检测组织细胞蛋白的测试片;
(ii)使用说明书。
在另一优选例中,所述的使用说明书记载利用如本发明第一方面所述的检测组织细胞蛋白的测试片检测组织细胞蛋白。
本发明第三方面,提供一种如本发明第一方面所述的测试片在检测组织细胞蛋白中的应用。
在另一优选例中,所述的检测为体外检测。
在另一优选例中,所述的检测包括定性和/或定量检测。
在另一优选例中,所述的检测为辅助性检测。
在另一优选例中,所述的检测为非治疗和非诊断性检测。
本发明第四方面,提供一种检测组织细胞蛋白的方法,所述方法包括利用本发明第一方面所述的检测组织细胞蛋白的测试片检测待测样品中的组织细胞蛋白。
在另一优选例中,所述的检测为体外检测。
在另一优选例中,所述的检测包括定性和/或定量检测。
在另一优选例中,所述的检测为辅助性检测。
在另一优选例中,所述的检测为非治疗和非诊断性检测。
在另一优选例中,所述的样品包括细胞裂解液、组织裂解液、血浆、血清、全血、尿液或痰液。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1为实施例1的测试片的结构式示意图。
图2为不同浓度的her2蛋白标准品溶液在测试片的蛋白检测点的阳性显色,按照序号顺序1-5,her2标准品蛋白的浓度依次为4ng/ml、20ng/ml、100ng/ml、500ng/ml、2500ng/ml。
图3为不同浓度的her2蛋白准品溶液和其总吸光度值绘制的标准曲线,标准曲线如图2所示,标准曲线的相关系数r2=0.99。
图4为免疫组化法检测结果。
图5为蛋白印迹检测定结果。
图6为实施例1的测试片对不同受试者的her2蛋白表达检测结果。
图7为实施例1测试片和对比例1测试片对相同浓度的her2蛋白标准品溶液检测结果,其中,左侧为对比例1的平行阵列检测点的检测结果,右侧为实施例1的交替阵列检测点的检测结果
具体实施方式
本发明人经过广泛而深入的研究,通过大量筛选和摸索,意外地发现了一种能够快速定量检测组织细胞蛋白的测试片,在所述的测试片中,蛋白检测区上的检测点呈现特定的排列。所述的检测片能够对组织细胞蛋白进行快速、准确的定量检测。在此基础上,发明人完成了本发明。
术语
除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。
如本文所用,术语“包含”、“包括”、“含有”可互换使用,不仅包括封闭式定义,还包括半封闭、和开放式的定义。换言之,所述术语包括了“由……构成”、“基本上由……构成”。
如本文所用,术语“her2蛋白”与“原癌基因人类表皮生长因子受体2(humanepidermalgrowthfactorreceptor-2,her2)”可互换使用,her2是指乳腺癌靶向治疗的靶点蛋白,her2阳性(过表达或扩增)的乳腺癌,对靶向her2的赫赛汀等靶向药具有良好的治疗效果,治疗模式也与其他类型的乳腺癌有很大的区别。
测试片
本发明提供一种用于检测组织细胞蛋白的测试片,所述的测试片能够对组织细胞蛋白水平进行快速的定性和定量检测,尤其是与肿瘤细胞相关的细胞蛋白水平进行快速定性和定量检测。
本发明的测试片也可称为试剂条或检测卡等
典型地,所述的测试片包括一基片,从所述基片的一端到另一端方向,依次设有位于基片上的加样区、胶体金区、蛋白检测区和吸水区;
所述的蛋白检测区包括多个检测点,所述的检测点排成多列,每列检测点的圆心之间相互连接形成一直线,所述直线与待测样品流动前进方向垂直;
蛋白检测区上的检测点呈现交替阵列。
在本发明中,应当理解的是,所述的交替阵列是指相邻两列的检测点之间是交替排列的。换言之,所述交替阵列指的是一列相邻的两个检测点之间的间隙对应相邻另一列的一个检测点。
在本发明中,所述的基片也可称为衬底、背衬等等,起到支撑的作用。
在本发明中,待测样品流动前进方向为从加样区到吸水区流动的方向,且与每列检测点的圆心之间相互连接形成的直线垂直。
加样区
在发明所述测试片中,所述加样区用于待测样品的加入。所述的加样区可包括加样垫。优选地,所述加样垫是纤维膜。
在另一优选例中,所述的待测样品可以包括细胞裂解液、组织裂解液、血浆、血清、全血、尿液或痰液。优选地,所述的待测样品中含有组织细胞蛋白,如her2蛋白。
胶体区
在发明所述测试片中,胶体金区可含有金反应垫。
所述的胶体金区可以负载一种或多种选自下组的复合物:胶体金抗体复合物、胶体银抗体复合物。
在另一优选例中,所述的胶体金抗体复合物为胶体金与选自下组的抗体偶联形成:待检测组织细胞蛋白的单抗、待检测组织细胞蛋白的多抗,或其组合。
在另一优选例中,所述的胶体银抗体复合物为胶体银与选自下组的抗体偶联形成:待检测组织细胞蛋白的单抗、待检测组织细胞蛋白的多抗,或其组合。
在另一优选例中,所述的待检测组织细胞蛋白为her2蛋白。
在另一优选例中,所述的胶体金区还负载igg胶体金复合物。
在另一优选例中,所述的胶体金区设有玻璃纤维,所述的复合物包被在玻璃纤维上。
蛋白检测区
在发明所述测试片中,蛋白检测区特定结构能够使所述的测试片能够对组织细胞蛋白水平进行快速的定性和定量检测,
在本发明,所述的检测点形状并没有特别的限制,只要满足本发明的目的即可,一种优选地的检测点的形状包括(但不限于):圆形、正方形,或其组合。更优选地,所述检测点的形状为圆形。
在本文中,应当理解的是,如果检测点形状不是圆形时,在对检测点的内径等特征进行定义时,需要将检测点模拟成圆形,具体模拟过程为:以检测点的形状上最远的两个点作为为直径,模拟成为圆形。
在本发明中,检测点的内径指的是检测点的直径,如检测点为圆形时,内径指的是圆形检测点的直径。
在本发明的一个优选例中,各个检测点的内径为0.5-1.2mm,较佳地0.6-1.0mm,更佳地0.7-0.9mm。
在另一优选例中,每列相邻两个检测点的圆心之间的距离为1.3-2.1mm,较佳地1.4-1.8mm,更佳地1.6-1.8mm。
在另一优选例中,,一列相邻的两个检测点与其之间的间隙对应的相邻另一列的一个检测点之间的圆心之间的距离分别为1.3-2.1mm,较佳地1.4-1.8mm,更佳地1.6-1.8mm。
在另一优选例中,所述的检测点排成n+1列,其中n=3-30,较佳地3-20,更佳地3-15,更佳地5-12,n为正整数(如1、2、3、4、9、15或30等)。
在另一优选例中,相邻两列之间的垂直距离为1.0-1.8mm,较佳地1.2-1.6mm,更佳地1.3-1.5mm。在本发明中,相邻两列之间的垂直距离指的是相邻两列的检测点的圆心相互连接形成的直线之间的垂直距离。换言之,“相邻两列之间的垂直距离”指的是一列检测点的的圆心之间相互连接形成的直线(l1)与相邻的另一列检测点的的圆心之间相互连接形成的直线(l2)之间的垂直距离,即直线(l1)与直线(l2)之间的垂直距离。
质控区
本发明所述的测试片还可以包括位于基片上的质控区。质控区可以设有一条质控线,优选地,所述的质控线与流动前进方向垂直。优选地,所述的质控区位于蛋白检测区和吸水区之间。
质控线可用于表示检测过程(如层析过程)是否正常。例如,在本发明的测试片中,加样区包被有igg的胶体金复合物,所述的质控线上包被有所述igg的抗体,所述igg和所述igg的抗体起到质控的作用,表示某次检测过程(层析过程)是否正常;即,如果所述igg能够经层析正常到达质控线,质控线上igg的抗体与该igg结合,从而显色;而如果该检测卡已经失效或受损,该igg无法正常到达质控线,则无法显色。
因此,本领域技术人员可以自行选择用于本发明的igg。在具体的实施方式中,所述igg包括但不限于:兔igg、马igg、鼠igg,等等。相应地,本领域技术人员可以自行选择用于本发明的igg抗体,只要该igg抗体是所述igg的抗体即可。在具体的实施方式中,所述igg抗体包括但不限于:羊抗兔igg、羊抗马igg,等等。
在本发明中,加样区、胶体金区、蛋白检测区和吸水区位于基片上。
吸水区
在本发明中,所述的吸水区可包括吸水纸。吸水区通过吸水作用驱动待测样品从加样区依次流动通过胶体金区和蛋白检测区,到达吸水区,从而保证检测的顺利进行。
本发明的主要优点包括:
1、本发明所述的测试片能够快速对组织细胞蛋白(如癌细胞组织蛋白her2)等进行准确的定性和定量测定,且灵敏度高,大大提高疾病诊断和治疗效果。
2、现有技术对组织细胞蛋白(如癌细胞组织蛋白her2)检测主要是通过高效液相色谱-串联质谱法、高效液相色谱法、生物芯片技术等检测方法进行,但这些技术具有明显的缺陷,例如,操作复杂、设备昂贵、耗时、不适合现场检测等等。此外,现有技术中对组织细胞蛋白(如癌细胞组织蛋白her2)进行检测的方法对仪器设备以及操作人员的要求较高、所需时间较长,从而造成较高的检测成本,而本发明所述的测试片操作简便、成本低廉且测定速度快,克服了现有技术中操作复杂、耗时、耗力的仪器设备检测,。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
实施例1
测试片
测试片的结构式示意图如图1所示,所述的测试片包括基片,从所述基片的一端到另一端方向,依次设有位于基片上的加样垫、胶体金区、蛋白检测区和吸水纸,待测样品加入到加样垫后,依次流经胶体金区、蛋白检测区和吸水纸;
胶体金区:胶体金区负载her2抗体的胶体金复合物,其包被在玻璃纤维上;
蛋白检测区:所述的蛋白检测区含有多个检测点,所述的检测点上负载抗her2的鼠源抗体,其固定在硝酸纤维素膜上;所有检测点形状相同且都为圆形,所述的检测点排成多列,每列检测点的圆心之间相互连接形成一直线,所述直线与待测样品流动前进方向垂直,蛋白检测区上的检测点呈现交替阵列,每列相邻两个检测点的圆心距离相同,每列检测点的圆心之间相互连接形成的直线相互平行,各个检测点的内径d1为0.8mm,每列相邻检测点的圆心之间的距离为d2为1.66mm,一列相邻的两个检测点与其之间的间隙对应的相邻另一列的一个检测点之间圆心之间的距离分别为d3和d4,d3=1.66mm和d4=1.66mm。
实施例2
定量检测her2蛋白
利用实施例1的测试片分别对不同浓度的her2蛋白标准品溶液进行检测,具体检测方法如下:将her2蛋白标准品在磷酸盐缓冲液中按照比例稀释为4ng/ml、20ng/ml、100ng/ml、500ng/ml和2500ng/ml。然后取100μl不同浓度的her2蛋白标准品稀释液分别加入测试片的加样区,5分钟后,不同浓度的her2蛋白标准品溶液的测试片的蛋白检测点的阳性显色如图2所示,在图2中,按照序号顺序1-5,her2标准品蛋白的浓度依次为4ng/ml、20ng/ml、100ng/ml、500ng/ml、2500ng/ml。用吸光度扫描检测仪分别计数各个测试片的阳性显色检测点的数目及其吸光度值,并计算总吸光度值(ab525nm),该总吸光值为所有检测点对525nm波长光的吸光值总和,具体如表1所示,然后根据不同浓度的her2蛋白准品溶液与总吸光度值(ab525nm)绘制标准曲线,标准曲线如图3所示。
表1her2浓度与总总吸光值的对应关系
a=0.68c+22.10,相关系数r2=0.9966
从表1和图3的标准曲线可以看出,实施例1的测试片能够对her2蛋白标准品溶液进行准确定量测定,因此,实施例1的测试片可用于定量检测her2蛋白浓度,且定量结果的准确度高。
实施例3
实施例3分别通过免疫组化法、蛋白印迹法检测法和实施例1的测试片对5个受试者乳腺癌中her2蛋白表达进行测定,对比考察实施例1的测试片对乳腺癌中her2蛋白表达检测的准确性,其中,免疫组化法为临床常规检测方法,蛋白印迹法作为第三方金标准,在免疫组化法、蛋白印迹法和实施例1的检测方法中,采用5个受试者乳腺癌组织中her2蛋白(分别标记为1、2、3、4和5)进行测定,相同序号的标本均来源于同一受试者乳腺癌组织。
免疫组化法检测
利用手术后肿瘤标本进行甲醛固定,并行石蜡包埋;切片后经脱蜡、水化、通透、封闭,然后加入鼠源的her2抗体,最后和辣根过氧化物酶标记的羊抗鼠igg二抗孵育,最后显色、显微镜更好拍片,颜色越深说明被检测蛋白的表达越高。来源于不同受试者的相同组织的标本经免疫组化检测,检测结果如图4所示:
金标准蛋白印迹检测
肿瘤标本经组织匀浆、sds裂解液破碎提取总蛋白,测定蛋白浓度后,取相同质量的总蛋白,加热变性后经8%的sds-聚丙烯酰胺凝胶分离,并转移至0.45μm的硝酸纤维膜上,最后经封闭、一抗和荧光素标记的二抗孵育后扫描成像。来源于不同受试者的相同组织的标本经蛋白印迹检测,蛋白印迹检测定结果如下图5所示:
实施例1的测试片检测
利用实施例1的测试片对5个受试者乳腺癌组织中her2蛋白表达水平进行检测,具体检测方法如下:0.1g左右的乳腺癌新鲜组织剪碎后,加入250微升蛋白裂解液并结合研磨的作用完全裂解,然后95度加热5分钟,并迅速冰上冷却。然后取50微升组织裂解液加入试纸条的加样区,5分钟后,不同受试者的her2蛋白表达检测结果如图6所示。
从图4-6中可以看出,实施例1的测试片的检测结果和传统的免疫组化检测结果存在一定的差异,但和第三方金标准(蛋白印迹检测)结果一致,对标本4和标本5的检测结果表明免疫组化呈现的趋势与金标准蛋白印迹法检测的结果明显不一致,但实施例1的测试片的检测结果与蛋白印迹法检测结果高度一致,从而表明实施例1的测试片的检测准确度要高于传统的免疫组化检测,可以看出,实施例1的测试片检测不同标本之间的数值与蛋白印迹法检测的结果更趋一致,从而表明实施例1的测试片的检测准确度要高于传统的免疫组化检测。
对比例1
对比例1提供一种测试片,所述的测试片与实施例1的区别在于:蛋白检测区上的检测点呈现平行阵列。
按照实施例2的定量检测her2蛋白的方法,实施例1测试片和对比例1测试片对相同浓度的her2蛋白标准品溶液检测结果如图7所示。
从图7中可以,对比例1测试片的阳性显色检测点的数目明显小于实施例1测试片的阳性显色蛋白检测点的数目,显色检测点的数目越多,测定结构的准确度和灵敏度越优异,实施例1测试片明显优于对比例1测试片,通过吸光度扫描检测仪得到的总吸光度值分别为2170和2930(吸光度值越大,准确度和灵敏度越高),该总吸光值为所有检测点对525nm波长光的吸光值总和。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!