采用荧光技术检测多种待检测物质的方法及荧光检测产品与流程
本发明涉及生物应用技术领域,具体而言,涉及一种采用荧光技术检测多种待检测物质的方法及荧光检测产品。
背景技术:
荧光免疫层析技术是新型的诊断技术,在蛋白检测方面已得到较为广泛运用,基本原理如下:利用荧光探针标记一种抗原或抗体,在试纸的硝酸纤维素(nc)膜上包被相应的配对抗原或抗体,检测时当样品中含相应的特异性抗体或抗原时,荧光探针标记颗粒和样品中配体相结合形成复合物,然后在nc膜上层析,再被包被抗原或抗体捕获,形成具有一定荧光信号的t线,通过荧光检测仪对检测线荧光强度的扫描来实现对结果的判定。
技术实现要素:
本发明旨在提供一种采用荧光技术检测多种待检测物质的方法及荧光检测产品,以实现不同检测项目反应同一时间完成,且具有较高的检测准确度和灵敏度。
为了实现上述目的,根据本发明的一个方面,提供了一种采用荧光检测待检测物质的方法,待检测物质包括第一待检测物质和第二待检测物质,该方法包括以下步骤:s1,获取可与第一待检测物质发生配对反应的第一配体和第二配体,且第一配体和第二配体与第一待检测物质的配对位点不同;获取可与第二待检测物质发生配对反应的第三配体和第四配体,且第三配体和第四配体与第二待检测物质的配对位点不同,对第一配体进行量子点或量子点微球标记得到量子点或量子点微球标记的第一配体,对第三配体进行时间分辨微球标记得到时间分辨微球标记的第三配体,且量子点或量子点微球和时间分辨微球的荧光发射波长有重合;将第二配体和第四配体固定在载体上;s2,将量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体与检测样本接触后再与第二配体和第四配体进行接触并分别进行反应;s3,单激发光源同时照射激发第二配体和第四配体所在的位置,量子点或量子点微球在有激发光下进行第一次荧光数据读取,时间分辨微球在无激发光下进行第二次荧光数据读取,第一次荧光数据读取和第二次荧光数据读取的时间间隔为小于10秒。
进一步地,s1中,获取能够与第一配体和第三配体结合的第五配体,将第五配体固定在载体上;s2中,将量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体与检测样本接触后再与第五配体进行接触,在s3中同时对第五配体所在的位置进行检测并进行荧光数据读取。
进一步地,量子点或量子点微球的激发光波长在300~480nm,荧光发射波长在590~630nm;时间分辨微球的激发光波长在300~480nm,荧光发射波长在590~630nm;第一次荧光数据读取和第二次荧光数据读取的时间间隔为100~500μs;优选的,在同一激发波长下,量子点或量子点微球和时间分辨微球的荧光发射波长差值为0~30nm,更优选差值为0~20nm。
进一步地,量子点或量子点微球的激发光波长为365nm,荧光发射波长为610nm;时间分辨微球的激发光波长为365nm,荧光发射波长为610nm;优选时间分辨微球的荧光物质为铕离子。
进一步地,s3中,量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合使用,s1中,第二配体和第四配体混合后固定在载体上。
进一步地,载体选自硝酸纤维素膜、聚酯膜、聚偏二氟乙烯膜、经壳聚糖进行表面处理的玻璃基片或高聚物基片;优选的,高聚物基片的材质选自由纸纤维、玻璃纤维或聚苯乙烯组成的组中的一种或多种。
进一步地,步骤s1包括,提供微孔板,将量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合后固化在微孔板的每一微孔内;步骤s2包括,将检测样本加入到微孔内溶解固化的量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体,然后再与第二配体和第四配体进行接触。
进一步地,步骤s1包括,提供具有吸取液体功能的管状物,管状物具有储存固体或液体的储存件,将量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合后置于储存件内;步骤s2包括,使用管状物吸取检测样本,使检测样本与量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体接触以形成混合溶液,然后将混合溶液与第二配体和第四配体进行接触。
进一步地,管状物为移液器或塑料吸管;优选地,管状物为移液器,储存件为移液器的枪头,将量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合后固化于枪头内部;优选地,管状物为塑料吸管,储存件为塑料吸管的管腔,将量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合后制作成固体荧光球置于管腔内,或将量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合后以液态储存于管腔内。
根据本发明的另一个方面,提供一种荧光检测产品。该荧光检测产品包括:量子点或量子点微球标记的第一配体;时间分辨微球标记的第三配体;第一载体,用于固定量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体,第一配体可与第一待检测物质发生配对反应,第三配体可与第二待检测物质发生配对反应;第二配体,可与第一待检测物质发生配对反应;第四配体,可与第二待检测物质发生配对反应;以及第二载体,用于固定可与第一待检测物质发生配对反应的第二配体和可与第二待检测物质发生配对反应的第四配体,其中,第一配体和第二配体与第一待检测物质的配对位点不同,第三配体和第四配体与第二待检测物质的配对位点不同,量子点和时间分辨微球的荧光发射波长有重合。
进一步地,第一载体和第二载体为一体设置的荧光检测试纸,荧光检测试纸包括支撑板和设置在支撑板上依次连接排布的上样垫、荧光释放垫、反应膜和吸样垫;其中,荧光释放垫含有量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体;反应膜上设置有检测线,检测线为包被在反应膜上的第二配体和第四配体形成的线状印迹;荧光检测试纸还包括与检测线平行设置的质控线,质控线为包被在反应膜上的能够与第一配体和第三配体结合的第五配体形成的线状印迹;优选的,荧光检测试纸包括采用相同方法设置的针对多种待检测物质的多条检测线。
进一步地,第一载体为微孔板,量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合后固化在微孔板的每一微孔内,优选微孔板包括采用相同方法设置的针对多种待检测物质的多个微孔;或第一载体为具有吸取液体功能的管状物,管状物具有储存固体或液体的储存件,储存件内储存有量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体的混合物;优选的,管状物为移液器,储存件为移液器的枪头,枪头的内部固化有量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体的混合物;优选的,管状物为塑料吸管,储存件为塑料吸管的管腔,管腔内含有量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合制作成的固体荧光球,或者量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合液体。
进一步地,第二载体上还固定有能够与第一配体和第三配体结合的第五配体;优选的,第二配体和第四配体形成检测线,第五配体形成与检测线平行设置的质控线。
进一步地,量子点或量子点微球的激发光波长在300~480nm,荧光发射波长在590~630nm;时间分辨微球的激发光波长在300~480nm,荧光发射波长在590~630nm;优选地,量子点或量子点微球和时间分辨微球的激发光波长为365nm,量子点或量子点微球和时间分辨微球的荧光发射波长为610nm。
根据本发明的再一方面,提供了一种采用荧光检测待检测物质的方法。该方法包括采用上述荧光检测产品进行检测。
应用本发明的技术方案,分别采用量子点(或量子点微球)和时间分辨荧光微球作为标记,与比传统的荧光探针相比,实现了同时检测多种蛋白的可能,同时不强制要求仪器必须使用多种激发光元器件,可操作性强,稳定性好。
附图说明
构成本申请的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
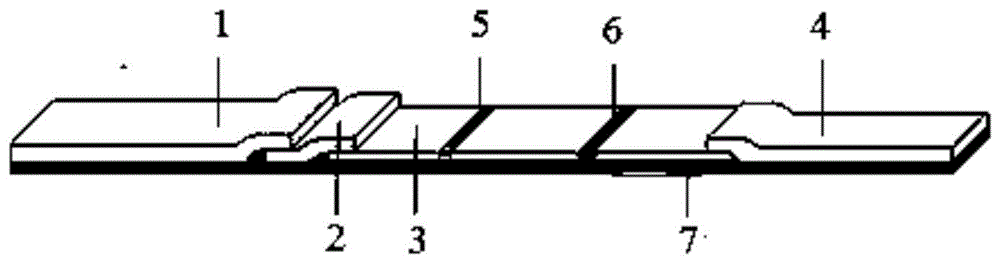
图1示出了根据本发明一实施方式的量子点时间分辨微球联合荧光检测试纸结构示意图。
附图符号说明:
1:上样垫;2:荧光释放垫;3:nc膜;4:吸样垫;5:检测t线;6:质控c线;7:塑料支撑板。
具体实施方式
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将参考附图并结合实施例来详细说明本发明。
发明人分析发现,现有的荧光免疫层析技术还存在以下技术问题:1)要求包被在硝酸纤维素膜上同一位置的抗体只能为一种,若同时检测多个项目需要在不同位置包被抗体,而硝酸纤维素膜上有限的空间无法实现多种抗体同时包被;2)该技术实现多种蛋白检测的另一个方向是,释放垫上标记不同蛋白的抗体使用激发和发射光波长完全不同的荧光纳米材料,一方面使荧光检测仪的成本上升,另一方面不同激发和发射光的切换不但会大大增加荧光检测仪的体积也会导致荧光信号检测准确度下降;3)使用同一种荧光材料标记不同的项目抗体的话,质控线的强度会分别受到两种项目阳性检测结果的干扰,在后期利用仪器内置的算法进行拟合浓度时准确度将难以保证。
针对上述一系列技术问题,本发明提出了下列技术方案。
根据本发明一种典型的实施方式,提供一种采用荧光技术检测多种待检测物质的方法。在该检测方法中,待检测物质包括第一待检测物质和第二待检测物质,方法包括以下步骤:s1,获取可与第一待检测物质发生配对反应的第一配体和第二配体,且第一配体和第二配体与第一待检测物质的配对位点不同;获取可与第二待检测物质发生配对反应的第三配体和第四配体,且第三配体和第四配体与第二待检测物质的配对位点不同,对第一配体进行量子点或量子点微球标记得到量子点或量子点微球标记的第一配体,对第三配体进行时间分辨微球标记得到时间分辨微球标记的第三配体,且量子点或量子点微球和时间分辨微球的荧光发射波长有重合;将第二配体和第四配体固定在载体上;s2,将量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体与检测样本接触后再与第二配体和第四配体进行接触并分别进行反应;s3,单激发光源同时照射激发第二配体和第四配体所在的位置,量子点或量子点微球在有激发光下进行第一次荧光数据读取,时间分辨微球在无激发光下进行第二次荧光数据读取,第一次荧光数据读取和第二次荧光数据读取的时间间隔为小于10秒。
应用本发明的技术方案,分别采用量子点(或量子点微球)和时间分辨荧光微球作为标记物,与比传统的荧光探针相比,实现了同时检测多种蛋白的可能,同时不强制要求仪器必须使用多种激发光元器件,可操作性强,稳定性好。
需要说明的是,当待检测物质为免疫学意义上的抗原时,本申请中的“配体”通常指抗体;当待检测物质为免疫学意义上的抗体时,本申请中的“配体”则通常指的是抗原。
为了进一步提高检测的准确性,优选的,在本发明中s1好包括,获取能够与第一配体和第三配体结合的第五配体,将第五配体固定在载体上,s2中将量子点标记的第一配体和时间分辨微球标记的第三配体与检测样本接触后再与第五配体进行接触,在s3中同时对第五配体所在的位置进行检测并进行荧光数据读取。在本申请中,质控线强度可以分别计算完全不受另一项目的荧光值影响(即第一配体和第三配体分别和第五配体结合,彼此不会干扰独立计算荧光信号),在利用(t线)检测线荧光强度和质控线荧光强度的比值进行浓度拟合的系统内大大提高了多项检测的准确度。
在一些实施例中,量子点或量子点微球的激发光波长在300~480nm,荧光发射波长在590~630nm;时间分辨微球的激发光波长在300~480nm,荧光发射波长在590~630nm;第一次荧光数据读取和第二次荧光数据读取的时间间隔为100~500μs;优选的,在同一激发波长下,量子点或量子点微球和时间分辨微球的荧光发射波长差值为0~30nm,更优选差值为0~20nm。在实际检测中,仪器的照射光源关闭后检测的时间可能会在60~400μs的范围内波动。
典型的,在本发明一实施方式中,量子点或量子点微球的激发光波长为365nm,荧光发射波长为610nm;时间分辨微球的激发光波长为365nm,荧光发射波长为610nm;优选时间分辨微球的荧光物质为铕离子。在365nm左右的激发光源下,第一次荧光数据读取在激发光源不熄灭的状态下检测,第二次荧光数据读取在激发光熄灭后100μs左右检测。这种方式易于工业化应用。
在本申请的发明构思指导下,本申请的实现方式有多种,例如,根据本发明一种典型的实施方式,s3中,量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合使用,s1中,第二配体和第四配体混合后固定。检测物质与量子点标记的第一配体和时间分辨微球标记的第三配体接触后,再与第二配体、第四配体和第五配体等接触,典型的,第二配体、第四配体和第五配体固定在载体上,载体选自硝酸纤维素膜、聚酯膜、聚偏二氟乙烯膜、经壳聚糖进行表面处理的玻璃基片或高聚物基片;优选的,高聚物基片的材质选自由纸纤维、玻璃纤维或聚苯乙烯组成的组中的一种或多种。
在本发明一种典型的实施方式中,步骤s1包括,提供微孔板,将量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合后固化在微孔板的每一微孔内;步骤s2包括,将检测样本加入到上述微孔内溶解固化的量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体,然后再与第二配体和第四配体进行接触。
在本发明另一种典型的实施方式中,步骤s1包括,提供具有吸取液体功能的管状物,管状物具有储存固体或液体的储存件,将量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合后置于储存件内;步骤s2包括,使用管状物吸取检测样本,使检测样本与量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体接触以形成混合溶液,然后将混合溶液与第二配体和第四配体进行接触。其中,管状物为移液器或塑料吸管,也可以为本领域技术人员所能获取的其它具有相同功能的工具。在一些实施例中,管状物为移液器,储存件为移液器的枪头,将量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合后固化于枪头内部。在另一些实施例中,管状物为塑料吸管,储存件为塑料吸管的管腔,将量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合后制作成固体荧光球置于管腔内,或将量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体混合后以液态储存于管腔内。
根据本发明一种典型的实施方式,提供一种荧光检测产品。该试剂盒包括第一配体、第二配体、第三配体、第四配体、第一载体和第二载体,其中,第一载体用于固定量子点或量子点微球标记的第一配体和时间分辨微球标记的第三配体,第一配体可与第一待检测物质发生配对反应,第三配体可与第二待检测物质发生配对反应;第二载体用于固定可与第一待检测物质发生配对反应的第二配体和可与第二待检测物质发生配对反应的第四配体,其中,第一配体和第二配体与第一待检测物质的配对位点不同,第三配体和第四配体与第二待检测物质的配对位点不同,量子点和时间分辨微球的荧光发射波长有重合。
在本发明一种典型的实施方式中,第一载体和第二载体为一体设置的荧光检测试纸,荧光检测试纸包括支撑板和设置在支撑板上依次连接排布的上样垫、荧光释放垫、反应膜和吸样垫;其中,荧光释放垫含有量子点标记的第一配体和时间分辨微球标记的第三配体;反应膜上设置有检测线,检测线为包被在反应膜上的可与第一待测物质发生配对反应的第二配体和可与第二待测物质发生配对反应的第四配体形成的线状印迹;荧光检测试纸还包括与检测线平行设置的质控线,质控线为包被在反应膜上的能够与第一配体和第三配体结合的第五配体形成的线状印迹。上述实施例实现了同时检测两种待检测物,根据本申请提供的荧光检测原理,在一种优选的实施例中,荧光检测试纸包括采用相同方法设置的针对多种待检测物质的多条检测线。具体地,每条检测线包被有两种配体,每一种配体对应于一种可与之发生配对反应的待检测物,根据实际检测需求,可设计出包括两条、四条或六条检测线的荧光检测试纸,实现四种、八种或十二种待检测物的同时检测。
在本发明一典型的实施方式中,荧光检测试纸如图1所示,包括:上样垫1、荧光释放垫2、nc膜3、吸样垫4、检测t线5、质控c线6和塑料支撑板7。上样垫1的一端紧密压接含有量子点标记的第一配体以及时间分辨微球标记的第三配体的荧光释放垫2,荧光释放垫2一端紧密压接硝酸纤维素(nc)膜3,硝酸纤维素膜包被有混合在一起的第二配体和第四配体检测t线,质控c线7为包被在nc膜上的山羊抗小鼠抗体,硝酸纤维素膜的另一端连接吸样垫4形成试纸。
在本发明一种典型的实施方式中,第一载体为微孔板,量子点标记的第一配体和时间分辨微球标记的第三配体混合后固化在微孔板的每一微孔内。上述实施方式实现了同时检测两种待检测物,根据本申请提供的荧光检测原理,在一种优选的实施例中,微孔板包括采用相同方法设置的针对多种检测物质的多个微孔。具体地,每个微孔中混合固化有两种配体,每一种配体对应于一种可与之发生配对反应的待检测物,根据实际检测需求,可设计出包括两个、四个、六个甚至更多个微孔的微孔板,实现四种、八种、十二种或更多种待检测物的同时检测。
在上述实施方式中,第一载体还可以为具有吸取液体功能的管状物,管状物具有储存固体或液体的储存件,储存件内储存有量子点标记的第一配体和时间分辨微球标记的第三配体的混合物。
典型的,管状物为移液器,储存件为移液器的枪头,枪头的内部固化有量子点标记的第一配体和时间分辨微球标记的第三配体的混合物。
典型的,管状物为塑料吸管,储存件为塑料吸管的管腔,管腔内含有量子点标记的第一配体和时间分辨微球标记的第三配体混合制作成的固体荧光球,或量子点标记的第一配体和时间分辨微球标记的第三配体混合液体。
在一些实施例中,第二载体为经壳聚糖进行表面处理的玻璃基片或高聚物基片,优选的,高聚物基片的材质选自由纸纤维、玻璃纤维或聚苯乙烯组成的组中的一种或多种;更优选的,第二载体上还固定有能够与第一配体和第三配体结合的第五配体;进一步优选的,第二配体和第四配体形成检测线,第五配体形成与检测线平行设置的质控线。
在一些实施例中,量子点的激发光波长在300~480nm,荧光发射波长在590~630nm;时间分辨微球的激发光波长在300~480nm,荧光发射波长在590~630nm。在一种优选的实施例中,量子点和时间分辨微球的激发光波长为365nm,量子点和时间分辨微球的荧光发射波长为610nm。
典型的,第一配体、第二配体、第三配体和第四配体为鼠源单克隆抗体,第五配体为山羊抗小鼠抗体或兔抗小鼠抗体。
下面将结合实施例进一步说明本发明的有益效果。
实施例1
制备犬c反应蛋白(crp)和犬血清淀粉样蛋白(saa)的量子点时间分辨微球荧光检测试纸
1主要材料
1.1犬crp抗体一对:为小鼠igg,单抗1用于量子点标记,单抗2用于nc膜t线包被;犬saa抗体一对:为公司自主制备纯化的小鼠igg,单抗3用于时间分辨微球标记,单抗4用于nc膜t线包被;山羊抗小鼠igg:杭州贤至生物科技有限公司,用于nc膜c线包被;量子点:纳晶科技股份有限公司产品;时间分辨微球:bangslaboratoriesfceu002;硝酸纤维素(nc)膜:milliporecn95公司产品;牛血清白蛋白(bsa),聚乙二醇peg20000:sigma产品。其它常用试剂均为分析纯试剂。
1.2临床血清:犬crp和犬saa的血清由公司在相关医院获得,其中犬crp浓度高于10mg/l的阳性样本45份,犬saa高于10mg/l的阳性样本28份,犬crp和犬saa浓度低于5mg/l的正常样本30份。
1.3犬c反应蛋白(crp)酶联免疫分析试剂盒(elisa法)和犬血清淀粉样蛋白(saa)酶联免疫分析试剂盒(elisa法)。
2方法
2.1犬crp单克隆抗体的量子点标记与犬saa单克隆抗体的铕时间分辨微球标记使用公司自制的量子点(量子点微球)溶液,制备完成后取100ml,用0.2mk2co3将溶液ph值调到8.0。然后将溶液置于磁力搅拌器上缓慢搅拌,按每100ml溶液加入0.5mg将犬crp单克隆标记抗体缓慢滴加到量子点标记溶液中,继续搅拌2小时,再滴加入浓度为10%的peg20000溶液30ul和3ml10%的bsa溶液进行封闭20min,标记结束后以8000r/m离心,弃上清,沉淀使用ph值8.0的硼酸盐缓冲液复溶至100ml,后的,再添加bsa1mg、羊igg1mg,蔗糖3mg和吐温200.5mg后溶解摇匀后备用。犬saa单克隆抗体的铕时间分辨微球标记方法与上述犬crp量子点标记方法相同,将标记得到的犬crp量子点标记溶液和犬saa铕时间分辨微球标记溶液等比例混合后按1ml溶液铺22cm2的比例加样于无纺布上,在温度20~25℃,相对湿度在<30%的干燥间干燥2~4小时,制成量子点铕时间分辨微球荧光释放垫。
2.2nc膜包被用0.01mph7.4pbs将犬crp和犬saa单克隆包被抗体混合后稀释成终浓度1mg/ml、,然后用喷膜仪在nc膜下部按1ul/cm进行分别划线包被,同时在nc膜上部包被山羊抗小鼠抗体,用于产品的质控,包被完成后将nc膜在在温度20~25℃,相对湿度在<30%的干燥间干燥2~5小时。
2.3犬crp和犬saa的量子点时间分辨微球荧光检测试纸的组装在干燥室内(温度20~25℃,相对湿度<30%)取塑料支撑板,将已包被的nc膜放置在塑料支撑板的中部粘贴,在nc膜t线一侧搭接荧光释放垫(搭荧光释放垫的1/3)粘贴,在荧光垫另一侧搭接粘贴上样垫(搭荧光释放垫的1/5);在nc膜c线一侧搭接吸样垫(搭吸样垫的1/10);然后用裁剪机将贴好塑料板切成3mm或4mm宽的试纸条。切好的试纸条可以再装入塑料卡内,形犬crp和犬saa的量子点时间分辨微球荧光检测卡。
2.4检测方法将被检血清平衡至温室,将制备好的试纸条或试剂卡平放,在上样垫上加入100μl被检样品,若样品中含crp或saa,则和样品垫上的标记单克隆抗体的荧光标记物结合,形成复合物,并扩散到nc膜上进一步层析,当遇到包被在nc膜上t线处的另外crp或saa单克隆抗体时,复合物则又和包被单克隆抗体结合,被捕获在包被处;当被捕获的荧光复合物达到一定数量时,则可以通过荧光检测仪进行检测;第一次仪器内部激发光源保持照射状态下对c/t线荧光信号进行扫描读取,第二次仪器内部激发光源照射关闭后100μs左右对c/t线荧光信号扫描读取;其中第二次荧光扫描t线读取荧光值和第二次照射c线荧光值的比值进行输出,仪器内部根据预置的标准曲线将比值和犬saa的浓度值进行换算从而得到犬saa的最终检测浓度值。其中第一次荧光扫描t线读取荧光值减去第二次照射t线读取荧光值再和第一次荧光扫描c线读取的荧光值的比值进行输出,仪器内部根据预置的标准曲线将比值和犬crp的浓度值进行换算从而得到犬crp的最终检测浓度值。第一次照射检测时间在点样完成后300s时,第二次照射检测时间在点样完成后310s时。
2.5临床血清检测用本试剂按检测方法对所有临床血清进行检测,同时用商用检测elisa试剂进行对照检测。
3结果
3.1临床血清检测以elisa试剂为对照,elisa试剂采用双抗体夹心法检测样本中犬crp或saa的浓度。犬crp或saa捕获抗体已预包被于酶标板上,当加入标本或参考品时,其中的犬crp或saa会与捕获抗体结合,其它游离的成分通过洗涤的过程被除去。当加入与生物素化的抗犬crp或saa抗体后,抗犬crp或saa抗体与犬crp或saa接合,形成夹心的免疫复合物,其它游离的成分通过洗涤的过程被除去。再加入亲和素连接的hrp结合物,生物素与亲和素结合,其它游离成分通过洗涤的过程被除去,最后加入显色剂,若样本中存在犬crp或saa将会形成免疫复合物,辣根过氧化物酶会催化无色的显色剂氧化成蓝色物质,在加入终止液后呈黄色。通过酶标仪检测,读其450nm处的od值,crp浓度与od450值之间呈正比,通过参考品绘制标准曲线,对照未知样本中od值,即可算出标本中犬crp或saa浓度。本试剂犬crp检测出超过10mg/l的阳性样本45份,elisa试剂检测出阳性45份,灵敏度=45/45=100.0%;本试剂犬saa检测出超过10mg/l的阳性样本28份,elisa检测出阳性28份,灵敏度=28/28=100.0%;本试剂阴性样本检测均为阴性,相对特异性100%。p>0.05。以elisa试剂为对照,临床检测表明本试剂的性能和elisa试剂相比无显著性差异,适合用于临床检测。
对比例
分别制备犬c反应蛋白(crp)和犬血清淀粉样蛋白(saa)的量子点荧光检测试纸。
1主要材料
1.1犬crp抗体一对:为小鼠igg,单抗1用于量子点标记,单抗2用于nc膜t线包被;犬saa抗体一对:为公司自主制备纯化的小鼠igg,单抗3用于量子点标记,单抗4用于nc膜t线包被;山羊抗小鼠igg:杭州贤至生物科技有限公司,用于nc膜c线包被;量子点:纳晶科技股份有限公司产品;硝酸纤维素(nc)膜:milliporecn95公司产品;牛血清白蛋白(bsa),聚乙二醇peg20000:sigma产品。其它常用试剂均为分析纯试剂。
1.2临床血清:犬crp和犬saa的血清由公司在相关医院获得,其中犬crp浓度高于10mg/l的阳性样本45份,犬saa高于10mg/l的阳性样本28份,犬crp和犬saa浓度低于5mg/l的正常样本30份。
2方法
2.1犬crp单克隆抗体的量子点标记与犬saa单克隆抗体的量子点标记使用公司自制的量子点(量子点微球)溶液,制备完成后取100ml,用0.2mk2co3将溶液ph值调到8.0。然后将溶液置于磁力搅拌器上缓慢搅拌,按每100ml溶液加入0.5mg将犬crp单克隆标记抗体缓慢滴加到量子点标记溶液中,继续搅拌2小时,再滴加入浓度为10%的peg20000溶液30ul和3ml10%的bsa溶液进行封闭20min,标记结束后以8000r/m离心,弃上清,沉淀使用ph值8.0的硼酸盐缓冲液复溶至100ml,后的,再添加bsa1mg、羊igg1mg,蔗糖3mg和吐温200.5mg后溶解摇匀后备用。犬saa单克隆抗体的量子点标记方法与上述犬crp量子点标记方法相同,将标记得到的犬crp量子点标记溶液和犬saa量子点标记溶液等比例混合后按1ml溶液铺22cm2的比例加样于无纺布上,在温度20~25℃,相对湿度在<30%的干燥间干燥2~4小时,制成量子点荧光释放垫。
2.2nc膜包被用0.01mph7.4pbs将犬crp和犬saa单克隆包被抗体分别稀释至终浓度1mg/ml,然后用喷膜仪在nc膜下部按1ul/cm进行分别划线包被,其中犬saa的单克隆包被抗体更接近释放垫位置同时在nc膜上部包被山羊抗小鼠抗体,用于产品的质控,包被完成后将nc膜在在温度20~25℃,相对湿度在<30%的干燥间干燥2~5小时。
2.3犬crp和犬saa的量子点荧光检测试纸的组装在干燥室内(温度20~25℃,相对湿度<30%)取塑料支撑板,将已包被的nc膜放置在塑料支撑板的中部粘贴,在nc膜t线一侧搭接荧光释放垫(搭荧光释放垫的1/3)粘贴,在荧光垫另一侧搭接粘贴上样垫(搭荧光释放垫的1/5);在nc膜c线一侧搭接吸样垫(搭吸样垫的1/10);然后用裁剪机将贴好塑料板切成3mm或4mm宽的试纸条。切好的试纸条可以再装入塑料卡内,形犬crp和犬saa的量子点荧光检测卡。
2.4检测方法将被检血清平衡至温室,将制备好的试纸条或试剂卡平放,在上样垫上加入100μl被检样品,若样品中含crp或saa,则和样品垫上的标记单克隆抗体的荧光标记物结合,形成复合物,并扩散到nc膜上进一步层析,当遇到包被在nc膜上t1线处的犬saa单克隆抗体时,复合物和包被的犬saa单克隆抗体结合,被捕获在t1线处;当遇到包被在nc膜上t2线处的犬crp单克隆抗体时,复合物和包被的犬crp单克隆抗体结合,被捕获在t2线处.多余的犬crp和犬saa单克隆抗体量子点荧光标记物最后会被包被在c线处的山羊抗小鼠捕获。c/t1/t2线位置中当被捕获的荧光复合物达到一定数量时,则可以通过荧光检测仪进行检测;仪器内部激发光源保持照射状态下对c/t线荧光信号进行扫描读取,仪器内部根据预置的标准曲线将比值和犬crp和犬saa的浓度值进行换算从而得到最终检测浓度值。
2.5临床血清检测用本试剂按检测方法对所有临床血清进行检测,同时用商用检测elisa试剂进行对照检测。
3结果
3.1临床血清检测以elisa试剂为对照,elisa试剂采用双抗体夹心法检测样本中犬crp或saa的浓度。犬crp或saa捕获抗体已预包被于酶标板上,当加入标本或参考品时,其中的犬crp或saa会与捕获抗体结合,其它游离的成分通过洗涤的过程被除去。当加入与生物素化的抗犬crp或saa抗体后,抗犬crp或saa抗体与犬crp或saa接合,形成夹心的免疫复合物,其它游离的成分通过洗涤的过程被除去。再加入亲和素连接的hrp结合物,生物素与亲和素结合,其它游离成分通过洗涤的过程被除去,最后加入显色剂,若样本中存在犬crp或saa将会形成免疫复合物,辣根过氧化物酶会催化无色的显色剂氧化成蓝色物质,在加入终止液后呈黄色。通过酶标仪检测,读其450nm处的od值,crp浓度与od450值之间呈正比,通过参考品绘制标准曲线,对照未知样本中od值,即可算出标本中犬crp或saa浓度。本试剂犬crp检测出超过10mg/l的阳性样本35份,elisa试剂检测出阳性45份,灵敏度=35/45=77.8%;本试剂犬saa检测出超过10mg/l的阳性样本26份,elisa检测出阳性28份,灵敏度=26/28=92.9%;犬crp和犬saa量子点试剂阴性样本检测均为阴性,相对特异性100%。以elisa试剂为对照,临床检测表明该试剂的灵敏度显著低于elisa试剂。
从上述对比例的检测结果可知,现有技术中在硝酸纤维素膜上包被两种项目的抗体来实现多项检测,由于液体层析本身的指向性,两种项目检测不是同一时间完成,抗体抗原反应是按照包被在硝酸纤维素膜上的位置的先后依次进行反应,导致了第二种检测项目特异性灵敏度以及检出时间均会落后于第一种检测项目。
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:
1)通过按照本发明的发明构思设置多条检测,使得两种/四种/六种的项目在现有的荧光免疫层析技术及荧光检测仪上同时检测通过使用该技术成为可能;
2)在同样检测项目数量的情况下,使用本发明申请中的技术,可以做到不同检测项目反应同一时间完成,避免了由于反应先后完成导致的灵敏度和特异性较差问题;
3)使用本申请的技术方案,质控线强度可以分别计算完全不受另一项目的荧光值影响,在利用t线检测线荧光强度和质控线荧光强度的比值进行浓度拟合的系统内大大提高了多项检测的准确度;
4)使用本申请的技术方案,荧光检测仪器仅需一种激发光源器件及相应滤光材料即可实现多项检测,大大降低了仪器开发和生产成本,延长了荧光仪器的使用寿命,减小了仪器的体积,增加了仪器在多项检测时的灵敏度和特异性。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!