一种多孔PVDF模板几何约束免疫磁珠复合材料制备方法及应用与流程
本发明涉及生物化学技术领域,特别是涉及一种多孔pvdf模板几何约束免疫磁珠复合材料制备方法及应用。
背景技术:
临床上,测定c肽的浓度能得知胰岛细胞的功能,对糖尿病的诊断和治疗具有重要的意义。c肽商业化的免疫测定方法是通过c肽免疫反应活性来测定c肽浓度,但是通常会出现检测值偏高的情况。同位素稀释质谱法时能够区别内源和外源蛋白质,从而能直接准确的测定目标物质。日本计量院将6-氨基喹啉基-n-羟基琥珀酰亚胺基甲酸酯(aqc)修饰c肽n端氨基,氨基喹啉基可以通过在肽段中添加正电荷来提高电离效率,化学修饰和磁珠免疫提取法提高了血清中c肽的定量限,其柱上0.003~2.9ng范围内线性关系良好,相对标准偏差为4.0%,加入nmijcrm6901-b作为标准物质,提供了一种潜在的c肽标准测量程序,但是该方法流程复杂,会影响结果准确度。
目前在同位素稀释质谱法的样品前处理中,蛋白质类样品通常是通过抗原和抗体免疫结合进行分离,其特异性和高效性为提取低丰度复杂基质中样品提供了便捷途径。因此将具有超顺磁性物质的表面包覆不同的官能团与抗体或抗原进行共价或非共价结合,既可以发挥抗原抗体的特性结合优势,又可以发挥超顺磁性物质的特点,通过磁场的改变达到混合均匀、高效分离和基质残留量少的目的。目前的研究都集中在建立颗粒表面功能化和探索固定抗体最优方法方面,以达到特异性富集和获得最佳提取效率的目的。由于磁性粒子可以用不同的合成方法来制备,它们的大小和理化性质有很大的差异,这限制了对抗体可靠结合能力的预测。因此,定量控制颗粒的可变性和功能化,开发通用的分析方法来准确定量结合抗体的数量是非常重要的。
dynabeads免疫磁珠是一种均匀无孔、超顺磁性、单分散和高度交联的聚苯乙烯微球,由均匀分散的γ-fe2o3和磁铁矿(fe3o4)的混合物组成。磁珠因有超强的顺磁性,具有能够在磁场中迅速聚集固定和离开磁场后又能迅速均匀分散的特点。同时,微纳米级别的磁珠比表面积高,沉降速率极低,在包覆丰富的官能团之后,能够应用到各种物质的提取和富集中。与传统的分离方法相比,dynabeads免疫磁珠孵育时间短、可以使生化样品复杂组分的分离和富集同时进行,实验结果背景干扰少、重现性好。
免疫磁珠的无孔结构在一定程度上能降低杂质的捕获能力,减少抗体的消耗,但是在提取血清基质中蛋白质,尤其是低丰度蛋白时,提取后的剩余基质中依然可以检测到大量剩余目标蛋白的存在,说明磁珠在提取过程中富集效率有限,远远没有达到理想状态。另外磁珠粒径的不均一化可能会阻碍部分免疫磁珠定位到磁铁而造成实验中目标蛋白的丢失。同时在前处理过程中,低丰度样品的浓度越低往往需要的磁珠量越多,因此磁珠和抗体的添加量都是远远过量的,造成了极大的浪费。
因此本发明从增加抗体和抗原的接触面积,确定抗原和磁珠的接触方向为出发点制备多孔pvdf模板几何约束免疫磁珠的复合材料。
技术实现要素:
本发明的目的是提供一种多孔pvdf模板几何约束免疫磁珠复合材料制备方法及应用。
为实现上述目的,本发明采用的技术方案具体如下:
一种多孔pvdf模板几何约束免疫磁珠复合材料制备方法,具体为:
(1)传统
将3.6ml水、10ml氨水、甲醇:异丙醇=1:3(10ml,30ml)混合搅拌加热至40℃,缓慢逐滴加入0.6ml正硅酸乙酯(teos),转速为300rpm,搅拌反应30min,得到硅球种子溶液,然后再缓慢滴加3.4mlteos,继续反应2h,在通风橱放置5h除去多余氨。离心后去离子水和乙醇各洗涤两次,40℃干燥备用。样品加入无水乙醇中超声分散2h,室温干燥后在30%过氧化氢中浸泡12h,真空干燥后备用。
(2)丁二酸改性:
将0.5gsio2溶于25ml乙腈中,超声振荡后形成均匀的分散溶液。在三口烧瓶中加入1.5g丁二酸,25ml乙腈,连续搅拌回流加热至60℃,加入5ml去离子水直到丁二酸完全溶解,再将分散溶液倒入三口烧瓶中,继续搅拌回流升温至75℃。连续搅拌保温24h后将产物冷却到65℃左右,热抽滤后用去离子水和无水乙醇的混合溶液洗涤三次,60℃干燥备用。
(3)浸渍sio2微球:
将载玻片在使用前用质量分数为30%的过氧化氢和质量分数为98%的浓硫酸的混合溶液中(体积比3:7)浸泡静置12h,再经去离子水反复漂洗后在氮气流中干燥备用。用去离子水配成质量分数为2%sio2分散溶液,超声分散转移至染色缸中。将处理后的载玻片插入染色缸中垂直置于悬浮液中,真空干燥后取出载玻片。
(4)多孔pvdf膜的制备:
将2gpvdf粉末溶解在10ml二甲基亚砜(dmso)中,搅拌均匀,滴适量在sio2浸渍后的载玻片上,保持均匀,在60℃烘箱中干燥6h,取出后浸泡在去离子水中,膜自动与载玻片分离。配置刻蚀液1ml乙醇、1ml氢氟酸和5ml去离子水,将得到的膜浸泡在刻蚀液中5天,刻蚀后的pvdf膜用大量去离子水冲洗。
(5)多孔pvdf模板几何约束免疫磁珠复合材料的制备:
将免疫磁珠悬浮在涂层缓冲液中,把刻蚀sio2后的pvdf膜浸泡在其中,室温振荡孵育5h,取出制备好的组装磁珠膜材料,冲洗表面残留磁珠。
其中,实验所用磁珠表面的官能团为对甲苯磺酰基,可以与抗体上的氨基发生二级亲核取代反应,使磁珠可以通过共价键偶合不同抗体,并且产生等摩尔质量的对甲苯磺酸。
本发明制备的多孔pvdf模板几何约束免疫磁珠复合材料在c肽定量上的应用:准确称取500μl血清样品,按免疫法测得的c肽浓度加入等质量c肽标记物,准确称量、混匀;将制备好的模板分散免疫磁珠复合材料与抗体偶合,加入50μl磁珠-抗体复合物,室温下混匀一小时,结合了目标物的磁珠以1mltbst洗涤三次,再用1mltbs洗涤一次;最后用100μl0.1%三氟乙酸水溶液将磁珠上结合的c肽收集下来,上机检测。
同现有技术相比,本发明的突出效果在于:
本发明从提高c肽提取源头效率出发,使其能够不通过衍生化处理就可以进一步提高方法定量限。从增加抗体和抗原的接触面积,确定抗原和磁珠的接触方向为出发点,制备了多孔pvdf模板几何约束免疫磁珠的复合材料。
将制备的多孔pvdf模板几何约束免疫磁珠复合材料应用于c肽定量限考察,通过与未分散免疫磁珠对比,用多孔pvdf模板几何约束免疫磁珠复合材料提取c肽纯品后将定量限由柱上0.3ng降低至0.05ng,与日本计量院发表的c肽潜在参考测量程序相比,不通过衍生化处理后就能达到定量正常人血清c肽的目标,简化了检测流程,同时减少了磁珠和抗体的用量。
下面结合附图说明和具体实施例对本发明所述的多孔pvdf模板几何约束免疫磁珠复合材料制备方法及应用作进一步说明。
附图说明
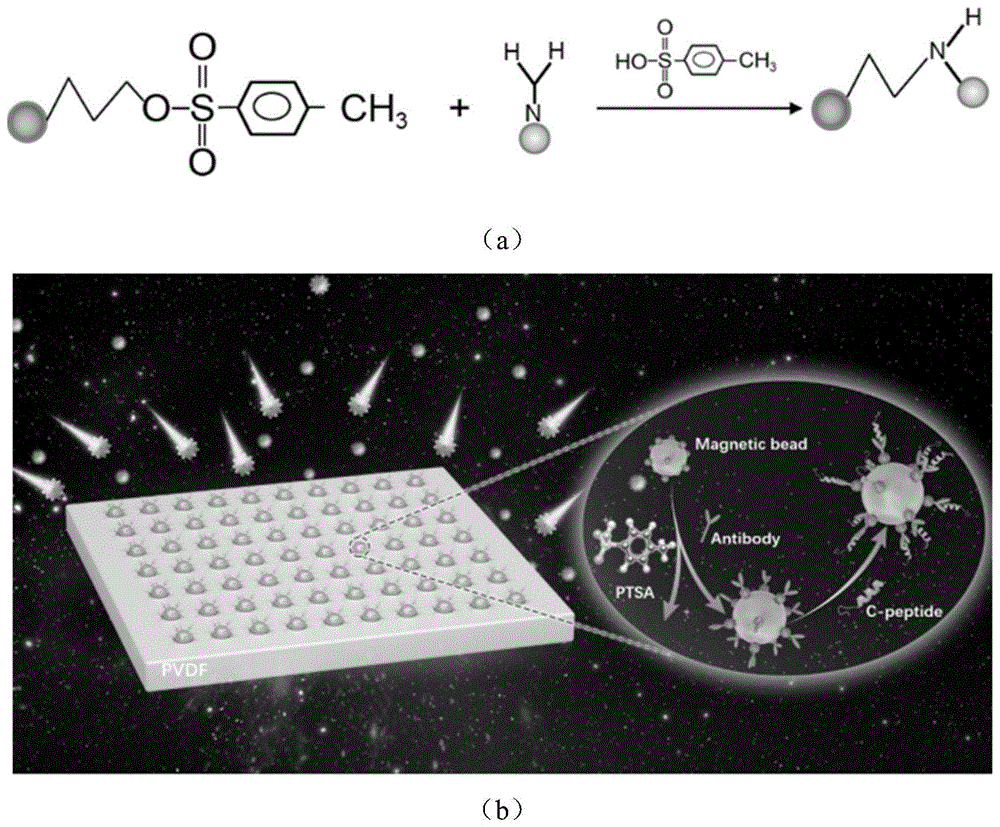
图1中,(a)为磁珠偶合抗体反应机理;(b)为制备方法原理示意图;
图2中,(a)为对甲苯磺酸液相色谱图;(b)为对甲苯磺酸线性拟合图;
图3中,(a)丁二酸改性二氧化硅;(b)2wt.%sio2负载在载玻片上;(c)pvdf填充sio2微球间隙;(d)刻蚀sio2后多孔pvdf膜;(e)将免疫微球负载在pvdf膜上;(f)改性前后sio2xrd图;
图4为sio2微球的sem图,(a)高倍下;(b)低倍下;
图5为sio2微球的xrd图谱;
图6为改性sio2sem图,(a)煅烧法;(b)丁二酸改性法;
图7为kcl改性sio2sem图,(a)3mlkcl;(b)4mlkcl;
图8为改性后sio2微球xrd图谱;从上至下依次为kcl改性法、丁二酸改性法及煅烧法;
图9为sio2浸渍载玻片sem图,(a)1wt.%sio2;(b)2wt.%sio2;(c)3wt.%sio2;(d)4wt.%sio2;
图10为pvdf/sio2sem图,(a)真空干燥;(b)烘箱干燥;
图11为刻蚀sio2后三维微孔pvdf膜结构,(a,b)真空干燥;(c,d)烘箱干燥;
图12为多孔pvdf模板几何约束免疫磁珠复合材料sem图,(a)高倍下;(b)低倍下;
图13为血清中c肽定量mrm图谱;
图14为同位素稀释质谱法检测c肽线性考察结果;
图15为上清液c肽与提取c肽mrm对比谱图;
图16中,(a)结构调控前后液相对比图(红色:磁珠结构调控前;黑色:pvdf调控磁珠结构后);(b)c肽检测限线性拟合图。
具体实施方式
1、材料
正硅酸乙酯(99.9%,美国阿法埃沙公司),免疫磁珠(美国thermofisherscientific、dynabeadsmyonetosylactivated),血清(中国航天总医院提供)、c肽(南京金斯瑞生物科技有限公司),c肽抗体(芬兰hytest,clone#7e10),bsa(中国计量科学研究院)、载玻片(美国赛默飞公司)、丁二酸(比利时acros,99%)、对甲苯磺酸(比利时acros)。
2、免疫磁珠偶合效率
将磁珠与抗体孵育后的液体过滤后直接进样,通过称量法准确配置对甲苯磺酸标准品浓度分别为5.132、10.264、20.528和41.056μg/g,将标准品以相同条件进液相检测,测量三次取积分面积的平均值,拟合线性曲线。
液相色谱条件:岛津液相lc-20at;色谱柱:shiseidoacrc18色谱柱(150mm×4.6mm×5μm);洗脱条件:等度洗脱;流动相a:100%甲醇;流动相b:1.15wt.%的磷酸二氢铵水溶液,体积比为15:85;流速:1ml/min;柱温:40℃;进样体积:10μl;检测波长:221nm。
实验所用磁珠表面的官能团为对甲苯磺酰基,可以与抗体上的氨基发生二级亲核取代反应,使磁珠可以通过共价键偶合不同抗体,并且产生等摩尔质量的对甲苯磺酸,其反应机理如图1所示。因此,通过抗体与磁珠上偶联官能团反应的生成产物对甲苯磺酸对其结合密度进行评价。
如图2(a)所示,反应后溶液中的主要物质出峰时间和甲苯磺酸纯品的保留时间一致,出峰时间在9.7min左右。标准品以相同条件进液相检测,拟合线性曲线,如图2(b)所示,相关系数为0.9999。通过线性拟合后,将样品三次测量的积分面积代入拟合公式y=24597.45x+37095.66,计算得出样品中对甲苯磺酸的浓度为18.9928μg/g。免疫磁珠活性基团物质的量浓度为40~60μmol/g,计算结合率为13.79%,其结合密度相对较低是由于为保证抗体的结合效率,磁珠的添加量过量。相对较低的结合密度会减少在抓取抗原时抗体和抗原的有效碰撞几率,降低反应灵敏度。在提取低丰度蛋白质时加入过量的磁珠,在造成磁珠和抗体浪费的同时会减小磁珠间的空隙,对偶合在磁珠表面的抗体产生遮蔽作用,降低免疫效率。有文献表明抗体与磁珠结合密度的增大会增加其捕获抗原的能力,从而可以获得更高响应。增加抗体与磁珠的结合密度不仅需要增加抗体加入的质量,还需要增加磁珠与磁珠之间的间距,增大比表面积从而减少抗原与免疫磁珠结合的空间位阻。
3、多孔pvdf模板几何约束免疫磁珠复合材料的制备(如图1b)
(1)传统
将3.6ml水、10ml氨水、甲醇:异丙醇=1:3(10ml,30ml)混合搅拌加热至40℃,缓慢逐滴加入0.6ml正硅酸乙酯(teos),转速为300rpm,搅拌反应30min,得到硅球种子溶液,然后再缓慢滴加3.4mlteos,继续反应2h,在通风橱放置5h除去多余氨。离心后去离子水和乙醇各洗涤两次,40℃干燥备用。样品加入无水乙醇中超声分散2h,室温干燥后在30%过氧化氢中浸泡12h,真空干燥后备用。
(2)丁二酸改性:
将0.5gsio2溶于25ml乙腈中,超声振荡后形成均匀的分散溶液。在三口烧瓶中加入1.5g丁二酸,25ml乙腈,连续搅拌回流加热至60℃,加入5ml去离子水直到丁二酸完全溶解,再将分散溶液倒入三口烧瓶中,继续搅拌回流升温至75℃。连续搅拌保温24h后将产物冷却到65℃左右,热抽滤后用去离子水和无水乙醇的混合溶液洗涤三次,60℃干燥备用。
(3)浸渍sio2微球:
将载玻片在使用前用质量分数为30%的过氧化氢和质量分数为98%的浓硫酸的混合溶液中(体积比3:7)浸泡静置12h,再经去离子水反复漂洗后在氮气流中干燥备用。用去离子水配成质量分数为2%sio2分散溶液,超声分散转移至染色缸中。将处理后的载玻片插入染色缸中垂直置于悬浮液中,真空干燥后取出载玻片。
(4)多孔pvdf膜的制备:
将2gpvdf粉末溶解在10ml二甲基亚砜(dmso)中,搅拌均匀,滴适量在sio2浸渍后的载玻片上,保持均匀,在60℃烘箱中干燥6h,取出后浸泡在去离子水中,膜自动与载玻片分离。配置刻蚀液1ml乙醇、1ml氢氟酸和5ml去离子水,将得到的膜浸泡在刻蚀液中5天,刻蚀后的pvdf膜用大量去离子水冲洗。
(5)多孔pvdf模板几何约束免疫磁珠复合材料的制备:
将免疫磁珠悬浮在涂层缓冲液中,把刻蚀sio2后的pvdf膜浸泡在其中,室温振荡孵育5h,取出制备好的组装磁珠膜材料,冲洗表面残留磁珠。
所用的dynabeads免疫磁珠粒径为1μm左右,因此选用制备粒径为0.7~1μm的制备条件,并通过丁二酸改性制备出了粒径均一、球型完整的sio2微球颗粒,其形貌如图3(a)所示。
对所制备的sio2颗粒进行成分分析,如图3(f)所示。xrd图与sio2标准卡片对比,在2θ为23°左右出现非晶态的衍射峰,表明所合成的微球为无定形sio2固体颗粒。
将sio2微球在载玻片上浸渍后,形成了多层紧密堆积结构,如图3(b)所示。这是由于载玻片在浓硫酸和过氧化氢溶液中浸泡后,其表面羟基化增加了亲水能力,形成了自组装层。将载玻垂直置于丁二酸改性sio2分散液中后,载玻片上的羟基会和丁二酸改性后sio2表面残留的羧基发生反应,通过共价键结合形成结构稳定的单层铺展sio2微球结构。同时由于sio2微球间的相互作用力会在部分区域形成多层排列结构。pvdf通过涂敷法烘箱干燥后形成光滑致密皮层,如图3(c)所示。膜厚度较薄在电镜图中能够观察到下方的sio2微球,并在该条件下能够保持sio2微球原有的浸渍结构。多孔表面的疏水程度可以根据杨氏方程cosθ’=rcosθ计算,θ’为粗糙面的表观接触角,θ为光滑面接触角,r代表粗糙度。由于r总是大于1,光滑表面的疏水性最弱,较低的疏水性可以降低pvdf膜对于蛋白质的吸附程度,增加其在血清中提取蛋白质时的抗污染能力。当sio2微球被刻蚀留下孔洞后,如图3(d)所示,空气被困在固体和液体之间的空隙中,形成复合界面,用cassie-baxter模型来描述其润湿行为,疏水性会随着孔隙直径的增大而增强。制备的多孔pvdf膜表面的微孔和周围的平滑致密区域就可以形成具有疏水能力差的微观结构,为免疫磁珠的组装提供驱动力。同时根据wenzel公式,粗糙表面的自由能是光滑表面的r倍,免疫磁珠在组装时更倾向于降低表面自由能而填充孔洞,使其在pvdf膜表面形成按照孔洞结构排列的单分散免疫磁珠复合材料。另外在旋转组装免疫磁珠过程中,由于pvdf膜的去湿作用,毛细管力足够大能把免疫磁珠推入模板孔洞,同时重力驱动的沉积作用,以及孔洞尖端与微球之间的范德华力强相互作用和布朗运动的多重力推动下使其按照模板图案进行排列。
当免疫磁珠悬浮液的浓度足够高时,模板填满免疫磁珠的最大数量由几何约束图形和直径比所决定。通过pvdf孔状结构的导向作用,从图3(e)可以看出疏水pvdf膜上排列出了单层,分散性好的免疫磁珠。在pvdf膜上所有视野范围内未见孔状结构,磁珠对孔隙的利用率可达约100%。当孔径d小于免疫磁珠的直径d时,会形成在表面突出的立体结构,同时保证每个孔只被一个免疫磁珠占据,可以有效防止pvdf膜对免疫磁珠在抓取蛋白时的遮蔽作用,同时又最大限度的提高比表面积。免疫磁珠在膜上的定向排列,可以使偶合的抗原具有方向性,遮蔽的部分官能团可以提高抗体偶合密度。露出的光滑pvdf表面疏水能力较弱,可以减少对蛋白质的特异性吸附,增强其抗污染能力。
pvdf模板辅助自组装免疫磁珠间的相互作用是多方面的。从扫描图3(d)和图3(b)可以看出分散在pvdf模板上的免疫磁珠的数量略多于孔的数量,kralchevsky等人证明了微球部分浸入水平固体衬底上的液体层时,由于旋转孵育过程中引起的液-气界面变形,产生了强而远距离的粒子间相互作用,这种引力可能是毛细管相互作用的结果。这种粒子间的相互作用使孔洞被填充完之后也能一定程度上在pvdf表面进行自发排列,提高了pvdf膜上的负载量。
为突出本步骤中相关技术参数的效果,对部分技术环节进行了以下详细讨论:
(1)sio2形貌及成分
合成温度、teos、氨水和含水量会显著影响sio2球的粒径,通常温度越低、teos和氨水的用量越大、含水量越高粒径越大。本发明所用的dynabeads免疫磁珠粒径为1μm左右,因此选用制备粒径为0.7~1μm的制备条件:甲醇与异丙醇比例为1:3,正硅酸乙酯:氨水比例为3:10。
从图4(a)可以看出,制备出了粒径均一、球型完整的sio2微球颗粒。通过在sem照片中取100个微球测量直径,并计算平均直径为0.87μm。如图4(b)所示,sio2微球间接触紧密,存在较大程度的团聚。为扩大sio2微球间距离,制备出高分散度的微球,对微球接触表面进行改性。
对所制备的sio2颗粒进行成分分析,xrd图(图5)与sio2标准卡片对比,在2θ为23°左右出现非晶态的衍射峰,表明所合成的微球为无定形sio2固体颗粒。其反应机理是在氨水催化条件下,oh-浓度迅速增加,oh-直接进攻硅原子核的亲核反应,teos水解后产生的si-oh会发生基团间脱水缩合反应,形成链式聚合物后进一步交联,最后形成聚集体。
(2)改性法
对比了煅烧法及kcl改性法。
(一)煅烧法
将离心干燥后sio2微球用马弗炉900℃煅烧,升温速度5℃/min,保温3h,冷却至室温后得到样品。
(二)kcl改性法
4ml正硅酸乙酯和10ml氨水分别溶于40ml醇溶液中(甲醇:异丙醇=1:3),配制kcl溶液(1mg/ml),控制不同量加入混有氨水的醇溶液中,转速为300rpm,搅拌30min。将正硅酸乙酯醇溶液缓慢滴加进混有氨水的醇溶液中,继续反应22h,离心后水洗两次,60℃干燥后备用。
煅烧过程可以提高二氧化硅的结晶度,除去二氧化硅内部的有机物,消除内应力,使sio2微球结构收缩,球体之间的通道变宽,降低团聚程度。但是如图6(a)所示煅烧之后球状结构坍塌,熔融粘连在一起。这可能是由于sio2形成速率过快,内部有过多未完全反应的残留有机物,900℃高温下内部有机物分解,结构迅速坍塌,改变了sio2的分子间作用力使结构破坏。通过传统法制备的sio2微球经丁二酸改性后粒径没有发生变化如图6(b)所示。与传统制备法相比,粒子间的接触距离增大,团聚得到改善。其改性原理为丁二酸一端的羧酸与过氧化氢浸泡后的sio2颗粒表面的羟基发生酯化反应,通过共价键结合在sio2微球表面。溶液中过量的丁二酸会环绕在sio2微球周围,使丁二酸尽可能发生单酯化反应,另一端的羧酸暴露在sio2微球表面,从而提高了sio2颗粒表面荷电数,使其分散程度增加。
在相同制备条件下,加入氯化钾改性剂形成了单分散的sio2球状结构,通过控制kcl的加入量为3ml和4ml,分别如图7(a)、(b)所示。与未加入氯化钾的传统制备法相比,氯化钾的加入使sio2微球的粒径增大,同时随着加入量的增加粒径逐渐增大,这可能是由于氯化钾的引入加速了sio2种子的快速聚集生长。在微球的形成过程中,微球表面的羟基带负电荷会和金属离子带正电荷发生反应,在进一步的交联过程中进入微球内部或是存在于微球的表面,进入内部的钾离子具有屏蔽链电荷的作用,使得交联的si-o-si链静电斥力减小,从而加速亚微晶间的团聚成核过程。在微球表面的钾离子会增加扩散层表面的电位(ξ电位),使微球分散程度增加。
通过比较图6(a)、(b)和图7(a),可以看出三种改性法中丁二酸改性法中的sio2微球间距离最大,单分散程度最好,制备的粒径也符合预期设想。这可能是由于kcl改性法中加入的k+部分进入微球内部造成表面电荷密度减小,使其微球间斥力较小。而丁二酸改性法中丁二酸的羧基完全与微球表面反应,使表面电荷密度相对增大,同时丁二酸的空间结构大于钾离子半径也能一定程度增加微球间距离,改善使分散程度。另外,丁二酸改性法是在sio2制备好的基础上进一步改性,sio2微球粒径不会随着丁二酸的加入而发生改变,有利于控制微球粒径。
将三种改性法制备的sio2微球进行xrd分析,如图8所示。与未改性微球相比其图谱没有发生变化,改性后的微球依旧为无定形sio2固体颗粒。
(3)浸渍浓度
通过真空干燥法浸渍丁二酸改性后的sio2微球在载玻片上,控制分散液的sio2质量分数分别为1%、2%、3%和4%,其形貌如图9所示。从图中可以看出sio2微球在载玻片上浸渍后,形成了多层紧密堆积结构。这可能是由于载玻片在浓硫酸和过氧化氢溶液中浸泡后,其表面羟基化增加了亲水能力,形成了自组装层。将载玻垂直置于丁二酸改性sio2分散液中后,载玻片上的羟基会和丁二酸改性后sio2表面残留的羧基发生反应,通过共价键结合形成结构稳定的单层铺展sio2微球结构。同时由于sio2微球间的相互作用力会在部分区域形成多层排列结构。
如图9(a)所示,1wt.%条件下sio2在载玻片上浸渍过程中胶体溶液的浓度过低在玻璃片上分散度好仅形成条带状样貌。图9(b)所示,2wt.%条件下sio2在载玻片上形成了一到两层的紧密结构,通过扫描图中视野范围内的sio2个数,得到大致的密度为3.73×106个/mm2。同时随着分散液浓度增加如图9(c)、(d)所示,sio2微球更倾向于浸渍在载玻片上,而非增加排列层数,微球间相互作用力仅能使微球排列两到三层。为获得单层铺展的免疫磁珠材料选取质量分数为2%的sio2分散液浓度作为刻蚀模板。该浸渍条件为室温静置,浸渍后的sio2球型结构完整,未出现结构塌陷和破损的现象,实验结果符合预期的设想。
(4)多孔pvdf形貌
对比了真空干燥法。
真空干燥法:制备好的样品放置在平底托杯中,将2gpvdf粉末溶解在10ml二甲基亚砜(dmso)中,搅拌均匀,加入至平底托杯中,60℃真空干燥12h。最后用hf溶液刻蚀24h得到膜材料。
通过两种方法制备的pvdf/sio2复合材料其形貌如图10所示。将pvdf溶解在dmso中,聚合物流体通过微球间的毛细管作用可以完全填充进微球间空隙通道形成连续结构。图10(a)中,真空干燥法中溶剂挥发快,膜的表面粗糙度增加,同时膜的形成改变了sio2原有的组装结构,部分sio2微球被pvdf完全包覆。图10(b)中pvdf通过涂敷烘箱干燥后形成光滑致密皮层,膜厚度较薄在电镜图中能够观察到下面的sio2微球,在该条件下能够保持sio2微球原有的浸渍结构。
多孔表面的疏水程度可以根据杨氏方程cosθ’=rcosθ计算,θ’为粗糙面的表观接触角,θ为光滑面接触角,r代表粗糙度。由于r总是大于1,光滑表面的疏水性最弱,因此通过真空干燥法制备的pvdf膜的疏水性大于烘箱干燥法,较低的疏水性可以降低pvdf膜对于蛋白质的吸附程度,增加其在血清中提取蛋白质时的抗污染能力。
将sio2通过氢氟酸刻蚀后,真空干燥法中仍然有大量sio2微球存在,如图11(a)和(b)所示,即使sio2未被pvdf膜包裹或者pvdf膜出现裂口,也未能将二氧化硅进行完全刻蚀,这可能是由于氢氟酸的刻蚀条件不合适造成的。在烘箱干燥法中如图11(c)和(d)所示,表面涂敷pvdf形成薄膜后通过水相分离法分离载玻片上的pvdf膜,使sio2微球暴露在膜表面,延长刻蚀时间为5天,形成了表面孔洞,表层下仍然具有部分sio2微球的三维膜结构。
当sio2微球被刻蚀留下孔洞后,空气被困在固体和液体之间的空隙中,形成复合界面,用cassie-baxter模型来描述其润湿行为,其计算公式为cosθ’=f1cosθ-f2,其中θ’为粗糙面的表观接触角,θ为光滑面接触角,f1和f2分别代表固液、液气界面区域对应的覆盖度,理论上f2会随孔径d成线性变化,f1随孔径的增大而减小,因此接触角会随着孔隙直径的增大而增强,疏水性增强。制备的多孔pvdf膜表面的微孔和周围的平滑致密区域就可以形成具有疏水能力差的微观结构,为免疫磁珠的组装提供驱动力。
(5)多孔pvdf模板几何约束免疫磁珠复合材料的形貌
当免疫磁珠悬浮液的浓度足够高时,模板填满免疫磁珠的最大数量由几何约束图形和直径比所决定。通过pvdf孔状结构的导向作用,从图12可以看出疏水pvdf膜上排列出了单层,分散性好的免疫磁珠。在pvdf膜上所有视野范围内未见孔状结构,磁珠对孔隙的利用率可达约100%。当孔径d小于免疫磁珠的直径d时,会形成在表面突出的立体结构,同时保证每个孔只被一个免疫磁珠占据,可以有效防止pvdf膜对免疫磁珠在抓取蛋白时的遮蔽作用,同时又最大限度的提高比表面积。免疫磁珠在膜上的定向排列,可以使偶合的抗原具有方向性,遮蔽的部分官能团可以提高抗体偶合密度。露出的光滑pvdf表面疏水能力较弱,可以减少对蛋白质的特异性吸附,增强其抗污染能力。
pvdf模板辅助自组装免疫磁珠间的相互作用是多方面的。在旋转组装免疫磁珠过程中,由于pvdf膜的去湿作用,毛细管力足够大能把免疫磁珠推入模板孔洞,同时重力驱动的沉积作用,以及孔洞尖端与微球之间的范德华力强相互作用和布朗运动的多重力推动下使其按照模板图案进行排列。同时根据wenzel公式,粗糙表面的自由能是光滑表面的r倍,免疫磁珠在组装时更倾向于降低表面自由能而填充孔洞,使其在pvdf膜表面形成按照孔洞结构排列的单分散免疫磁珠复合材料。
从扫描图11(d)和图12(b)可以看出分散在pvdf模板上的免疫磁珠的数量略多于孔的数量,kralchevsky等人证明了微球部分浸入水平固体衬底上的液体层时,由于旋转孵育过程中引起的液-气界面变形,产生了强而远距离的粒子间相互作用,这种引力可能是毛细管相互作用的结果。这种粒子间的相互作用使孔洞被填充完之后也能一定程度上在pvdf表面进行自发排列,提高了pvdf膜上的负载量。
4、c肽定量
准确称取500μl血清样品,按免疫法测得的c肽浓度加入等质量c肽标记物,准确称量、混匀;加入50μl磁珠-抗体复合物,室温下混匀一小时,结合了目标物的磁珠以1mltbst(含0.05%吐温20的tbs缓冲液)洗涤三次,再用1mltbs洗涤一次,以此减少非特异性结合,降低背景干扰;最后用100μl0.1%三氟乙酸水溶液将磁珠上结合的c肽收集下来,上机检测。准确称量c肽纯品,加入dmso溶解后用去离子水稀释,将制备好的模板分散免疫磁珠复合材料和未模板分散的免疫磁珠分别与抗体偶合,提取c肽。
液相色谱条件:色谱柱:shiseidocapcellpakc18柱(1.5mm×150mm×5.0μm);柱温:室温;进样体积:10μl;流速:0.2ml/min;流动相:a为0.1%甲酸的超纯水,b为0.1%甲酸的乙腈;质谱条件:多反应收集模式(mrm),正离子模式,c肽检测离子对m/z=1007.7>147.1,出口电压156v,碰撞能20ev。使用仪器agilent6410-qqqlc-ms/ms。
添加了同位素标记c肽的血清样本经磁珠富集后的mrm图谱如图13所示,图片上方是同位素标记的c肽色谱图,下方是血清中的天然c肽色谱图,两种物质的保留时间一致,根据二者的峰面积进行定量。
用浓度约0.05μg/g的c肽校准溶液,经过磁珠富集后进行线性范围的考察,结果表明在柱上样品量为0.3-10.0ng的范围内,该方法线性关系较好,相关系数r2为0.9946(图14(a));以10倍信噪比作为该方法的定量限,计算得出定量限为0.3ng(柱上);同时考察了当c肽和同位素标记c肽的质量比在0.2-4.0的范围内时(比值为0.2的点对应的c肽柱上含量约为0.3ng),线性关系良好,相关系数r2为0.9995(图14(b))。
该方法中最后c肽的剥离浓度由加入的三氟乙酸决定,可以在最大程度上达到对c肽的富集。在三氟乙酸的加入体积为80μl时,此方法在c肽浓度低于2.5ng/ml的情况下无法准确定量,需要进一步提高方法的检测限和定量限。
5、复合材料性能评价
收集未使用模板分散的免疫磁珠富集提取的c肽和上清液进行质谱分析,在上清液中仍然检测到c肽的存在,如图15所示。在c肽提取过程中洗脱液为100μl,上清液的缓冲液体积为500μl,根据其与样品中的峰面积响应比值推算浓度比值约为1:1.3,缓冲液中有大量的c肽没有被提取出来。虽然加入c肽的标记物可以在一定程度上校准实验误差,但是血清中c肽浓度很低,正常范围为0.5~10ng/ml,过大的损失会失去定量的意义,同时对检测方法的灵敏度有更高的要求。
当c肽实际浓度1.09ng/g时,在未使用模板分散磁珠提取的样品中没有信号,但是使用模板分散磁珠提取的样品的信号稳定,如图16(a)所示。在pvdf模板分散免疫磁珠复合材料提取c肽后,柱上理论样品量为0.05~0.5ng范围内线性关系良好,相关系数r2为0.99951,如图16(b)所示。在对其上清液进行检测后没有出现c肽的响应信号,可见磁珠结构的优化确实能提高对c肽的提取效率。同时在使用结构优化磁珠样品时,磁珠的加入量约为未优化磁珠加入量的五十分之一,大大减少了磁珠的用量和抗体的添加量。pvdf模板分散后的免疫磁珠在不衍生化条件下,在三氟乙酸的加入体积为100μl,上样体积为20μl时就能满足对正常人血清c肽浓度(0.5~10ng/ml)进行定量的要求,如果减少洗脱体积和使用更高灵敏度的质谱仪器,其定量限和检测限将会进一步降低。
pvdf模板分散免疫磁珠复合材料在提取c肽时能够发挥优势,可能的原因为磁珠在与抗体进行偶合后,由于磁珠的位点固定,其抗体的结合具有方向性,同时部分官能团被遮挡,可以提高抗体的表观结合密度。同时pvdf对于抗体也具有强烈的吸引力,能够提升抗体的偶合效率。在对磁珠进行官能团封闭时,pvdf表面未结合免疫磁珠部分表面光滑,疏水能力弱,加入过量的bsa后,pvdf膜上吸附bsa,也能达到封闭作用,减少实验过程中的非特异性结合。在对血清样品中高丰度蛋白进行去除后,pvdf膜的高比表面积增加了抗体和c肽的结合几率,通过三氟乙酸洗脱后,可以将与抗体结合的c肽洗脱下来,提高富集效率,从而显著提高方法的定量限。
以上所述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!