单细胞萃取电喷雾质谱分析系统和方法与流程
本发明涉及仪器检测和分析领域。具体地,本发明涉及单细胞萃取电喷雾质谱分析系统和方法。
背景技术:
目前,单细胞分析得到越来越多的重视。在生物医学领域,如基因分析、药物研发、组织形成、癌症机理、疾病治疗等方面需要对单细胞进行分析。在传统的细胞生物学研究中,人们以群体细胞作为研究对象,已经探索出了许多疾病的致病机制和治疗方法。然而随着生命科学的发展,研究者们开始逐渐意识到单个细胞之间也存在着差异,这种差异被称作“单细胞的异质性”,它在许多生命过程中扮演着至关重要的角色。在癌症的临床治疗中,一群癌细胞在经过抗癌药物的作用后,会有极少量的癌细胞意外地存活了下来,逐渐成为强大的耐药癌细胞,使后续的化疗以失败而告终。除了癌细胞耐药这一生命过程以外,单细胞的异质性在干细胞的分化中也表现得尤为明显。一群干细胞会向着不同的方向分化,从而形成生命体中不同的组织和器官。这些实际的生物现象表明,看似相同的一群细胞,其实彼此之间是存在差异的,而探索这样的差异正是破解生命奥秘的关键。传统的检测方法只能针对群体细胞进行检测,由此获得的平均化的检测结果会将单细胞之间的异质性掩盖,使得这些重要的生命过程难以被深入研究。因此,为了阐明这些与生物发育、疾病治疗息息相关的重大生命问题,以单细胞作为研究对象,致力于发展针对单个细胞的研究方法是至关重要的。
荧光显微成像仪器结合荧光探针技术是目前单细胞分析与成像的主要技术手段,已有多种荧光显微成像技术用于单细胞成像。常用的荧光探针有荧光小分子探针、荧光纳米探针和荧光蛋白探针等,在流式细胞检测、亚细胞区域定位、细胞中蛋白、基因、小分子代谢物的分析以及细胞动态行为研究等方面获得了广泛的应用。但是,荧光成像技术在细胞分析中存在两个局限:一是需要有明确的识别对象,据此方可设计对该目标分子有选择性响应的荧光探针,不适于细胞中未知成分的分析;二是受到分子光谱谱带宽度的限制,能够同时测定的组分数目有限,难以进行细胞中多组分分子的同时分析。鉴于细胞中发生的生物过程常常是多种分子协同作用的结果,因此,发展新的单细胞分析方法,最大限度地满足细胞中多组分的同时分析的需求,并能够对细胞事件中的未知成分进行快速定性和精准定量分析,是单细胞生物学研究对分析化学的迫切需求。
利用质谱单细胞分析仪器系统将会具备解决上述两个问题的潜力。首先,质谱是一种多组分同时分析的仪器,依据细胞中各种成分的分子量不同,在质谱中能够形成按照质量数排列的谱峰,进一步通过多级质谱分析,即可获得细胞中各种成分的分子信息,实现多组分的同时分析。由于质谱法无需标记,不需要事先获知待测分子的信息,因此,能够对细胞中各种未知成分进行快速鉴定,获得细胞中蛋白质乃至小分子代谢物的“组学”信息。此外,质谱能够容易地获得各组分分子的同位素信息,采用同位素内标和稀释技术,可以实现细胞中各种待测分子的精准定量,因此,质谱单细胞分析最近受到高度重视,被认为在单细胞的“组学”分析研究中将会发挥重要的作用。
目前基于电喷雾质谱的单细胞分析方法可以分成两类。第一类是使用分离手段对样品进行预处理后再进行电喷雾质谱分析的方法。其中最为著名的是美国sweedler课题组建立的毛细管电泳-电喷雾质谱(ce-esi)联用的单细胞分析方法。研究者通过复杂的手术操作将加州海兔的单个神经元剥离,使用电解液萃取后进行毛细管电泳分离,随后使用电喷雾质谱检测。这类方法的优点在于利用了不同物质在毛细管电泳中的保留时间差异,可以对细胞内的众多代谢物进行分离,减少组分间的干扰。然而,由于毛细管电泳必须使用的微升量级电解液会不可避免地对单细胞组分进行过多的稀释,因此该方法只能用于诸如加州海兔神经元这样的物质含量多的大体积细胞,目前还无法应用于人类癌细胞(直径约10微米,体积约为1皮升)的研究。第二类是样品不经过预处理,直接使用纳喷针或金属针采样后进行电喷雾质谱分析。日本的masujima课题组将玻璃毛细管拉制成纳喷针,刺入单个大鼠细胞中,直接吸取细胞质后进行纳升电喷雾分析。清华大学也建立了基于探针电喷雾离子源的单细胞分析方法,将一根尖锐的钨针插入单个洋葱细胞中进行采样,随后在钨针上施加高压电并润湿针尖后,即可产生电喷雾,实现单细胞的代谢物分析。这类方法由于使用尖端直径为1-3微米的采样针对未经稀释的样品直接取样,因此可以实现单细胞水平和亚细胞水平的代谢物检测。然而,它们依赖于研究者手工控制细小的采样针,操作难度大,稳定性不足。并且由于细胞质非常粘稠、组分繁多,其中包含了诸如蛋白质、脂质、核苷酸、无机盐等在内的多种物质,直接采样的方法难以去除不同组分之间的相互干扰,进而影响对目标组分的检测。
因此,目前利用质谱分析技术检测单细胞仍有待改进。
技术实现要素:
本发明旨在至少在一定程度上解决现有技术中存在的技术问题至少之一。为此,本发明提出了单细胞质谱分析系统,其实现了单细胞的高精密度、高速度、高重复度和高自动化的质谱检测分析,分析量可达皮升级。同时,可以克服手工操作过程中固有的缺点,使质谱单细胞分析摆脱对操作人员的依赖,过程更加规范,使用更加简便,分析更加精准,结果更加可靠。
在本发明的一个方面,本发明提出了一种单细胞质谱分析系统。根据本发明的实施例,所述单细胞质谱分析系统包括:顺次设置的第一微动台、显微镜、第二微动台、第一图像采集部件及质谱仪;其中,所述显微镜的载物台上设置有细胞定位芯片;所述第一微动台上设置有加液针,适于向所述细胞定位芯片上加入萃取液;所述第二微动台上设置有取液针,适于从所述细胞定位芯片上吸取经所述萃取液萃取所得到的萃取物并送至所述质谱仪中。
通过移动第一微动台和第二微动台以控制加液针和取液针的位置,以便将萃取液由加液针滴加至细胞定位芯片上,并由取液针吸取经萃取所得到的萃取物,利用第一图像采集部件观察取液针的位置,以便将电喷雾产物送至质谱仪进行质谱检测。由此,根据本发明实施例的单细胞质谱分析系统实现了单细胞的高精密度、高速度、高重复度和高自动化的质谱检测分析,分析量可达皮升级。同时,可以克服手工操作过程中固有的缺点,使质谱单细胞分析摆脱对操作人员的依赖,过程更加规范,使用更加简便,分析更加精准,结果更加可靠。
根据本发明的实施例,所述单细胞质谱分析系统还可以具有下列附加技术特征:
根据本发明的实施例,所述第一微动台包括:第一固定件,所述第一固定件固设于所述第一微动台上;第一连接杆,所述第一连接杆的一端可拆卸地固定于所述第一固定件上;第一夹持器,所述第一夹持器的一端与所述第一连接杆的另一端可拆卸地相连;加液针,所述加液针的尾端与所述第一夹持器的另一端可拆卸地相连,所述加液针头端朝向所述细胞定位芯片的上表面。
根据本发明的实施例,所述第二微动台包括:旋转电机,所述旋转电机固定于所述第二微动台上;第二固定件,所述第二固定件固定于所述旋转电机上;第二连接杆,所述第二连接杆的一端可拆卸地固定于所述第二固定件上;压电换能器,所述压电换能器的一端与所述第二连接杆的另一端可拆卸地相连;第二夹持器,所述第二夹持器的一端与所述压电换能器的振动面可拆卸地相连,所述第二夹持器内设置有电极;取液针,所述取液针的尾端与所述第二夹持器的另一端可拆卸地相连,且所述第二夹持器内的电极插入所述取液针的空腔内,所述取液针的头端朝向所述细胞定位芯片的上表面。
根据本发明的实施例,所述第二夹持器内部形成有空腔,电极沿轴向固定于所述空腔内;所述第二夹持器的侧壁上开设有旁路通道,所述旁路通道与气压软管气密连接,所述取液针与所述第二夹持器的另一端气密连接,适于使所述气压软管、旁路通道以及取液针内腔形成一个气体通路;除了不含有电极以外,所述第一夹持器与第二夹持器结构的相同。
根据本发明的实施例,所述取液针呈圆锥状,头端呈尖状,尾端与所述第二夹持器相连。
根据本发明的实施例,所述加液针呈圆柱形或圆锥形。
根据本发明的实施例,所述加液针的头端内径为12~18微米,锥角不大于5°,所述取液针的头端内径为2~3微米,锥角为12~18°。
根据本发明的实施例,所述电极中距离所述取液针头端最近的一端与所述取液针头端之间的距离为0.5~1.5cm。
根据本发明的实施例,所述第一图像采集部件选自双目视觉相机。
根据本发明的实施例,所述显微镜的载物台的一侧表面设置有细胞定位芯片,所述载物台远离所述细胞定位芯片的一侧下部设置有第二图像采集部件及光学成像系统,所述第二图像采集部件可观察所述细胞定位芯片、加液针和取液针呈现在所述光学成像系统中的像。
根据本发明的实施例,所述细胞定位芯片包括:基底;电极层,所述电极层设置于所述基底表面;捕获层,所述捕获层设置于所述电极层表面,且所述捕获层表面设置有多个捕获孔,所述捕获孔贯穿所述捕获层;储液容器,所述储液容器可拆卸地设置于所述捕获层表面,所述储液容器内部形成有容纳腔室,所述容纳腔室底部设置有与所述捕获孔相连通且一一对应的通孔。
根据本发明的实施例,所述储液容器进一步含有盖体,所述盖体上设置有进液孔和出液孔,适于向所述容纳腔室中注入细胞悬液及将培养液排出。
根据本发明的实施例,所述捕获孔的孔径为20~30微米。
根据本发明的实施例,所述系统进一步包括:微动台控制器,所述微动台控制器分别与所述第一微动台和第二微动台相连;载物台控制器,所述载物台控制器与所述载物台相连;信号发生器,所述信号发生器与所述压电换能器相连;气压泵,所述气压泵分别与所述第一夹持器和第二夹持器的气压软管相连;总控制器,所述总控制器分别与所述微动台控制器、载物台控制器、信号发生器、气压泵、旋转电机、第一图像采集部件、第二图像采集部件、光学成像系统和细胞定位芯片相连。
在本发明的另一方面,本发明提出了一种采用前面所述系统实施单细胞质谱分析的方法。根据本发明的实施例,所述方法包括:将细胞悬液加入到细胞定位芯片上,以便捕获和定位单细胞;获得所述单细胞的位置和加液针的位置信息,并基于所述位置信息使所述加液针将萃取液加入到所述单细胞上,以便对所述单细胞进行萃取,获得萃取物;获得所述萃取物和取液针的位置信息,并基于所述位置信息使所述取液针吸取所述萃取物;基于所述第一图像采集部件确定所述取液针的位置,使所述取液针运动至所述质谱仪的进样口,使所述萃取物进入所述质谱仪中,以便进行质谱分析。由此,根据本发明实施例的方法能够实现单细胞的高精密度、高速度、高重复度和高自动化的质谱检测分析,分析量可达皮升级。同时,可以克服手工操作过程中固有的缺点,使质谱单细胞分析摆脱对操作人员的依赖,过程更加规范,使用更加简便,分析更加精准,结果更加可靠。
根据本发明的实施例,通过下列方法确定所述单细胞位置:将所述细胞定位芯片上所有单细胞所在的区域划分为若干个与所述第二图像采集部件相当的单元格,利用所述第二图像采集部件对每个所述单元格进行图像采集,并识别出每个细胞在相应的单元格内的坐标,沿着规划的扫描路径逐一得到每个所述单元格相对所述载物台的坐标并解算出目标细胞的绝对坐标。
根据本发明的实施例,通过下列方法对所述加液针和取液针进行定位:观察所述加液针的头端及取液针头端的现有位置和目标位置的坐标差,以驱动所述加液针和取液针运动,并通过算法在每个采集数据周期后进行反馈以调整所述加样针或取液针运动的位置及速度,从而对所述加液针和取液针进行定位。
根据本发明的实施例,进入所述质谱仪中的萃取物体积是通过下列方式获得的:向所述捕获孔中加入萃取液后观察形成的液滴体积,随着所述液滴不断蒸发,当所述液体的体积小于阈值后使所述取液针吸取全部所述液滴,其中,所述液滴体积是基于液滴与捕获孔的接触角以及液滴的直径而换算得到的。
根据本发明的实施例,当所述加液针与所述捕获孔刚好接触时,加入所述萃取液,其中,当所述加液针与所述捕获孔接触时接触面将形成圆形状压痕,所述圆形状压痕的直径超过阈值是所述加液针与所述捕获孔刚好接触的指示。
根据本发明的实施例,所述捕获层的材料比玻璃硬度低、弹性高。
根据本发明的实施例,当所述取液针与所述液滴刚好接触时,吸取全部所述液滴,其中,所述取液针与所述液滴刚好接触是通过下列方式确定的:开启所述信号发生器产生电压信号以驱动所述压电换能器产生机械振动,所述取液针朝向所述液滴运动,在所述液滴表面产生波纹是所述取液针与所述液滴刚好接触的指示。
根据本发明的实施例,所述取液针携带萃取物移动至距离所述质谱仪的进样口0.3~1.5厘米时,停止移动。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
图1显示了根据本发明一个实施例的单细胞质谱分析系统的结构示意图;
图2显示了根据本发明另一个实施例的单细胞质谱分析系统的结构示意图;
图3显示了根据本发明一个实施例的第二夹持器的结构示意图;
图4显示了根据本发明一个实施例的加液针和取液针的形态显微照片;
图5显示了根据本发明一个实施例的细胞芯片结构、内部电场仿真与单细胞捕获流程的示意图;
图6显示了根据本发明一个实施例的实施单细胞质谱分析的方法的流程示意图;
图7显示了根据本发明一个实施例的大范围细胞扫描定位的区域划分与扫描路径的示意图;
图8显示了根据本发明一个实施例的加液针206xy定位和取液针506xy定位的工作流程图;
图9显示了根据本发明一个实施例的取液针或加液针的针尖图像识别结果图;
图10显示了根据本发明一个实施例的萃取液体积控制的工作流程图;
图11显示了根据本发明一个实施例的1101萃取液液滴轮廓图像识别结果图;
图12显示了根据本发明一个实施例的萃取液液滴体积计算模型示意图;
图13显示了根据本发明一个实施例的利用针尖压痕进行加液针206z定位示意图;
图14显示了根据本发明一个实施例的利用压电换能器509在液滴表面产生波纹进行取液针509z定位示意图;
图15显示了根据本发明一个实施例的从原始图像生成灰度共生矩阵的算法示意图;
图16显示了根据本发明一个实施例的利用灰度共生矩阵识别液滴表面波纹结果图;
图17显示了根据本发明另一个实施例的实施单细胞质谱分析的方法的流程示意图;
图18显示了根据本发明一个实施例的自动化控制软件界面图;
图19显示了根据本发明一个实施例的对于单细胞磷脂萃取物分析的质谱图。
具体实施方式
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
需要说明的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。进一步地,在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
在本发明的描述中,需要理解的是,术语“底部”、“表面”、“上部”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性。
在本发明的描述中,需要说明的是,除非另有明确的规定和限定,术语“连接”、“连通”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。
本发明提出了单细胞质谱分析系统及利用其进行单细胞质谱分析的方法,下面将分别对其进行详细描述。
单细胞质谱分析系统
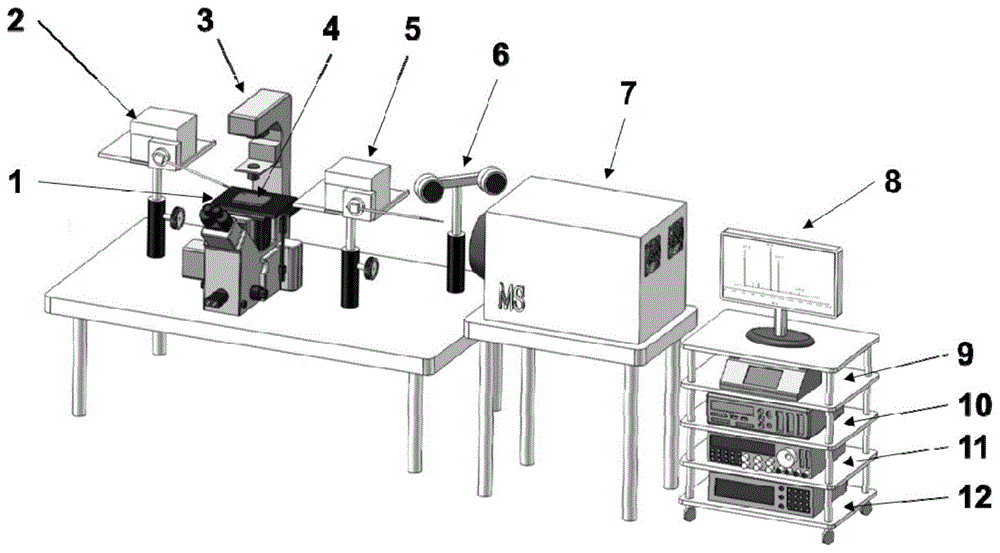
在本发明的一个方面,本发明提出了一种单细胞质谱分析系统。根据本发明的实施例,参见图1,该单细胞质谱分析系统包括:顺次设置的第一微动台2、显微镜3、第二微动台5、第一图像采集部件6及质谱仪7,其中,显微镜3的载物台1上设置有细胞定位芯片4,参见图2,第一微动台2上设置有加液针206,适于向细胞定位芯片上加入萃取液;第二微动台5上设置有取液针207,适于从细胞定位芯片上吸取经萃取液萃取所得到的萃取物并对萃取物进行电喷雾。
通过移动第一微动台在x轴(左右)、y轴(上下)、z轴(前后)方向移动,以便控制其上设置的加液针准确地将萃取液滴加至细胞定位芯片上,通过移动第二微动台在x轴、y轴和z轴方向移动,以便控制其上设置的取液针将经萃取的萃取物吸出,再利用第一图像采集部件观察取液针,以便将其对准质谱仪的进样口。由此,根据本发明实施例的单细胞质谱分析系统实现了高精密度、高速度、高重复度和高自动化的单细胞样本制备、萃取取样和质谱仪皮升级电喷雾进样。同时,可以克服手工操作过程中固有的缺点,使质谱单细胞分析技术摆脱对操作人员的依赖,过程更加规范,使用更加简便,分析更加精准,结果更加可靠。
根据本发明的实施例,参见图2,第一微动2包括:第一固定件203,第一固定件203固设于第一微动台2上;第一连接杆204,第一连接杆204的一端可拆卸地固定于第一固定件203上;第一夹持器205,第一夹持器205的一端与第一连接杆204的另一端可拆卸地相连;加液针206,加液针206的尾端与第一夹持器205的另一端可拆卸地相连,加液针206头端朝向细胞定位芯片的上表面。
第一微动台2上与第一固定件203固定连接的位置可以相对于细胞定位芯片沿x轴、y轴和z轴方向运动,从而带动第一固定件203运动,并在第一连接杆的带动下以便准确将加液针206定位于细胞定位芯片上方,实现准确滴加萃取液的目的。第一夹持器可拆卸地夹持着加液针的尾端,以方便不工作时可取下加液针并清洗。
根据本发明的实施例,第二微动台5包括:旋转电机510,旋转电机510固定于第二微动台5上;第二固定件503,第二固定件503固定于旋转电机510上;第二连接杆504,第二连接杆504的一端可拆卸地固定于第二固定件503上;压电换能器509,压电换能器509的一端与第二连接杆504的另一端可拆卸地相连;第二夹持器505,第二夹持器505的一端与压电换能器509的振动面可拆卸地相连,第二夹持器内设置有电极508;取液针506,取液针506的尾端与第二夹持器505的另一端可拆卸地相连,且第二夹持器505内的电极508插入取液针506的空腔内,取液针506的头端朝向细胞定位芯片的上表面。
旋转电机的设置以便于取液针吸取萃取物后可以旋转至质谱仪的进样口处。压电换能器及第二夹持器中电极的设置可以使得取液针发生机械振动,该机械振动可以在第二图像采集部件视场中观察到波纹,当取液针与细胞定位芯片上的萃取物发生接触时,可以带动萃取物的液面产生波纹,从而可以实现取液针准确定位的目的。第二夹持器内设置有电极,通过导线向所述电极施加高压直流电压,使所述萃取物溶液发生电喷雾,实现对所单细胞萃取物的离子化,以便后续质谱分析。
根据本发明的实施例,电极中距离取液针头端最近的一端与取液针头端之间的距离为0.5~1.5cm。由此,避免电极与萃取物溶液发生接触,实现非接触电喷雾。具体地,电极工作时的高压直流电压幅值为1~2kv,正负均可。
根据本发明的实施例,参见图3,第二夹持器505内部形成有空腔,电极508沿轴向固定于空腔内;第二夹持器505的侧壁上开设有旁路通501,旁路通道501与气压软管502气密连接,取液针505与第二夹持器505的另一端气密连接,适于使气压软管502、旁路通道501以及取液针505内腔形成一个气体通路;除了不含有电极以外,第一夹持器205与第二夹持器505结构的相同。由此,可以通过按压和松开气压软管以便产生负压,实现吸取萃取液的目的,再按压气压软管,以便将萃取液排出,例如加至细胞定位芯片上。
根据本发明的实施例,参见图4,取液针506呈圆锥状,头端呈尖状,尾端与所述第二夹持器相连。根据本发明的另一实施例,取液针的头端内径为2~3微米(即取液针尖端出液孔的孔径),锥角β为12~18°。由此,以便于准确且完全地将萃取物从细胞定位芯片上吸取出来。
根据本发明的实施例,参见图4,加液针206呈圆柱形或圆锥形。根据本发明的另一实施例,加液针的尖端内径为12~18微米(即加液针尖端出液孔的孔径),锥角α不大于5°。由此,以便起到准确定位及实现准确放出萃取液的目的。
根据本发明的实施例,第一图像采集部件选自双目视觉相机。由此,以便准确观察取液针头部的位置,以便对准质谱仪的进样口。
根据本发明的实施例,参见图2,显微镜3的载物台1的一侧表面设置有细胞定位芯片4,载物台1远离细胞定位芯片4的一侧下部设置有第二图像采集部件201及光学成像系统202,第二图像采集部件201可观察细胞定位芯片4呈现在光学成像系统202中的像。由此,以便实现准确观察及定位的目的。
根据本发明的实施例,参见图5,细胞定位芯片4包括:基底410;电极层420,电极层420设置于基底410表面;捕获层430,捕获层430设置于电极层420表面,且捕获层430表面设置有多个捕获孔431,捕获孔431贯穿捕获层430;储液容器440,储液容器440可拆卸地设置于捕获层430表面,储液容器440内部形成有容纳腔室,容纳腔室底部设置有与捕获孔431相连通且一一对应的通孔(图中未示出)。
电极层与外接电源相连后,在捕获层底部形成捕获电场,向储液容器的容纳腔室中加入细胞悬液,细胞在电极电场和重力场的双重作用下落入捕获孔中,再将细胞液倒出,以便捕获分离出单细胞。
根据本发明的实施例,储液容器440进一步含有盖体450,盖体450上设置有进液孔451和出液孔452,适于向容纳腔室中注入细胞悬液及将培养液排出。由此,以便于减少细胞与外界接触。
根据本发明的实施例,捕获孔431的孔径为20~30微米。发明人发现,捕获孔的直径越小,单细胞分离能力越强,但是其细胞捕获效率受限;反之,捕获孔直径越大,虽然细胞捕获效率得以提升,但是单个捕获孔中通常出现多细胞干扰。进而,发明人经过缜密的实验设计获得了上述较佳的捕获孔孔径,由此,可以高效分离出单细胞。
根据本发明的实施例,参见图1,该系统进一步包括:微动台控制12,微动台控制器12分别与第一微动台2和第二微动台5相连。由此,以便控制第一/第二微动台沿x轴、y轴和z轴方向移动,从而带动加液针向细胞定位芯片移动以便于加入萃取液,以及带动取液针向细胞定位芯片移动以便于吸取出萃取物以及送至质谱仪进样口处。
根据本发明的实施例,参见图1,该系统进一步包括:载物台控制器9,载物台控制器9与载物台1相连。由此,通过调节载物台控制器以便于第二图像采集部件能够清晰地观察到细胞定位芯片在光学成像系统中的成像。
根据本发明的实施例,参见图1,该系统进一步包括:信号发生器11,信号发生器11与压电换能器509相连。信号发生器能够发生电压信号驱动压电换能器,使压电换能器产生周期性机械振动,该机械振动带动取液针产生振动,可以在显微镜视场中观察到波纹,当取液针与细胞定位芯片上的萃取液发生接触时,可以带动萃取液的液面产生波纹,从而实现取液针准确定位的目的。
根据本发明的实施例,参见图1,该系统进一步包括:气压泵10,气压泵10与第一夹持器205和第二夹持器505的气压软管相连。由此,以便于实现加液针和取液针吸液和放液。
根据本发明的实施例,参见图1,该系统进一步包括:总控制器8,总控制器8分别与微动台控制器12、载物台控制器9、信号发生器11、气压泵10、旋转电机510、第一图像采集部件6、第二图像采集部件301、光学成像系统302和细胞定位芯片4相连。由此,以便于摆脱对操作人员的依赖,实现自动化控制,从而实现高精密度、高速度、高重复和搞自动化分析。
采用单细胞质谱分析系统实施单细胞质谱分析的方法
在本发明的另一方面,本发明提出了一种采用前面所述系统实施单细胞质谱分析的方法。根据本发明的实施例,参见图6,该方法包括:
s100将细胞悬液加入到细胞定位芯片上,以便捕获和定位单细胞
在该步骤中,将细胞悬液加入到细胞定位芯片上,以便捕获和定位单细胞。将细胞悬液加入到细胞定位芯片上,在电极电场及重力双作用下能够使得单细胞落入捕获孔中,从而实现捕获和定位单细胞的作用。
根据本发明的实施例,通过下列方法确定单细胞位置:将细胞定位芯片上所有单细胞所在的区域划分为若干个与第二图像采集部件相当的单元格,利用第二图像采集部件对每个单元格进行图像采集,并识别出每个细胞在相应的单元格内的坐标,沿着规划的扫描路径逐一得到每个单元格相对载物台的坐标并解算出目标细胞的绝对坐标。
为了对大范围、数量众多的细胞进行识别及筛选,手动操作时需要反复地移动显微镜载物台使第二图像采集部件(例如相机)视野外的细胞进入到视野内,也无法记忆各细胞坐标。如图7所示,根据本发明实施例的方法将大范围区域划分为若干个与相机视野相当(每个区域的面积为相机视野的1倍)的单元格,对每个单元格利用相机进行拍摄并识别出细胞在本单元格内的坐标,沿着规划的扫描路径逐一得到单元格相对显微镜载物台的坐标并解算出目标细胞的绝对坐标。
在一些实施例中,该方法可以适用于荧光成像、明场/暗场成像,对细胞进行图像识别时可依据单通道或多通道图像。在另一些实施例中,定义电动载物台的左下顶点为地图扫描的起始点。根据本发明实施例的方法完成目标识别后,会自动将所有目标的坐标存储下来。在一些实施例中,细胞识别完成后,系统会自动将第一个目标细胞置于屏幕视野的中心位置。
s200使加液针将萃取液加入到单细胞上,以便对单细胞进行萃取,获得萃取物
在该步骤中,获得单细胞的位置和加液针的位置信息,并基于位置信息使加液针将萃取液加入到单细胞上,以便对单细胞进行萃取,获得萃取物。移动电动载物台,对阵列化的单细胞目标位置进行显微扫描,从图像中定位细胞的位置。通过图像处理算法获得加液针头端(针尖)的空间位置关系,进行加液针xyz定位,从而使得加液针准确地将萃取液加入到捕获孔中的单细胞上。
根据本发明的实施例,通过下列方法对加液针和取液针进行定位:观察加液针的头端及取液针头端的现有位置和目标位置的坐标差,以驱动加液针和取液针运动,并通过算法在每个采集数据周期后进行反馈以调整加样针或取液针运动的位置及速度,从而对加液针和取液针进行定位。
由于系统运动部件第一微动台2(第二微动台5)和末端执行器加液针206(取液针506)之间的连接存在不可避免的微小随机相对移动,为了自动化控制加液针和取液针移动到图像坐标系xc-yc中的任意位置,本发明采用了基于图像的视觉伺服针尖控制方法,该方法利用机器视觉跟踪针尖的现有位置与目标位置的坐标差来驱动系统运动部件移动,并通过算法在每个采样周期后不断进行反馈调整,从而实现了针尖xy方向定位。
本发明工作流程如图8所示,利用pid控制方法实现了简单稳定的反馈控制,其输出表达式为:
其中,kp、ki、kd分别为比例、积分和微分增益,ts为取样时间,e(t)为误差。恰当地调节kp、ki、kd就可以实现无差控制。
902微针图像识别利用了基于贝叶斯估计的运动物体提取算法得到了运动微针的二值化图像,进而得出针尖的图像坐标,识别结果如图9所示。
对于时间t时某一点的像素值x(t),为了确定像素属于背景(bg)还是前景(fg),贝叶斯决策因子r由下式确定:
假设某一点是背景还是前景的概率相同,即p(bg)=p(fg),同时假设前景物体具有均匀的分布,即p(x(t)|fg)=cfg。所以可以通过下式确定像素值是否属于背景区域:
其中cthreshold是阈值,p(x(t)|bg)是背景模型,可以通过一段时间t内的帧序列集合{x(t),...,x(t-t)}进行估计。由于场景中光照条件稳定且背景固定,那么某一点处的像素值会比较稳定,考虑到噪声的存在,使用m个高斯分布模型叠加即可比较好的估计该点像素值,对于单一像素点
其中
近似的α=1/t。对于一个新样本,它最符合的分布模型的归属因子
最后对权重进行归一化,方程如下:
算法识别运动到场景中的物体(本发明中是微针)得到的二值化结果如图9(b),进而识别出针尖在当前图像中的坐标并反馈到pid控制方法中。
s300使取液针吸取萃取物
在该步骤中,获得萃取物和取液针的位置信息,并基于位置信息使取液针吸取萃取物。通过图像处理算法获得取液针头端(针尖)的空间位置关系,进行取液针xyz定位,从而使得取液针准确地将萃取物吸出。
根据本发明的实施例,萃取物的体积为200-980皮升。由此,利用本发明的系统可以实现皮升级单细胞萃取物的分析,并且,结果准确性强、精密度高,不仅适用于诸如加州海兔神经元这样的物质含量多的大体积细胞,还可以应用于人类癌细胞这种物质含量少的小体积细胞。
根据本发明的实施例,进入质谱仪中的萃取物体积是通过下列方式获得的:向捕获孔中加入萃取液后观察形成的液滴体积,随着液滴不断蒸发,当液体的体积小于阈值后使取液针吸取全部液滴,其中,液滴体积是基于液滴与捕获孔的接触角以及液滴的直径而换算得到的。
本发明控制取样针吸取萃取液的体积,进而控制电喷雾时进入质谱仪的液体量,以满足质谱分析时的样品浓度和喷雾时间。
在萃取之前的加液过程中,本发明对所加液体的体积的精度并不做太高要求,因为目前典型的皮升级微量液体分发方式(如气泵法、微流泵法)每次得到的液体体积并不稳定。相反,本发明利用图像识别算法不断跟踪加液后形成的液滴体积,随着液滴不断蒸发,等到其体积减小到设定数值后控制取样针吸取所有液体,保证了每次电喷雾进入质谱仪的液体体积一致性。
液滴实时跟踪工作流程如图10所示,1101识别液滴轮廓利用canny算法提取边界并通过轮廓间的包络关系提取出外侧最大的液滴轮廓(如图11),利用hough圆变换拟合出液滴的直径d。如图12所示,液滴体积的计算利用到了萃取液与芯片表面的接触角δ(指在气、液、固三相交点处所作的气-液界面的切线,此切线在液体一方的与固-液交界线之间的夹角)和液滴直径d,由于液体表面张力的影响及液滴体积很小(皮升量级),因此可以认为液滴形状近似一球缺(球缺是指球体被平面截去一部分后剩余的部分。截面称为球缺的底面,垂直于截面的直径被此截面截得的线段长称为球缺的高),球缺体积公式如下:
其中r为球缺半径,h为球缺的高;
代入接触角δ和直径d,得到
根据本发明的实施例,当加液针与捕获孔刚好接触时,加入萃取液,其中,当加液针与捕获孔接触时接触面将形成圆形状压痕,圆形状压痕的直径超过阈值是加液针与捕获孔刚好接触的指示。
由于相机视野xc-yc为二维平面,故针尖的xy方向信息很容易通过平面图像观察到,而深度信息的缺乏,使得通过相机获得针尖在z方向上的高度信息变得困难。为了定位加液针206与细胞定位芯片4在z方向上的位置关系,本发明利用加液针与细胞定位芯片间接触后产生的圆环状压痕这一现象(如图13所示),通过实时图像识别是否产生压痕得到针尖与芯片刚好接触的时刻,从而实现加液针206z方向定位。
所述压痕的图像识别方法利用了902微针图像识别中的基于贝叶斯估计的运动物体提取算法,得到圆环状压痕的二值化分割图像,利用hough圆变换拟合出圆环状压痕的直径,当直径超过设定的阀值时,即判断此时刻为加液针尖与芯片取得接触。
根据本发明的实施例,捕获层的材料比玻璃硬度低、弹性高。由此,可以实现可观察的压痕。
根据本发明的实施例,当取液针与液滴刚好接触时,吸取全部液滴,其中,取液针与液滴刚好接触是通过下列方式确定的:开启信号发生器产生电压信号以驱动压电换能器产生机械振动,取液针朝向液滴运动,在液滴表面产生波纹是取液针与液滴刚好接触的指示。
为了定位取液针506与萃取液液滴在z方向上的位置关系,本发明设计的系统利用信号发生器11产生正弦电压信号驱动压电换能器509,使压电换能器509产生周期性机械振动,压电换能器509带动取液针产生振动,在压电换能器509随第二微动台5下降的过程中,当取液针接触液滴表面后,液滴在取液针振动的激励下产生可以在显微镜视场中观察到的波纹(如图14所示),此波纹在未接触前是不会产生的;因此,通过实时图像识别是否产生波纹能得到取液针刚好接触液滴的时刻,从而实现509取液针z方向定位。
正弦信号的幅值只改变针尖振动以及波纹的大小,频率则改变针尖的振动模式,从而影响波纹形态。
波纹的图像识别方法基于灰度共生矩阵的图像纹理识别技术,灰度共生矩阵能反映图像灰度关于方向、相邻间隔、变化幅度的综合信息,它是分析图像的局部模式和它们排列规则的基础。如图15所示,灰度共生矩阵用两个位置的像素的联合概率密度来定义,是有关图象亮度变化的二阶统计特征。设f(x,y)为一幅二维数字图象,其大小为m×n,灰度级别为ng,则满足一定空间关系的灰度共生矩阵可表示为:
p(i,j)=#((x1,y1),(x2,y2)∈m×n|f(x1,y1)=i,f(x2,y2)=j)
其中#(x)表示集合x中元素的个数,则灰度共生矩阵p为ng×ng的矩阵。
产生波纹前后图像在局部产生了明显的灰度变化,即明暗条纹,而通过灰度共生矩阵可以计算出反映了图像局部变化程度的对比度。灰度起伏越明显,其对比度越大。对比度的计算方式如下:
图16显示了在实际运行中,针尖五次下降接触液面并上升再分离液面的过程中对比度的变化,其中黑色虚线标注的即为针尖与液面的接触时刻。发现利用对比度参数可以很好地获取到取液针刚好接触液滴的时刻。
s400使取液针运动至质谱仪的进样口,使萃取物进入质谱仪中,以便进行质谱分析
在该步骤中,基于第一图像采集部件确定取液针的位置,使取液针运动至质谱仪的进样口,使萃取物进行质谱仪中,以便进行质谱分析。利用第一图像采集部件确定取液针的针尖位置,以便对准质谱仪的进样口。
本发明的目的是保证毛细针尖端正对质谱仪进样口,并保证两者之间距离为0.3~1.5cm。本发明利用了对于空间物体表面任意一点,如果从左右2个相机同时观察p,并能确定在左相机图像上的点pl与右相机图像上的点pr是空间同一点p的图像点(称pl与pr,为共轭对应点),则可计算出空间点p的三维坐标(包含距离信息)。
根据本发明的实施例,双目视觉系统需要提前利用棋盘格进行相机标定得到摄像机矩阵,才可以计算出毛细针尖的空间三维坐标。
本领域技术人员能够理解的是,前面针对单细胞质谱分析系统所描述的特征和优点,同样适用于该实施单细胞质谱分析的方法,在此不再赘述。
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1
采用图1~5的单细胞质谱分析系统对肺癌细胞进行分析,其中,加液针尖端内径15微米,锥角小于5°,取液针尖端内径为2微米,锥角15°,捕获孔孔径为30微米。
将a549肺癌细胞样本转移到单细胞定位芯片上,将单个细胞捕获于芯片上阵列分布的定位单元中。接着通过干燥裂解细胞,细胞裂解后将单细胞定位芯片放置到电动载物台上,启动自动化单细胞皮升萃取操作软件(如图18),调节载物台使样本置于目镜正上方,选择合适倍率的物镜(这里针对10~15m级别的a549使用10×物镜),调节显微镜焦平面使操作区域在计算机屏幕上呈现清晰的图像。点击软件界面“esi”按钮,系统自动按图17所示的自动化单细胞皮升萃取过程进行工作。
图19为利用本发明分析单细胞磷脂萃取物的质谱图,从图中可以看出,分析物都能够被很好地离子化,在质谱图中显示出非常强的信号,足以证明本发明的单细胞质谱分析系统和方法有着良好的通用性与分析性能。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!