一种基于重组单链抗体的LP-PLA2胶乳增强比浊法测定试剂盒及其制备使用方法与流程
本发明涉及临床检验领域,尤其涉及一种基于重组单链抗体的lp-pla2胶乳增强比浊法测定试剂盒及其制备使用方法。
背景技术:
lp-pla2是一种能够促进炎症反应的生化指标,在血浆中以组成活性形式循环。lp-pla2由炎症细胞分泌,包括单核细胞来源的巨噬细胞、t细胞和肥大细胞,主要与ldl-c结合。它是磷脂酶a2超家族的成员之一,具有水解磷脂底物sn-2酯键的能力。lp-pla2的催化活性被认为是脂蛋白依赖性的,它的活性更多地集中在小而致密的ldl胆固醇上,包括被认为是最容易引起动脉粥样硬化的lp(a)颗粒。除能水解血小板活化因子外,该酶对包括氧化磷脂和短链磷脂等多种极性磷脂具有特异性。因为这一作用机制,lp-pla2在脂蛋白相关的氧化磷脂的代谢、修饰中起着重要作用,对血管炎症反应具有高的敏感性和特异性特点。lp-pla2是一种由四百多个氨基酸残基组成的酶,人体血浆中的lp-pla2主要是和富含apo-b的脂蛋白相结合,低密度脂蛋白占4/5。当lp-pla2和hdl结合时,lp-pla2能够降解血小板活化因子,抑制血小板活化反应,从而抑制动脉粥样硬化的发展;但是,结合了ldl-c的lp-pla2可水解和氧化ldl-c,最终使得内皮细胞功能受损、凋亡,致使更多促炎活性物质生成,促使粥样硬化斑块的生成和进展,是冠心病的预测生化指标。既往国外众多研究结果均提示:伴随着lp-pla2浓度的升高,冠状动脉粥样硬化性心脏病的发病人群也会逐渐增加。此外,lp-pla2浓度升高与冠状动脉粥样硬化性心脏病病人心血管事件复发率相关。众多研究表明,lp-pla2水平和冠状动脉粥样硬化性心脏病发生风险存在正相关性,并且不受其它危险因素干扰。
抗体的基本单位是“y”字型结构的ig单体,含有两条h链和两条l链,igh链和l链中靠近n端氨基酸序列变化较大的区域称为可变区(variableregion,v),重链和轻链的v区分别称为vh和vl。vh和vl中各含有3个氨基酸组成和排列顺序高度可变的区域,称为高变区(hypervariableregion,hvr)或互补决定区(complementaritydeterminingregion,cdr),包括hvrl(cdrl)、hvr2(cdr2)和hvr3(cdr3),其中,hvr3(cdr3)氨基酸序列可变程度更高,vh和vl的3个cdr共同组成ig的抗原结合部位(antigen-bindingsite),决定抗体的特异性,是抗体识别及结合抗原的部位。单链抗体(singlechainantibodyfragment,scfv)是由抗体vh和vl通过15-20个氨基酸的短肽(linker)连接而成的抗体。
目前,检测lp-pla2的原理基于酶活性检测和抗原抗体反应,常用的方法是比色法、化学发光法、酶联免疫法。其中,比色法成本高,且反应干扰较大;化学发光检测成本高;酶联免疫法的特异性和灵敏度都较低,且检测周期较长,操作繁琐,不便于临床检测大规模使用。因此,目前急需一种成本低、特异性与灵敏度高,并且检测周期短、操作简单,适于临床检测大规模使用的lp-pla2检测方法。
技术实现要素:
本发明所要解决的技术问题在于提供一种成本低、特异性与灵敏度高,并且检测周期短、操作简单,适于临床检测大规模使用的基于重组单链抗体的lp-pla2胶乳增强比浊法测定试剂盒及其制备使用方法。
本发明采用以下技术方案解决上述技术问题:
一种基于重组单链抗体的lp-pla2胶乳增强比浊法测定试剂盒,包括试剂r1和试剂r2;
所述试剂r1包括的成分及相应含量为:nah2po41.00-5.00g/l,na2hpo410.00-50.00g/l,nacl3.00-20.00g/l,mgcl20.10-5.00g/l,peg60005.00-29.00g/l,nan30.1-5g/l,溶剂为纯化水;
所述试剂r2包括的成分及相应含量为:nah2po41.00-5.00g/l,na2hpo410.00-50.00g/l,nacl3.00-20.00g/l,明胶0.1-1.0g/l,曲拉通-1000.01%-1.00%,bsa10.00-100.00g/l,nan30.1-5g/l,重组抗人lp-pla2单链抗体胶乳颗粒1.0-10.0%,溶剂为纯化水;
其中,所述试剂r2中,重组抗人lp-pla2单链抗体胶乳颗粒采用的是重组抗人lp-pla2单链抗体与胶乳颗粒相偶联制成。
作为本发明的优选方式之一,所述试剂r1包括的成分及相应含量具体为:nah2po42.86g/l,na2hpo428.65g/l,nacl6.87g/l,mgcl20.34g/l,peg600016.00g/l,nan31.00g/l,溶剂为纯化水。
作为本发明的优选方式之一,所述试剂r2包括的成分及相应含量具体为:nah2po42.86g/l,na2hpo428.65g/l,nacl9.00g/l,明胶0.5g/l,曲拉通-1000.05%,bsa50.00g/l,nan31.00g/l,重组抗人lp-pla2单链抗体胶乳颗粒5.0%,溶剂为纯化水。
作为本发明的优选方式之一,所述试剂r2中重组抗人lp-pla2单链抗体胶乳颗粒的获取方法如下:
(1)将1-5g直径大小为100-150nm的羧基化的乳胶微球加入到50ml的含有1-(3-二甲基氨基丙基)-3-乙基碳二亚胺100-300mg/l的ph6.0的0.1-0.5mol/l的mes缓冲液中,反应30min;
(2)将反应液分成25ml/管,在转速为16000r/m的高速冷冻离心机中离心30min后,去掉上清液,每管加浓度为0.1-0.5mol/l的磷酸盐缓冲液5ml混匀;继续在转速为16000r/m的高速冷冻离心机中离心30min后,去掉上清液,每管加浓度为0.1-0.5mol/l的磷酸盐缓冲液25ml混匀;
(3)每管加入重组抗人lp-pla2单链抗体10-100mg,在37℃水浴反应6h;
(4)向每管中加入含有1-30g/l的6-氨基己酸ph8.0的磷酸盐缓冲液10ml;
(5)每管液体加小牛白蛋白0.1-4.0g,摇匀反应12h;
(6)将所得的液体通过2次离心,转速为16000r/m,洗涤去掉未结合抗体,即得目标所需的重组抗人lp-pla2单链抗体胶乳颗粒。
作为本发明的优选方式之一,所述重组抗人lp-pla2单链抗体的获取方法如下:
(1)设计lp-pla2cds序列特异性引物:人lp-pla2基因引物序列的上游引物序列如seqidno.1所示,下游引物序列如seqidno.2所示;lp-pla2人工序列全序列如seqidno.3所示;其中,上游引物带有ncoi酶切位点,下游引物带有ecorv酶切位点,上下游引物均带有肠激酶酶切位点;
(2)从人全血中提取基因组dna,进行pcr扩增反应,获得pcr扩增产物;
(3)克隆载体制备;
(4)表达载体制备;
(5)表达菌制备;
(6)重组人lp-pla2的表达;
(7)将表达产物进行纯化和鉴定;
(8)balb/c小鼠免疫达到指定抗体水平后取脾脏,制备杂交瘤细胞;
(9)筛选抗lp-pla2阳性的细胞株,扩大培养,收获阳性细胞;
(10)提取阳性细胞的总rna,使用小鼠ig简并引物扩增出小鼠ig轻重链可变区;
(11)测序获得该lp-pla2单克隆抗体的基因序列,针对该vh和vl设计overlappcr引物和设计轻重链上下游引物:轻链上游引物的序列如seqidno.4所示,轻链下游引物的序列如seqidno.5所示;重链上游引物的序列如seqidno.6所示,重链下游引物的序列如seqidno.7所示;其中,轻链上游引物带有ncoi酶切位点,重链下游引物带有ecorv酶切位点,轻链上游引物和重链下游引物均带有肠激酶酶切位点;并且,轻链下游引物和重链上游引物均含有柔性linker,柔性linker的序列如seqidno.8所示;
(12)使用上述提取的阳性细胞的总rna逆转录产物cdna为模板扩增出vh-vl的融合基因片段;
(13)重组抗人lp-pla2单链抗体的表达;
(14)重组抗人lp-pla2单链抗体粗制品的制备;
(15)重组抗人lp-pla2单链抗体粗制品纯化。
一种上述基于重组单链抗体的lp-pla2胶乳增强比浊法测定试剂盒的制备方法,包括如下步骤:
一、抗人lp-pla2重组单链抗体的制备
(1)设计lp-pla2cds序列特异性引物:人lp-pla2基因引物序列的上游引物序列如seqidno.1所示,下游引物序列如seqidno.2所示;lp-pla2人工序列全序列如seqidno.3所示;其中,上游引物带有ncoi酶切位点,下游引物带有ecorv酶切位点,上下游引物均带有肠激酶酶切位点;引物由华大基因进行合成;
(2)从人全血中提取基因组dna,进行pcr扩增反应:采用大连宝生物公司dna提取试剂盒takaraminibestwholebloodgenomicdnaextractionkit从人全血中提取dna,使用大连宝生物公司takaralapcrtmkitver.2.1,利用合成的引物进行pcr反应;pcr反应条件“95℃预变性5min;95℃变性40s,58℃退火60s,72℃延伸90s,循环35次,最后72℃延伸10min”,获得pcr扩增产物;
(3)克隆载体制备:pcr产物经测序无误后使用连接酶连接到克隆载体pmd-18t中,导入到克隆菌感受态细胞dh5α中;
(4)表达载体制备:lb培养基37℃培养过夜,使用大连宝生物公司质粒提取试剂盒takaraminibestplasmidpurificationkitver.4.0提取质粒,ncoi酶和ecorv酶进行双酶切,将双酶切产物进行琼脂糖凝胶电泳,将1293bp大小片段切下使用大连宝生物公司胶回收试剂盒takaraminibestagarosegeldnaextractionkitver.4.0回收dna,将回收的dna使用连接酶连接到pet32a上,并导入bl21大肠埃希菌感受态细胞中;
(5)表达菌制备:lb培养基37℃220rpm摇菌2h,涂布于含氨苄青霉素的lb培养基平板培养过夜,取lb平板上生长的菌落经pcr鉴定目的基因,鉴定为阳性,即表示表达载体构建成功,记为pet-32a/rlp-pla2;
(6)重组人lp-pla2的表达:挑取pet-32a/rlp-pla2工程菌于含氨苄青霉素50μg/ml的lb培养基中37℃摇菌1h来复苏工程菌活性,后在含50μg/ml氨苄青霉素的lb培养基中放大培养8h;之后测od值达到1.5时,加入ipt,28℃诱导表达5h;收集细菌,破碎后获得上清和沉淀,即为带his标签的目的蛋白rlp-pla2;
(7)将表达产物进行纯化和鉴定:
离心收集细菌,加入质量体积比1:5的pbs重悬沉淀,-80℃与4℃反复冻融沉淀3次,4℃超声裂解细菌沉淀,功率:400w,工作3s,间隔3s,超声破碎15min,重复3次,于4℃、12000r/min离心15min分别取上清、沉淀,得到粗制蛋白;
肠激酶酶切:将粗制蛋白使用大连宝生物公司肠激酶于23℃,酶切过夜;
亲和层析:将酶切后粗制蛋白过滤处理后过gst亲和层析柱,用第一elutionbuffer梯度洗脱,收集rlp-pla2峰;所述第一elutionbuffer的配方为:60mmtris-cl、50mm还原性谷胱甘肽,ph7.0;
脱盐、缓冲液置换:将第一步纯化的rlp-pla2过脱盐柱,用置换缓冲液置换,准备下一步离子交换层析;所述置换缓冲液的配方为:60mmtris-cl,ph9.0;
离子交换层析:分别用loadingbuffer平衡好柱体,上样后用第二elutionbuffer梯度洗脱,收集rlp-pla2峰;所述loadingbuffer的配方为:60mmtris-cl,ph7.0;所述第二elutionbuffer的配方为:60mmtris-cl、0.8mnacl,ph7.0;
分子筛层析:离子交换层析收集到的rlp-pla2过分子筛层析柱,第三elutionbuffer收集rlp-pla2峰;所述第三elutionbuffer的配方为:60mmna2hpo4、0.2mnacl,ph7.0;
取收集rlp-pla2做werstenblot验证:使用abcam公司lp-pla2鼠单克隆抗体为抗体,使用abcam公司hrp标记的山羊抗鼠igg为第二抗体做wb,沉淀与上清样本在47kd处均有阳性条带,表明纯化后所得rlp-pla2为lp-pla2;
(8)制备杂交瘤细胞:8-ag选择性培养基筛选依赖型sp2/0细胞;脾脏制备成单个悬浮细胞,分别计数,取含1×108个脾细胞和2×107个sp2/0细胞的悬液加入同一支50ml离心管中,补加不完全培液至30ml;充分混匀,1500r/min离心15min,吸去上清,将沉积的融合细胞悬浮在200ml的hat培养基中;将细胞接种到10个96孔平底细胞板,每孔0.2ml;置37℃、5%co2、饱和湿度条件下培养;
(9)筛选抗lp-pla2阳性的细胞株,扩大培养,收获阳性细胞:用rlp-pla2抗原1μg/ml包被酶标板,每孔100μl;用含有10%小牛血清的封闭液于37℃封闭60min;.用含有0.05%吐温的pbst洗涤液洗涤3次,5min/次;取杂交瘤上清液100μl加入包被板中,置湿盒37℃孵育60min;用pbst液洗涤3次,5min/次;加入hrp标记的羊抗鼠igg,每孔100μl,置湿盒37℃孵育60min;用pbst液洗涤3次,5min/次;加入opd底物液,100μl/孔,置室温15min观察;当阳性对照孔出现明显颜色变化后,每孔加入终止液50ul终止反应,测定各孔od值;选取阳性孔杂交瘤细胞,将其克隆化并扩大培养;取细胞培养上清作为一抗,使用hrp标记的abcam山羊抗鼠igg作为二抗,使用已验证的rlp-pla2作为抗原,使用abcam抗人lp-pla2单克隆抗体作为参照一抗,经wb验证该融合杂交瘤细胞为抗rlp-pla2阳性;
(10)提取阳性细胞的总rna,使用小鼠ig简并引物扩增出小鼠ig轻重链可变区:取上述阳性杂交瘤细胞使用大连宝生物公司rna提取试剂盒提取rna,逆转录,使用novagen公司的小鼠ig简并引物扩增出小鼠igg轻重链可变区;连接pmd-18t克隆载体,导入dh5α感受态细胞中,发酵提取质粒,送测序公司进行轻重链可变区基因的测序,确定轻重链可变区的基因序列;
(11)测序获得该lp-pla2单克隆抗体的基因序列,针对该vh和vl设计overlappcr引物和设计轻重链上下游引物:轻链上游引物的序列如seqidno.4所示,轻链下游引物的序列如seqidno.5所示;重链上游引物的序列如seqidno.6所示,重链下游引物的序列如seqidno.7所示;其中,轻链上游引物带有ncoi酶切位点,重链下游引物带有ecorv酶切位点,轻链上游引物和重链下游引物均带有肠激酶酶切位点;并且,轻链下游引物和重链上游引物均含有柔性linker,柔性linker的序列如seqidno.8所示;
(12)使用上述提取的阳性细胞的总rna逆转录产物cdna为模板扩增出vh-vl的融合基因片段:以上述逆转录所得cdna为模板,分别以轻链上下游引物、重链上下游引物进行pcr,得到pcr产物,记为l和h;以轻链上游引物和重链下游引物,以l和h为模板进行overlappcr,得到pcr产物,记为vlh;将vlh使用连接酶连接到pmd-18t克隆载体,导入dh5α感受态细胞中,发酵提取质粒送测序公司进行重组基因的测序,确定重组基因片段的序列,记为rlp-pla2-ab,符合设计序列;将上述rlp-pla2-ab基因经双酶切后与双酶切后的pet-32a(+)表达载体使用t4连接酶连接,导入到bl-21感受态表达菌中,即为目的表达载体;
(13)重组抗人lp-pla2单链抗体的表达:挑取上述工程菌于含氨苄青霉素100μg/ml的lb培养基中,37℃摇菌1h复苏工程菌活性,后在含氨苄青霉素100μg/ml的lb培养基中放大培养4h后,测od值达到1.0时,加入iptg;32℃诱导表达8h,收集细菌,破碎后获得上清和沉淀,即为带his标签的目的蛋白rlp-pla2-ab;
(14)重组抗人lp-pla2单链抗体粗制品的制备:离心收集细菌,加入质量体积比1:5的pbs重悬沉淀,-80℃与4℃反复冻融沉淀3次,4℃超声裂解细菌沉淀,功率:400w,工作3s,间隔3s,超声破碎15min,重复3次,于4℃、12000r/min离心15min,分别取上清、沉淀,得到粗制蛋白;
(15)重组抗人lp-pla2单链抗体粗制品纯化:
肠激酶酶切:将粗制单链抗体使用大连宝生物公司肠激酶于23℃酶切过夜;
亲和层析:将酶切后粗制蛋白过滤处理后过gst亲和层析柱,用第四elutionbuffer梯度洗脱,收集rlp-pla2-ab波峰;所述第四elutionbuffer的配方为:50mmtris-cl、40mm还原性谷胱甘肽,ph7.0;
脱盐、缓冲液置换:将上述纯化的rlp-pla2-ab过脱盐柱,用第二置换缓冲液置换,准备下一步离子交换层析;所述第二置换缓冲液的配方为:50mmtris-cl,ph6.0;
离子交换层析:分别用第二loadingbuffer平衡好柱体,上样后用第五elutionbuffer梯度洗脱,收集rlp-pla2-ab波峰;所述第二loadingbuffer的配方为:50mmtris-cl,ph6.0;所述第五elutionbuffer的配方为:50mmtris-cl、1mnacl,ph6.0;
分子筛层析:离子交换层析收集到的rlp-pla2-ab过分子筛层析柱,第六elutionbuffer收集rlp-pla2-ab峰;所述第六elutionbuffer的配方为:50mmna2hpo4、0.15mnacl,ph7.0;
取收集rlp-pla2-ab做werstenblot验证:使用上述制备的rlp-pla2为抗原,上述收集的rlp-pla2-ab为第一抗体,使用hrp标记的abcam公司山羊抗鼠igg为第二抗体做wb,在47kd处有阳性条带产生,表明单链抗体rlp-pla2-ab制备成功;
二、重组抗人lp-pla2单链抗体胶乳颗粒的制备
(1)将1-5g直径大小为100-150nm的羧基化的乳胶微球加入到50ml的含有1-(3-二甲基氨基丙基)-3-乙基碳二亚胺100-300mg/l的ph6.0的0.1-0.5mol/l的mes缓冲液中,反应30min;
(2)将反应液分成25ml/管,在转速为16000r/m的高速冷冻离心机中离心30min后,去掉上清液,每管加浓度为0.1-0.5mol/l的磷酸盐缓冲液5ml混匀;继续在转速为16000r/m的高速冷冻离心机中离心30min后,去掉上清液,每管加浓度为0.1-0.5mol/l的磷酸盐缓冲液25ml混匀;
(3)每管加入制备得到的重组抗人lp-pla2单链抗体10-100mg,在37℃水浴反应6h;
(4)向每管中加入含有1-30g/l的6-氨基己酸ph8.0的磷酸盐缓冲液10ml;
(5)每管液体加小牛白蛋白0.1-4.0g,摇匀反应12h;
(6)将所得的液体通过2次离心,转速为16000r/m,洗涤去掉未结合抗体,即得目标所需的重组抗人lp-pla2单链抗体胶乳颗粒;
三、配制试剂r1
按照试剂r1的组分含量,将各组分物质于同一容器中混合,混合均匀后,制得试剂r1;
四、配制试剂r2
按照试剂r2的组分含量,将制得的重组抗人lp-pla2单链抗体胶乳颗粒以及余下的其他组分物质于同一容器中混合,混合均匀后,制得试剂r2。
一种上述基于重组单链抗体的lp-pla2胶乳增强比浊法测定试剂盒的使用方法,包括如下具体步骤:
(1)吸取10μl样本,加入240μl试剂r1,反应5min,读点a1;
(2)再加入80μl试剂r2,反应5min,读点a2;
(3)计算吸光度变化值δa,根据吸光度变化值δa计算出样本中lp-pla2含量。
本发明检测的原理是:利用抗原抗体反应,先加入试剂r1,使血清中的lp-pla2的位点暴露,当加入抗人的lp-pla2胶乳颗粒溶液,使溶液中的抗原抗体反应形成不溶于溶液的抗原抗体复合物,从而产生一定的浊度,在人血清中lp-pla2的含量在一定的范围内lp-pla2的含量与浊度成正比;再通过标准曲线进行计算,从而得到lp-pla2的含量。
本发明相比现有技术的优点在于:
(1)本发明建立了一种价格低廉的能够大量应用于临床检测的方法,通过自制的重组单链lp-pla2抗体与胶乳颗粒偶联,采用胶乳增强比浊法来测定人体血清中lp-pla2的含量,不需要预处理标本,操作简单,准确度高,重复性好,且能够在全自动生化分析仪或者特种蛋白仪上使用;
(2)本发明试剂盒具有较高的检测灵敏度,最低检测能够达到0.1ng/l,操作简单、快速,从检测到出结果最多只需要10min,甚至更短;
(3)本发明的试剂盒的试剂r2中的抗体乳胶的制备由于采用的化学偶联法,稳定性好,在2-8℃至少可以保存12个月;
(4)本发明试剂盒与elisa试剂盒对样品中lp-pla2含量检测的数据,经统计分析,无显著性差异,检测结果可靠,在临床上可以替代elisa试剂或者化学发光试剂,大幅降低成本以及检测时间。
附图说明
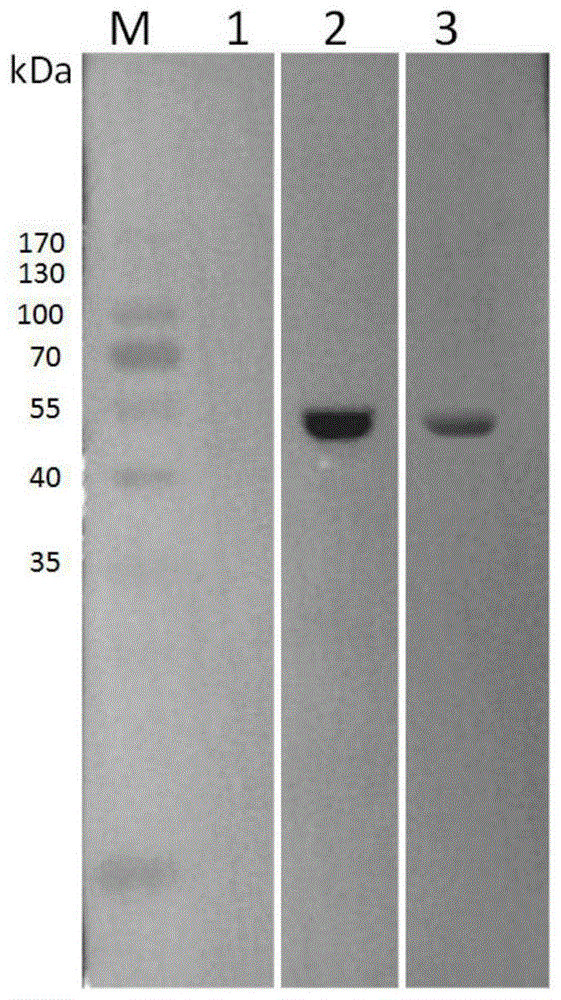
图1是实施例7中相应产物的westernblot鉴定图(图1中,泳道m:蛋白marker26616;泳道1:pet32a空载对照;泳道2:自制重组lp-pla2为抗原,abcam单克隆抗体为一抗;泳道3:abcam重组lp-pla2位抗原,自制单链抗体为一抗);
图2是实施例9中本发明测定试剂盒的lp-pla2校准曲线图;
图3是实施例10中本发明试剂盒的拟合曲线图;
图4是实施例10中本发明试剂盒与酶联免疫方法试剂盒的相关性曲线图。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1
本实施例的一种基于重组单链抗体的lp-pla2胶乳增强比浊法测定试剂盒,包括试剂r1和试剂r2。
试剂r1包括的成分及相应含量为:nah2po41.00g/l,na2hpo410.00g/l,nacl3.00g/l,mgcl20.10g/l,peg60005.00g/l,nan30.1g/l,溶剂为纯化水。
试剂r2包括的成分及相应含量为:nah2po41.00g/l,na2hpo410.00g/l,nacl3.00g/l,明胶0.1g/l,曲拉通-1000.01%,bsa10.00g/l,nan30.1g/l,重组抗人lp-pla2单链抗体胶乳颗粒1.0%,溶剂为纯化水。
其中,试剂r2中,重组抗人lp-pla2单链抗体胶乳颗粒采用的是重组抗人lp-pla2单链抗体与胶乳颗粒相偶联制成。
实施例2
本实施例的一种基于重组单链抗体的lp-pla2胶乳增强比浊法测定试剂盒,包括试剂r1和试剂r2。
试剂r1包括的成分及相应含量为:nah2po45.00g/l,na2hpo450.00g/l,nacl20.00g/l,mgcl25.00g/l,peg600029.00g/l,nan35g/l,溶剂为纯化水。
试剂r2包括的成分及相应含量为:nah2po45.00g/l,na2hpo450.00g/l,nacl20.00g/l,明胶1.0g/l,曲拉通-1001.00%,bsa100.00g/l,nan35g/l,重组抗人lp-pla2单链抗体胶乳颗粒10.0%,溶剂为纯化水。
其中,试剂r2中,重组抗人lp-pla2单链抗体胶乳颗粒采用的是重组抗人lp-pla2单链抗体与胶乳颗粒相偶联制成。
实施例3
本实施例的一种基于重组单链抗体的lp-pla2胶乳增强比浊法测定试剂盒,包括试剂r1和试剂r2。
试剂r1包括的成分及相应含量为:nah2po42.86g/l,na2hpo428.65g/l,nacl6.87g/l,mgcl20.34g/l,peg600016.00g/l,nan31.00g/l,溶剂为纯化水。
试剂r2包括的成分及相应含量为:nah2po42.86g/l,na2hpo428.65g/l,nacl9.00g/l,明胶0.5g/l,曲拉通-1000.05%,bsa50.00g/l,nan31.00g/l,重组抗人lp-pla2单链抗体胶乳颗粒5.0%,溶剂为纯化水。
其中,试剂r2中,重组抗人lp-pla2单链抗体胶乳颗粒采用的是重组抗人lp-pla2单链抗体与胶乳颗粒相偶联制成。
实施例4
本实施例的一种上述实施例1-3中重组抗人lp-pla2单链抗体胶乳颗粒的制备方法,包括如下步骤:
(1)将1g直径大小为100nm的羧基化的乳胶微球加入到50ml的含有1-(3-二甲基氨基丙基)-3-乙基碳二亚胺100-300mg/l的ph6.0的0.1mol/l的mes缓冲液中,反应30min;
(2)将反应液分成25ml/管,在转速为16000r/m的高速冷冻离心机中离心30min后,去掉上清液,每管加浓度为0.1mol/l的磷酸盐缓冲液5ml混匀;继续在转速为16000r/m的高速冷冻离心机中离心30min后,去掉上清液,每管加浓度为0.1mol/l的磷酸盐缓冲液25ml混匀;
(3)每管加入制备得到的重组抗人lp-pla2单链抗体10mg,在37℃水浴反应6h;
(4)向每管中加入含有1g/l的6-氨基己酸ph8.0的磷酸盐缓冲液10ml;
(5)每管液体加小牛白蛋白0.1g,摇匀反应12h;
(6)将所得的液体通过2次离心,转速为16000r/m,洗涤去掉未结合抗体,即得目标所需的重组抗人lp-pla2单链抗体胶乳颗粒。
实施例5
本实施例的一种上述实施例1-3中重组抗人lp-pla2单链抗体胶乳颗粒的制备方法,包括如下步骤:
(1)将5g直径大小为150nm的羧基化的乳胶微球加入到50ml的含有1-(3-二甲基氨基丙基)-3-乙基碳二亚胺300mg/l的ph6.0的0.5mol/l的mes缓冲液中,反应30min;
(2)将反应液分成25ml/管,在转速为16000r/m的高速冷冻离心机中离心30min后,去掉上清液,每管加浓度为0.5mol/l的磷酸盐缓冲液5ml混匀;继续在转速为16000r/m的高速冷冻离心机中离心30min后,去掉上清液,每管加浓度为0.5mol/l的磷酸盐缓冲液25ml混匀;
(3)每管加入制备得到的重组抗人lp-pla2单链抗体100mg,在37℃水浴反应6h;
(4)向每管中加入含有30g/l的6-氨基己酸ph8.0的磷酸盐缓冲液10ml;
(5)每管液体加小牛白蛋白4.0g,摇匀反应12h;
(6)将所得的液体通过2次离心,转速为16000r/m,洗涤去掉未结合抗体,即得目标所需的重组抗人lp-pla2单链抗体胶乳颗粒。
实施例6
本实施例的一种上述实施例1-3中重组抗人lp-pla2单链抗体胶乳颗粒的制备方法,包括如下步骤:
(1)将2g直径大小为120nm的羧基化的乳胶微球加入到50ml的含有1-(3-二甲基氨基丙基)-3-乙基碳二亚胺200mg/l的ph6.0的0.4mol/l的mes缓冲液中,反应30min;
(2)将反应液分成25ml/管,在转速为16000r/m的高速冷冻离心机中离心30min后,去掉上清液,每管加浓度为0.4mol/l的磷酸盐缓冲液5ml混匀;继续在转速为16000r/m的高速冷冻离心机中离心30min后,去掉上清液,每管加浓度为0.2mol/l的磷酸盐缓冲液25ml混匀;
(3)每管加入制备得到的重组抗人lp-pla2单链抗体25mg,在37℃水浴反应6h;
(4)向每管中加入含有10g/l的6-氨基己酸ph8.0的磷酸盐缓冲液10ml;
(5)每管液体加小牛白蛋白3.2g,摇匀反应12h;
(6)将所得的液体通过2次离心,转速为16000r/m,洗涤去掉未结合抗体,即得目标所需的重组抗人lp-pla2单链抗体胶乳颗粒。
实施例7
本实施例的一种上述实施例4-6中抗人lp-pla2重组单链抗体的制备方法,包括如下步骤:
(1)设计lp-pla2cds序列特异性引物:人lp-pla2基因引物序列的上游引物序列如seqidno.1所示,下游引物序列如seqidno.2所示;lp-pla2人工序列全序列如seqidno.3所示;其中,上游引物带有ncoi酶切位点,下游引物带有ecorv酶切位点,上下游引物均带有肠激酶酶切位点;引物由华大基因进行合成;
(2)从人全血中提取基因组dna,进行pcr扩增反应:采用大连宝生物公司dna提取试剂盒takaraminibestwholebloodgenomicdnaextractionkit从人全血中提取dna,使用大连宝生物公司takaralapcrtmkitver.2.1,利用合成的引物进行pcr反应;pcr反应条件“95℃预变性5min;95℃变性40s,58℃退火60s,72℃延伸90s,循环35次,最后72℃延伸10min”,获得pcr扩增产物;
(3)克隆载体制备:pcr产物经测序无误后使用连接酶连接到克隆载体pmd-18t中,导入到克隆菌感受态细胞dh5α中;
(4)表达载体制备:lb培养基37℃培养过夜,使用大连宝生物公司质粒提取试剂盒takaraminibestplasmidpurificationkitver.4.0提取质粒,ncoi酶和ecorv酶进行双酶切,将双酶切产物进行琼脂糖凝胶电泳,将1293bp大小片段切下使用大连宝生物公司胶回收试剂盒takaraminibestagarosegeldnaextractionkitver.4.0回收dna,将回收的dna使用连接酶连接到pet32a上,并导入bl21大肠埃希菌感受态细胞中;
(5)表达菌制备:lb培养基37℃220rpm摇菌2h,涂布于含氨苄青霉素的lb培养基平板培养过夜,取lb平板上生长的菌落经pcr鉴定目的基因,鉴定为阳性,即表示表达载体构建成功,记为pet-32a/rlp-pla2;
(6)重组人lp-pla2的表达:挑取pet-32a/rlp-pla2工程菌于含氨苄青霉素50μg/ml的lb培养基中37℃摇菌1h来复苏工程菌活性,后在含50μg/ml氨苄青霉素的lb培养基中放大培养8h;之后测od值达到1.5时,加入ipt,28℃诱导表达5h(终浓度100μg/ml);收集细菌,破碎后获得上清和沉淀,即为带his标签的目的蛋白rlp-pla2;
(7)将表达产物进行纯化和鉴定:
离心收集细菌,加入质量体积比1:5的pbs重悬沉淀,-80℃与4℃反复冻融沉淀3次,4℃超声裂解细菌沉淀,功率:400w,工作3s,间隔3s,超声破碎15min,重复3次,于4℃、12000r/min离心15min分别取上清、沉淀,得到粗制蛋白;
肠激酶酶切:将粗制蛋白使用大连宝生物公司肠激酶于23℃,酶切过夜;
亲和层析:将酶切后粗制蛋白过滤处理后过gst亲和层析柱,用第一elutionbuffer梯度洗脱,收集rlp-pla2峰;所述第一elutionbuffer的配方为:60mmtris-cl、50mm还原性谷胱甘肽,ph7.0;
脱盐、缓冲液置换:将第一步纯化的rlp-pla2过脱盐柱,用置换缓冲液置换,准备下一步离子交换层析;所述置换缓冲液的配方为:60mmtris-cl,ph9.0;
离子交换层析:分别用loadingbuffer平衡好柱体,上样后用第二elutionbuffer梯度洗脱,收集rlp-pla2峰;所述loadingbuffer的配方为:60mmtris-cl,ph7.0;所述第二elutionbuffer的配方为:60mmtris-cl、0.8mnacl,ph7.0;
分子筛层析:离子交换层析收集到的rlp-pla2过分子筛层析柱,第三elutionbuffer收集rlp-pla2峰;所述第三elutionbuffer的配方为:60mmna2hpo4、0.2mnacl,ph7.0;
取收集rlp-pla2做werstenblot验证:使用abcam公司lp-pla2鼠单克隆抗体(ab234703)为抗体,使用abcam公司hrp标记的山羊抗鼠igg为第二抗体做wb,沉淀与上清样本在47kd处均有阳性条带,表明纯化后所得rlp-pla2为lp-pla2(如图1的泳道2所示);
(8)balb/c小鼠免疫达到指定抗体水平后取脾脏,制备杂交瘤细胞:
balb/c小鼠的免疫:取10mlrlp-pla2抗原(2mg/ml)与等量弗氏完全佐剂充分匀浆形成稳定乳液(记为乳化抗原)。每只小鼠腹腔注射0.5ml乳化抗原,免疫20只小鼠,第7日使用乳化抗原加强免疫一次,第14日使用乳化抗原加强免疫一次,第28日使用乳化抗原加强免疫一次,第42日使用未乳化的纯抗原再次进行加强免疫,第45日摘除眼球取血,处死小鼠,取脾脏;
融合细胞的制备:8-ag选择性培养基筛选依赖型sp2/0细胞;脾脏制备成单个悬浮细胞,分别计数,取含1×108个脾细胞和2×107个sp2/0细胞的悬液加入同一支50ml离心管中,补加不完全培液至30ml;充分混匀,1500r/min离心15min,吸去上清,将沉积的融合细胞悬浮在200ml的hat培养基中;将细胞接种到10个96孔平底细胞板(96孔板),每孔0.2ml;置37℃、5%co2、饱和湿度条件下培养;
(9)筛选抗lp-pla2阳性的细胞株,扩大培养,收获阳性细胞:用rlp-pla2抗原1μg/ml包被酶标板,每孔100μl;用含有10%小牛血清的封闭液于37℃封闭60min;.用含有0.05%吐温的pbst洗涤液洗涤3次,5min/次;取杂交瘤上清液100μl加入包被板中,置湿盒37℃孵育60min;用pbst液洗涤3次,5min/次;加入hrp标记的羊抗鼠igg(1:2000倍稀释),每孔100μl,置湿盒37℃孵育60min;用pbst液洗涤3次,5min/次(每次实验均设阴性、阳性、空白对照各3孔);加入opd底物液,100μl/孔,置室温15min观察;当阳性对照孔出现明显颜色变化后,每孔加入终止液50ul终止反应,测定各孔od值;选取阳性孔杂交瘤细胞,将其克隆化并扩大培养;取细胞培养上清作为一抗,使用hrp标记的abcam山羊抗鼠igg作为二抗,使用已验证的rlp-pla2作为抗原,使用abcam抗人lp-pla2单克隆抗体作为参照一抗,经wb验证该融合杂交瘤细胞为抗rlp-pla2阳性;
(10)提取阳性细胞的总rna,使用小鼠ig简并引物扩增出小鼠ig轻重链可变区:取上述阳性杂交瘤细胞使用大连宝生物公司rna提取试剂盒提取rna,逆转录,使用novagen公司的小鼠ig简并引物扩增出小鼠igg轻重链可变区;连接pmd-18t克隆载体,导入dh5α感受态细胞中,发酵提取质粒,送测序公司进行轻重链可变区基因的测序,确定轻重链可变区的基因序列;
(11)测序获得该lp-pla2单克隆抗体的基因序列,针对该vh和vl设计overlappcr引物和设计轻重链上下游引物:轻链上游引物的序列如seqidno.4所示,轻链下游引物的序列如seqidno.5所示;重链上游引物的序列如seqidno.6所示,重链下游引物的序列如seqidno.7所示;其中,轻链上游引物带有ncoi酶切位点,重链下游引物带有ecorv酶切位点,轻链上游引物和重链下游引物均带有肠激酶酶切位点;并且,轻链下游引物和重链上游引物均含有柔性linker,柔性linker的序列如seqidno.8所示;
(12)使用上述提取的阳性细胞的总rna逆转录产物cdna为模板扩增出vh-vl的融合基因片段:以上述逆转录所得cdna为模板,分别以轻链上下游引物、重链上下游引物进行pcr,得到pcr产物,记为l和h;以轻链上游引物和重链下游引物,以l和h为模板进行overlappcr,得到pcr产物,记为vlh;将vlh使用连接酶连接到pmd-18t克隆载体,导入dh5α感受态细胞中,发酵提取质粒送测序公司进行重组基因的测序,确定重组基因片段的序列,记为rlp-pla2-ab,符合设计序列;将上述rlp-pla2-ab基因经双酶切后与双酶切后的pet-32a(+)表达载体使用t4连接酶连接,导入到bl-21感受态表达菌中,即为目的表达载体;
(13)重组抗人lp-pla2单链抗体的表达:挑取上述工程菌于含氨苄青霉素100μg/ml的lb培养基中,37℃摇菌1h复苏工程菌活性,后在含氨苄青霉素100μg/ml的lb培养基中放大培养4h后,测od值达到1.0时,加入iptg;32℃诱导表达8h(终浓度100μg/ml),收集细菌,破碎后获得上清和沉淀,即为带his标签的目的蛋白rlp-pla2-ab;
(14)重组抗人lp-pla2单链抗体粗制品的制备:离心收集细菌,加入质量体积比1:5的pbs重悬沉淀,-80℃与4℃反复冻融沉淀3次,4℃超声裂解细菌沉淀,功率:400w,工作3s,间隔3s,超声破碎15min,重复3次,于4℃、12000r/min离心15min,分别取上清、沉淀,得到粗制蛋白;
(15)重组抗人lp-pla2单链抗体粗制品纯化:
肠激酶酶切:将粗制单链抗体使用大连宝生物公司肠激酶于23℃酶切过夜;
亲和层析:将酶切后粗制蛋白过滤处理后过gst亲和层析柱,用第四elutionbuffer梯度洗脱,收集rlp-pla2-ab波峰;所述第四elutionbuffer的配方为:50mmtris-cl、40mm还原性谷胱甘肽,ph7.0;
脱盐、缓冲液置换:将上述纯化的rlp-pla2-ab过脱盐柱,用第二置换缓冲液置换,准备下一步离子交换层析;所述第二置换缓冲液的配方为:50mmtris-cl,ph6.0;
离子交换层析:分别用第二loadingbuffer平衡好柱体,上样后用第五elutionbuffer梯度洗脱,收集rlp-pla2-ab波峰;所述第二loadingbuffer的配方为:50mmtris-cl,ph6.0;所述第五elutionbuffer的配方为:50mmtris-cl、1mnacl,ph6.0;
分子筛层析:离子交换层析收集到的rlp-pla2-ab过分子筛层析柱,第六elutionbuffer收集rlp-pla2-ab峰;所述第六elutionbuffer的配方为:50mmna2hpo4、0.15mnacl,ph7.0;
取收集rlp-pla2-ab做werstenblot验证:使用上述制备的rlp-pla2为抗原,上述收集的rlp-pla2-ab为第一抗体,使用hrp标记的abcam公司山羊抗鼠igg为第二抗体做wb,在47kd处有阳性条带产生,表明单链抗体rlp-pla2-ab制备成功(如图1泳道3所示)。
实施例8
本实施例的一种上述实施例中基于重组单链抗体的lp-pla2胶乳增强比浊法测定试剂盒的制备方法,包括如下步骤:
一、抗人lp-pla2重组单链抗体的制备
见实施例7;
二、重组抗人lp-pla2单链抗体胶乳颗粒的制备
见实施例4-6;
三、配制试剂r1
按照试剂r1的组分含量,将各组分物质于同一容器中混合,混合均匀后,制得试剂r1;
四、配制试剂r2
按照试剂r2的组分含量,将制得的重组抗人lp-pla2单链抗体胶乳颗粒以及余下的其他组分物质于同一容器中混合,混合均匀后,制得试剂r2。
实施例9
本实施例的一种上述实施例中基于重组单链抗体的lp-pla2胶乳增强比浊法测定试剂盒的使用方法。
一、制备校准品
校准品稀释液包括的成分及相应含量为:nah2po42.86g/l,na2hpo428.65g/l,nacl9.00g/l,bsa50.00g/l,蔗糖10.00g/l,nan31.00g/l,溶剂为纯化水。按照需要的lp-pla2,参考校准品浓度将相应的重组lp-pla2纯品(即,实施例7的步骤(7)得到的rlp-pla2)1.0mg加入1ml校准品稀释液中,制备得到1000ng/ml浓度的lp-pla2校准品;在使用的时候再用校准品稀释液按照比例稀释成多个浓度。本实施例中,校准品浓度选择0ng/ml、62.5ng/ml、125ng/ml、250ng/ml、500ng/ml和1000ng/ml。
二、lp-pla2测定方法(日立7060全自动生化分析仪)
测定波长:主波长340nm,副波长700nm;
试剂比例:r1∶r2∶s=240μl∶80μl∶10μl;
校准方式:spline;
读点方式:将试剂r1与样品加入,反应5min,读点a1;然后加入试剂r2后,反应5min,再读点a2;计算吸光度的变化。
其中,校准曲线见图2。
实施例10
本实施例用以评估上述实施例中基于重组单链抗体的lp-pla2胶乳增强比浊法测定试剂盒的性能。
1.灵敏度测定
用本发明所述的试剂盒对空白样本(含有5%牛血清的生理盐水)重复测定20次,最低检测限度为空白的均值浓度加上2个标准差,得到最低检测限度为4.51ng/ml,具体见表1。
表1本发明试剂盒的重复测定结果表
2.线性范围
线性相关系数:在[0ng/ml-800.0ng/ml]范围内用生理盐水稀释接近线性区间上限的高值标本,混合成至少5个不同浓度(xi)的标本,每个标本重复测定3次,分别计算测定结果的均值(yi)。测定与计算结果如表2所示,以稀释浓度(xi)为自变量,以测定结果均值(yi)为因变量求出线性回归方程。按公式(1)计算线性回归的相关系数r,所得结果应满足线性相关系数r≥0.9900。
表2本发明试剂盒的线性评价结果表
图3是本发明试剂盒的拟合曲线图,如图3所示,本试剂盒的直线拟合曲线为:y=1.0284x-3.7395,r2=0.999,r2>0.99,满足临床要求。
3.与酶联免疫方法试剂盒测定结果的相关性
通过测定60例标本(其中,阳性血清30例,阴性血清30例)验证本发明试剂盒与酶联免疫方法试剂盒的相关性,检测结果如表3所示。将检测结果绘制成曲线图,如图4所示。由图4可知,本发明试剂盒与酶联免疫方法试剂盒的相关系数r2=0.955,相关方程为:y=1.1881x+0.6625。
表3本发明试剂盒与酶联免疫方法试剂盒的检测结果对比表
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
序列表
<110>安徽大千生物工程有限公司
<120>一种基于重组单链抗体的lp-pla2胶乳增强比浊法测定试剂盒及其制备使用方法
<130>2020
<160>8
<170>siposequencelisting1.0
<210>1
<211>45
<212>dna
<213>人工序列()
<400>1
ccatgggatgatgatgataaatttgactggcaatacataaatcct45
<210>2
<211>43
<212>dna
<213>人工序列()
<400>2
gatactctactactactatttctaattgtatttctctattcct43
<210>3
<211>1305
<212>dna
<213>人工序列()
<400>3
ccatgggatgatgatgataaatttgactggcaatacataaatcctgttgcccatatgaaa60
tcatcagcatgggtcaacaaaatacaagtactgatggctgctgcaagctttggccaaact120
aaaatcccccggggaaatgggccttattccgttggttgtacagacttaatgtttgatcac180
actaataagggcaccttcttgcgtttatattatccatcccaagataatgatcgccttgac240
accctttggatcccaaataaagaatatttttggggtcttagcaaatttcttggaacacac300
tggcttatgggcaacattttgaggttactctttggttcaatgacaactcctgcaaactgg360
aattcccctctgaggcctggtgaaaaatatccacttgttgttttttctcatggtcttggg420
gcattcaggacactttattctgctattggcattgacctggcatctcatgggtttatagtt480
gctgctgtagaacacagagatagatctgcatctgcaacttactatttcaaggaccaatct540
gctgcagaaataggggacaagtcttggctctaccttagaaccctgaaacaagaggaggag600
acacatatacgaaatgagcaggtacggcaaagagcaaaagaatgttcccaagctctcagt660
ctgattcttgacattgatcatggaaagccagtgaagaatgcattagatttaaagtttgat720
atggaacaactgaaggactctattgatagggaaaaaatagcagtaattggacattctttt780
ggtggagcaacggttattcagactcttagtgaagatcagagattcagatgtggtattgcc840
ctggatgcatggatgtttccactgggtgatgaagtatattccagaattcctcagcccctc900
ttttttatcaactctgaatatttccaatatcctgctaatatcataaaaatgaaaaaatgc960
tactcacctgataaagaaagaaagatgattacaatcaggggttcagtccaccagaatttt1020
gctgacttcacttttgcaactggcaaaataattggacacatgctcaaattaaagggagac1080
atagattcaaatgtagctattgatcttagcaacaaagcttcattagcattcttacaaaag1140
catttaggacttcataaagattttgatcagtgggactgcttgattgaaggagatgatgag1200
aatcttattccagggaccaacattaacacaaccaatcaacacatcatgttacagaactct1260
tcaggaatagagaaatacaattagaaatagtagtagtagagtatc1305
<210>4
<211>40
<212>dna
<213>人工序列()
<400>4
ccatgggatgatgatgataaacattgctagtccgtaagct40
<210>5
<211>83
<212>dna
<213>人工序列()
<400>5
ggcggcggcggcagcggcggcggcggcagcggcggcggcggcagcggcggcggcggcagc60
ttctgaagatcagtggtaggttc83
<210>6
<211>79
<212>dna
<213>人工序列()
<400>6
ggcggcggcggcagcggcggcggcggcagcggcggcggcggcagcggcggcggcggcagc60
ctggatcgcatgcattccg79
<210>7
<211>46
<212>dna
<213>人工序列()
<400>7
gatactctactactactattttttctgaagtgtcagccaagctagg46
<210>8
<211>60
<212>dna
<213>人工序列()
<400>8
ggcggcggcggcagcggcggcggcggcagcggcggcggcggcagcggcggcggcggcagc60
- 还没有人留言评论。精彩留言会获得点赞!