一种联合检测2019新型冠状病毒IgM和IgG抗体的试剂盒及其制备方法与流程
本发明涉及体外诊断试剂技术领域,尤其涉及一种联合检测2019新型冠状病毒igm和igg抗体的试剂盒及其制备方法。
背景技术:
2019新型冠状病毒,即“covid-19”,2020年2月11日被世界卫生组织命名。新型冠状病毒属于β属的新型冠状病毒,有包膜,颗粒呈圆形或椭圆形,常为多形性,直径60-140nm。s蛋白是病毒的主要蛋白之一,其编码基因用于病毒分型。n蛋白包裹病毒基因组,可作为诊断抗原。基于目前的流行病学调查,其临床表现:潜伏期一般为3~7天,最长不超过21天。人群普遍易感,以发热、乏力、干咳为主要表现。少数患者伴有鼻塞、流涕、腹泻等症状。重型病例多在一周后出现呼吸困难,严重者快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和出凝血功能障碍。值得注意的是重型、危重型患者病程中可为中低热,甚至无明显发热。部分患者仅表现为低热、轻微乏力等,无肺炎表现,多在1周后恢复。多数患者预后良好,儿童病例症状相对较轻,少数患者病情危重。死亡病例多见于老年人和有慢性基础疾病者。可能的传播途径包括飞沫传播、粪口传播以及接触传播。
目前covid-19指南对于疑似患者的检查缺乏特异性以及时效性。过去对疫情的防控时期均有免疫诊断试剂做为辅助诊断的先例,如2003年的传染性非典型肺炎(sars),钟南山院士曾在专家论坛发表《sars预防与治疗研究》的期刊中提到“应该考虑结合特异性诊断手段(冠状病毒rt-pcr,elisa,igg及igm免疫荧光检测)等”。人体在接触外来抗原的时候,最早产生的抗体是igm,是由b细胞表面受体直接分泌,产生igm的b细胞进入淋巴结,在发生中心接受t细胞和抗原提呈细胞的刺激,进一步成熟,分化为浆细胞,大量产生igg。
igm一般在感染3-7天后产生,所以可以用igm来反应机体是不是处于急性感染状态,作为早期诊断的主要指标。igg抗体较lgm抗体出现稍晚,逐渐上升。现有技术中主要通过核酸进行检测,但是由于样本采集比较困难,此外对实验室的条件以及检测人员的技术水平要求比较高,上述影响因素出现一个都会影响检测结果,导致检测结果呈假阴性,影响检测结果的准确性。因此针对上述问题,本发明建立了一种联合检测2019新型冠状病毒igm和igg抗体的干式免疫荧光试剂盒及其制备方法。
技术实现要素:
本发明所要解决的技术问题是:针对现有技术存在的不足,提供一种联合检测2019新型冠状病毒igm和igg抗体的干式免疫荧光试剂盒,利用该试剂盒可以提高检出率,而且操作简单。
为解决上述技术问题,本发明的技术方案是:
一种联合检测2019新型冠状病毒igm和igg抗体的试剂盒,所述试剂盒包括双联检测卡和检测缓冲液;所述双联检测卡内设有2019新型冠状病毒igm抗体检测试纸条和2019新型冠状病毒igg抗体检测试纸条,所述2019新型冠状病毒igm抗体检测试纸条和2019新型冠状病毒igg抗体检测试纸条分别包括样品垫、硝酸纤维素膜和吸水垫,其中样品垫上包被有抗绵羊红细胞抗体,硝酸纤维素膜上设有荧光抗体固相线、检测线和质控线。
作为一种改进的技术方案,所述2019新型冠状病毒igm抗体检测试纸条的硝酸纤维素膜的荧光抗体固相线包被有荧光标记的鼠抗人igm单抗,所述2019新型冠状病毒igg抗体检测试纸条的硝酸纤维素膜的荧光抗体固相线包被有荧光标记的鼠抗人igg单抗,且所述2019新型冠状病毒igm抗体检测试纸条和所述2019新型冠状病毒igg抗体检测试纸条的硝酸纤维素膜的检测线包被有2019新型冠状病毒的n蛋白抗原和s蛋白抗原的组合物,质控线包被有羊抗鼠igg多抗。
作为一种改进的技术方案,所述检测缓冲液按照每100ml、10~20mmtris溶液中含有0.1~1.5wt%peg、0.1~10wt%s9和0.1~0.5v/v%pc300的进行配制。
本发明所要解决的技术问题是:针对现有技术存在的不足,提供一种联合检测2019新型冠状病毒igm和igg抗体的试剂盒的制备方法,该方法下制备的试剂盒可以提高检出率。
为解决上述技术问题,本发明的技术方案是:
一种联合检测2019新型冠状病毒igm和igg抗体的试剂盒的制备方法,所述制备方法包括以下步骤:
(1)抗原蛋白组合物稀释液的制备:将抗原包被液与2019新型冠状病毒的n蛋白抗原和s蛋白抗原组合物混合,得到抗原蛋白组合物稀释液;
(2)荧光标记抗体稀释液的制备:将固相液与荧光标记的抗体混合,得到荧光标记抗体稀释液;
(3)喷膜:将荧光标记抗体稀释液、抗原蛋白组合物稀释液和羊抗鼠igg多抗分别喷涂在2019新型冠状病毒igm和igg抗体检测试纸条的硝酸纤维素膜上得到荧光抗体固相线、检测线和质控线,再用bsa对抗原检测线进行封闭,封闭结束后进行干燥,得到的硝酸纤维素膜;
(4)贴板、裁切得到2019新型冠状病毒igm抗体检测试纸条和2019新型冠状病毒igg抗体检测试纸条;再将上述两种试纸条分别置于双联检测卡的下板块内,将上板块的加样口和检测窗口分别与样品垫和硝酸纤维素膜对齐后与下板块进行组装,即可。
作为一种改进的技术方案,步骤(1)中的抗原包被液按照10~50mm、ph7.0~8.0pbs中含有1~3wt%海藻糖和0.5~5v/v%甲醇进行配置,且所述2019新型冠状病毒n蛋白抗原和s蛋抗原的组合物与抗原包被液按照体积比1:2-10的比例混合。
作为一种改进的技术方案,步骤(1)中2019新型冠状病毒的n蛋白抗原和s蛋白抗原的组合物中n蛋白抗原和s蛋白抗原按照体积比1:2-10的比例混合。
作为一种改进的技术方案,所述步骤(2)中的固相液按照50mm、ph7.0-8.0的pb中含有0.1-1wt%酪蛋白、0.5-10wt%bsa、0.5-10wt%海藻糖、0.1-5wt%pvp、0.01-1v/v%吐温进行配置,且荧光标记的igm抗体和igg抗体与所述固相液均按照体积比1:1-10的比例混合。
作为一种改进的技术方案,步骤(3)中将喷膜后的硝酸纤维素膜放于15%~40%的湿度、37℃的温度下,干燥0.5h;再用1wt%bsa进行封闭抗原,封闭结束后放入干燥箱,在15%~40%的湿度、37℃的温度下,干燥2h即可。
采用了上述技术方案后,本发明的有益效果是:
与现有技术相比,本发明主要具有以下优点:
(1)优化了抗原包被工艺,一定浓度的糖类物质的加入增强了抗原结构稳定性;添加一定量的甲醇使抗原质控线条更加均一,避免了仪器吸收荧光不均匀而产生的重复性问题;抗原用一定浓度的bsa进行封闭,增加了特异性和敏感度;采用n蛋白与s蛋白一起包被,降低漏检的同时,增加了试剂盒的灵敏度。同时检测igm与igg抗体,提高检出率,避免漏检。
(2)本发明的试剂盒提供了一种荧光标记固相液,并把荧光标记物固相在nc膜极大提高了精密度;解决了荧光标记物和板条储存条件不一致的困难,同时大大简化了组装工艺,降低了生产成本及时间。
(3)优化后的检测缓冲液,添加了大分子聚合物peg和表面活性剂s9,替代了蛋白质的加入,大大拓宽了荧光免疫法储存条件及储存环境,由检测缓冲液2-8度储存12个月拓宽为4-30度储存24个月。
(4)与核酸检测新型冠状病毒相比,抗体检测样本为血清或血浆,受样本采样的影响较小,有利于早期诊断和排除可疑病例,同时检测方便、快速、适合大规模筛查。
(5)依据机体对新型冠状病毒产生的抗体机制,该试剂盒对igm和igg抗体联合检测,避免了漏检,大大提高了检出率。
附图说明
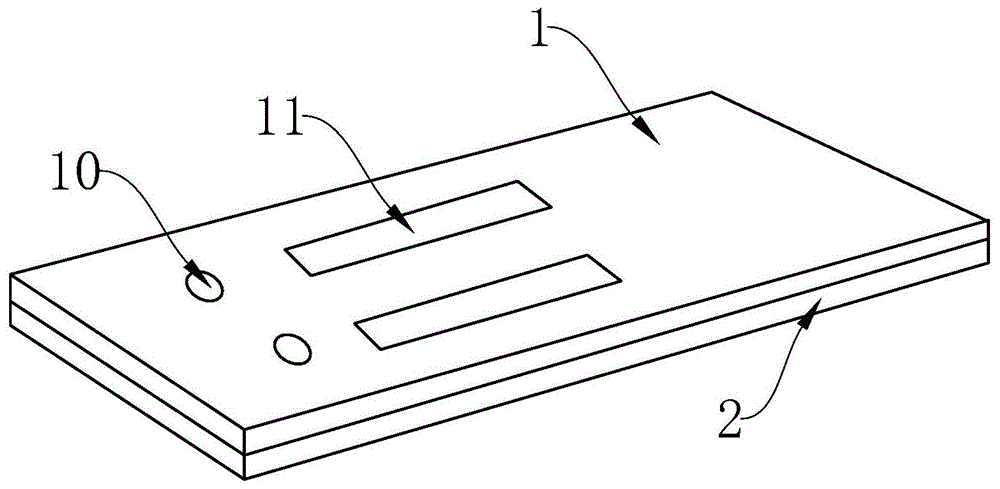
图1为本发明双联检测卡的结构示意图;
图2为2019新型冠状病毒igm抗体检测试纸条的结构示意图;
图3为2019新型冠状病毒igg抗体检测试纸条的结构示意图;
其中,1-上板块,10-加样口,11-反应窗口,2-下板块,3-2019新型冠状病毒igm抗体检测试纸条,30-样品垫,31-硝酸纤维素膜,310-荧光抗体固相线,311-检测线,312-质控线,32-吸水垫,4-2019新型冠状病毒igg抗体检测试纸条,40-样品垫,41-硝酸纤维素膜,410-荧光抗体固相线,411-检测线,412-质控线,42-吸水垫,5-pvc板。
具体实施例方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1
一种联合检测2019新型冠状病毒igm和igg抗体的干式免疫荧光试剂盒,所述试剂盒包括双联检测卡和检测缓冲液;所述双联检测卡内设有2019新型冠状病毒igm抗体检测试纸条和2019新型冠状病毒igg抗体检测试纸条,所述2019新型冠状病毒igm抗体检测试纸条和2019新型冠状病毒igg抗体检测试纸条分别包括样品垫、硝酸纤维素膜和吸水垫,其中样品垫上包被有抗绵羊红细胞抗体(将样品垫置于终浓度为5mg/ml抗绵羊红细胞抗体中浸泡30min,干燥处理后获得),硝酸纤维素膜上设有荧光抗体固相线、检测线和质控线。
其中所述2019新型冠状病毒igm抗体检测试纸条的硝酸纤维素膜的荧光抗体固相线包被有荧光标记的鼠抗人igm单抗,所述2019新型冠状病毒igg抗体检测试纸条的硝酸纤维素膜的荧光抗体固相线包被有荧光标记的鼠抗人igg单抗,且所述2019新型冠状病毒igm抗体检测试纸条和所述2019新型冠状病毒igg抗体检测试纸条的硝酸纤维素膜的检测线包被有2019新型冠状病毒的n蛋白抗原和s蛋白抗原的组合物,质控线包被有羊抗鼠igg多抗。
其中检测缓冲液按照每100ml、10~20mmtris溶液中含有0.3wt%peg、0.5wt%s9和0.1v/v%pc300的进行配制。
其制备方法包括以下步骤:
(1)抗原蛋白组合物稀释液的制备:将抗原包被液与2019新型冠状病毒的n蛋白抗原和s蛋白抗原组合物混合,得到抗原蛋白组合物稀释液;
(2)荧光标记抗体稀释液的制备:将固相液与荧光标记的抗体混合,得到荧光标记抗体稀释液;
(3)喷膜:将荧光标记抗体稀释液、抗原蛋白组合物稀释液和羊抗鼠igg多抗(2mg/ml)喷涂在2019新型冠状病毒igm抗体检测试纸条的硝酸纤维素膜上得到荧光抗体固相线、检测线和质控线,再用bsa进行封闭抗原,封闭结束后进行干燥,得到的硝酸纤维素膜;
(4)贴板、裁切得到2019新型冠状病毒igm抗体检测试纸条和2019新型冠状病毒igg抗体检测试纸条;再将上述两种试纸条分别置于双联检测卡的下板块内,将上板块的加样口和检测窗口分别与样品垫和硝酸纤维素膜对齐后与下板块进行组装,即可;
其中步骤(1)中的抗原包被液按照15mm、ph7.0的pbs中含有1wt%海藻糖和1v/v%甲醇进行配置,且所述2019新型冠状病毒n蛋白抗原和s蛋抗原的组合物与抗原包被液按照体积比1:2比例混合。
其中步骤(1)中2019新型冠状病毒的n蛋白抗原和s蛋白抗原的组合物中n蛋白抗原(终浓度为1.5mg/ml)和s蛋白抗原(终浓度为3mg/ml)按照体积比1:2的比例混合。
其中所述步骤(2)中的固相液按照50mmpbph7.0中含有0.2wt%酪蛋白、1wt%bsa、2wt%海藻糖、1wt%pvp和0.03v/v%吐温进行配置,且荧光标记的igm抗体和igg抗体与所述固相液均按照体积比1:1的比例混合。
作为一种改进的技术方案,步骤(3)中将喷膜后的硝酸纤维素膜放于15%~40%的湿度、37℃的温度下,干燥0.5h;再用1wt%bsa进行封闭抗原,封闭结束后放入干燥箱,在15%~40%的湿度、37℃的温度下,干燥2h即可。
实施例2
一种联合检测2019新型冠状病毒igm和igg抗体的干式免疫荧光试剂盒,所述试剂盒包括双联检测卡和检测缓冲液;所述双联检测卡内设有2019新型冠状病毒igm抗体检测试纸条和2019新型冠状病毒igg抗体检测试纸条,所述2019新型冠状病毒igm抗体检测试纸条和2019新型冠状病毒igg抗体检测试纸条分别包括样品垫、硝酸纤维素膜和吸水垫,其中样品垫上包被有抗绵羊红细胞抗体(将样品垫置于终浓度为5mg/ml抗绵羊红细胞抗体中浸泡30min,干燥处理后获得),硝酸纤维素膜上设有荧光抗体固相线、检测线和质控线。
其中所述2019新型冠状病毒igm抗体检测试纸条的硝酸纤维素膜的荧光抗体固相线包被有荧光标记的鼠抗人igm单抗,所述2019新型冠状病毒igg抗体检测试纸条的硝酸纤维素膜的荧光抗体固相线包被有荧光标记的鼠抗人igg单抗,且所述2019新型冠状病毒igm抗体检测试纸条和所述2019新型冠状病毒igg抗体检测试纸条的硝酸纤维素膜的检测线包被有2019新型冠状病毒的n蛋白抗原和s蛋白抗原的组合物,质控线包被有羊抗鼠igg多抗。
其中检测缓冲液按照每100ml、10~20mmtris溶液中含有1wt%peg、5wt%s9和0.3v/v%pc300的进行配制。
其制备方法包括以下步骤:
(1)抗原蛋白组合物稀释液的制备:将抗原包被液与2019新型冠状病毒的n蛋白抗原和s蛋白抗原组合物混合,得到抗原蛋白组合物稀释液;
(2)荧光标记抗体稀释液的制备:将固相液与荧光标记的抗体混合,得到荧光标记抗体稀释液;
(3)喷膜:将荧光标记抗体稀释液、抗原蛋白组合物稀释液和羊抗鼠igg多抗(2mg/ml)喷涂在2019新型冠状病毒igm和igg抗体检测试纸条的硝酸纤维素膜上得到荧光抗体固相线、检测线和质控线,再用bsa进行封闭抗原,封闭结束后进行干燥,得到的硝酸纤维素膜;
(4)贴板、裁切得到2019新型冠状病毒igm抗体检测试纸条和2019新型冠状病毒igg抗体检测试纸条;再将上述两种试纸条分别置于双联检测卡的下板块内,将上板块的加样口和检测窗口分别与样品垫和硝酸纤维素膜对齐后与下板块进行组装,即可;
其中步骤(1)中的抗原包被液按照50mm、ph7.4的pbs中含有3wt%海藻糖和1.5v/v%甲醇进行配置,且所述2019新型冠状病毒n蛋白抗原和s蛋抗原的组合物与抗原包被液按照体积比1:2比例混合。
其中步骤(1)中2019新型冠状病毒的n蛋白抗原和s蛋白抗原的组合物中n蛋白抗原(终浓度为1.5mg/ml)和s蛋白(终浓度为3mg/ml)抗原按照体积比1:2的比例混合。
其中所述步骤(2)中的固相液按照50mmpbph7.4中含有0.1wt%酪蛋白、1wt%bsa+3wt%海藻糖、0.5wt%pvp和0.1v/v%吐温进行配置,且荧光标记的igm抗体和igg抗体与所述固相液均按照体积比1:5的比例混合。
其中步骤(3)中将喷膜后的硝酸纤维素膜放于15%~40%的湿度、37℃的温度下,干燥0.5h;再用1wt%bsa进行封闭抗原,封闭结束后放入干燥箱,在15%~40%的湿度、37℃的温度下,干燥2h即可。
实施例3
一种联合检测2019新型冠状病毒igm和igg抗体的干式免疫荧光试剂盒,所述试剂盒包括双联检测卡和检测缓冲液;所述双联检测卡内设有2019新型冠状病毒igm抗体检测试纸条和2019新型冠状病毒igg抗体检测试纸条,所述2019新型冠状病毒igm抗体检测试纸条和2019新型冠状病毒igg抗体检测试纸条分别包括样品垫、硝酸纤维素膜和吸水垫,其中样品垫上包被有抗绵羊红细胞抗体(将样品垫置于终浓度为5mg/ml抗绵羊红细胞抗体中浸泡30min,干燥处理后获得),硝酸纤维素膜上设有荧光抗体固相线、检测线和质控线。
其中所述2019新型冠状病毒igm抗体检测试纸条的硝酸纤维素膜的荧光抗体固相线包被有荧光标记的鼠抗人igm单抗,所述2019新型冠状病毒igg抗体检测试纸条的硝酸纤维素膜的荧光抗体固相线包被有荧光标记的鼠抗人igg单抗,且所述2019新型冠状病毒igm抗体检测试纸条和所述2019新型冠状病毒igg抗体检测试纸条的硝酸纤维素膜的检测线包被有2019新型冠状病毒的n蛋白抗原和s蛋白抗原的组合物,质控线包被有鼠抗人igg多抗。
其中检测缓冲液按照每100ml、20mmtris溶液中含有1.5wt%peg、8wt%s9和0.5v/v%pc300的进行配制。
其制备方法包括以下步骤:
(1)抗原蛋白组合物稀释液的制备:将抗原包被液与2019新型冠状病毒的n蛋白抗原和s蛋白抗原组合物混合,得到抗原蛋白组合物稀释液;
(2)荧光标记抗体稀释液的制备:将固相液与荧光标记的抗体混合,得到荧光标记抗体稀释液;
(3)喷膜:将荧光标记抗体稀释液、抗原蛋白组合物稀释液和鼠抗人igg多抗(2mg/ml)喷涂在2019新型冠状病毒igm抗体检测试纸条的硝酸纤维素膜上得到荧光抗体固相线、检测线和质控线,再用bsa进行封闭抗原,封闭结束后进行干燥,得到的硝酸纤维素膜;
(4)贴板、裁切得到2019新型冠状病毒igm抗体检测试纸条和2019新型冠状病毒igg抗体检测试纸条;再将上述两种试纸条分别置于双联检测卡的下板块内,将上板块的加样口和检测窗口分别与样品垫和硝酸纤维素膜对齐后与下板块进行组装,即可;
其中步骤(1)中的抗原包被液按照30mm、ph8.0的pbs中含有3wt%海藻糖和5v/v%甲醇进行配置,且所述2019新型冠状病毒n蛋白抗原和s蛋抗原的组合物与抗原包被液按照体积比1:8比例混合。
其中步骤(1)中2019新型冠状病毒的n蛋白抗原和s蛋白抗原的组合物中n蛋白抗原(终浓度1.5mg/ml)和s蛋白抗原(终浓度3mg/ml)按照体积比1:2的比例混合。
其中所述步骤(2)中的固相液按照50mm、ph8.0的pb中含有1wt%酪蛋白、8wt%bsa+8wt%海藻糖、5wt%pvp和1v/v%吐温进行配置,且荧光标记的igm抗体和igg抗体与所述固相液均体积比按照1:8的比例混合。
其中步骤(3)中将喷膜后的硝酸纤维素膜放于15%~40%的湿度、37℃的温度下,干燥0.5h;再用1wt%bsa进行封闭抗原,封闭结束后放入干燥箱,在15%~40%的湿度、37℃的温度下,干燥2h即可。
本试剂盒依据荧光免疫层析原理:当样本中含有新型冠状病毒covid-19igm、igg抗体时,covid-19igm抗体与荧光标记的鼠抗人igm单抗结合,covid-19igg抗体与荧光标记的鼠抗人igg单抗结合,在层析作用下迁移至检测线处时被新型冠状病毒n蛋白与s蛋白混合抗原所获取,形成复合物。荧光标记的鼠抗人igm单抗、荧光标记的鼠抗人igg单抗继续迁移至质控线处时,与羊抗鼠igg多抗结合,形成复合物。通过荧光免疫分析仪,检测covid-19igm、igg抗体的相对含量。
试剂盒操作步骤:
1.打开内包装,取出检测卡放于水平台面上;
2.取10μl血清、血浆样本或20μl全血样本到检测缓冲液中充分混匀;
3.在检测卡的加样孔中加入75ul稀释样本,室温平置10分钟;
4.将检测卡插入分析仪的卡槽中,确保检测卡方向正确并将其完全推入,开始检测,仪器将自动扫描检测卡,未在规定时间内的检测结果无效;
5.从分析仪的显示屏幕上读取或直接打印结果。
试剂盒阳性判断值或参考区间:
通过荧光免疫分析仪读出结果,
阴性:结果<1.0;结果为阴性,表明未检测出covid-19抗体;
可疑:1.0≤结果<1.2;建议使用其他适当的检测方法进行确认;
阳性:结果≥1.2。表明检测出covid-19抗体。
产品性能指标:
1.阴性符合率:用阴性参考品n1-n10进行检测,结果应均为阴性(阴性符合率:10/10)。
2.阳性符合率:用阳性参考品p1-p5进行检测,结果应均为阳性(阳性符合率:5/5)。
3.最低检出限:用最低检出限参考品s进行检测,结果应为阳性。
4.重复性:用重复性参考品r1、r2平行进行10人份检测,反应结果应均为阳性且变异系数应均不大于15.0%。
实施例4
试剂盒稳定性考察
将实施例2试剂盒置37℃进行破坏性试验,每天考察试剂盒稳定性,检测标准如下:
外观:包装盒整洁,内部组分齐全;铝箔袋封口整齐、严密。
阴性符合率:用阴性参考品n1-n10进行检测,结果应均为阴性阴性符合率:10/10,且试剂盒的准确度均满足要求。
阳性符合率:用阳性参考品p1-p10进行检测,结果应均为阳性阳性符合率:10/10,且试剂盒的准确度均满足要求。
covid-19igm和igg产品试剂盒稳定性考察结果如下:
表1试剂盒igm产品37℃加速破坏后阴性质控品检测结果
表2试剂盒igm产品37℃加速破坏后阳性质控品检测结果
表3试剂盒igg产品37℃加速破坏后阴性质控品检测结果
表4试剂盒igg产品37℃加速破坏后阳性质控品检测结果
通过上述表1-4的实验数据可以发现,经试验在37℃可稳定至少61天。根据稳定性实验原理,阿伦尼乌斯公式:d(ink)/dt=ea/rt2ea。常温保存24个月,相当于37度破坏61天。可满足医院诊所及卫生检疫部门的临床需求,也可用于大专院校和科研机构的疾病诊断研究。
实施例5
准确性考察
选取187例血清样本包含一定比例阳性和阴性414份血清标本进行检测,对可疑及临床诊断为新型冠状病毒阳性的标本进行考核试剂与核酸的对比试验,考核试剂为我公司生产的一种干式免疫荧光法联合检测covid-19igm和igg抗体的试剂盒,参比试剂为市场上认可度较好的核酸检测试剂盒。进行同步检测,分别记录结果。通过结果考察考核试剂与参比试剂的一致性以及与临床符合率情况。考核试剂与参比试剂检测结果统计见下表。187例血清标本,65例临床诊断为新冠病毒阳性患者,18例可疑人群患者,104例正常健康人群。其中,采集患者发病后4天(部分患者)、8天、11天、15天的标本均采集了;核酸检测结果为发病后8-11天左右采集样本进行检测的结果;104例正常健康人群体检的正常标本。
表5采样后试剂盒检测结果
表6试剂盒检出率统计表
从表5和表6中可看出,本发明中的一种联合检测covid-19igm和igg抗体的干式免疫荧光试剂盒,其主要性能指标完全能达到现有的核酸检测新型冠状病毒的水平,且符合临床辅助诊断要求。临床效果分析显示,检测的104例健康人群,全部呈阴性,未出现假阳性结果;本发明的试剂盒可以检测出“假阴性”(在发病极早期(4天内)3例,该试剂盒在患者发病8天内抗体的检出率为35%,第8-11天快速上升到约70%,在发病15天的检出率近100%;本发明的实施例试剂盒在18例可疑人群中检出2例,后经继续诊断治疗,最后确诊为新型冠状病毒患者。
为了更好的证明本发明的试剂盒具有较好的检测效果,以本发明实施例2作为对照,给出了对比例1、对比例2、对比例3、对比例4。
对比例1
与实施例2相比较其余操作相同,唯一的不同在于抗原包被的蛋白配方不同:
对比例1中的包被蛋白分别为单独的n蛋白、s蛋白而不是按照一定比例的混合。
用企业内部质控品检测对比试验,结果如下表7:
表7
注:“+”表示阳性;“-”表示阴性;通过荧光免疫分析仪读出结果,临界值:1.0。
阳性:结果≥1.0;阴性:结果<1.0。
结果表明:包被n蛋白与s蛋白混合抗原明显优于单独包被n蛋白或s蛋白,避免漏检,提高了检出率。
对比例2
与实施例1相比较其余操作相同,唯一的不同在于抗原包被液的配方不同:
对比例2
抗原包被液的配制如下:将磷酸氢二钠、磷酸二氢钠、氯化钠置于容量瓶内,加入双蒸水,轻摇使之完全溶解,然后继续加入双蒸水至100ml混匀,用浓盐酸调节ph为7.4。配制好后经0.45um的硝酸纤维素膜过滤后放在广口瓶瓶内,置于2~8℃保存;
用2人份阴性企业内部质控品、3人份阳性企业内部质控品检验,每个质控品重复10次,检测结果如下表8:
表8
注:“+”表示阳性;“-”表示阴性;通过荧光免疫分析仪读出结果,临界值:1.0。
阳性:结果≥1.0;阴性:结果<1.0;igm、igg分别用各自的质控品。
结果表明,抗原包被液中加入一定量的甲醇,提高了试剂盒的重复性,cv<15%,均符合要求,cv值均好于不加甲醇的抗原包被液的cv值。
对比例3
与实施例1相比较其余操作相同,唯一的不同在于抗原包被完毕后未经过bsa的封闭:
用企业内部质控品的检测对比试验,结果如下表9:
表9
注:“+”表示阳性;“-”表示阴性;通过荧光免疫分析仪读出结果,临界值:1.0。
阳性:结果≥1.0;阴性:结果<1.0;igm、igg分别用各自的质控品。
结果表明,用一定的bsa进行封闭抗原,提高了检测结果的特异性,消除假阳的同时并增强了结果的敏感性,整体灵敏度好于抗原未封闭。
对比例4
与实施例1相比较其余操作相同,不同在于检测缓冲液的配方不同:
对比例4检测缓冲液的配制方法:将121.1mg的tris置于容量瓶内,加入双蒸水,轻摇使之完全溶解,然后继续加入双蒸水至100ml,混匀后再用浓盐酸将其ph调节为8.0-8.5,加入1g牛血清白蛋白bsa最后加入0.5ml的pc300,经0.45um的硝酸纤维素膜过滤后,放在样本稀释液瓶内,置于2~30℃保存。
将本发明所述检测缓冲液置于37℃进行破坏性试验,考察其稳定性,检测标准如下:
(1)产品性能指标
检测缓冲液外观:应无色透明,显色度均一无差别。
阴性符合率:用阴性参考品n1-n5进行检测,结果应均为阴性阴性符合率:5/5,且试剂盒的准确度均满足要求。
阳性符合率:用阳性参考品p1-p5进行检测,结果应均为阳性阳性符合率:5/5,且试剂盒的准确度均满足要求。
(2)检验结果如下:
表10检测缓冲液物理状态稳定性结果
2.12019-ncovigm检测缓冲液性能稳定性结果
表11检测缓冲液37℃加速破坏后阴性质控品检测结果
表12检测缓冲液37℃加速破坏后阳性质控品检测结果
2.22019-ncovigg样本稀释液性能稳定性结果
表13检测缓冲液37℃加速破坏后阴性质控品检测结果
表14检测缓冲液37℃加速破坏后阳性质控品检测结果
试验表明,加有稳定剂的检测缓冲液保存期较长,可稳定至少24个月,期间样本稀释液的颜色、性状以及对于阳性质控品的性能均比常规只加有bsa的工作液保存期长,因此本检测缓冲液可作为试剂盒的较优选择。
通过上述实施例数据、临床实验数据、稳定性试验数据、对比例试验等检测数据可以证明,本发明的试剂盒具有较好的稳定性,而且准确、快速的检测2019新型冠状病毒,检出率高,操作简单,使用方便。
以上所述仅为本发明的较佳实施例例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!