一种基于GC-MS与酶化学法结合测定生物样本中尿素含量的方法与流程
本发明属于生物材料检测领域,具体涉及一种基于gc-ms与酶化学法检测生物样品中尿素含量的方法。
背景技术:
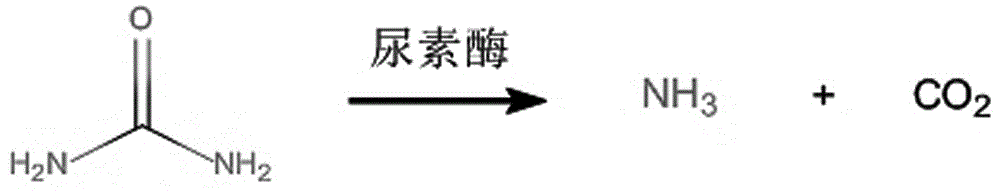
:尿素别名碳酰二胺、碳酰胺、脲。是由碳、氮、氧和氢组成的有机化合物。其化学公式为con2h4、co(nh2)2或cn2h4o,国际非专利药品名称为carbamide。外观是白色晶体或粉末。尿素在肝合成,是哺乳类动物排出的体内含氮代谢物。这代谢过程称为尿素循环。尿素是第一种以人工合成无机物质而得到的有机化合物。化学式:co(nh2)2,分子质量60.06,无色或白色针状或棒状结晶体,工业或农业品为白色略带微红色固体颗粒,无臭无味。含氮量约为46.67%,密度1.335g/cm3。溶于水、醇,不溶于乙醚、氯仿,呈弱碱性。casno.:57-13-6,分子量:60.05;熔点:131-135℃;沸点:196.6,折射率:n20/d1.40;闪光点:72.7℃,密度:1.335;水溶性:1080g/l(20℃)。化学性质:可与酸作用生成盐。有水解作用。在高温下可进行缩合反应,生成缩二脲、缩三脲和三聚氰酸。尿素于1828年被德国人wohler首次合成,并于20世纪50年代被广泛使用,作为反刍动物的非蛋白氮源。它为低毒物质,大鼠经口ld5015g/kg,小鼠经口ld50为11.5g/kg。反刍动物由于其独特的消化系统结构,使得它们能够利用尿素来合成蛋白质。在牛的瘤胃中存在着大量具有脲酶活性的微生物,当牛进食含有尿素的饲料时可以将尿素分解为氨,这些微生物能够通过氨化反应或转氨反应将氨与碳水化合物合成菌体蛋白(mcp),随后mcp在牛的真胃和小肠消化吸收。虽然尿素为低毒物质,但正因牛瘤胃中微生物能够分解尿素产氨这个特性,不恰当的使用反而会造成牛中毒死亡。主要原因如下:尿素管理不当,造成尿素被牛偷食或误食;饲料中尿素含量过高或尿素与饲料未混合均匀;投喂含尿素的饲料时同时饲喂含尿素酶的大豆饼或蚕豆;牛在食用含有尿素的饲料后大量饮水。以上均能导致尿素迅速分解,产生大量氨,导致牛瘤胃中的微生物无法将氨全部利用,以至于氨经瘤胃壁吸收入血导致中毒。在司法鉴定工作中时常会遇到牛尿素中毒的案件,而以现有技术报道方法无法很好地解决这类问题。因此,研制开发一种可快速准确的检测生物样品中尿素的方法一直是亟待解决的新课题。技术实现要素:尿素由于分子极性很大,且很难气化,无法直接利用气相色谱-质谱联用技术(gc-ms)检测。鉴于现有技术存在的问题,本发明的目的在于提供一种准确、简便的检测生物样品中尿素的方法,通过脲酶和衍生化试剂对尿素处理后,使用gc-ms来间接检测尿素的方法,能够有针对性的检测出生物样品中的尿素含量,可排除许多外界因素的干扰,提高了检测的灵敏度,同时大大简化了检测步骤,节省了时间和成本。为了实现上述目的,本发明采用以下技术方案。一种基于gc-ms与酶化学法结合测定生物样本中尿素含量的方法,具体包括以下步骤。(1)检测条件。气质联用仪:采用气相色谱-质谱联用仪(gc-ms)。色谱柱:hp-5ms毛细管柱,规格:30m×0.25mm,0.25μm。前进样口温度、ei离子源温度、四极杆温度和接口温度分别为280℃、150℃、230℃、280℃,质谱仪采用单离子检测扫描(sim)模式,电子能量为70ev。载气为高纯氦气(99.999%),流速为1.0ml/min,不分流进样1μl。升温程序:初始柱温60℃,保持1min,随后以20℃/min的升温速率升至280℃,保持11min。(2)样品处理。取2份待检血样或其他生物样本0.5ml分别置于10ml离心管中,加入200μg/ml内标10μl,加入pbs缓冲液1ml后再加入22u/ml尿素酶0.5ml,另一份添加0.5mlpbs缓冲液,密封后放入45℃水浴锅中温育30min。此时尿素可全部被尿素酶分解为氨,待样品冷却后,加入3mol/lnaoh溶液1ml,再加入50μl衍生化试剂七氟丁酰氯并在水浴锅中40℃水浴10min,以对氨和内标进行衍生化。水浴结束后加入2ml乙酸乙酯:正己烷=9:1,随后在涡旋仪上震荡5min以萃取,8000rpm/min离心5min。取上层有机溶剂1ml,干燥氮气吹至近干后取1μl于gc-ms进样分析。(3)图谱分析。衍生化产物七氟丁酰胺,保留时间3.0min,特征质量数为m/z214(分子离子峰)、m/z194、m/z166、m/z146、m/z100、m/z69和m/z44(基峰)。(4)标准工作曲线样品溶液的制备。尿素酶溶液配置:将尿素酶溶于ph7.4磷酸盐缓冲液(pbs)中,配置成22u/ml的尿素酶溶液(由于尿素酶的活性会随时间降低,尽量现用现配)。内标配置:取适量1,6-己二胺,用0.1mol/lhcl稀释至200μg/ml,4℃冷藏储存。尿素工作液配置:根据所需线性范围将尿素稀释成不同浓度尿素标准液,超声波清洗机超声除菌10min,-20℃冰冻储存。(5)含量计算。将步骤(4)中制成的标准工作曲线样品溶液按照步骤(2)中样品处理的方法进行处理后进样分析。选择检测m/z100的选择离子色谱图,以衍生化产物七氟丁酰胺的峰面积为纵坐标,以血中添加尿素的质量浓度为横坐标,计算回归方程,计算含量时,将待测样品中七氟丁酰胺的峰面积代入回归方程即得到待测样品含量。所述的生物样本为尿液、胃内容物或血浆样品。该方法的最低检出限以s/n=3进行计算,对于血中尿素的最低检出限为0.05μg/ml,定量限为0.10μg/ml。与现有技术相比,本发明的有益效果如下。1、本发明提供的基于gc-ms与酶化学法结合测定生物样本中尿素含量的方法检测原理为间接测定生物样品中的尿素。2、本发明提供的基于gc-ms与酶化学法结合测定生物样本中尿素含量的方法采用的是衍生化后的质谱法,而非传统的光谱法。可将血液凝固状态、溶血、试剂干扰等一些外界影响因素有效降低。3、本发明提供的基于gc-ms与酶化学法结合测定生物样本中尿素含量的方法所用到的试剂种类更少,操作简单快速。4、本发明提供的基于gc-ms与酶化学法结合测定生物样本中尿素含量的方法可检测的生物材料包括尿液、胃内容物或血浆样品。5、本发明提供的基于gc-ms与酶化学法结合测定生物样本中尿素含量的方法用gc-ms检测尿素的方法,该方法利用尿素酶能专一地分解尿素地特性,将尿素转化为氨,再利用七氟丁酰氯与之较为迅速、完全地反应,使不能被gc-ms检测地尿素得以被检测与定量。该方法灵敏度较光谱法更高,线性关系较好。附图说明图1是尿素酶分解尿素化学式。图2是衍氨与七氟丁酰氯衍生化反应(主反应)。图3是不同碱性体系对衍生化效果的影响。图4是不同温度对衍生化效果的影响。图5是不同反应时间对衍生化效果的影响。图6是尿素经气相色谱质谱联用仪测定(典型的色谱图)。图7是尿素经气相色谱质谱联用仪测定(典型的质谱图)。图8是血中添加尿素线性关系图。具体实施方式下面结合附图和实施例对本发明的具体实施方式作进一步详细描述。以下实施例详细说明了本发明,但不用于限制本发明的范围。本实施例采用常规实验技术,这些均是本
技术领域:
人员所熟悉的,可以按照本实施例使用材料厂商所提供的说明书即可进行。实施例1基于gc-ms与酶化学法结合测定生物样本中尿素含量的方法相关反应过程和条件的优化。尿素酶是一种含镍的寡聚酶,最适ph值为7.4,具有绝对专一性,能够特异性地催化尿素分解为氨和二氧化碳,反应过程如图1所示。由尿素酶分解尿素产生的氨随后与衍生化试剂七氟丁酰氯反应,生成七氟丁酰胺,从而被气相色谱-质谱检出。反应方程式见图2。在此反应体系中,有两步平衡需要控制。第一,反应体系中pbs缓冲溶液用量,在尿素酶分解尿素过程中,一分子尿素生成两分子氨,并与水分子结合生成氨水,使尿素酶反应环境变为碱性,而尿素酶在ph约9的条件下失活。当样本中尿素含量过高时,尿素酶还未将尿素全部分解就已失活,在这种状况下可以适当增加pbs缓冲液容量。在本发明反应体系中共加入2mlpbs缓冲液,最大能完全分解尿素浓度约6mg/ml的样本;第二,七氟丁酰氯用量和碱液使用量,七氟丁酰氯与氨、水反应产酸,反应产物七氟丁酰胺在酸性条件下以离子形式存在,而无法被有机溶剂提取。基于此原因,在进行衍生化之前应加入适量碱液,使反应结束后下层水溶液恰好变为弱碱性,使待检物质七氟丁酰胺游离出来,加入碱液使酸碱中和,也起到了促使反应向正方向进行的作用。在第二步衍生化步骤中我们考察了不同的碱性体系、不同温度、不同反应时间对整个检测过程的影响,结果如图3-图5所示,最终选择了当ph为14,40摄氏度下反应5分钟这样的衍生化条件。此外,在使用有机溶剂萃取时,由于乙酸乙酯与水密度接近且反应体系为碱性,若单用乙酸乙酯提取容易导致乳化,使用乙酸乙酯:正己烷=9:1作为萃取液时能很好地避免乳化现象。2.色谱-质谱图(最低检测限)。尿素经过酶解后,与七氟丁酰氯反应,得到的典型产物质谱图见图6-7所示。3.标准曲线(以血中添加为例)。准确吸取尿素标准工作液适量,分别加入0.5ml空白血浆中,配置成尿素浓度为0.1μg/ml、10μg/ml、200μg/ml、1mg/ml、3mg/ml、5mg/ml的添加血浆样本,按照上述操作步骤对血样进行前处理,减去添加尿素酶的空白血浆中总氨后,以浓度为横坐标(x),氨的衍生化产物(七氟丁酰胺)与内标衍生化产物峰之比为纵坐标(y),线性关系见图8所示,得出一元线性方程为y=0.0793x+1.9703(r2=0.9994,p<0.0001)。4、方法学考察。4.1回收率与精密度。分别对三份样本进行日内和日间精密度考察,计算七氟丁酰胺峰面积与内标峰面积之间的比值。测得日内精密度rsd=3.7-6.2%;日间精密度rsd=4.0%-6.8%。在0.5ml空白样本中分别添加尿素10μg/ml、1mg/ml、5mg/ml,衍生化后减去空白血样中原本存在的尿素以计算回收率,平行测量三次。低、中、高三个浓度组平均回收率在90.3%-97.5%之间。4.2稳定性实验。基于七氟丁酰氯极其活泼的化学性质,氨与之发生的亲核取代反应所形成的共价键十分稳定,在一般外界条件下不易断裂。在对放置0h、12h、24h、48h和96h经前处理后的样本中七氟丁酰胺与内标衍生化产物峰面积比值进行比较后发现,在0-96h内该比值较为稳定p=0.8621(p>0.05),rsd=1.65%。实施例2实际案例应用。一种基于gc-ms与酶化学法结合测定生物样本中尿素含量的方法,具体包括以下步骤。(1)检测条件。气质联用仪:采用气相色谱-质谱联用仪(gc-ms)。色谱柱:hp-5ms毛细管柱,规格:30m×0.25mm,0.25μm。前进样口温度、ei离子源温度、四极杆温度和接口温度分别为280℃、150℃、230℃、280℃,质谱仪采用单离子检测扫描(sim)模式,电子能量为70ev。载气为高纯氦气(99.999%),流速为1.0ml/min,不分流进样1μl。升温程序:初始柱温60℃,保持1min,随后以20℃/min的升温速率升至280℃,保持11min。(2)样品处理。取待检牛血样0.5ml分别置于10ml离心管中,加入200μg/ml内标10μl,加入pbs缓冲液1ml后再加入22u/ml尿素酶0.5ml(另一份添加0.5mlpbs缓冲液),密封后放入45℃水浴锅中温育30min。此时尿素可全部被尿素酶分解为氨,待样品冷却后,加入3mol/lnaoh溶液1ml,再加入50μl衍生化试剂七氟丁酰氯并在水浴锅中40℃水浴10min,以对氨和内标进行衍生化。水浴结束后加入2ml乙酸乙酯:正己烷=9:1,随后在涡旋仪上震荡5min以萃取,8000rpm/min离心5min。取上层有机溶剂1ml,干燥氮气吹至近干后取1μl于gc-ms进样分析。(3)图谱分析。衍生化产物七氟丁酰胺,保留时间3.0min,特征质量数为m/z214(分子离子峰)、m/z194、m/z166、m/z146、m/z100、m/z69和m/z44(基峰)。(4)标准工作曲线样品溶液的制备。尿素酶溶液配置:将尿素酶溶于ph7.4磷酸盐缓冲液(pbs)中,配置成22u/ml的尿素酶溶液(由于尿素酶的活性会随时间降低,尽量现用现配)。内标配置:取适量1,6-己二胺,用0.1mol/lhcl稀释至200μg/ml,4℃冷藏储存。尿素工作液配置:根据所需线性范围将尿素稀释成不同浓度尿素标准液,具体浓度分别为0.1μg/ml、10μg/ml、200μg/ml、2000μg/ml、5000μg/ml,超声波清洗机超声除菌10min,-20℃冰冻储存。(5)含量计算。将步骤(4)中制成的标准工作曲线样品溶液按照步骤(2)中样品处理的方法进行处理后进样分析。选择检测m/z100的选择离子色谱图,以衍生化产物七氟丁酰胺的峰面积为纵坐标,以血中添加尿素的质量浓度为横坐标,计算回归方程得到y=0.0793x+1.9703(r2=0.9994)。计算含量时,将待测样品中七氟丁酰胺的峰面积代入回归方程即得到待测样品含量。采用上述提供的基于gc-ms与酶化学法结合测定生物样本中尿素含量的方法测定了7个案例中的牛血中尿素的含量,具体尿素含量见表1。实验结果表明该测定方法有很强的应用性。表1.7个案例中的牛血中尿素的含量。牛血尿素含量(mmol/l)氨含量(mmol/l)no.114.447.54no.26.059.7no.32.6315.61no.46.086.08no.52.93415no.616.413.86no.79.247.43当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1