一种广谱型微囊藻毒素酶联免疫检测试剂盒的制作方法
本发明涉及生物检测领域,特别涉及一种检测微囊藻毒素总量的酶联免疫检测试剂盒。
背景技术:
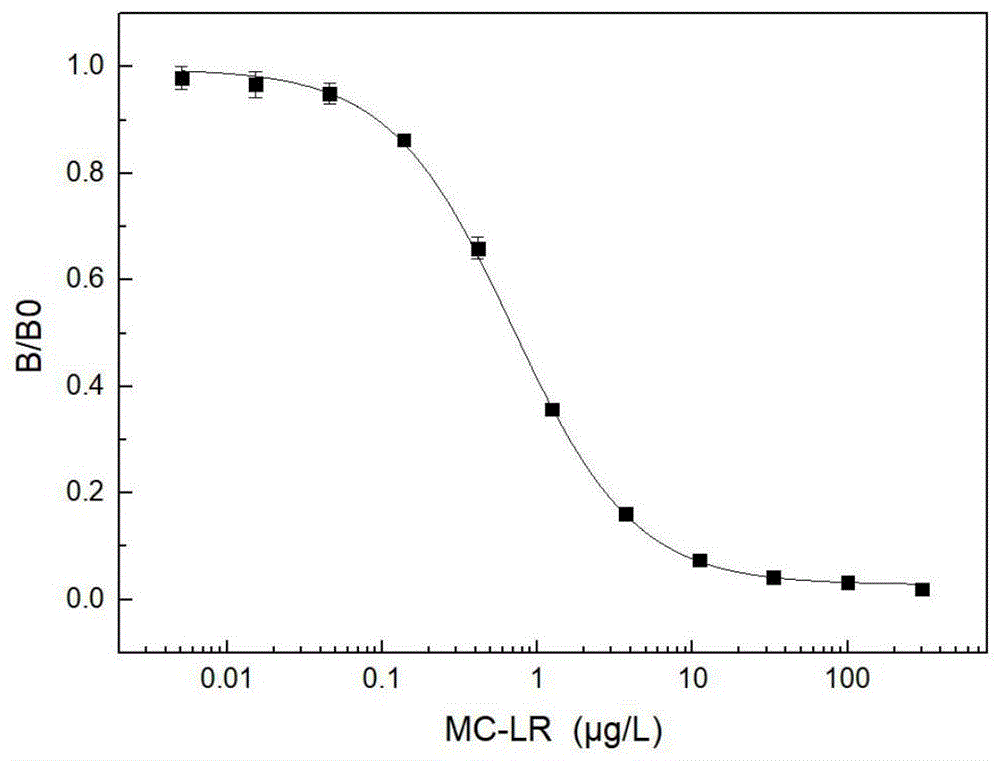
:微囊藻毒素(microcystins,mcs)是水华爆发时,微囊藻属、鱼腥藻属等蓝藻产生的次级代谢产物,是淡水中分布最广泛的蓝藻毒素之一。mcs是一类具有共性环状七肽结构的小分子,由5个非蛋白原氨基酸(如脱氢丙氨酸衍生物和特殊的β-氨基酸adda等)和2个蛋白原氨基酸(第2位和第4位的可变氨基酸)组成,其化学结构式如式1所示。到目前为止已有超过100个微囊藻毒素异构体被报道,自然界中分布较广的mc异构体为mc-lr、mc-rr和mc-yr(l、r、y分别代表亮氨酸、精氨酸和酪氨酸)。mcs化学性质稳定,能够强烈抑制蛋白磷酸酶的活性,还是强烈的肝脏肿瘤促进剂,严重威胁着生态环境安全和人类健康,发展水中微囊藻毒素总量的及时准确监测技术十分迫切且重要。目前对水中微囊藻毒素的检测技术主要有高效液相色谱、高效液相色谱-串联质谱、酶联免疫吸附试验、免疫传感器检测以及蛋白磷酸酶抑制试验等。常规的仪器分析技术具有准确性好、灵敏度高等优势,但依赖于价格昂贵、占地面积大的分析仪器,且检测费用高、对技术人员的操作要求较高等不足;更为不足的是,仪器分析技术只能通过对单个微囊藻毒素异构体进行检测和浓度加和获得微囊藻毒素总量浓度。由于微囊藻毒素异构体众多,性质近似,目前尚没有针对所有异构体建立相应的检测条件和方法,且无法获得一些尚未得到鉴定的微囊藻毒素浓度信息。免疫检测是基于抗原-抗体特异性亲和反应原理建立的一种快速分析方法,通过筛选获得针对mcs具有广谱性识别能力的抗体,结合酶放大发展的广谱型微囊藻毒素酶联免疫检测(enzyme-linkedimmunosorbentassay,elisa)试剂盒具有检测广谱性强、灵敏度高、分析通量大、检测速度快、费用低廉等优点,能适应大规模样品的微囊藻毒素总量快速筛查和预警监测。目前已有的微囊藻毒素检测试剂盒大部分只能检测一种微囊藻毒素异构体,无法直接检测微囊藻毒素总量。技术实现要素:本发明的目的是提供一种广谱型微囊藻毒素酶联免疫检测试剂盒。本发明所提供的微囊藻毒素酶联免疫检测试剂盒,包括包被抗原、微囊藻毒素单克隆抗体溶液以及酶标二抗;所述包被抗原由下述12种抗原组成:nh2-mc-lr-bsa、nh2-mc-rr-bsa、nh2-mc-yr-bsa、nh2-mc-la-bsa,nh2-mc-lf-bsa、nh2-mc-lw-bsa,、nh2-mc-ly-bsa、nh2-mc-wr-bsa、nh2-mc-htyr-bsa、nh2-mc-hilr-bsa、nh2-[d-asp3]mc-lr-bsa和nh2-[d-asp3]mc-rr-bsa;其中所述nh2-mc-lr-bsa为氨基修饰的mc-lr与bsa偶联物;所述nh2-mc-rr-bsa为氨基修饰的mc-rr与bsa偶联物;所述nh2-mc-yr-bsa为氨基修饰的mc-yr与bsa偶联物;所述nh2-mc-la-bsa为氨基修饰的mc-la与bsa偶联物;所述nh2-mc-lf-bsa为氨基修饰的mc-lf与bsa偶联物;所述nh2-mc-lw-bsa为氨基修饰的mc-lw与bsa偶联物;所述nh2-mc-ly-bsa为氨基修饰的mc-ly与bsa偶联物;所述nh2-mc-wr-bsa为氨基修饰的mc-wr与bsa偶联物;所述nh2-mc-htyr-bsa为氨基修饰的mc-htyr与bsa偶联物;所述nh2-mc-hilr-bsa为氨基修饰的mc-hilr与bsa偶联物;所述nh2-[d-asp3]mc-lr-bsa为氨基修饰的[d-asp3]mc-lr与bsa偶联物;所述nh2-[d-asp3]mc-rr-bsa为氨基修饰的[d-asp3]mc-rr与bsa偶联物;所述微囊藻毒素单克隆抗体溶液是将微囊藻毒素单克隆抗体用磷酸盐缓冲液稀释,再加入牛血清白蛋白和硫柳汞得到的液体。所述组成包被抗原的12种抗原的等质量组合,得到包被抗原。所述氨基修饰的mc-lr为式2中r1为亮氨酸、r2为精氨酸和r3为甲基的化合物;所述氨基修饰的mc-rr为式2中r1为精氨酸、r2为精氨酸和r3为甲基的化合物;所述氨基修饰的mc-yr为式2中r1为酪氨酸、r2为精氨酸和r3为甲基的化合物;所述氨基修饰的mc-la为式2中r1为亮氨酸、r2为丙氨酸和r3为甲基的化合物;所述氨基修饰的mc-lf为式2中r1为亮氨酸、r2为苯丙氨酸和r3为甲基的化合物;所述氨基修饰的mc-lw为式2中r1为亮氨酸、r2为色氨酸和r3为甲基的化合物;所述氨基修饰的mc-ly为式2中r1为亮氨酸、r2为酪氨酸和r3为甲基的化合物;所述氨基修饰的mc-wr为式2中r1为色氨酸、r2为精氨酸和r3为甲基的化合物;所述氨基修饰的mc-htyr为式2中r1为高酪氨酸、r2为精氨酸和r3为甲基的化合物;所述氨基修饰的mc-hilr为式2中r1为同异亮氨酸、r2为精氨酸和r3为甲基的化合物;所述氨基修饰的[d-asp3]mc-lr为式2中r1为亮氨酸、r2为精氨酸和r3为氢的化合物;所述氨基修饰的[d-asp3]mc-rr为式2中r1为精氨酸、r2为精氨酸和r3为氢的化合物。其中,所述微囊藻毒素单克隆抗体是以抗原a为免疫原得到的抗体;所述抗原a由nh2-mc-lr-klh、nh2-mc-rr-klh、nh2-mc-yr-klh、nh2-mc-la-klh,nh2-mc-lf-klh、nh2-mc-lw-klh,、nh2-mc-ly-klh、nh2-mc-wr-klh、nh2-mc-htyr-klh、nh2-mc-hilr-klh、nh2-[d-asp3]mc-lr-klh和nh2-[d-asp3]mc-rr-klh组成;其中所述nh2-mc-lr-klh为氨基修饰的mc-lr与klh偶联物;所述nh2-mc-rr-klh为氨基修饰的mc-rr与klh偶联物;所述nh2-mc-yr-klh为氨基修饰的mc-yr与klh偶联物;所述nh2-mc-la-klh为氨基修饰的mc-la与klh偶联物;所述nh2-mc-lf-klh为氨基修饰的mc-lf与klh偶联物;所述nh2-mc-lw-klh为氨基修饰的mc-lw与klh偶联物;所述nh2-mc-ly-klh为氨基修饰的mc-ly与klh偶联物;所述nh2-mc-wr-klh为氨基修饰的mc-wr与klh偶联物;所述nh2-mc-htyr-klh为氨基修饰的mc-htyr与klh偶联物;所述nh2-mc-hilr-klh为氨基修饰的mc-hilr与klh偶联物;所述nh2-[d-asp3]mc-lr-klh为氨基修饰的[d-asp3]mc-lr与klh偶联物;所述nh2-[d-asp3]mc-rr-klh为氨基修饰的[d-asp3]mc-rr与klh偶联物。所述微囊藻毒素单克隆抗体可按照下述方法制备:用完全抗原a免疫小鼠,取免疫小鼠的脾细胞,与小鼠骨髓瘤细胞融合,筛选出阳性杂交瘤细胞株;培养所述阳性杂交瘤细胞株或将所述阳性杂交瘤细胞株注入同系小鼠腹腔诱生腹水,得到微囊藻毒素的单克隆抗体。所述用于免疫的小鼠具体可为balb/c小鼠;免疫方法为:首次免疫每只小鼠免疫所述抗原b50μg;之后按照30μg所述抗原b/只小鼠的剂量对小鼠进行加强免疫,免疫间隔时间为2周,共加强免疫6次;所述小鼠骨髓瘤细胞为小鼠骨髓瘤细胞sp2/0。所述筛选阳性杂交瘤细胞株的方法具体可为:先用包被抗原筛选1-2次,再用12种bsa-mc单体筛选至少1次;所述包被抗原为将经氨基修饰的微囊藻毒素与载体蛋白bsa偶联得到的完全抗原b;本发明利用上述免疫方法和筛选方法,用合成的完全抗原免疫小鼠,得到了针对完全抗原的微囊藻毒素的抗体。所述方法中还可包括纯化所述单克隆抗体的步骤,将上述腹水或上层培养液分离纯化后,即获得抗微囊藻毒素的单克隆抗体。为提高单克隆抗体的纯度,可用免疫亲和层析方法对其进行纯化。所述阳性杂交瘤细胞株具体可为分泌抗微囊藻毒素单克隆抗体的小鼠杂交瘤细胞株mcab1,其保藏号为cgmccno.19194。所述微囊藻毒素的单克隆抗体,具体可由保藏号为cgmccno.19194的小鼠杂交瘤细胞株mcab1产生。能分泌抗微囊藻毒素单克隆抗体的小鼠杂交瘤细胞株mcab1,已于2019年12月10日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址是中国北京市海淀区中关村北一条13号),保藏编号为cgmccno.19194。所述抗体溶液是将保藏号为cgmccno.19194的杂交瘤细胞株mcab1产生的单克隆抗体用磷酸盐缓冲液稀释,再加入牛血清白蛋白和硫柳汞得到的液体。抗体溶液中,单克隆抗体mcab1的含量为0.0625μg/ml,bsa的含量为1%(质量百分含量),硫柳汞的含量为0.01%(质量百分含量)。其中,磷酸盐缓冲液是浓度为0.01m,ph值为7.0-7.2的pbs缓冲液,其配置方法如下:8.0gnacl、0.2gkcl、2.9gna2hpo4·12h2o、0.24gkh2po4,1l去离子水。所述酶标二抗的标记酶可为辣根过氧化物酶。为了更方便现场监控和大量样本筛查,所述试剂盒还包括微囊藻毒素标准品溶液、显色剂、终止液、洗涤液和底物溶液等酶联免疫检测用溶液。本检测试剂盒具体可包括:微囊藻毒素标准溶液试剂瓶;上述广谱型微囊藻毒素单克隆抗体溶液试剂瓶;酶标二抗溶液试剂瓶;样品稀释液试剂瓶;洗涤液试剂瓶;显色剂溶液试剂瓶;终止液试剂瓶;酶标板和试剂盒盒体。试剂瓶和酶标板均安装在试剂盒盒体内。酶标板是包被了上述包被抗原的96孔聚苯乙烯微量反应板。所述还包括微囊藻毒素-lr标准品溶液、显色剂、样品稀释液、终止液和洗涤液。所述样品稀释液为含有吐温-20和明胶的磷酸盐缓冲液,其中吐温-20的体积百分含量为0.1%,明胶的质量百分含量为0.1%。所述洗涤液为含0.05%吐温-20和8g/l氯化钠的0.01mol/l磷酸盐缓冲液。所用试剂的配制和酶标板的包被如下:a)标准溶液的配制:以微囊藻毒素-lr作为标准品,分别配制成一系列浓度梯度的微囊藻毒素标准溶液,分别灌装入微囊藻毒素标准品试剂瓶中。其中,中浓度应该接近标准曲线的半抑制浓度(ic50)、低浓度和高浓度应分别接近试剂盒定量检测区间最低和最高检测浓度。b)抗体溶液配制:将上述微囊藻毒素单克隆抗体用磷酸盐缓冲液稀释成工作浓度,并加入0.5%-5%的牛血清白蛋白(bsa)和防腐剂,灌装入试剂瓶中。c)样品稀释液配制:1000ml磷酸盐缓冲液中添加1ml吐温-20和1g明胶。d)酶标二抗溶液配制:辣根过氧化物酶-羊抗鼠igg原液,灌装入试剂瓶中,使用时用样品稀释液稀释成工作浓度。e)洗涤液配制:配制含吐温-20的pbs干粉,或配制n倍含吐温-20的磷酸盐缓冲液(n=1-12),灌装入试剂瓶中。使用时,将该溶液用纯水稀释成含0.05%吐温-20和8g/l氯化钠的0.01mol/lph=7.5磷酸盐缓冲液。f)显色剂溶液:采用从北京索莱宝科技有限公司购买的双组分tmb显色液。g)终止液配制:1mol/lh2so4溶液,灌装入试剂瓶中。h)酶标板的包被:采用聚苯乙烯酶标板包被,包被抗原采用上述完全抗原a;封闭采用大分子蛋白,真空封装。本发明的微囊藻毒素间接竞争elisa试剂盒的使用方法是将标准溶液或样品溶液与适当稀释的抗微囊藻毒素抗体依次加入酶标板小孔中,同时设置空白和阴性对照孔,37℃温育0.5-1h,倒出孔内液体,重复用洗涤液洗涤3-5次,将酶标板倒置在吸水纸上排干;加入适当稀释度的酶标二抗溶液于酶标板小孔中,或37℃温育0.5-1h,用洗涤液重复洗3-5次,排干;加入显色剂溶液到酶标板小孔中,室温下反应10-15min,颜色显蓝色,再加入终止液,立即变成黄色;用酶标仪在波长450m处测定吸光度a,以不加抗体的小孔作为空白调零。测定系列微囊藻毒素标准溶液孔的吸光度a,以各浓度的吸光度a为纵坐标,以对应微囊藻毒素浓度的1og值为横坐标,绘制半对数标准曲线图。以待测样品溶液的吸光度,在标准曲线上查出相应的微囊藻毒素浓度,再换算出样品中微囊藻毒素的含量。本发明采用方阵试验,确定最佳的包被抗原浓度(0.5μg/ml)和抗体工作浓度(0.0625μg/ml)。设置包被抗原浓度分别为4μg/ml、2μg/ml、1μg/ml、0.5μg/ml、0.25μg/ml、0.125μg/ml、0.0625μg/ml、0.0313μg/ml;抗体工作浓度分别为1μg/ml、0.5μg/ml、0.25μg/ml、0.125μg/ml、0.0625μg/ml、0.03125μg/ml。分别设置空白孔和抑制孔,抑制孔标准品浓度为10ng/ml。分别计算各组抑制率,选择抑制率大,空白孔的吸光度值在1.0左右的组合。本发明的微囊藻毒素酶联免疫检测试剂盒的检测原理:使用时将标准品或样品和抗体依次加入酶标板中,标准品或样品中的抗原和固相载体上的包被抗原一起竞争性地与溶液中的抗体结合,洗涤去除游离的抗原以及抗原抗体复合物,与固相载体上包被抗原结合的抗体再与酶标二抗结合,用酶底物进行测定,结合的酶标记物将无色的显色剂转化为有色的产物。加入反应终止液后用酶标仪测量吸光度,吸光度与样品中的微囊藻毒素浓度成反比,绘制标准曲线,对样品浓度进行测定。本发明的广谱型微囊藻毒素酶联免疫检测试剂盒,具有对mcs异构体广谱响应能力强、灵敏度高、分析通量大、检测速度快、费用低廉等优点,可适用于水中、动物源淡水产品(如鱼类、蚌壳类等)以及植物源淡水产品中微囊藻毒素总量的定量检测。例如实施例2中的广谱型微囊藻毒素酶联免疫检测试剂盒,其对mc-lr检出限为0.10μg/l,定量检测区间在0.22μg/l-2.25μg/l之间,可同时检测上百个样品,单次检测时间小于3小时。例如实施例2中的广谱型微囊藻毒素酶联免疫检测试剂盒,其对河水中12种mcs异构体的回收率在(54.6±2.5)%~(142.4±1.6)%,批内误差小于7%。例如实施例2中的广谱型微囊藻毒素酶联免疫检测试剂盒,其对河水、湖水及自来水中mc-lr,mc-rr,mc-yr异构体的回收率平均值为(93.1±10.8)%,批内误差小于15%。本发明的广谱型微囊藻毒素酶联免疫检测试剂盒对至少12种mcs具有广谱响应能力,准确度和精密度符合要求,能进行环境样品中微囊藻毒素总量的大规模快速筛查和预警监测。保藏说明生物材料的的分类命名:分泌微囊藻毒素广谱型抗体的阳性小鼠杂交瘤细胞株。生物材料的编号:mcab1。保藏单位全称:中国微生物菌种保藏管理委员会普通微生物中心。保藏单位简称:cgmcc。地址:北京市朝阳区北辰西路1号院3号。保藏日期:2019年12月10日。保藏编号:cgmccno.19194。附图说明图1为实施例2的广谱型微囊藻毒素酶联免疫检测试剂盒对微囊藻毒素-lr的间接竞争标准曲线。图2为实施例2的广谱型微囊藻毒素酶联免疫检测试剂盒对微囊藻毒素-rr的间接竞争标准曲线。图3为实施例2的广谱型微囊藻毒素酶联免疫检测试剂盒对微囊藻毒素-yr的间接竞争标准曲线。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本
技术领域:
普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中所用方法如无特别说明均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。骨髓瘤细胞sp2/0种子(北京华大蛋白质研发中心);spf级balb/c纯系雌性小鼠(斯贝福北京生物技术有限公司);新生牛血清(南京维森特生物技术有限公司);酶标二抗(羊抗小鼠igg/hrp)(北京中杉金桥生物技术有限公司);peg1500(roche公司);hat储液、ht储液、石蜡油、bsa、klh、三羟甲基氨基甲烷盐酸盐(tris-hcl)、2.2%甲基纤维素、2-巯基乙胺、戊二醛、柠檬酸、柠檬酸钠、氯化钠、磷酸氢二钠、磷酸二氢钠、碳酸盐缓冲液、四甲基联苯胺(tmb)、过氧化氢合尿素(co(nh2)2·h2o2)、吐温-20、弗氏完全佐剂、弗氏不完全佐剂(sigma-aldrich公司);imdm培养基(invitrogen公司);二甲基亚砜(dmso)(amresco公司);buphpbs缓冲液(thermofisherscientific公司);赖氨酸(上海源叶生物科技有限公司);无水乙醚、乙酸、异丙醇、甲醇、盐酸、硫酸、氢氧化钠(北京化工厂);mc-lr、mc-rr、mc-yr、mc-la、mc-lf、mc-lw、mc-ly、mc-wr、mc-htyr、mc-hilr、[d-asp3]mc-lr、[d-asp3]mc-rr(enzolifesciences公司)。实施例1、阳性杂交瘤细胞株的获得、鉴定以及广谱型微囊藻毒素单克隆抗体的制备1、免疫原klh-mcs的合成上述12种微囊藻毒素小分子结构变异体,分别在其第七位氨基酸(mdha)上通过2-巯基乙胺化学修饰引入一个氨基活性基团,经固相萃取纯化后采用戊二醛两步法分别将修饰后的微囊藻毒素分子与klh偶联,再经凝胶过滤层析后得到12种完全抗原,等量混合后得到免疫原klh-mcs。具体方法如下:步骤1氨基修饰的微囊藻毒素分子与klh偶联物的制备1.1、氨基修饰的mc-lr与klh偶联物的制备将摩尔比3000:1的2-巯基乙胺和微囊藻毒素小分子mc-lr溶于碱性碳酸盐缓冲液中(ph=8.0),50℃水浴中反应1-3小时;降至室温后加入乙酸使反应停止得到中间产物;将中间产物采用固相萃取技术在spe固相萃取c18小柱(500mg/6ml)(agelatechnologies)上进行纯化,得到氨基修饰的mc-lr,具体纯化步骤为:活化:先用甲醇活化柱子,15分钟后将超纯水以一定的流速流过柱子;上样:将样品以一定的流速流过柱子进行富集浓缩,重力过滤;淋洗:上样完毕后,用5%体积比的甲醇水溶液淋洗以净化样品;洗脱:用甲醇洗脱样品并收集,得到经氨基修饰的mc-lr。20mg载体蛋白klh,先用少量pbs充分溶解,再加入2ml1.25%的戊二醛溶液,室温反应12h以上,活化产物经sephadexg-25pd-10desaltingcolumn(gehealthcare)进行层析,其中流动相为超纯水,得到活化后的klh,并用pbs溶液稀释;0.5mg活化后的klh与30μg氨基修饰的mc-lr充分混合,室温下反应24h,得到氨基修饰的mc-lr与klh偶联物,以下简称为nh2-mc-lr-klh,将nh2-mc-lr-klh放置于-20℃冰箱中备用。1.2、氨基修饰的mc-rr与klh偶联物的制备将步骤1.1中的mc-lr替换为mc-rr,其它操作完全相同,得到氨基修饰的mc-rr与klh偶联物,以下简称为nh2-mc-rr-klh,将nh2-mc-rr-klh放置于-20℃冰箱中备用。1.3、氨基修饰的mc-yr与klh偶联物的制备将步骤1.1中的mc-lr替换为mc-yr,其它操作完全相同,得到氨基修饰的mc-yr与klh偶联物,以下简称为nh2-mc-yr-klh,将nh2-mc-yr-klh放置于-20℃冰箱中备用。1.4、氨基修饰的mc-la与klh偶联物的制备将步骤1.1中的mc-lr替换为mc-la,其它操作完全相同,得到氨基修饰的mc-la与klh偶联物,以下简称为nh2-mc-la-klh,将nh2-mc-la-klh放置于-20℃冰箱中备用。1.5、氨基修饰的mc-lf与klh偶联物的制备将步骤1.1中的mc-lr替换为mc-lf,其它操作完全相同,得到氨基修饰的mc-lf与klh偶联物,以下简称为nh2-mc-lf-klh,将nh2-mc-lf-klh放置于-20℃冰箱中备用。1.6、氨基修饰的mc-lw与klh偶联物的制备将步骤1.1中的mc-lr替换为mc-lw,其它操作完全相同,得到氨基修饰的mc-lw与klh偶联物,以下简称为nh2-mc-lw-klh,将nh2-mc-lw-klh放置于-20℃冰箱中备用。1.7、氨基修饰的mc-ly与klh偶联物的制备将步骤1.1中的mc-lr替换为mc-ly,其它操作完全相同,得到氨基修饰的mc-ly与klh偶联物,以下简称为nh2-mc-ly-klh,将nh2-mc-ly-klh放置于-20℃冰箱中备用。1.8、氨基修饰的mc-wr与klh偶联物的制备将步骤1.1中的mc-lr替换为mc-wr,其它操作完全相同,得到氨基修饰的mc-wr与klh偶联物,以下简称为nh2-mc-wr-klh,将nh2-mc-wr-klh放置于-20℃冰箱中备用。1.9、氨基修饰的mc-htyr与klh偶联物的制备将步骤1.1中的mc-lr替换为mc-htyr,其它操作完全相同,得到氨基修饰的mc-htyr与klh偶联物,以下简称为nh2-mc-htyr-klh,将nh2-mc-htyr-klh放置于-20℃冰箱中备用。1.10、氨基修饰的mc-hilr与klh偶联物的制备将步骤1.1中的mc-lr替换为mc-hilr,其它操作完全相同,得到氨基修饰的mc-hilr与klh偶联物,以下简称为nh2-mc-hilr-klh,将nh2-mc-hilr-klh放置于-20℃冰箱中备用。1.11、氨基修饰的[d-asp3]mc-lr与klh偶联物的制备将步骤1.1中的mc-lr替换为[d-asp3]mc-lr,其它操作完全相同,得到氨基修饰的[d-asp3]mc-lr与klh偶联物,以下简称为nh2-[d-asp3]mc-lr-klh,将nh2-[d-asp3]mc-lr-klh放置于-20℃冰箱中备用。1.12、氨基修饰的[d-asp3]mc-rr与klh偶联物的制备将步骤1.1中的mc-lr替换为[d-asp3]mc-rr,其它操作完全相同,得到氨基修饰的[d-asp3]mc-rr与klh偶联物,以下简称为nh2-[d-asp3]mc-rr-klh,将nh2-[d-asp3]mc-rr-klh放置于-20℃冰箱中备用。上述步骤中,12种微囊藻毒素小分子结构变异体的结构通式如式(1)所示,修饰后的12种微囊藻毒素小分子结构变异体的结构通式如式(2)所示,12种微囊藻毒素小分子结构变异体的r1、r2和r3的具体基团分别如表1所示。表112种微囊藻毒素小分子结构变异体在可变位点的特定基团r1r2r3mc-lr亮氨酸残基(leu)精氨酸残基(arg)甲基(me)mc-rr精氨酸残基(arg)精氨酸残基(arg)甲基(me)mc-yr酪氨酸残基(tyr)精氨酸残基(arg)甲基(me)mc-la亮氨酸残基(leu)丙氨酸残基(ala)甲基(me)mc-lf亮氨酸残基(leu)苯丙氨酸残基(phe)甲基(me)mc-lw亮氨酸残基(leu)色氨酸残基(trp)甲基(me)mc-ly亮氨酸残基(leu)酪氨酸残基(tyr)甲基(me)mc-wr色氨酸残基(trp)精氨酸残基(arg)甲基(me)mc-htyr高酪氨酸残基(hty)精氨酸残基(arg)甲基(me)mc-hilr同异亮氨酸残基(hil)精氨酸残基(arg)甲基(me)[d-asp3]mc-lr亮氨酸残基(leu)精氨酸残基(arg)氢(h)[d-asp3]mc-rr精氨酸残基(arg)精氨酸残基(arg)氢(h)2、免疫原的制备将步骤1.1-1.12中制备的偶联物nh2-mc-lr-klh,nh2-mc-rr-klh,nh2-mc-yr-klh,nh2-mc-la-klh,nh2-mc-lf-klh,nh2-mc-lw-klh,nh2-mc-ly-klh,nh2-mc-wr-klh,nh2-mc-htyr-klh,nh2-mc-hilr-klh,nh2-[d-asp3]mc-lr-klh和nh2-[d-asp3]mc-rr-klh等质量混合后,得到免疫原klh-mcs溶液。(2)动物免疫与效价测定将步骤2的免疫原klh-mcs溶液与免疫佐剂等体积混合后免疫小鼠。选取适龄的spf级balb/c雌性小鼠,采用低剂量长程免疫法进行免疫,方法为:皮下多点注射,按照50μgklh-mcs/只小鼠的剂量,对5只小鼠(编号为:1、2、3、4、5)进行初次免疫,每次每只小鼠注射0.1ml液体,其中,该0.1ml液体由0.05ml免疫原klh-mcs溶液和0.05ml弗氏完全佐剂组成;之后按照30μgklh-mcs/只小鼠的量对5只小鼠进行加强免疫,免疫间隔时间为2周,共免疫6次,每次每只小鼠注射0.06ml液体,其中,该0.06ml液体由0.03ml免疫原klh-mcs溶液和0.03ml弗氏不完全佐剂组成。在第6次加强免疫1周后,对小鼠进行眼眶取血,用间接elisa法测定效价,其中,包被抗原为12种bsa-mc的等量混合物,包被浓度为2μg/ml。对抗血清效价达到要求的小鼠,按照50μg免疫原/只小鼠的量进行一次腹腔注射冲击免疫,此次所用免疫原为12种bsa-mc的等量混合物(bsa-mcs),3天后再次测定效价,选取血清效价最高的小鼠脾细胞进行细胞融合。上述实验中,包被抗原bsa-mc的合成方法具体为:包被抗原的合成方法同步骤1中所述的步骤,将步骤1的中的klh替换为bsa,最后再加入20μl浓度为0.2m的赖氨酸溶液于室温下反应1~4h,以阻断未反应的醛基,得到的包被抗原放置于-20℃冰箱中备用。对12种bsa-mc分别用maldi-tof/ms进行质谱鉴定,测定的12种微囊藻毒素小分子与bsa的偶联比均为1:1。所述12种包被抗原bsa-mc分别为nh2-mc-lr-bsa、nh2-mc-rr-bsa、nh2-mc-yr-bsa、nh2-mc-la-bsa,nh2-mc-lf-bsa、nh2-mc-lw-bsa,、nh2-mc-ly-bsa、nh2-mc-wr-bsa、nh2-mc-htyr-bsa、nh2-mc-hilr-bsa、nh2-[d-asp3]mc-lr-bsa和nh2-[d-asp3]mc-rr-bsa;其中所述nh2-mc-lr-bsa为氨基修饰的mc-lr与bsa偶联物;所述nh2-mc-rr-bsa为氨基修饰的mc-rr与bsa偶联物;所述nh2-mc-yr-bsa为氨基修饰的mc-yr与bsa偶联物;所述nh2-mc-la-bsa为氨基修饰的mc-la与bsa偶联物;所述nh2-mc-lf-bsa为氨基修饰的mc-lf与bsa偶联物;所述nh2-mc-lw-bsa为氨基修饰的mc-lw与bsa偶联物;所述nh2-mc-ly-bsa为氨基修饰的mc-ly与bsa偶联物;所述nh2-mc-wr-bsa为氨基修饰的mc-wr与bsa偶联物;所述nh2-mc-htyr-bsa为氨基修饰的mc-htyr与bsa偶联物;所述nh2-mc-hilr-bsa为氨基修饰的mc-hilr与bsa偶联物;所述nh2-[d-asp3]mc-lr-bsa为氨基修饰的[d-asp3]mc-lr与bsa偶联物;所述nh2-[d-asp3]mc-rr-bsa为氨基修饰的[d-asp3]mc-rr与bsa偶联物。(2)细胞融合1)将状态良好的小鼠骨髓瘤细胞sp2/0细胞轻轻地从培养瓶壁上吹打下来,转移至50ml离心管中;小鼠摘眼球取血后拉颈处死,放入75%的酒精中浸泡5min;2)在平皿中倒入少量不含血清的imdm培养基,将细胞筛及注射器内芯放入平皿中3)在无菌状态下取出小鼠脾脏,置于细胞筛上,用注射器内芯轻轻地将脾脏充分碾碎,再将碾好的细胞吸入到装有sp2/0细胞的离心管中,室温1500r/min下离心5min;4)取小鼠的胸腺并碾碎,转移至15ml离心管中,再加入1mlhat培养液,于孵箱中(37℃,5%co2)进行培养。5)将离心好的细胞弃上清液,用不含血清的imdm培养基将细胞小心轻柔地吹匀,再次于室温1500r/min下离心5min。6)将离心好的细胞弃上清液,轻拍离心管底使细胞充分悬浮,再将离心管置于37℃温水浴中,并在1min内缓慢加入1ml聚乙二醇(peg),静置1min后,在2min内缓慢加入2ml不含血清的imdm培养基,接着在2min内缓慢加入8ml不含血清的imdm培养基,室温1000r/min下离心5min。7)弃上清,加入10ml血清,并小心将细胞吹匀,加入步骤4)备好的胸腺细胞,再加入25ml无菌的半固体培养基,充分混匀后均匀倒入30个细胞培养皿中并置于湿盒中,于孵箱中(37℃,5%co2)培养。8)在第11天左右,开始挑克隆,此时细胞团大小肉眼可见,在显微镜下能够很好的分辩(注意防止培养基颜色变黄,导致营养不够,细胞团出现死亡;若细胞融合团较多,可提前挑克隆)。挑10板×93个细胞单克隆于96孔细胞培养板中培养(事先用含小鼠胸腺细胞的20%imdm+2%ht培养液铺板,120μl/孔),第3天换液一次,第5天细胞已铺满96孔板,此时采用间接elisa检测培养基上清液中的抗体。(5)阳性克隆株筛选1)用包被液(50mm碳酸盐缓冲液,ph9.6)稀释“bsa-mc”使其终浓度为2μg/ml,100μl/孔加入到96孔酶联板中进行包被,于4℃包被过夜后用pbs-t(0.05%吐温-20-pbs)洗液洗涤3次。2)用封闭液(2%脱脂牛奶-pbs)封闭,200μl/孔,37℃孵育2h后用洗液洗涤3次。3)分别于相应孔中加入一抗(96孔板中的细胞培养上清液)、阴性对照(sp2/0培养上清液)、空白对照(pbs溶液)、阳性对照(pbs稀释1000倍阳性血清),均为100μl/孔,37℃孵育1h后用洗液洗涤3次。4)加入pbs稀释20000倍的酶标二抗(山羊抗小鼠igg/hrp),100μl/孔,37℃孵育1h后用洗液洗涤3次。5)加显色液(1%a液+10%b液+超纯水(a液:1%tmb-dmso;b液:0.1%h2o2-柠檬酸缓冲液)),100μl/孔,显色时间为5min左右。6)加终止液(2m浓硫酸),50μl/孔,终止反应。7)酶标仪测450nm处吸光值,记录保存数据。a450值为阴性对照2.1倍的为阳性杂交瘤细胞株。对于一筛呈阳性的31株克隆株,进一步培养后,按照同样方法进行第二次筛选,得到23株阳性杂交瘤细胞株。(6)阳性克隆株亚类鉴定1)用100mmpbs(ph7.4)溶液稀释包被抗体(各亚类抗体混合物)至0.5μg/ml,0.1ml/孔,4℃孵育过夜。2)pbs-t洗2次,加入封闭液,200μl/孔,37℃孵育2h。3)pbs-t洗3次,加入阳性杂交瘤上清液,100μl/孔,37℃孵育1h。4)pbs-t洗3次,相应孔中分别加入封闭液(2%bsa+3%蔗糖于pbs中)1:1000(轻链:κ,λ)或1:2000(重链:m,g1,g2a,g2b,g3,a)稀释的各亚类酶标二抗,0.1ml/孔,37℃孵育1h。5)pbs-t洗3次,加入显色溶液,100μl/孔,5min后加终止液,50μl/孔,10-20min内用酶标仪测450nm处吸光值,记录保存数据。7株阳性细胞株进行亚类鉴定后,确认其中1株为igg1型阳性杂交瘤细胞株。分别用12种bsa-mc单体和bsa再次包板,采用间接elisa方法做筛选,确认该株igg1型阳性杂交瘤细胞株对12种微囊藻毒素均具有特异性响应。该株阳性杂交瘤细胞株名称命名为mcab1,于2019年12月10日保藏于中国普通微生物菌种保藏管理中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),杂交瘤细胞株mcab1的保藏编号分别为cgmccno.19194。分别取上述杂交瘤细胞株按照步骤(7)和步骤(8)的方法制备单克隆抗体,并将杂交瘤细胞株mcab1分泌的单克隆抗体命名为抗体mcab1。(7)腹水制备1)将恒温水浴箱温度调节至37℃-40℃。2)从液氮罐中取出冻存的细胞株,立即放入37℃-40℃温水中迅速晃动,直至完全溶解。3)将细胞冻存悬浮液转移到离心管中,加入5ml完全培养基(imdm+15%新生牛血清),轻轻吹打混匀。4)将细胞悬浮液于室温1000r/min下离心5min,弃上清液。5)向细胞沉淀内加入完全培养基,轻轻吹打混匀后,转移到细胞培养皿内,置于37℃细胞培养箱中培养。6)将细胞培养到对数生长期,pbs溶液洗涤并对细胞计数。7)小鼠腹腔在接种一周前采用腹腔注射方式打石蜡油,500μl/balb/c小鼠。8)采用腹腔注射方式接种细胞,每只小鼠注射1ml(细胞量5×105-9×105个/ml)。9)一周后取腹水,5000r/min下离心10min,取上清液,于-20℃保存。(8)抗体纯化1)腹水样本预处理:用偶联缓冲液(20mm磷酸钠溶液,ph7.0)将解冻后的腹水上清液稀释3倍,12000r/min,4℃下离心10min,再用0.22μm滤膜过滤,以除去脂肪、细胞残渣及小颗粒物质。2)平衡:用10倍抗体亲和预装柱(hitraprproteinaff)体积的偶联缓冲液平衡柱子,保持流速为1ml/min。3)上样:柱中加入样品,收集流出液,保持流速为1ml/min。4)洗杂:用5倍柱体积的偶联缓冲液过柱,保持流速为1ml/min。5)洗脱:用5倍柱体积的洗脱缓冲液(0.1m柠檬酸钠溶液,ph3.5)洗脱抗体,收集于离心管中,保持流速为1ml/min,之后立即用1mph9.0的tris-hcl缓冲液将收集液的ph调整至7.0。6)透析:使用0.01mpbs缓冲液将抗体透析过夜,换液3次。得到的抗体采用sds-page(12%分离胶浓度)检测纯度,采用紫外分光光度计检测浓度。确认得到的1株抗体纯度在90%以上,满足下游分析需求。实施例2、广谱型微囊藻毒素elisa试剂盒的组成1、广谱型微囊藻毒素elisa试剂盒的组成该试剂盒包括安装在试剂盒盒体内的下述试剂和酶标板:a)抗微囊藻毒素标准溶液的配制:将mc-lr标准品用样品稀释液分别作一系列3倍梯度稀释,配制成浓度分别为20.000μg/l、6.667μg/l、2.222μg/l、0.741μg/l、0.247μg/l、0.082μg/l、0.027μg/l、0μg/l的标准溶液,分别灌装入标准品试剂瓶中。b)抗体溶液配制:将实施例1的单克隆抗体mcab6用磷酸盐缓冲液稀释,再加入牛血清白蛋白(bsa)和硫柳汞,得到抗体溶液。抗体溶液中,单克隆抗体mcab6的含量为0.0625μg/ml,bsa的含量为1%(质量百分含量),硫柳汞的含量为0.01%(质量百分含量)。其中,磷酸盐缓冲液是浓度为0.01m,ph值为7.0-7.2的pbs缓冲液,其配置方法如下:8.0gnacl、0.2gkcl、2.9gna2hpo4·12h2o、0.24gkh2po4,1l去离子水。将抗体溶液灌装入试剂瓶中。c)酶标二抗溶液配制:辣根过氧化物酶-羊抗鼠igg原液,灌装入试剂瓶中,使用时用样品稀释液按1:1000配制成工作浓度。d)洗涤液配制(10×pbst):含0.5%(体积百分含量)吐温-20和0.1mol/l磷酸盐缓冲液,磷酸盐缓冲液是浓度为0.01m,ph值为7.0-7.2的pbs缓冲液,其配置方法如下:80gnacl、2gkcl、29gna2hpo4·12h2o、2.4gkh2po4,1l去离子水。灌装入试剂瓶中。使用时,将该溶液用纯水稀释10倍得到1×pbst再用。e)显色剂溶液:采用从北京索莱宝科技有限公司购买的双组分tmb显色液。f)终止液配制:1mol/lh2so4溶液,灌装入试剂瓶中。g)酶标板是包被了包被抗原的96孔聚苯乙烯微量反应板。酶标板的包被:包被抗原为nh2-mc-lr-bsa,nh2-mc-rr-bsa,nh2-mc-yr-bsa,nh2-mc-la-bsa,nh2-mc-lf-bsa,nh2-mc-lw-bsa,nh2-mc-ly-bsa,nh2-mc-wr-bsa,nh2-mc-htyr-bsa,nh2-mc-hilr-bsa,nh2-[d-asp3]mc-lr-bsa和nh2-[d-asp3]mc-rr-bsa这12种bsa-mc的等质量混合后得到的混合物。nh2-mc-lr-bsa,nh2-mc-rr-bsa,nh2-mc-yr-bsa,nh2-mc-la-bsa,nh2-mc-lf-bsa,nh2-mc-lw-bsa,nh2-mc-ly-bsa,nh2-mc-wr-bsa,nh2-mc-htyr-bsa,nh2-mc-hilr-bsa,nh2-[d-asp3]mc-lr-bsa和nh2-[d-asp3]mc-rr-bsa这12种bsa-mc的合成方法具体为:合成方法同实施例1的步骤1中所述的步骤,将实施例1的步骤1的中的klh替换为bsa,最后再加入20μl浓度为0.2m的赖氨酸溶液于室温下反应1~4h,以阻断未反应的醛基,得到的产物放置于-20℃冰箱中备用。对12种bsa-mc分别用maldi-tof/ms进行质谱鉴定,测定的12种微囊藻毒素小分子与bsa的偶联比均为1:1。包被缓冲液:0.05mol/l的碳酸钠-碳酸氢钠缓冲液(ph9.6),溶剂为水,溶质及其浓度如下:na2co31.5g/l和nahco32.93g/l。用包被缓冲液稀释包被抗原至这12种bsa-mc的总浓度为0.5μg/ml(即每种bsa-mc的浓度为0.04μg/ml),得到包被抗原溶液,取100μl包被抗原溶液加入反应板孔中,4℃冰箱中过夜,倒出孔内液体,用洗涤液1×pbst洗涤3-5次,将酶标板倒置在吸水纸上拍打,吸干,在已包被抗原的酶标板小孔中加入200μl1%(质量百分含量)的bsa溶液封闭,37℃温育1h,用洗涤液1×pbst洗涤3-5次,用吸水纸吸干,封装。2、广谱型微囊藻毒素elisa试剂盒标准曲线的获得及分析(1)广谱型微囊藻毒素elisa试剂盒标准曲线的获得针对每一批试剂盒都必须测定其检测微囊藻毒素的标准曲线,以确定和评价试剂盒的各项性能参数。溶液的配制同实施例1,不同的是标准溶液的浓度,标准溶液的浓度梯度如下(单位:μg/l)300、100、33.3、11.1、3.70、1.23、0.412、0.137、0.046、0.0150、0.005.采取3组平行试验(n=3)。采用mc-lr、mc-rr、mc-yr三种微囊藻毒素异构体,分别测量标准曲线,进行对比。将标准溶液与抗体溶液依次加入酶标板小孔中,同时设置空白孔(将添加的抗体换成高纯水,其它一致)和阴性对照孔(标准溶液用高纯水代替,即不含mc-lr、mc-rr或mc-yr,其它一致),37℃温育0.5h,倒出孔内液体,重复用洗涤液洗涤3-5次,将酶标板在吸水纸上排干;加入酶标二抗溶液于酶标板小孔中,37℃温育0.5h,用洗涤液重复洗3-5次,吸干;加入显色溶液到酶标板小孔中,室温下反应10-15min,用酶标仪在波长450m处测定吸光度a,以不加抗体的小孔作为空白调零。以各浓度吸光度与阴性对照孔吸光度的比值(即结合率b/b0)为纵坐标,以对应mc-lr、mc-rr或mc-yr浓度的1og值为横坐标,绘制半对数标准曲线图。结果如图1所示,表明标准曲线具有完整的反s形状,并具有上平台和下平台,标准曲线的平行测定次数3次,误差线为n=3次平行实验的标准偏差,实验重复性良好,相对标准偏差(变异系数)均在15%以内,表明精密度良好。对试剂盒半抑制浓度、检测限、定量检测区间等描述,基于对图1-图3的标准曲线进行模型拟合后进一步评价。采用4参数logistic模型作为水环境样品elisa检测试剂盒数据分析和评价的基础,模型如下:(4参数logistic模型)其中:x:未标记抗原浓度(质量浓度或物质的量浓度),自变量;y:x对应的结合率b/b0,因变量;a1:上端渐近线(x=0),常数;a2:下端渐近线(x→∞),常数;p:与曲线的斜率有关,常数;x0:曲线的中点,或称拐点,常数;对于图1的标准曲线,a1为0.986,a2为0.026,p为1.20,x0为0.706。对于图2的标准曲线,a1为1.003,a2为0.023,p为1.00,x0为0.676。对于图3的标准曲线,a1为0.959,a2为0.030,p为1.07,x0为0.801。(2)半抑制浓度ic50是竞争elisa一个很重要的评价指标。在竞争elisa中,ic50=x0。(3)在竞争elisa中,依据上述logistic模型,定义结合率如下式。a:x浓度下对应的吸光度值;(4)竞争elisa标准曲线最低检测限和最高检测限的确定采用结合率法,即最低和最高检测限分别为b/b0=90%和b/b0=10%时对应的目标物质(待测物)的浓度。(5)竞争elisa标准曲线的定量检测区间的确定采用结合率法,定量检测区间即b/b0=80%-20%对应的目标物质(待测物)的浓度区间。对图1、2、3中的标准曲线采用四参数的logistic模型拟合,对比分析mc-lr、mc-rr、mc-yr三种微囊藻毒素异构的标准曲线,半抑制浓度ic50分别为0.71μg/l、0.68μg/l、0.80μg/l;检测限为0.10μg/l、0.08μg/l、0.06μg/l;定量检测区间分别为0.22μg/l-2.25μg/l、0.17μg/l-2.69μg/l、0.22μg/l-2.93μg/l。以此证明,该试剂盒中的广谱型抗体对mc-lr、mc-rr、mc-yr三种微囊藻毒素的异构体的检测能力接近,能够完成样品中微囊藻毒素总量测定。最终以mc-lr作为标准品,绘制标准曲线,来检测下述步骤3和步骤4的样品中的微囊藻毒素总量浓度。3、采用本发明的试剂盒对某地河水中12种微囊藻毒素浓度进行检测对水体中的微囊藻毒素总量检测方法同步骤2。分别取某地河水,分别单独添加12种微囊藻毒素异构体,加标浓度为4μg/l,测定并计算回收率。其中,回收率测定方法如下:样品添加浓度(最终浓度)用x表示,未添加异构体的样品测定平均值为x1,添加了异构体的样品测定平均值为x2,每个样品平行测定4次,则回收率计算如下式。结果如表2所示,结果表明上述样品检测结果的变异系数都在7%以内,精密度良好;对于mc-lr、mc-rr、mc-yr三种异构体回收率均高于90%,对于其余九种异构体回收率均高于50%。结果表明本发明的广谱型微囊藻毒素免疫检测试剂盒对12种微囊藻毒素分子均具有响应,其良好的广谱性可适用于实际样品中的微囊藻毒素总量检测。表2河水中12种微囊藻毒素异构体回收率测定结果4、采用本发明的试剂盒对某地几处水体中的微囊藻毒素总量进行检测对水体中的微囊藻毒素总量检测方法同步骤2。分别取某地河水、湖水、自来水样品,对水样过滤处理后用本试剂盒进行测定,得到原水样测定结果,每个样品平行测定4次,计算变异系数,用变异系数确认本试剂盒的稳定性;将mc-lr、mc-rr、mc-yr异构体分别按照50%、25%、25%的比例样品加标,使得加标的微囊藻毒素总量浓度为2μg/l;将mc-lr、mc-rr、mc-yr异构体分别按照33.3%、33.3%、33.3%的比例样品加标,使得加标的微囊藻毒素总量浓度为3μg/l。然后用本试剂盒进行测定,得到测定结果,并计算回收率,用回收率确认本试剂盒的准确度。表3不同水体中mc-lr、mc-rr、mc-yr回收率测定结果表3结果表明上述样品检测结果的变异系数都在15%以内,精密度良好;检测结果的回收率为(93.1±10.8)%,准确度良好。因此本发明的微囊藻毒素免疫检测试剂盒可以满足实际水样检测的需要。以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- 一种实时荧光定量PCR检测土壤西瓜枯萎病菌的方法及引物与制造工艺
- 一种基于反射镜的荧光定量PCR的检测系统的制造方法与工艺