Piezo1抑制剂在制备治疗或预防异位骨化的药物中的应用
piezo1抑制剂在制备治疗或预防异位骨化的药物中的应用
技术领域
1.本发明属于生物医药领域,涉及piezo1抑制剂在制备治疗或预防异位骨化的药物中的应用。
背景技术:
2.异位骨化(heterotopic ossification,ho)的特征是在软组织诸如与骨组织及关节相邻的肌肉、肌腱、韧带等组织中形成的病理性异位骨。异位骨化最通常与创伤诸如脊髓损伤、脑损伤、头损伤、烧伤、骨折、肌肉挫伤、搏斗相关的创伤和手术(特别是关节成形术)相关联。此外,ho可能出现在接受神经肌肉阻断以控制成人呼吸窘迫综合征的患者和具有非创伤性脊髓病的患者中。在罕见情况下,ho可能表现为遗传性疾病的一部分,并且有时与下运动神经元紊乱相关。ho的后果可以包括,尤其是关节挛缩和强直、疼痛、痉挛、肿胀、发热、神经血管压迫、压疮和严重残疾。损伤范围从临床上不明显的小病灶到遍布身体的大量沉积物。
3.异位骨化一般分为两种情况:第一创伤性异位骨化,也是较为常见的一种骨化现象,经常在发生严重灼烧、损伤以及髋关节置换等手术之后。第二种遗传性异位骨化包括进行性肌肉骨化症和渐进性骨发育异常。遗传性疾病是研究异位骨化形成机制的良好实验模型。异位骨化现象是一种异常普遍且严重的健康问题。然而,目前临床上针对异位钙化仍然缺乏有效的治疗手段。
4.强直性脊柱炎(ankylosing spondylitis,as)是一种慢性炎症性结缔组织病,该疾病主要累及包括骶髂关节在内的中轴骨,亦可累及外周关节以及关节外器官。其特征性病理改变是伴有慢性炎症改变的肌腱和韧带附着点炎[1]。慢性炎症性疼痛和脊柱强直是该疾病致残的两大关键因素[2]。既往研究和治疗的重点集中在控制炎症活动、缓解炎症性疼痛方面。由于对脊柱强直在病因与治疗上仍未有足够的认识,目前仍无公认有效的方法抑制脊柱强直的进展[3]。脊柱强直进展最终导致脊柱僵硬后凸、活动范围显著下降,严重影响患者的劳动能力与生活质量,为患者、家庭和社会带来沉重的负担[1,3]。脊柱强直的主要原因是附着点部位存在异位新骨形成,并逐渐蔓延至韧带与关节囊,导致活动部位之间出现骨性连接,活动度严重下降甚至消失[2]。何种机制导致附着点异位新骨形成,目前仍不清楚。
技术实现要素:
[0005]
一方面,本发明提供了piezo1的检测试剂在制备异位骨化检测试剂或试剂盒中的应用。
[0006]
一方面,本发明提供了一种异位骨化检测试剂盒,所述的试剂含有piezo1的检测试剂。
[0007]
在一些实施方式中,所述piezo1的检测试剂选自western blot试剂和/或试剂盒,免疫组化检测试剂及和/或试剂盒,免疫荧光检测试剂及和/或试剂盒,elisa检测试剂及
和/或试剂盒,rna探针试剂及和/或试剂盒,核酸试剂及和/或试剂盒,钙离子荧光探针试剂及和/或试剂盒中的一种或多种。
[0008]
一方面,本发明提供了一种异位骨化的检测系统,所述的系统含有:
[0009]
a.piezo1的检测构件,以及,
[0010]
b.结果判断构件。
[0011]
在一些实施方式中,所述的piezo1的检测构件含有western blot试剂和/或试剂盒,免疫组化检测试剂及和/或试剂盒,免疫荧光检测试剂及和/或试剂盒,elisa检测试剂及和/或试剂盒,rna探针试剂及和/或试剂盒,核酸试剂及和/或试剂盒,钙离子荧光探针试剂及和/或试剂盒中的一种或多种。
[0012]
在一些实施方式中,所述的结果判断构件用于根据检测系统检测的piezo1表达结果和/或piezo1钙离子内流水平,输出异位骨化的患病风险和/或异位骨化类型。
[0013]
在一些实施方式中,所述的患病风险是根据通过结果比较待测样本与正常样本的piezo1表达量和/或piezo1钙离子内流水平,当待测样本与正常样本的piezo1核酸水平和/或蛋白表达量相比升高且具有显著差异或极显著差异时,和/或piezo1钙离子内流水平升高且具有显著差异或极显著差异时,结果判断待测样本患病风险高。
[0014]
在一些实施方式中,当待测样本与正常样本的piezo1核酸水平和/或蛋白表达量相比,大于正常样本的1.5倍以上时,结果判断待测样本患病风险高。
[0015]
在一些实施方式中,当待测样本与正常样本的piezo1钙离子内流水平相比,大于正常样本的1.5倍以上时,结果判断待测样本患病风险高。
[0016]
本发明中所述“待具有显著差异或极显著差异”是指待测样本与正常样本的相应数值相比,大于正常样本1.5倍以上。
[0017]
在本发明的一个具体的实施例中,显示dba/1模型小鼠异位成骨部位piezo1表达显著升高。
[0018]
一方面,本发明提供了piezo1作为靶点在制备治疗或预防异位骨化的药物中的应用。
[0019]
一方面,本发明提供了piezo1抑制剂在制备治疗或预防异位骨化的药物中的应用。
[0020]
在一些实施方式中,所述的piezo1抑制剂为抑制piezo1活性的物质,或降解piezo1的物质,或降低piezo1水平的物质。
[0021]
在一些实施方式中,所述的抑制piezo1活性的物质选自化合物。
[0022]
在一些实施方式中,所述化合物选自gsmtx4,毒胡萝卜素(thapsigargin),乙二醇二乙醚二胺四乙酸(egta),细胞松弛素d(cytochalasin-d),钌红(ruthenium red),或维拉帕米(verapamil),及它们的衍生物,光学异构体,螯合形式,水合形式或药学上可接受的盐或酯中的一种或多种。
[0023]
在一些实施方式中,所述gsmtx4具有式i所示的结构式:
[0024][0025]
在一些实施方式中,所述毒胡萝卜素具有式ii所示的结构式:
[0026][0027]
在一些实施方式中,所述乙二醇二乙醚二胺四乙酸具有式iii所示的结构式:
[0028][0029]
在一些实施方式中,所述细胞松弛素d具有式iv所示的结构式:
[0030][0031]
在一些实施方式中,所述钌红具有式v所示的结构式:
[0032][0033]
在一些实施方式中,所述维拉帕米具有式vi所示的结构式:
[0034][0035]
在一些实施方式中,所述的降低piezo1水平的物质选自rna干扰,microrna,基因编辑或基因敲除材料。
[0036]
在一些实施方式中,所述药物的剂型选自药学上允许的任意一种剂型。
[0037]
在一些实施方式中,所述剂型选自片剂,颗粒剂,胶囊剂,丸剂,口服液,注射液,脂
质体中的一种或多种。
[0038]
在一些实施方式中,所述药物或药物组合物的给药方式选自口服给药,局部给药,鼻内给药,全身给药,静脉内给药,皮下给药,肌肉内给药,脑室内给药,鞘内给药或透皮给药中的一种或多种。
[0039]
在一些实施方式中,所述异位骨化选自炎症性异位骨化,创伤性异位骨化中的一种或多种。
[0040]
在一些实施方式中,所述异位骨化选自炎症性异位骨化。
[0041]
在一些实施方式中,所述炎症性异位骨化选自强直性脊柱炎异位骨化,骨关节炎异位骨化,风湿病异位骨化,痛风异位骨化中的一种或多种。
[0042]
在一些实施方式中,所述炎症性异位骨化选自强直性脊柱炎异位骨化。
[0043]
在本技术中,所述“预防”是指当用于疾病或病症时,与未给予药物的受试者相比,所述药物能降低受试者体内的医学病症症状的频率或推迟其发病。
[0044]
在本技术中,所述“治疗”是指减轻、缓解或改善疾病或病症的症状,改善潜在的代谢引起的症状,抑制疾病或症状,例如阻止疾病或病症的发展、缓解疾病或病症、引起疾病或病症的消退、缓解疾病或病症引起的病况、或阻止疾病或病症的症状。
[0045]
如本技术中所使用的术语“和/或”是指并且涵盖一个或多个相关联的所列项目的任何和所有可能的组合。当在两个或多个项目的列表中使用时,术语“和/或”表示所列出的项目中的任何一个可以单独使用,或者可以使用两个或多个所列出的项目的任何组合。例如,如果组合物,组合,构造等被描述为包括(或包含)组分a,b,c和/或d,则该组合物可以单独包含a;单独包含b;单独包含c;单独包含d;包含a和b的组合;包含a和c的组合;包含a和d的组合;包含b和c的组合;包含b和d的组合;包含c和d的组合;包含a,b和c的组合;包含a,b和d组合;包含a,c和d的组合;包含b,c和d组合;或a,b,c和d组合使用。
[0046]
在本技术中,所述“一种或多种”表示至少一种;“多种”表示2个或以上的任意个数的组合。
附图说明
[0047]
图1为gsmtx4的结构式;
[0048]
图2为在dba/1和smts动物模型中piezo1上调与异位新骨形成的相关性。图中:sp:棘突上韧带;il:棘突间韧带cb:皮质骨;nb:新生骨;uf:未钙化纤维软骨;cf:钙化的纤维软骨;at:跟腱。
[0049]
(a-c):sofg染色,免疫组织荧光化学染色(ifc)和wb实验显示piezo1在as患者的脊柱韧带标本中表达升高,piezo1阳性细胞数明显增多。(d)μct显示dba/1小鼠的足背处有异位骨形成;(e-f)dba/1和正常小鼠的足背的he和sofg染色以及piezo1的免疫组织荧光化学染色(ifc)结果;(g)μct显示smts小鼠跟腱起止点处异位骨的形成;(h-k)smts小鼠dba/1小鼠跟腱起止点处的he和sofg染色以及piezo1的ifc结果,免疫组化和免疫荧光染色显示piezo1阳性细胞的定量分析。
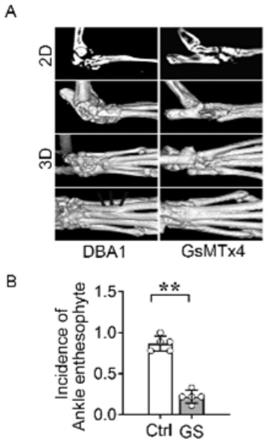
[0050]
图3为gsmtx4减弱了动物模型小鼠中异位骨的形成。(a-b)μct显示,注射gsmtx4的dba/1小鼠的足背异位骨形成较少;(c)gsmtx4和对照组的dba/1小鼠的足背的he,sofg染色;(d)μct显示注射gsmtx4的smts小鼠跟腱起止点处异位骨减小(e-g)gsmtx4和对照组的
smts小鼠跟腱起止点处异位骨的he,sofg染色。
[0051]
图4为gsmtx4减弱了动物模型小鼠中异成骨相关蛋白的表达。(a)免疫荧光显示dba/1小鼠的足背处成骨相关转录因子蛋白ocn和runx2明显升高;(b)免疫荧光显示smts小鼠跟腱起止点处成骨相关转录因子蛋白ocn和runx2明显升高;(c-d)gsmtx4明显抑制了减低dba/1小鼠ocn和runx2的升高;(e-f)gsmtx4明显抑制了减低smts小鼠ocn和runx2的升高;(g-h)体外实验中,gsmtx4明显抑制了人骨髓间充质干细胞的成骨分化和矿化。
具体实施方式
[0052]
以下通过具体的实施例进一步说明本发明的技术方案,具体实施例不代表对本发明保护范围的限制。其他人根据本发明理念所做出的一些非本质的修改和调整仍属于本发明的保护范围。
[0053]
实施例1模型建立
[0054]
1.自发关节炎dba/1小鼠模型的建立
[0055]
获得雄性8周龄dba/1小鼠(北京维通利华实验动物公司),9只/笼合笼饲养。记录炎症评分,观察关节炎的临床症状,小鼠每周评分两次。评分标准:0:没有症状;1:一个脚趾发红和肿胀;2:多于一个脚趾发红和肿胀;3:脚趾畸形;4:整足畸形或踝关节受累。对两只后爪进行评估,得到最大分数为8,除以足数2,记录平均值。对于组织学检查,用福尔马林固定后足,使用decal(serva)脱钙,石蜡包埋,并在矢状平面切片。采用组织学评分,1:炎性细胞浸润;2:诱导成纤维细胞样细胞增殖;3:软骨形成;4:骨形成;和5:出现强直畸形。在每只小鼠中,通过各个关节评分计算总和。分别于8,16,30周处死小鼠,取材进行μct扫描和切片染色。
[0056]
2.跟腱半切模型(semi-achilles tendon transection,smts)小鼠模型的建立[4-6]
[0057]
获得雄性8周龄c57小鼠(北京维通利华实验动物公司),5只/笼合笼饲养。麻醉后固定后肢,小切口暴露跟腱,从中间将跟腱分为两半,剪短其中一侧,充分止血后缝合皮肤关闭伤口。
[0058]
3.μct扫描
[0059]
将样本固定在支架上,使用scancoμct40扫描仪进行μct扫描,使用microct ray v3.0软件进行三维重建及分析。
[0060]
4.he染色
[0061]
将切好的切片放在37℃烘箱过夜,取出后放到60℃烘箱继续烧烤30min,在两份二甲苯中各浸泡10min;再在100%乙醇,95%乙醇,80%乙醇,75%乙醇中各浸泡5min,用蒸馏水漂洗5min完成脱蜡。放脱蜡好的片子放入苏木精中染色10min,流水冲洗3次,用蒸馏水漂洗2min。放入1%盐酸乙醇分化液10s,用蒸馏水漂洗2min。放入返蓝染色液浸泡2min,用蒸馏水漂洗2min。用95%乙醇浸泡1min后入伊红染色液15s完成染色。再将切片依次放入80%乙醇,95%乙醇,100%乙醇各2min完成脱水,在二甲苯中浸泡5min透明。最后中性树脂封片。
[0062]
5.sofg(safranin o-fastgreen,番红o-固绿)染色
[0063]
将切好的切片放在37℃烘箱过夜,取出后放到60℃烘箱继续烧烤30min,在两份二
860.
[0079]
5.mcclure,j.,the effect of diphosphonates on heterotopic ossification in regenerating achilles tendon of the mouse.j pathol,1983.139(4):p.419-30.
[0080]
6.jacques,p.and d.mcgonagle,the role of mechanical stress in the pathogenesis of spondyloarthritis and how to combat it.best pract res clin rheumatol,2014.28(5):p.703-10.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1