一种可用于临床样品等位基因分型的DNA纳米筛可再生电化学传感器的制作方法
一种可用于临床样品等位基因分型的dna纳米筛可再生电化学传感器
技术领域
[0001]
本发明涉及可用于临床样品等位基因分型的dna纳米筛可再生电化学传感器的制备方法,属于生物传感技术领域。
背景技术:
[0002]
单核苷酸多态性(snps),也称点突变,是癌症诊断和预后有价值的遗传标志,也是预测药物疗效及耐药性的重要指标之一。目前,大多数应用于snps的检测方法是基于pcr扩增技术和直接测序法,但这些方法成本高、需要精密的仪器设备且对人工操作高要求,以及在检测低丰度点突变方面能力有待提高,因此,不适合作为临床常规性的诊断工具。dna电化学传感器由于具有灵敏度高、成本低、信号读出方式简便以及易于微型化等优点,在snp检测以及开发成床边检测工具方面具有其独特的优势。
[0003]
随着工具酶、纳米材料及分子器件的引入,dna电化学传感器的灵敏度和特异性不断提升,然而它的稳定性和重现性一直困扰着广大科研工作者。传感器在组装过程中不可避免会产生批间差异,即传感器间的差异(chip-to-chip variance),主要包括基底差异以及界面功能化修饰差异,是导致传感器重现性差的主要原因之一
[1]
。而通过构建可再生传感器,实现单一传感器对多个样品的连续检测,可有效地消除传感器间的差异,不仅进一步降低成本,且提高了传感器的重现性、可靠性以及准确性
[2]
。
[0004]
为实现dna电化学传感器的再生,已报道方法的切入点主要是考虑如何破坏dna双链间的氢键,如通常采用改变ph值、提高温度和添加化学试剂(胍盐、尿素或甘氨酸等)
[3-7]
等方法。然而,这些方法不仅会改变界面离子的种类和排布,还会不可逆地破坏界面上dna捕获探针的二级结构,使dna自组装单分子层的电荷和构象发生改变,难以获得持续且可靠的再生效果
[2]
。因此,迫切需要从另一个角度来开发具有高稳定性和可靠性的可再生dna电化学传感器。
[0005]
通常,用于dna检测的dna电化学传感器的制备包括在电极表面上形成dna 自组装单分子层(sam),通过靶标诱导的三明治结构与标记探针进行非共价杂交,以及使用电化学技术监控电子转移过程。在“信号开”的检测模式下,通常需要采用“倒立型杂交三明治”使如亚甲基蓝(mb)和二茂铁(fc)等电活性物质靠近电极表面。值得注意的是,这种倒立型杂交过程与通常在酶催化的dna电化学传感器
[8]
中使用的“正立型杂交模式”完全不同。对于后者,仅需要参与杂交的单链dna(ssdna)部分进入sam即可完成杂交,但是,前者需要整个双链dna(dsdna)部分渗透进入sam,使得突出的ssdna与捕获探针充分碰撞才能形成三明治结构。据我们所知,ssdna像羊毛球一样盘绕,而dsdna具有像棍棒一样的刚性结构特征,因此,这种明显的柔韧性差异应使它们对sam具有不同的渗透性。
[0006]
基于以上讨论,本发明公开一种新型的可再生dna电化学传感器,通过调节巯基修饰dna浓度来对sam的探针间距进行纳米调控,形成能够区分ssdna和dsdna的dna纳米筛。我们假设,棒状dsdna由于其长度大于纳米筛的腔长,会被阻挡在纳米筛之外,不能以倒置的
2020, 92(6):4498-4503.[9] johnson-buck, a.; su, x.; giraldez, m. d.; zhao, m.; tewari, m.; walter, n. g. kinetic fingerprinting to identify and count single nucleic acids. nat. biotechnol. 2015, 33 (7), 730-732。
技术实现要素:
[0008]
本发明的目的是提供一种可用于临床样品等位基因分型的dna纳米筛可再生电化学传感器及其对cyp2c19等位基因分型的电化学传感方法。
[0009]
为了实现上述目的,本发明采用以下技术方案:一种基于界面探针密度调控的可再生dna纳米筛界面用于对cyp2c19等位基因分型的电化学传感方法,其特征是通过巯基修饰dna(capture probe)在金电极表面的自组装构建一种能够区分ssdna和dsdna的界面型dna纳米筛,其空腔大小能通过改变巯基修饰dna的浓度来调节,通过以[ru(nh3)6]
3+
为氧化还原的电化学计时库仑法对界面上巯基修饰dna的间距进行表征,当巯基修饰dna的间距小于dsdna的长度时,dsdna由于其刚性结构不能透过dna纳米筛,而无规则卷曲结构的ssdna由于其高度的柔韧性能进入纳米筛,接着以连接酶循环反应为ssdna扩增策略对样品中的等位基因进行扩增,用所构建的dna纳米筛传感界面对ssdna进行检测,使用方波伏安法对电信号进行采集,根据电流大小实现对目标链的定性定量分析;在检测完成后,加入再生探针破坏ssdna的动态杂交过程,形成的dsdna由于其刚性结构且长度大于巯基修饰dna的间距而无法杂交,从而使信号物质从电极表面脱落,电极能再生并用于下一次检测,单个传感器能对7个不同样品进行连续检测。
[0010]
所述的基于界面探针密度调控的可再生dna纳米筛界面的制备方法,包括如下步骤:(1)金电极用0.05 μm al2o3和水的混合物抛光至镜面,依次用乙醇、蒸馏水超声清洗;将超声好的电极置于0.5 m h2so4中循环伏安扫描至稳定,用双蒸水清洗,n2吹干后待用;(2)将巯基修饰dna分别稀释至以下浓度: 2 μm、1 μm、800 nm、600 nm、500 nm、400 nm、200 nm;取3 μl上述各浓度的巯基修饰dna溶液分别滴至经预处理的裸金电极表面,室温放置过夜后,以pbs洗液冲洗电极表面,氮气吹干后将电极置于100 μl的2 mm mch溶液中浸泡2 h,用双蒸水清洗,氮气吹干备用;(3)将步骤(2)获得的电极浸入ph=7.4、浓度为10 mm的tris-hcl中进行第一次计时电量法测量,电压0 v至-0.5 v,500 ms,记录截距值q1;测量完成后将电极浸入50 μm氯化六胺合钌溶液中,室温孵育10 min,之后将电极用双蒸水彻底冲洗后再次浸入ph=7.4、浓度为10 mm的tris-hcl中进行第二次计时电量法测量,电压0 v至-0.5 v,500 ms,记录截距值q2,并计算两次测量得到的截距值的差值:δq=q2-q1;(4)将步骤(3)得到的δq代入以下公式:,其中γ0表示限定在电极表面附近的氯化六胺合钌的量,n是每个氧化还原过程转移的电子数,n=1,f是法拉第常数:f=96485.33289
±
0.00059 c/mol,a是电极面积;将计算得到的γ0代入公式:
,其中γ
dna
表示界面巯基修饰dna的密度,z是氧化还原分子所带的电荷量:z=3,m是巯基修饰dna的碱基个数:m=63,n
a
是阿伏伽德罗常数:n
a
≈6.02
×
10
23
;(5)计算探针间距:每个巯基修饰dna周围有一个圆圈面积,通过γ
dna
值的倒数来估算这个面积,从而由这个圆圈面积的直径计算出dna与dna之间的平均距离;得到dna间距小于17.34 nm的可再生dna纳米筛电化学传感界面。
[0011]
所述的基于界面探针密度调控的可再生dna纳米筛界面的再生方法,其特征是利用短寡核苷酸杂交的动态性,通过加入一条与被检测ssdna部分互补的再生探针,在ssdna处于杂交解离态时与其杂交形成dsdna,所形成的dsdna由于其刚性结构且几何长度大于纳米筛界面的空腔而被阻隔,从而使ssdna从界面脱落,使传感界面实现再生并可用于下一次ssdna的检测。
[0012]
所述的基于界面探针密度调控的可再生dna纳米筛界面构建及其对cyp2c19等位基因分型所涉及到的所有脱氧核苷酸序列,包括巯基修饰dna,lcr引物ap与sp以及再生探针rp:
[0013]
具体地说,本发明采用以下技术方案:(一)基于界面探针密度调控的可再生dna纳米筛界面的构建根据文献报道,随着巯基修饰dna(capture probe)的浓度的增加,在金电极界面所构建的dna自组装层的密度就越大,即巯基修饰dna间的距离减少。根据这一原理,首先将一系列浓度梯度的巯基修饰dna(序列见表1)固定于金电极表面,接着用巯基己醇(mch)对界面上剩余活性位点进行封闭,从而获得一定密度的dna自组装层。接着利用氯化六胺合钌能与dna磷酸骨架静电结合的特点,通过计时电量法对界面上捕获探针的密度以及间距进行定量分析。本发明所设计的cyp2c19等位基因目标序列长度为51 nt,可计算得出其与互补序列杂交后形成的dna双链的几何长度为17.34 nm,因此我们以捕获探针间距小于17.34 nm时的巯基修饰dna浓度为最优浓度用于后续实验。
[0014]
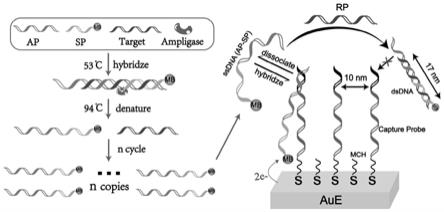
(二)pcr扩增技术结合连接循环反应(lcr)对样品中的cyp2c19等位基因进行扩增首先,从ncbi基因数据库genbank中,查找cyp2c19*2全基因序列,选取含突变位点的基因片段共1170 nt,设计上下游引物对全血样品的核酸总提物进行扩增,接着利用耐热连接酶(ampligase)具有特异性区分单碱基错配的能力,构建连接循环反应(lcr)信号放大体系,其原理见示意图1:存在完全互补的目标链时,ap(5’端的12个碱基可与捕获探针杂交)
和sp(3’端修饰亚甲基蓝mb)与目标链杂交后形成含有缺口的双链dna,ampligase催化缺口处的3
’-
oh与5
’-
po4形成磷酸二酯键,94 ℃高温解链后得到加长的ssdna(ap-sp),通过“94 ℃解链-53 ℃连接”的温度循环,得到大量的ssdna扩增产物;若为点突变目标链,则ap、sp与其杂交后在缺口处存在碱基错配,此时ampligase无法发挥其催化功能。
[0015]
(三)基于界面探针密度调控的可再生dna纳米筛电化学传感界面用于cyp2c19等位基因分型将lcr扩增产物(ap-sp)与可再生dna纳米筛电化学传感界面的捕获探针进行杂交,使sp末端的电活性物质亚甲基蓝(mb)靠近电极表面产生电子传递,通过方波伏安法对电信号进行采集并纪录峰电流值。接着加入再生探针rp,由于ap-sp与巯基修饰dna的杂交区域只有12 bp,因此该杂交存在动态过程,rp会在ap-sp处于杂交解离态时与其杂交形成刚性dna双链,由于其几何长度17 nm大于巯基修饰dna间距而无法进入dna自组装层进行杂交,从而使ap-sp从电极表面脱落,实现传感器再生并可接着进行下一个样品的检测。单个传感器可连续检测7个样品,最终根据每个样品所采集的峰电流大小可实现临床样品中cyp2c19等位基因准确分型。利用3个本发明所构建的可再生传感器对21例临床样品的检测结果如图2,方波伏安法峰电流值主要分布在3个区域:107 na~144 na(高), 62 na~74 na(中), 18 na~30 na(低)。对此,我们根据实验原理将信号落在高、中、低三个区域的样品分别判定为cyp2c19*2, cyp2c19*1 和 cyp2c19*1*2。同时,为了验证所构建的传感器检测的准确性,我们将这21例样品进行了测序(snp检测的金标准),测序结果如图3所示,我们将电化学检测结果与测序结果进行比对,发现这两者结果完全吻合,证明了所构建的基于可再生纳米筛的dna电化学传感器在临床样品核酸检测中具有高准确性。
[0016]
由上述技术方案可知,本发明所述的基于界面探针密度调控的可再生dna纳米筛电化学传感器可用于临床样品中cyp2c19等位基因的准确分型,并且利用所设计的新型再生策略可实现单个传感器对7个不同样品的高通量检测,一方面消除传感器间的差异,提高了分析的准确度,另一方面进一步降低了检测成本。
附图说明
[0017]
图1为基于界面探针密度调控的可再生dna纳米筛电化学传感器的原理图。
[0018]
图2为三个独立可再生传感器检测21例人的全血样品核酸总提物的pcr产物的检测图,图中:(a)为方波伏安法响应值,(b)为方波伏安法图。
[0019]
图3为所检测的21例人的全血样品的基因测序图,其中第243个碱基为g的是cyp2c19*1纯野生基因型,为a的是cyp2c19*2纯突变基因型,为g/a的是cyp2c19*1*2杂合基因型。
具体实施方式
[0020]
如图1所示,本发明所述的基于界面探针密度调控的可再生dna纳米筛电化学传感器,包括电极、巯基修饰dna(capture probe)、lcr引物、耐热连接酶、巯基己醇和再生探针rp,电极优选金电极,lcr引物包括ap(5’端的12个碱基可与巯基修饰dna杂交)和sp(3’端修饰亚甲基蓝mb),ap和sp与目标链杂交后形成含有缺口的双链dna,耐热连接酶ampligase催化缺口处的3
’ꢀ
oh与5
’ꢀ
po4形成磷酸二酯键,94 ℃高温解链后得到加长的ssdna(ap-sp),
通过“94 ℃解链-53 ℃连接”的温度循环,得到大量的ssdna扩增产物;若为点突变目标链,ap、sp与其杂交后在缺口处存在碱基错配,此时ampligase的催化效率将大大降低,因此得到的ssdna较少。将扩增得到的ssdna与通过金巯键固定于金电极表面的巯基修饰dna杂交,使sp末端的短程电活性物质亚甲基蓝mb靠近电极表面产生电子传递,使用方波伏安法对电信号进行采集,根据电流大小实现对目标链的定性定量分析。在检测完成后,加入可再生探针破坏ssdna的动态杂交过程,形成的dsdna由于其刚性结构且长度大于捕获探针dna的间距而无法杂交,从而使信号物质从电极表面脱落,电极再生并可用于下一次检测,单个传感器可对7个不同样品进行连续检测,一方面消除传感器间的差异,提高了分析的准确度,另一方面进一步降低了检测成本。本发明中涉及的核酸序列表以及实施例所用的核酸序列表见表1,为已知产品,由takara公司提供合成服务。
[0021]
表1.本发明中涉及的核酸序列表
[0022]
实施例1:基于界面探针密度调控的可再生dna纳米筛电化学传感界面用于临床样品中cyp2c19等位基因分型的步骤如下:(1)在可再生dna纳米筛电化学传感界面上滴加3 μl的lcr反应液,室温杂交1 h,用10 mm 的pbs洗液(ph 7.4)冲洗电极表面,除去未杂交的dna链,再用双蒸水冲洗后待测;(2)将步骤(2)制得的电极浸入电解液(10 mm pbs, 1 m nacl, ph=7.4)中,初始电位为-0.05 v, 终电位为-0.45 v,频率为100 hz,振幅为25 mv ,记录方波伏安法电流曲线后用pbs小心冲洗,氮气吹干备用。
[0023]
(3)将3 μl再生探针rp(1 μm)滴加到步骤(5)得到的电极表面,室温孵育5 min,用双蒸水冲洗后氮气吹干后重复步骤(1)、步骤(2)进行下一个样品检测。单个传感器可进行7次检测。
[0024]
实施例2:上述实施例1中的基于界面探针密度调控的可再生dna纳米筛电化学传感界面的制备步骤如下:(1)金电极用0.05 μm al2o3和水的混合物抛光至镜面,依次用乙醇、蒸馏水超声清洗。将超声好的电极置于0.5 m h2so4中循环伏安扫描至稳定,用双蒸水清洗,n2吹干后待用;(2)将巯基修饰dna分别稀释至以下浓度: 2 μm、1 μm、800 nm、600 nm、500 nm、400 nm、200 nm。取3 μl各浓度的巯基修饰dna溶液分别滴至经预处理的裸金电极表面,室温放置过夜(16 h)后,以pbs洗液冲洗电极表面,氮气吹干后将电极置于100 μl的2 mm 巯基己
醇溶液中浸泡2 h,用双蒸水清洗,氮气吹干备用。
[0025]
(3)将步骤(2)获得的电极浸入10 mm tris-hcl(ph=7.4)进行第一次计时电量法测量(电压0 v至-0.5 v,500 ms),记录截距值q1。测量完成后将电极浸入50 μm氯化六胺合钌溶液中,室温孵育10 min,之后将电极用双蒸水彻底冲洗后再次浸入10 mm tris-hcl(ph=7.4)进行第二次计时电量法测量(电压0 v至-0.5 v,500 ms),记录截距值q2,并计算两次测量得到的截距值的差值:δq=q2-q1。
[0026]
(4)将步骤(3)得到的δq代入以下公式:,其中γ0表示限定在电极表面附近的氯化六胺合钌的量,n是每个氧化还原过程转移的电子数(n=1),f是法拉第常数(f=96485.33289
±
0.00059 c/mol),a是电极面积。将计算得到的γ0代入公式:,其中γ
dna
表示界面巯基修饰dna的密度,z是氧化还原分子所带的电荷量(z=3),m是巯基修饰dna的碱基个数(m=63),n
a
是阿伏伽德罗常数(n
a
≈6.02
×
10
23
)。
[0027]
(5)计算探针间距:假设每个巯基修饰dna周围有一个圆圈面积,通过γ
dna
值的倒数来估算这个面积,从而由这个圆圈面积的直径计算出dna与dna之间的平均距离。得到dna间距小于17.34 nm的可再生dna纳米筛电化学传感界面。
[0028]
实施例3:上述实施例1所用到的lcr反应液的制备: 将4 μl ap(1 μm)、4 μl sp(1 μm)、0.2 μl ampligase(5 u/μl, 购自美国lucigen公司)、5.0 μl reaction buffer(10
×
,购自美国lucigen公司)与1 μl cyp2c19等位基因pcr扩增产物的混合溶液充分混匀,放入pcr仪进行扩增,反应条件:53 ℃ 2 min
ꢀ-ꢀ
94 ℃ 1 min,30个循环。反应完成后,加入2.63 μl的0.2 m 磷酸盐缓冲液(ph=7.4)。
[0029]
实施例4:上述实施例2所用的cyp2c19等位基因pcr扩增产物的制备方法:将1 μl的正向引物(5
’-
aagcaggtataagtctaggaaatga-3’)、1 μl反向引物(5
’-
actccttgacctgttaaacatccgt-3’)、1 μl模板、1 μl dntp (10 mm, 购自上海生工公司)、5 μl taq buffer(购自上海生工公司)、5 μl mgcl2(25 mm,购自上海生工公司)、0.5 μl taq酶(5 u/μl,购自上海生工公司)与15.5 μl 水的混合溶液充分混匀,放入pcr仪进行反应,反应条件:95 ℃预变性3 min后,“94 ℃ 30s
ꢀ-
55 ℃ 35s
ꢀ-ꢀ
72 ℃ 45s”30个循环,最后72 ℃修复延伸7 min。
[0030]
实施例5:将lcr扩增产物(ap-sp)与可再生dna纳米筛电化学传感界面的捕获探针进行杂交,使sp末端的电活性物质亚甲基蓝(mb)靠近电极表面产生电子传递,通过方波伏安法对电信号进行采集并纪录峰电流值。接着加入再生探针rp,由于ap-sp与巯基修饰dna的杂交区域只有12 bp,因此该杂交存在动态过程,rp会在ap-sp处于杂交解离态时与其杂交形成刚性dna双链,由于其几何长度17 nm大于巯基修饰dna间距而无法进入dna自组装层进行杂交,从而使ap-sp从电极表面脱落,实现传感器再生并可接着进行下一个样品的检测。单个传感器可连续检测7个样品,最终根据每个样品所采集的峰电流大小可实现临床样品中cyp2c19等位基因准确分型。利用3个本发明所构建的可再生传感器对21例临床样品的检测结果如图2,
方波伏安法峰电流值主要分布在3个区域:107 na~144 na(高), 62 na~74 na(中), 18 na~30 na(低)。对此,我们根据实验原理将信号落在高、中、低三个区域的样品分别判定为cyp2c19*2, cyp2c19*1 和 cyp2c19*1*2。同时,为了验证所构建的传感器检测的准确性,我们将这21例样品进行了测序(snp检测的金标准),测序结果如图3所示,我们将电化学检测结果与测序结果进行比对,发现这两者结果完全吻合,证明了所构建的基于可再生纳米筛的dna电化学传感器在临床样品核酸检测中具有高准确性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1