氨基脲在贝类组织中存在形态和含量的测定方法与流程
本发明属于水产品检测技术领域,是一种用高效液相色谱-串联质谱法(lc/-ms/ms)检测贝类组织中环境污染物氨基脲存在形态和含量的测定方法。
背景技术:
氨基脲(semicarbazide,sem)一直被认为是呋喃西林药物的特征性代谢产物,常作为监测食品中非法使用呋喃西林药物的标志物。欧盟、日本及中国先后规定呋喃西林及其代谢物在动物源性食品中不得检出。但近年来研究表明,呋喃西林的代谢降解并非是水产品中氨基脲残留的唯一来源,很多途径均可以引入氨基脲污染。氨基脲的主要来源包括:(1)呋喃西林药物的分解呋喃西林是人工合成的广谱抗菌药物,对大多数革兰氏阳性细菌和阴性菌、某些真菌以及原虫具有抗菌杀虫作用,在水产养殖业中曾被广泛使用。呋喃西林在动物体内可被迅速分解代谢,最终形成稳定性高、残留时间长、毒性作用更强的代谢产物-氨基脲,这是环境中氨基脲的主要来源之一。(2)化工原料和医药合成中间体氨基脲常用作测定和合成醛酮、氰酸盐的试剂。氨基脲被用于许多制药过程,特别是用于金属氨基脲衍生物的有机合成。(3)偶氮二甲酰胺的分解偶氮二甲酰胺常被作为与食品接触的塑料发泡剂使用,其在高温下分解可产生氨基脲,如在玻璃包装食品(包括婴幼儿食品、水果汁、果酱、蜂蜜等)金属盖垫圈中的氨基脲就来源于偶氮二甲酰胺的热分解。此外,偶氮二甲酰胺作为面粉发泡剂,在高温条件下可分解产生氨基脲。(4)食品经次氯酸盐处理可产生氨基脲在经次氯酸盐溶液处理的北海虾、鸡肉、牛奶、蛋白粉、大豆片、红藻和卡拉胶等样品中均检出氨基脲,表明氨基脲是次氯酸盐与食品中氨基酸作用后的产物。(5)氨基脲天然存在于一些动物和植物体内。上述各种途径产生的氨基脲均可能排入环境,成为环境中的一种新型污染物,污染水生生物赖以生存的环境,最终在其体内蓄积。目前已有文献报道部分海域的海水、海底沉积物已经受到不同程度的污染,同时在海洋生物体内检测到氨基脲残留。然而环境中的氨基脲进入贝类体内之后究竟是以结合态形式存在还是以游离态形式存在,目前尚不清楚。
技术实现要素:
本发明要解决的技术问题是建立一种环境污染物氨基脲在贝类组织中存在形态和含量的检测方法。本发明方法证实了贝类组织中氨基脲同时以结合态和游离态的形式存在,并提供了两种形态氨基脲含量的检测方法:分别测定氨基脲总量和结合态氨基脲,再计算游离态氨基脲含量。氨基脲总量测定方法:用盐酸水解样品,2-硝基苯甲醛衍生化,定量加入磷酸氢二钾溶液,加入乙酸乙酯液液萃取,上清液经浓缩、净化后,经液相色谱-串联质谱仪测定,内标法定量。结合态氨基脲的测定方法为样品分别用甲醇/水、甲醇和水分别洗涤游离态氨基脲,再加入盐酸水解,按照上述步骤测定结合态氨基脲含量。氨基脲总量减去结合态氨基脲即为游离态氨基脲含量。
本发明方法在贝类外套膜、性腺、闭壳肌和内脏组织中氨基脲的检测限均为0.5μg/kg。氨基脲在1.0μg/kg~10μg/kg添加浓度范围内,回收率为70%~120%,本方法的批内相对标准偏差和批间相对标准偏差均≤15%。
本发明是按照以下操作方法完成的:
一种氨基脲在贝类组织中存在形态和含量的测定方法,它包括氨基脲总量的测定、结合态氨基脲的测定、标准曲线的绘制、所用的仪器条件和定性与定量,具体步骤如下:
1)氨基脲总量的测定
(1)样品水解和衍生化
样品中加入盐酸、衍生化试剂、同位素内标,37℃水解和衍生化16h,取出放置至室温;
进一步,所述步骤(1)中的衍生化试剂是浓度为100mmol/l2-硝基苯甲醛,加入的体积与样品质量比为入3:40(ml:g)。
进一步,所述步骤(1)中盐酸的浓度为0.5mol/l,加入的盐酸体积与样品的质量比为5:2(ml:g)。
(2)提取和净化
向步骤(1)处理后的样品中加入磷酸氢二钾溶液,使样品溶液的ph在7.0~7.5,加入乙酸乙酯液液萃取,涡旋混匀后离心,取上清液转入在45℃下氮气吹干,加入5%甲醇水溶液涡旋振荡溶解残留物,转移至超滤离心管中,14000r/min离心后,供高效液相色谱-串联质谱仪测定;
进一步,所述步骤(2)中加入的磷酸氢二钾溶液浓度为1.0mol/l,加入的体积与样品的质量比为3:1(ml:g)。
2)结合态氨基脲的测定
(1)样品分别用甲醇/水、甲醇和水洗涤游离态氨基脲;
(2)然后按照上述步骤1)进行测定;
3)标准曲线的绘制
分别移取一定浓度的氨基脲标准溶液,除不加样品外,按照上述步骤1)中(1)和(2)的操作步骤进行样品水解和衍生化、提取和净化,然后进lc-ms/ms分析,绘制标准曲线;
4)所用的仪器条件
色谱条件如下:
a)色谱柱:c18反相色谱柱,2.1mm×100mm,2.6~5μm;
b)柱温:室温;
c)流速:0.3ml/min;
d)进样量:10μl;
e)流动相:a:甲醇,b:2mmol/l乙酸铵水溶液,梯度洗脱程序见表1。
表1流动相梯度洗脱条件
质谱条件如下:
电喷雾离子源;喷雾电压:5500v,正离子扫描;离子源温度:550℃,碰撞气:medium;气帘气:30psi;雾化气:35psi;辅助加热气:35psi;离子模式:多反应选择监测,选择反应监测母离子、子离子、碰撞能量和锥孔电压质谱参数见表2;
表2选择反应监测母离子、子离子和碰撞能量
注:*代表定量碎片离子
5)定性与定量
(1)定性测定
在同样测试条件下,试样液中目标化合物的保留时间与标准工作液中目标化合物的保留时间之比,偏差在±5%以内,且检测到的定性离子的相对丰度,应与浓度相近的标准工作液中定性离子相对丰度一致,其偏差应符合表3要求;
表3基峰与次强碎片离子丰度比要求
(2)定量测定
取试样溶液和相应的标准工作液,作多点校准,按内标法定量;标准溶液及试样溶液中目标化合物的响应值均应在仪器检测的线性范围之内;氨基脲以其同位素为内标进行定量;
(3)空白实验
除不加试样外,均按上述测定条件和步骤进行;
(4)结果计算和表述
按式(a)计算试样中目标化合物的残留量:
式中:
x—试样中目标化合物的残留量,μg/kg;
c—试样溶液中目标化合物的浓度,ng/ml;
v—最终样液定容体积,ml;
f—稀释倍数;
m—试样量,g;
注:计算结果需扣除空白值;
氨基脲总量、结合态氨基脲含量按照公式(a)计算得到,游离态氨基脲含量=氨基脲总量-结合态氨基脲含量。
本发明方法的灵敏度、准确度和精密度
灵敏度:闭壳肌、外套膜、鳃、内脏、性腺中氨基脲的检出限均为0.5μg/kg,定量限为1.0μg/kg。
准确度:本方法氨基脲在1.0μg/kg~10μg/kg添加浓度范围内,回收率为70%~120%。
精密度:本方法的批内相对标准偏和批间相对标准偏差均≤15%。
本发明与现有技术相比的有益效果:
本发明首次建立了贝类产品中氨基脲的存在形态和的测定方法,并首次应用该方法测定了贝类不同组织中氨基脲的存在形态及其分布特征。该方法对于开展贝类产品中环境污染物的研究,保障水产品质量安全具有非常重要的意义。
现在检测技术主要针对使用硝基呋喃药物后在体内的代谢产物进行检测,且该类药物进入体内后主要以蛋白结合态形式存在。而氨基脲是一种新型环境污染物,在自然状态下是以游离态形式存在的。作为一种新型环境污染物,其进入扇贝体内后是以结合态形式存在还是以游离态形式存在尚是未知,且目前还没有关于贝类不同组织中氨基脲存在形态的检测方法。本方法填补了我国目前没有环境新型污染物氨基脲在贝类体内存在形态的检测方法空白。
本发明分别通过测定氨基脲总量、结合态氨基脲方法,计算游离态氨基脲,采用液相色谱-串联质谱法测定,能够排除干扰准确定性,同时还能准确定量,本发明在定性、定量、灵敏度和准确度方面都具有明显的优势。
本方法对盐酸和磷酸氢二钾浓度和用量进行了优化,盐酸浓度为0.5mol/l,衍生化后,直接定量加入1.0mol/l磷酸氢二钾6ml,溶液的ph值即在7.0~7.5之间,无需再用不同浓度氧氧化钠调节ph值。该方法定量加入盐酸5ml和磷酸氢二钾溶液6ml,溶液的ph值即可在7.0~7.5之间,特别是在批量操作时,省去了逐一调节ph的繁琐操作过程,极大提高了提取效率。
附图说明
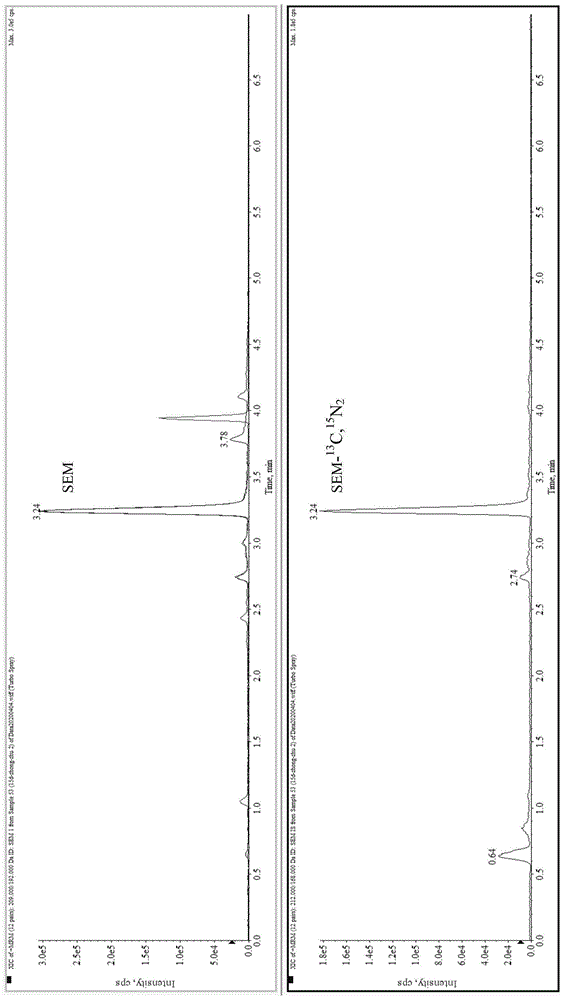
图1:闭壳肌中sem及其内标的特征离子质量色谱图;
图2:外套膜中sem及其内标的特征离子质量色谱图;
图3:鳃中sem及其内标的特征离子质量色谱图;
图4:内脏中sem及其内标的特征离子质量色谱图;
图5:性腺中sem及其内标的特征离子质量色谱图。
具体实施方式
下面通过实施例结合附图详细叙述本发明的技术内容:
本发明为利用高效液相色谱-串联质谱法分析环境污染物氨基脲在贝类组织中存在形态和含量的检测方法,分别通过测定氨基脲总量和结合态氨基脲,计算游离态氨基脲。
贝种类繁多,如扇贝、蛤蜊、牡蛎、贻贝等,在其生长过程中由于受到新型环境污染物的污染而导致在其体内残留,我们选择贝类最具有代表性的扇贝作为验证的实施例。
实施例1扇贝中氨基脲形态的测定
1.本实施例选用的仪器及设备:lc-ms/ms液相色谱-串联质谱仪
(1)hplc部分(岛津公司,型号lc-20a),使用kinetexxbc18反相色谱柱,100mm×2.1mm,2.6μm。
(2)abqtrap5500质谱仪(美国ab公司):配有esi离子源,三重四极杆,碰撞池,真空系统,气路控制系统;
(3)超声波清洗仪(昆山市超声仪器有限公司,型号kq-600de);
(4)高速离心机:8000r/min(thermofisher公司);
(5)涡旋混合器(美国talboys公司);
(6)氮吹仪(美国organomation公司,型号n-evap112);
(7)微型高速离心机:14000r/min(德国sigma公司);
(8)分析天平:感量0.00001g(德国赛多利斯公司,型号cp225d);
(9)天平:感量0.01g(德国赛多利斯公司,型号cpa1003p);
(10)10k超滤离心管(millipore);
(11)恒温振荡器(美国精骐有限公司,型号is-rds3);
(12)milli-q超纯水仪(美国millipore公司)。
2.配制标准溶液与试剂
(1)乙腈、甲醇:色谱纯(德国merck公司)。
(2)乙酸铵(德国merck公司)。
(3)2-硝基苯甲醛(美国sigma公司)
(4)盐酸、磷酸氢二钾:优级纯(国药集团化学试剂有限公司)。
(5)2mmol/l乙酸铵溶液:准确称取0.154g乙酸铵,用水溶解并定容至1l,混匀后备用。
(9)sem标准储备液:称取sem标准品约10.0mg,用甲醇溶解并定容至10ml,配成浓度分别为1.0mg/ml的标准储备液,-20℃冷冻保存。
(10)sem-13c,15n2同位素内标标准储备液:称取sem-13c,15n2标准品约10.0mg,用甲醇溶解并定容至10ml,配成浓度分别为1.0mg/ml的内标标准储备液,-20℃冷冻保存。
(11)sem标准工作液:分别准确移取适量标准储备液,用甲醇稀释并定容,配成浓度为100μg/l和10μg/l的标准工作液,2℃~8℃冷藏保存。
(12)sem-13c,15n2同位素内标标准工作液:分别准确移取适量sem-13c,15n2同位素内标标准储备液,用甲醇稀释并定容,配成浓度为100μg/l的内标标准工作液,2℃~8℃冷藏保存。
整个实验过程中用水均为超纯水。
3.样品处理的步骤
(1)氨基脲总量的样品前处理
①水解和衍生化
称取闭壳肌、外套膜、鳃、内脏和性腺匀浆组织各2g于50ml离心中,加入50μl同位素内标,静置5min,加入5ml0.5mol/lhcl,再加入150μl100mmol/l2-硝基苯甲醛,涡旋1min,置于37℃避光恒温振荡16h。
②提取和净化
取出离心管冷却至室温,定量加入1.0mol/l磷酸氢二钾溶液6ml(ph值7.0~7.5),加入乙酸乙酯8ml,涡旋振荡1min,8000r/min离心5min,取上层清液转移至10ml离心管中,于40℃下氮气吹干。准确加入5%甲醇溶液1.0ml,充分涡旋振荡溶解残留物,再将溶液转移至超滤离心管中,14000r/min离心10min,取下层清液供液相色谱-串联质谱分析。
(2)结合态氨基脲的样品前处理
称取闭壳肌、外套膜、鳃、内脏和性腺匀浆组织各2g,分别用6ml甲醇/水溶液(50:50,v/v)、6ml甲醇/水溶液(75:25,v/v)、6ml甲醇各洗涤一次,再用6ml水洗涤一次。
加入50μl内标,以下步骤按照(1)进行操作。
(3)标准曲线的绘制
分别准确移取适量标准工作液于50ml离心管中,除不加样品外,按照上述(1)中①和②的步骤操作,使氨基脲最终溶液浓度分别为0.0005μg/ml、0.001μg/ml、0.002μg/ml、0.005μg/ml、0.010μg/ml和0.020μg/ml,进lc-ms/ms分析,绘制标准曲线。
4.实验所用的仪器条件
色谱条件如下:
a)色谱柱:kinetexxbc18反相色谱柱,2.1mm×100mm,2.6μm;
b)柱温:室温;
c)流速:0.3ml/min;
d)进样量:10μl;
e)流动相:a:甲醇,b:2mmol/l乙酸铵水溶液,梯度洗脱程序见表1。
质谱条件如下:
a)离子化模式:电喷雾离子源(esi);
b)扫描方式:正离子扫描;
c)离子源温度:550℃;
d)碰撞气(cad):medium;
e)气帘气(curtaingas):30psi;
f)雾化气(gas1):35psi;
g)辅助加热气(gas2):35psi;
h)扫描模式:选择反应监测(srm),选择反应监测母离子、子离子和碰撞能量见表2;
5.样品检测与结果计算
(1)定性测定
在同样测试条件下,试样液中目标化合物的保留时间与标准工作液中目标化合物的保留时间之比,偏差在±5%以内,且检测到的定性离子的相对丰度,应与浓度相近的标准工作液中定性离子相对丰度一致,其偏差应符合表3要求。
(2)定量测定
取试样溶液和相应的标准工作液,作多点校准,按内标法以峰面积定量。标准溶液及试样溶液中氨基脲的响应值均应在仪器检测的线性范围之内。
(3)空白实验
除不加试样外,均按上述测定条件和步骤进行。
(4)结果计算和表述
以浓度为横坐标,以外标和相应内标峰面积的比值为纵坐标,绘制标准曲线,然后对样品峰进行分析处理,即可得到待测样液中目标化合物的浓度,按式(a)计算试样中目标化合物残留量:
式中:
x—试样中目标化合物的残留量,μg/kg;
c—试样溶液中目标化合物的浓度,ng/ml;
v—最终样液定容体积,ml;
f—稀释倍数;
m—试样量,g。
注:计算结果需扣除空白值。
氨基脲总量、结合态氨基脲含量直接按照公式(a)计算得到,游离态氨基脲含量=氨基脲总量-结合态氨基脲含量。
6.结果
本方法氨基脲检出限为0.5μg/kg,定量限为1.0μg/kg。氨基脲在1.0μg/kg~10μg/kg添加浓度范围内,回收率为70%~120%,本方法的批内相对标准偏差和批间相对标准偏差均≤15%。
扇贝组织中氨基脲的加标回收率和精密度的测定结果见表4,图1-图5。
表4扇贝组织加标回收率和精密度的测定结果
7.应用
应用建立的方法对在环境中暴露20d的扇贝组织中氨基脲存在形态及含量进行测定,其结果见表5。
表5氨基脲暴露20d后扇贝组织中氨基脲含量
- 还没有人留言评论。精彩留言会获得点赞!