一种SARS-CoV-2的灭活疫苗纯度分析方法与流程
一种sars-cov-2的灭活疫苗纯度分析方法
技术领域
[0001]
本发明属于生物技术领域,具体而言,涉及一种sars-cov-2的灭活疫苗纯度分析方法。
背景技术:
[0002]
严重急性呼吸综合征冠状病毒(sars-cov-2)引起的covid-19疫情,给人类身心健康造成巨大威胁,成为影响全球的重大公共卫生事件。sars-cov-2在分类学上属于冠状病毒科(coronaviridae)冠状病毒属(coronavirus)中的β类型冠状病毒,具有囊膜,以表面刺突蛋白为特征,基因组为线性单股正链的rna((+)ss rna)病毒
[1]
。其主要结构蛋白包括表面棘突糖蛋白s、膜蛋白m、小包膜蛋白e、核衣壳蛋白n、辅助蛋白3a。这些结构蛋白的糖基化修饰,蛋白酶剪切、其他的翻译后修饰以及多聚体的形成对这些蛋白的功能至关重要。
[0003]
糖基化后的s、m、e和多种形式的3a是sars-cov-2的膜蛋白,n蛋白与病毒基因组rna结合。有文献报道,在感染sars-cov-1后这些结构蛋白都会诱导或强或弱的体液免疫反应,主要中和抗原是n-linked糖基化s蛋白。s蛋白被furin-like蛋白酶切成s1和s2亚基,在病毒侵入细胞过程中分别介导受体结合和病毒与宿主细胞的膜融合。n蛋白与病毒rna结合形成核衣壳,具有较强的免疫原性,在成熟病毒粒子中每14-19个核苷酸残基结合一个n蛋白。n蛋白常被用于制备重组蛋白疫苗,n蛋白疫苗在小鼠体内诱导产生了高水平的t、b细胞免疫应答
[3]
。m蛋白是病毒体的主要结构成份,摩尔分子在结构蛋白中占比高,可介导病毒颗粒的装配和出芽,另外本研究也证实了m为n-linked糖化蛋白。3a蛋白形成离子通道,可能成为重要的药物和疫苗靶点,通过调节离子通道可能抑制sars-cov-1的复制
[4-5]
。本研究发现3a的摩尔分子与m蛋白的占比相当,且诱导更高的抗体反应。e蛋白是一种小跨膜蛋白,含量低,但在病毒颗粒的组装与释放过程中发挥着重要作用
[6]
。这些结构蛋白决定着免疫原性,影响着免疫持久性,甚至决定着病毒侵入机体的方式
[7]
。m和e共同表达,即可装配为病毒样颗粒。
[0004]
目前针对covid-19并无特效药,疫苗是控制covid-19疫情的必要手段。武汉生物制品研究所有限责任公司和中科院武汉病毒研究所合作研发了sars-cov-2灭活全病毒疫苗(cn111569058a),在已完成的灭活疫苗的i期和ii期临床试验中的初步观察结果表明,该疫苗的接种能够产生高水平的中和抗体阳转率和滴度,同时具有良好的耐受性,仅有低级别、低百分比的不良反应,表明灭活疫苗具有很好的安全性、耐受性及免疫原性
[8]
。
[0005]
当然,对于疫苗产品而言,疫苗的纯度直接与接种后的安全性、免疫原性及疫苗保护效力相关。但目前并没有针对sars-cov-2灭活全病毒结构蛋白鉴定及分析方法,因此,建立sars-cov-2灭活全病毒疫苗结构蛋白的鉴定方法,对于评价疫苗产品的质量就显得格外重要。
[0006]
综上,建立高灵敏度、高特异性的适合于sars-cov-2的灭活全病毒疫苗纯度分析方法,也是疫苗研发过程中急需解决的重要问题。
[0007]
参考文献
[0008]
[1]夏立秋.新型冠状病毒sars-cov-2研究进展.激光生物学报.2020,29(1):1
–
10.
[0009]
[2]issa e,merhi g,panossian b,et al.sars-cov-2and orf3a:nonsynonymous mutations,functional domains,and viral pathogenesis.msystems.2020,5(3):e00266
–
20.
[0010]
[3]马艺文,付雅璐,肖鑫,等.冠状病毒疫苗研究进展.传染病信息.2020,33(1):65-70.
[0011]
[4]firth ae.a putative new sars-cov protein,3a*,encoded in an orf overlapping orf3a.j gen virol.2020,101(10):1085
–
1089.
[0012]
[5]tan yj,teng e,shen s,et al.a novel severe acute respiratory syndrome coronavirus protein,u274,is transported to the cell surface and undergoes endocytosis.j virol.2004,78(13):6723
–
6734.
[0013]
[6]verdi
á-
b
á
guena c,nieto-torres jl,alcaraz a,et al.coronavirus e protein forms ion channels with functionally and structurally-involved membrane lipids.virology.2012,432(2):485
–
494.
[0014]
[7]graham sp,mclean rk,spencer aj,et al.evaluation of the immunogenicity of prime-boost vaccination with the replication-deficient viral vectored covid-19vaccine candidate chadox1 ncov-19.npj vaccines.2020,5:69.
[0015]
[8]xia s,duan k,zhang y,et al.effect of an inactivated vaccine against sars-cov-2on safety and immunogenicity outcomes:interim analysis of 2randomized clinical trials.jama.2020;324(10):1
–
10.
[0016]
[9]方会龙,曾庆仁,王俊杰,等.运用quantity one软件分析日本血吸虫不同发育时期蛋白组分差异.中国血吸虫病防治杂志.2010,04:320
–
323.
技术实现要素:
[0017]
本发明涉及一种用于sars-cov-2的灭活疫苗纯度分析方法,所述的sars-cov-2灭活疫苗的制备方法参见cn202010559132.3;所述的方法包括如下步骤:
[0018]
(1)以4
×
裂解-上样缓冲液处理灭活疫苗,所述的裂解-上样缓冲液以水为溶剂,其中含有:tris-hcl(ph6.8,浓度为250mm)、10%的十二烷基磺酸钠(w/v)、51%的甘油(v/v)、5%的β-巯基乙醇(v/v)、2%的乙基苯基聚乙二醇(np40)(v/v),即必要的显色剂;优选的,所述的显色剂为0.4%的溴酚蓝(w/v);
[0019]
(2)将步骤(1)获得的样品在4-20%的sds-page胶中进行电泳,在低温(4℃)低电流(20ma)低电压(100v)的条件下,进行sds-page电泳;
[0020]
(3)电泳结束后,对page胶进行银染,对银染结果使用如下公式进行半定量分析:
[0021][0022]
所述的灭活疫苗为灭活疫苗原液,优选的,所述的灭活疫苗为蛋白含量40-220μg/ml的灭活疫苗原液。
[0023]
优选的,检测所述灭活疫苗时,使用的sds-page胶的尺寸为:长
×
宽
×
厚为80
×
70
×
1mm;上样量为20μl/每个样品,其中含有灭活疫苗原液15μl,裂解-上样缓冲液5μl;
[0024]
优选的,电泳时间为90min。
[0025]
所述4-20%的sds-page胶的各成分含量为:
[0026][0027]
本发明的有益效果在于,
[0028]
本发明建立了sars-cov-2灭活疫苗全病毒蛋白相对含量分析方法。
[0029]
常规的蛋白纯度的分析的常规方法中,紫外分光光度法(如高压液相层析,毛细管电泳法)的结果与蛋白芳香族氨基酸残基含量相关,影响准确性;同位素蛋氨酸、半胱氨酸标记显色时,不同蛋白2种氨基酸含量差异比较大,影响准确性;sds-page电泳法后的染色灰度扫描,考马斯亮蓝染色,灵敏性较低;银染法虽然灵敏度较高,但蛋白过量灰度可能降低。抗体荧光染色法,灵敏度虽能提高,但方法复杂、设备和材料成本高。
[0030]
比较上述方法优劣性后,本发明采用蛋白电泳后的银染法,检测灭活疫苗中总蛋白。
附图说明
[0031]
图1、不同浓度sds-page电泳:图1a:蛋白在15%的胶中进行sds-page电泳,考马斯亮蓝染色。图1b:蛋白在8%的胶中进行sds-page电泳,考马斯亮蓝染色。3a’为剪切形式,m’为未糖基化形式。
[0032]
图2、蛋白在4-20%的胶中进行sds-page电泳,考马斯亮蓝染色。各泳道为:
[0033]
1.loading buffer中未加β-巯基乙醇和np40;
[0034]
2.loading buffer中已加0.5%β-巯基乙醇未加np40;
[0035]
3.loading buffer中已加0.5%β-巯基乙醇和2%np40。
[0036]
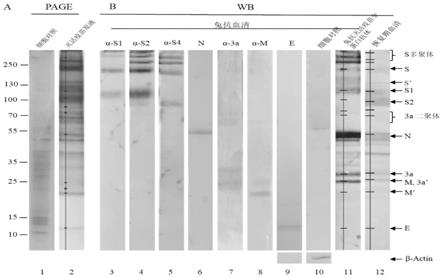
图3、sars-cov-2灭活全病毒疫苗结构蛋白鉴定,图3a:蛋白在4-20%的梯度胶中进行sds-page电泳,银染;图3b:分离的蛋白质被转移到nc膜上进行western blotting,使用的是病人恢复期血清和针对病毒全颗粒蛋白的兔抗血清以及顶部所示的单个蛋白兔抗血清。3a’,未被剪切;s’、m’,未糖基化。扫描了蛋白page图(泳道2)和western blotting图(泳道11、12)。小鼠β-actin单克隆抗体用作内参抗体。分子量标记显示在左侧以kda为单位,右侧箭头指示蛋白质。
[0037]
图4、s蛋白三聚体解聚分析:将尿素(6m)添加到含有2%np40的上样缓冲液中,并
20℃保存。将已灭活纯化的sars-cov-2原液经sds-page分离后,鉴定分析所制备的兔多克隆抗体,均正确识别目的蛋白。
[0058]
实施例3:胶浓度及裂解液配方选择
[0059]
将样本分别于8%、15%和4-20%的sds-page胶中进行电泳,通过对各条带分离程度的比较,4-20%的各条带分离最为清晰,故选择4-20%浓度的梯度胶作为纯度分析的胶浓度,如图1,3。4-12%sds-page对s1四种糖化形式条带进行分析,如图7。本实施例所使用的page胶尺寸均为:长
×
宽
×
厚为80
×
70
×
1mm。各个page胶的配方如下:
[0060]
4-20%的梯度page胶各成分用量
[0061][0062]
4-12%的梯度page胶各成分用量
[0063][0064][0065]
8%和15%的page胶各成分用量
page电泳,牛血清白蛋白参考品浓度为7.9μg/ml和0.06μg/ml,上样样品体积为15μl(再加5μl 4xloading buffer),即可显示肉眼可见蛋白条带。考马斯亮蓝染色和银染的敏感度分别约为,15μl浓度为7.9μg/ml和0.06μg/ml蛋白,或每泳道527ng和4.3ng蛋白。银染法比考马斯亮蓝染色,灵敏度高120倍。
[0076]
实施例6:质谱法分析疫苗中特异性抗体未识别部分
[0077]
将部分sds-page中对比获得疑似为vero细胞宿主蛋白的电泳条带切下后,经过质谱分析,确认其为vero细胞的宿主蛋白,如图6所示。
[0078]
实施例7:利用敏感的染色方法分析sars-cov-2灭活疫苗的纯度
[0079]
将不同批次的样品进行sds-page电泳(图10),运用更敏感的染色方式-银染对蛋白胶进行染色。基于实施例4中所确定的目的蛋白条带,确认各目的蛋白条带位置,其位置如图3所示,同时将vero细胞宿主蛋白作为对照,基于sds-page的分析,确定宿主蛋白的位置,以作为区别主要宿主细胞杂质蛋白的标准,如图3a所示。
[0080]
根据图10可得出结论,当浓度在小于40μg/ml时,上样样品体积为15μl时,不能检测到所有的待检的结构蛋白,如样品18号,而浓度在大于220μg/ml时,上样样品体积为15μl待测的结构蛋白因蛋白量过大,而无法分开,如样品22号。40μg/ml-220μg/ml上样样品体积为15μl(再加5μl 4xloading buffer),即可显示的清晰的待检的结构蛋白条带。因此建立的方法的检测限为上样样品体积15μl浓度为40μg/ml-220μg/ml(因为每个泳道的蛋白条带有十几条之多,并且该病毒各结构蛋白所占的比例不一,最多与最少的能相差几十倍,为了使待检的结构蛋白都可见,只能寻找一个平衡点,即检测限)。
[0081]
采用quantity one作为分析软件进行蛋白的纯度分析,以扫描所得的灰度值为基础进行纯度分析
[9]
。其计算公式如下:
[0082][0083]
以上述公式为基础,分析灭活疫苗的纯度以及各组分含量的稳定性,对每批样品进行实时监测。因为蛋白电泳后的银染法,蛋白过量灰度可能降低,疫苗中相对含量较高的n蛋白,采用考马斯亮蓝染色后,与其他的不同蛋白相对含量比较后,经过多批对比和计算得出比值s/n为0.17,从而根据比值调整银染法中的n及其他蛋白的百分比,如图9。调整前后的各蛋白百分比见表1.。表格中给出的是软件最终扫描出各结构蛋白的灰度值占总蛋白的比例,不是灰度值,前述s/n为0.17是指经过多批样本(至少三批)考马斯亮蓝染色的(s灰度值/n灰度值)得到的平均数,银染的时候,知道了s的灰度值,直接s除以0.17即得到n的灰度值,然后再和其他蛋白加一起计算总蛋白灰度值,最后相应蛋白的灰度除以总蛋白灰度,该数据就是相应蛋白所占比例。
[0084]
表1参考s/n比例调整银染法中n蛋白比例
[0085][0086]
最后需要说明的是,以上实施例仅用于帮助本领域技术人员理解本发明的实质,不用于限定本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1