光波导多微流道检测系统的制作方法
本发明涉及一种光波导多微流道检测系统,尤其涉及一种光波导多微流道生物检测系统。
背景技术:
在现代生化分析流程中,高通量检测设备已经被广泛使用。这些设备大多采用基于微流体技术或者微孔阵列的生物芯片,装载在高性能的光学系统中,实现对诸如核酸、蛋白、病毒、细菌、细胞等等不同尺寸的生物样品的分析。这些光学系统的设计通常都基于复杂的几何光学,其体积大、成本高、需要光学准直、维护成本较高。
在精准医疗时代,小型化、高性能、低成本和可移动的集成化分析系统受到很大关注。尤其是labonchip的概念,经过几十年的发展,基于微流体技术对生物样品的操控方面取得了长足的进步,但真正的labonchip系统仍然缺少一种微纳尺度下的高通量生物样品的芯片级的片上光学检测和分析集成系统。
技术实现要素:
为解决目前现代生化分析仪器体积庞大、成本高和满足精准医疗时代所需求的仪器小型化、可移动和集成化等一系列新的需求。
本发明提供一种光波导多微流道检测系统,包括:微流体芯片、显微镜、测量装置和分析装置;其特征在于,
所述微流体芯片包括微流体组,所述微流体组包括第一数量的微流体;
所述微流体包括光波导组和微流道,所述光波导组包括第二数量的光波导,所述光波导用以将光沿水平方向导入所述微流道内,所述显微镜用于收集所述微流道内的光信号并向所述测量装置传输所述光信号,所述测量装置用以处理所述光信号并产生待分析信号并向所述分析装置传输所述待分析信号,所述分析装置分析所述待分析信号形成光谱;
所述微流体芯片还包括:依次由下而上设置的衬底、下包层、波导层、上包层和流道盖板,所述波导层是氮化硅材料,所述波导层用以形成所述光波导;
所述微流道由上而下贯穿所述上包层、所述波导层和所述下包层延伸进所述衬底;
所述流道盖板覆盖所述微流道上开口,所述微流道盖板包括用以向所述微流道注入含待检测生物分子溶液的注液口;
所述下包层是厚度为2~3μm的二氧化硅,所述上包层是厚度为15~30μm的高分子聚合材料,所述微流道延伸进所述衬底10~15μm,所述微流道宽度为10-100μm。
优选地,还包括导光结构,用以向所述光波导组提供光源。
优选地,所述光波导组包括第二数量相互平行的所述光波导,以将光导入所述微流道,所述光波导的宽度为300-600nm。
优选地,所述第二数量为1,所述微流体对应的整层或大部分所述波导层形成一个片状的所述光波导。
优选地,所述波导层厚度为150-1000nm。
优选地,所述导光结构包括干路导光和导光组,所述导光组从所述干路导光中引出,所述导光组与所述光波导组光连接。
优选地,所述导光组采用分光结构从所述干路导光中引出。
优选地,所述干路导光包括第一导光,所述导光组包括第二导光,所述第一导光与所述第二导光通过交叉跨层结构交叉。
优选地,所述交叉跨层结构包括第一导光重叠区和第二导光重叠区;所述第一导光在交叉处断开,并在断开相对的两端形成两个锐角导光端面;所述第二导光在交叉处形成与所述锐角导光端面相匹配的锐角导光引面;所述第一导光重叠区包括所述锐角导光端面和与其相匹配的锐角导光引面,所述第二导光重叠区包括所述锐角导光端面和与其相匹配的锐角导光引面。
优选地,所述光波导是耦合光波导;
所述耦合光波导包括入射光栅,以将所述上包层上方的光导入所述耦合光波导直至导入所述微流道;所述入射光栅凸出于所述波导层向上延伸进所述上包层,所述波导层厚度为150-1000nm,所述耦合光波导的宽度为300-600nm。
本发明提供一种光波导多微流道检测系统,具有有益效果:本发明通过集成电路量产工艺来生产这种芯片级光学检测和分析系统,将传统光学系统的功能通过集成光学或片上光学器件来实现,不仅可以把传统的台式甚至大型的光学系统缩小到芯片尺寸,而且还保证同等甚至更出色的分析性能,实现微纳尺度下的生物样品的高通量芯片级光学检测和分析集成系统,大幅度降低系统成本。并形成光波导与多微流道一体化矩阵的结构,通过多微流体通道和大规模矩阵化的光波导来实现比传统光学系统更高通量的分析性能,可快速构建微纳尺度下的高通量生物样品的芯片级的片上光学检测和分析集成系统,实现微纳尺度下的生物样品检测的高通量芯片。
附图说明
附图1是本发明光波导多微流道检测系统侧面视图;
附图2是本发明的一种微流体的侧视图;
附图3是本发明的另一种微流体的侧视图;
附图4是图2或图3的俯视图;
附图5是图1片状光波导微流体的俯视图;
附图6是导光结构示意图;
附图7是图6中a的放大视图;
附图8是图6中b的放大视图;
附图9是图8的剖面图。
具体实施方式
下面结合附图对本发明的具体实施方式做详细说明。
在附图中,为了描述方便,层和区域的尺寸比例并非实际比例。当层(或膜)被称为在另一层或衬底“上”时,它可以直接在另一层或衬底上,或者也可以存在中间层。此外,当一层被称为在另一层“下”时,它可以直接在下面,并且也可以存在一个或多个中间层。另外,当层被称为在两个层之间时,它可以是两个层之间的唯一层,或者也可以存在一个或多个中间层。相同的附图标记始终表示相同的元件。另外,当两个部件之间称为“连接”时,包括物理连接,除非说明书明确限定,此种物理连接包括但不限于电连接、接触连接、无线信号连接。
本发明专利提出水平光波导与微流体通道一体化模块方案,同时提出多微流体通道系统矩阵化方案,快速构建微纳尺度下的高通量生物样品的芯片级的片上光学检测和分析集成系统。其中,水平光波导是指将光沿水平方向导入微流道的光波导
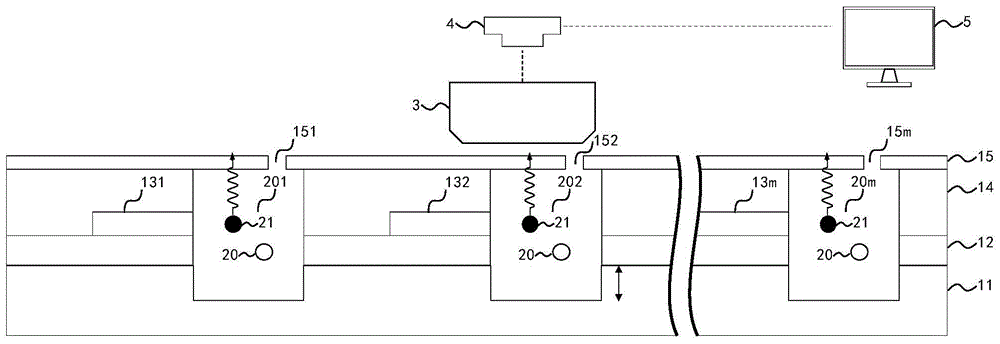
一种光波导多微流道检测系统,如图1所示,包括:微流体芯片(未示出)、显微镜3、测量装置4和分析装置5;
所述微流体芯片包括微流体组,所述微流体组包括第一数量的微流体(未示出),如图1所示,第一数量为m;
所述微流体包括光波导组和微流道,如图2所示的一个微流体包括波导组131和微流道201;所述光波导组131、132…13m包括第二数量的光波导,如图2和图4所示,第二数量为n,光波导组131包括n个光波导1311、1312…131n,以形成n*m矩阵化的检测系统。
所述光波导1311、1312…131n用以将光沿水平方向导入所述微流道201内,所述显微镜3用于收集所述微流道201、202…20m内的光信号并向所述测量装置4传输所述光信号,所述测量装置4用以处理所述光信号并产生待分析信号并向所述分析装置5传输所述待分析信号,所述分析装置5分析所述待分析信号形成光谱;
所述微流体芯片还包括:依次由下而上设置的衬底11、下包层12、波导层13、上包层14和流道盖板15,所述波导层13是氮化硅材料,所述波导层13用以形成所述光波导组131、132…13m;
所述微流道201、202…20m由上而下贯穿所述上包层14、所述波导层13和所述下包层12延伸进所述衬底11;
所述流道盖板15覆盖所述微流道201、202…20m上开口,所述微流道盖板15包括用以向所述微流道201、202…20m注入含待检测生物分子溶液的注液口151、152…15m;需要说明的是,还包括出液口(未示出),以与所述注液口151一一对应形成循环系统,该出液口可以是流道盖板15上的开口;该出液口也可以是微流道两端的开口,本发明在此不做限制。
所述下包层12是厚度为2~3μm的二氧化硅,所述上包层14是厚度为15~30μm的高分子聚合材料,所述微流道201、202…20m延伸进所述衬底11中10~15μm,所述微流道201、202…20m宽度为10-100μm;形成光波导与多微流道一体化矩阵的结构,快速构建微纳尺度下的高通量生物样品的芯片级的片上光学检测和分析集成系统。
需要说明的是,第一数量m的微流体可构成一个微流体组,还可以构建第三数量的微流体组构成的微流体矩阵,该第三数量为k,则可光波导总数为形成n*m*k矩阵化的检测系统;形成光波导与多微流道一体化矩阵的结构,快速构建微纳尺度下的高通量生物样品的芯片级的片上光学检测和分析集成系统。
需要说明的是,所述光波导组包括第二数量n相互平行的所述光波导,如图1和图4所示,光波导组131包括第二数量为n相互平行的所述光波导1311、1312…131n,以将光沿水平方向导入所述微流道201,所述光波导的宽度为300-600nm。
其中根据波导组131的光源方向不同,如:图2是光波导组131从左端引入光源、而图3是从光波导组131上方引入光源,在多微流道尤其是矩阵化检测系统中,前者需要在制造矩阵化芯片时从结构上增加如图6所示的导光结构、后者则无需增加该导光结构,下面结合图1~2、4~9说明该导光结构:
如图1和5所示,光波导组131、132…13m可只包括一个光波导,则导光组601、602…60m各包括一个导光线,以各与光波导组131、132…13m光连接;其中一个微流体对应的整层或大部分所述波导层13形成一个片状光波导1311,片状光波导1311导入的激发光场可减少检测标记生物分子中的背景光信号,大大提高小生物分子的检出率。
如图1和图4所示,光波导组131包括若干个,如n个,相互平行的光波导1311、1312…131n,那么与之光连接的导光组601则需要相应的n根导光线,以将光沿水平方向导入所述微流道201;在实际检测中,针对微流道201中含不同标记的生物分子,与n根导光线一一连接的光波导1311、1312…131n可分别将不同波长为λ1、λ2…λn的光沿水平方向导入微流道201中,利用不同波长的光激发不同标记的标记生物分子21可以同时识别这些生物分子,而不在光波导1311、1312…131n导入的激发光场中的非激生物分子20将不被识别,非激生物分子20是未经标记的正常生物分子或者经标记但位于光场之外而未被激发的生物分子;其中,如图3所示,所述光波导1311、1312…131n的宽度为300-600nm。
如图1~2所示,所述波导层13厚度为150-1000nm,亦即图2、图4~5中的所述光波导1311、1312…131n的厚度为150-1000nm。
其中,所述导光组与光波导组131光连接,进而与光波导组131中的光波导1311、1312…131n光连接。
随着干路导光60向具有n个光波导的第二个微流道202…直至第m个微流道20m提供导光组602…60m,导光线交叉,因而对于图1中多流道监测系统矩阵化集成光波导多微流道芯片,需要设计特定的导光结构(未示出),如图6~9所示,针对上述光波导n*m矩阵化的检测系统,提供如图6所述的导光结构,包括干路导光60,以及从干路导光60中引出的导光组601、602…60m,以分别向微流道201、202…20m传输光源;其中,干路导光60包括n根第一导光61,其传输的光波长分别为λ1、λ2、λ3…λn,亦即各导光组包括n根第二导光62,以分别传输给光波导组131中的光波导1311、1312…131n。其中,从干路导光60引出的导光组601、602…60m的引出节点a,以及引出导光与干路导光60中的导光交叉节点b需要进行特别设计;所述导光组601、602…60m采用分光结构从所述干路导光60中垂直引出,如图7~8所示,是引出节点a的分光结构,从干路导光60中的第一导光61引出导光组601、602…60m中的第二导光62即可;如图8所示,是交叉节点的交叉跨层结构b,所述干路导光60包括第一导光61,所述导光组601包括第二导光62,所述第一导光61与所述第二导光62通过交叉跨层结构交叉;所述交叉跨层结构包括第一导光重叠区610和第二导光重叠区620;所述第一导光61在交叉处断开,并在断开相对的两端形成两个锐角导光端面;所述第二导光62在交叉处形成与所述锐角导光端面相匹配的锐角导光引面;所述第一导光重叠区610包括所述锐角导光端面和与所述锐角导光端面相匹配的锐角导光引面,二者之间距离小于1μm;所述第二导光重叠区620包括所述锐角导光端面和与所述锐角导光端面相匹配的锐角导光引面,二者之间距离小于1μm;即第一导光61在交叉处断开,在断开的相对两端各形成一锐角导光端面,从干路导光60中引出的第二导光62在交叉处形成与上述两个锐角导光端面相匹配、距离小于1μm的两个锐角导光引面,从而形成第一导光重叠区610和第二导光重叠区620,从第一导光61断开一端传来的光通过第一导光重叠区610进入第二导光62、随即通过第二导光重叠区620进入第一导光61断开的另一端。
需要说明的是,针对上述光波导总数为形成n*m*k矩阵化的检测系统,可在各导光组601、602…60m采用上述分光结构a和交叉跨层结构b向下一个、直至第k个微流体组继续传输光源。
从光波导组131上方引入光源的光波导多微流道检测系统,无需特别导光结构设计:
如图3所示,还包括氮化硅材料的入射光栅(未示出),以与所述光波导1311、1312…131n形成耦合光波导,将所述上包层14上方的光导入所述光波导直至导入所述微流道201,上包层14是透光性层;所述入射光栅凸出于所述波导层13向上延伸进所述上包层14。
如图3和图4所示,一个微流体包括的光波导组131包括若干个,如n个,相互平行的耦合光波导,以将光沿水平方向导入所述微流道201,在实际检测中,针对微流道201中含不同标记的生物分子,耦合光波导可将分别将波长为λ1、λ2…λn的光沿水平方向导入微流道201中,利用不同波长的光激发不同标记的标记生物分子21可以同时识别这些生物分子,而不在耦合光波导导入的激发光场中的非激生物分子20将不被识别,非激生物分子20是未经标记的正常生物分子或者经标记但位于光场之外而未被激发的生物分子;其中,如图4所示,所述耦合光波导的宽度为300-600nm,其中,如图3所示,所述波导层13厚度为300-600nm。
在本发明中,所述衬底11是硅衬底;较佳地,所述衬底11是4、8、12英寸的硅片。
在本发明中,所述高分子聚合材料是su-8树脂、聚酰亚胺、聚二甲基硅烷、聚乙烯或苯丙环丁烯。
在本发明中,氮化硅波导层13是在沉积温度为25-150℃的低温下形成的厚度为150nm-500nm的氮化硅薄膜层;所述氮化硅薄膜的折射率为1.75-2.2。需要说明的是,氮化硅薄膜可以是折射率均匀的薄膜,也可以是折射率不均匀的薄膜,如折射率分层结构的氮化硅薄膜。
循环肿瘤细胞是脱离肿瘤组织并进入人体血液循环系统的各类肿瘤细胞的统称。通过检测外周血中痕量的循环肿瘤细胞,监测其类型和数量变化的趋势,可实时监测肿瘤动态、评估治疗效果,实现实时个体治疗。结合图1,下面说明利用上文光波导多微流体检测系统中光波导总数为形成n*m*k矩阵化的检测系统检测循环肿瘤细胞的一个实施例,主要步骤如下:
第一步:采用免疫磁珠技术(如免疫磁珠阳性分选)或者微流控技术对采集来的m*k个病患血样中可能存在各类肿瘤细胞进行分选和富集得到含循环肿瘤细胞的溶液,也可直接采用病患血样;
第二步:向上述含循环肿瘤细胞的溶液或血样中加入能与各类肿瘤细胞表面抗原相特异性结合的抗体群,或加入能与各类肿瘤细胞表面结合的适配体群,所述抗体群和适配体群修饰标记,其中与特定肿瘤细胞结合的抗体或适配体上修饰的标记具有唯一性,从而得到含标记循环肿瘤细胞的溶液或血样;所述标记有n种,所述标记可以是荧光分子的靶标探针;
第三步:如图1所示,将第二步中得到m*k份溶液或血样分别从注液口151、152…15m(不完全列示,注液口总数为m*k个)加入微流道201、202…20m中(不完全列示,微流道总数为m*k个)中,导光组601、602…60m(不完全列示,导光组总数为m*k个)将与上述n种标记一一对应的n不同波长的光导入所述光波导组131、132…13m(不完全列示,光波导组总数为m*k个)中的n个光波导(如图1和图4所示,光波导组131中的n个光波导1311、1312…131n,不完全列示,光波导总数为n*m*k个)的进而沿水平方向导入所述微流道201、202…20m中,上述含不同荧光分子标记的标记生物分子21是循环肿瘤细胞被该不同波长的光激发发出特定波长的荧光,显微镜3用于收集特定波长的荧光(光信号)并向所述测量装置4传输,所述测量装置4处理收集特定波长的荧光(光信号)并产生待分析信号并向所述分析装置5传输所述待分析信号,所述分析装置5分析所述待分析信号形成特定波长的荧光的光谱,通过读取光谱即可判断溶液或血样中循环肿瘤细胞的种类,可一次性分别检测不同病患的多种肿瘤循环细胞,实现微纳尺度下的多种肿瘤细胞检测的高通量芯片,从而实时监测肿瘤动态、评估治疗效果,实现实时个体治疗。
本发明提供一种光波导多微流道检测系统,具有有益效果:形成光波导与多微流道一体化矩阵的结构,通过多微流体通道和大规模矩阵化的光波导来实现比传统光学系统更高通量的分析性能,可快速构建微纳尺度下的高通量生物样品的芯片级的片上光学检测和分析集成系统,实现微纳尺度下的生物样品检测的高通量芯片。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!