ODMR温度测量方法
odmr温度测量方法
技术领域
1.本发明涉及odmr(optically detected magnetic resonance,光学检测磁共振)温度测量方法等。
背景技术:
2.以荧光检测为基础开发了各种测量细胞内部的温度的技术。作为这样的技术,例如报告有利用荧光色素、荧光聚合物纳米颗粒基于荧光光谱的波长峰值变化来测量温度的技术、利用量子点基于荧光光谱的波长峰值变化来测量温度的技术、利用荧光纳米金刚石等无机荧光颗粒基于光学检测电子自旋共振波谱的频率峰值变化来测量温度的技术等。这些技术虽然空间分辨率、温度灵敏度比较高,但迄今为止无法进行生物体内的温度测量。
3.另一方面,作为小鼠在体(in vivo)温度测量技术,报告有利用荧光色素、稀土类纳米颗粒的测量技术,但其空间分辨率和温度灵敏度低,无法进行一个细胞水平的温度测量。
4.现有技术文献
5.专利文献
6.专利文献1:国际公开第2014/165505号
技术实现要素:
7.发明要解决的技术问题
8.本发明人着眼于基于光学检测电子自旋共振波谱峰位移的温度测量法,对此进行了研究。在该测量方法中,现有技术报告了捕捉整个波谱峰并计算其峰位移的方法。然而,在该方法中,为了捕捉整个波谱峰而需要时间,难以进行实时温度测量。为了解决该问题,在专利文献1中提出了如下技术:不捕捉要推算的整个波谱峰,而是测量该峰中的4个点,根据所得到的测量值来计算峰位移。
9.本发明人在对该多点测量技术进一步进行研究的过程中发现,在细胞、个体水平这样的动态环境下进行实时温度测量时,会引起要测量的光子数的变动等,这会引起温度测量值的伪值(artifact)。由于这样的伪值,即使在实际的温度恒定的状况下,测量温度也会大幅变动。
10.因此,本发明的技术问题在于提供一种基于光学检测磁共振,能够以更高的精度测量温度的技术。优选的是,本发明的技术问题在于提供一种能够以更高的精度实时地测量细胞、个体内的温度变化的技术。
11.用于解决技术问题的技术方案
12.本发明人进行了深入研究,结果发现,在多点测量中使用的多个光子计数器之间存在光电计数响应性的差异(来自光子的脉冲的测量数的误差),这会引起上述的温度测量值的伪值。本发明人基于该发现进一步进行了研究,结果发现,如果是如下的方法,即,基于无机荧光颗粒的光学检测磁共振来测量对象物的温度的方法,则能够以更高的精度测量温
度,该方法包括:(a)对包含无机荧光颗粒的对象物照射频率彼此不同的多种微波的步骤;(b)分别用不同的光子计数器测量照射各种微波时的无机荧光颗粒的荧光强度的步骤;(c)基于光子计数器间的脉冲测量数的误差来修正荧光强度的步骤;和(d)基于得到的修正值来计算对象物的温度的步骤。本发明人基于该见解进一步进行了研究,从而完成了本发明。
13.即,本发明包含下述方式。
14.项1.一种基于无机荧光颗粒的光学检测磁共振来测量对象物的温度的方法,其包括:
15.(a)对包含无机荧光颗粒的对象物照射彼此不同的频率的多种微波的步骤;
16.(b)分别用不同的光子计数器测量照射各种微波时的无机荧光颗粒的荧光强度的步骤;
17.(c)基于光子计数器间的脉冲测量数的误差来修正荧光强度的步骤;和
18.(d)基于得到的修正值来计算对象物的温度的步骤。
19.项2.如项1所述的方法,其中,上述无机荧光颗粒为含有nv中心的金刚石。
20.项3.如项1或2所述的方法,其中,上述多种微波为2~10种。
21.项4.如项1~3中任一项所述的方法,其中,上述多种微波为6种。
22.项5.如项1~4中任一项所述的方法,其中,在测量中追踪上述无机荧光颗粒。
23.项6.如项1~5中任一项所述的方法,其中,上述对象物为细胞、微生物或类器官。
24.项7.如项1~6中任一项所述的方法,其中,测量上述对象物的温度的随时间变化。
25.项8.如项1~7中任一项所述的方法,其中,测量对上述对象物施与刺激时的温度变化。
26.项9.如项1~8中任一项所述的方法,其中,上述步骤(c)包括将光子计数器间的脉冲测量数的误差的预先测量的值从2个对应的荧光强度中的任一个荧光强度的测量值中减去、或者将光子计数器间的脉冲测量数的误差的预先测量的值加入到任一个荧光强度的测量值中的步骤。
27.项10.上述多种微波为6种,并且
28.上述步骤(d)包括将步骤(c)中得到的修正值代入下式来计算发光中心处的温度变化(δt
nv
)的步骤,
[0029][0030][0031][0032][0033]
式中,α表示发光中心(nv)的温度依赖性,δω表示从微波的低频侧起第1个与第3个、或者第4个与第6个之间的频率差,i1~i6表示在6种微波照射下分别得到的修正值。
[0034]
项11.一种温度测量装置,其包括(a)微波照射装置、(b)光子计数器、(c)修正荧光强度的运算部和(d)计算温度的运算部,上述温度测量装置基于无机荧光颗粒的光学检测
磁共振来测量对象物的温度。
[0035]
项12.如权利要求11所述的温度测量装置,其中,还包括(e)颗粒追踪系统。
[0036]
发明效果
[0037]
依照本发明,能够提供一种基于光学检测磁共振,能够以更高的精度测量温度的技术。
附图说明
[0038]
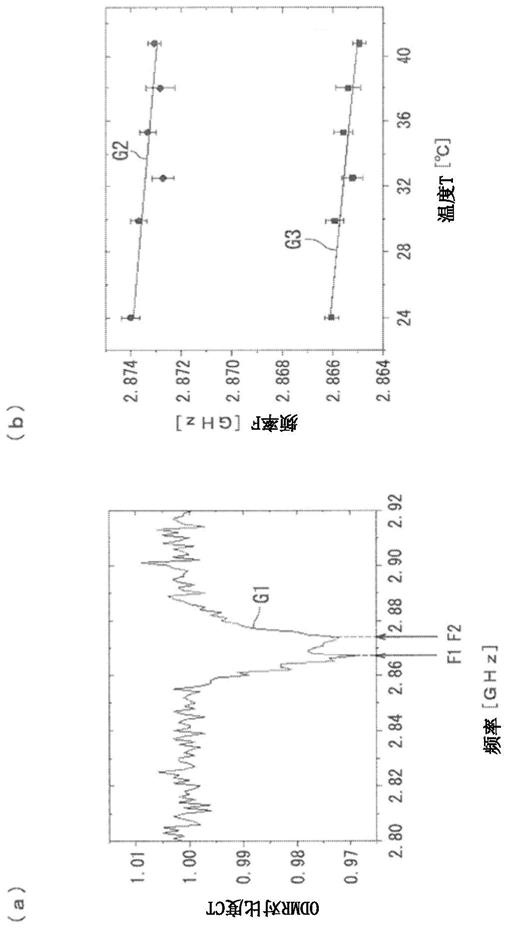
图1中,(a)是表示odmr波谱的一例的曲线图。(b)是表示odmr波谱的峰值的温度依赖性的一例的曲线图。
[0039]
图2是odmr波谱峰的示意图。
[0040]
图3表示实施例中的odmr温度测量中使用的装置中的光学配置和微波回路的概略图。ndf:nd滤光器(nd filter)。llf:激光线滤光片(laser-line filter)。hwp:半波长片。l:透镜(lens)。dbs:二色性分束器。lpf:长通滤光片(long-pass filter)。ccd:电荷耦合元件摄像机。bs:分束器。apd:雪崩光电二极管。spa:波谱分析仪。mw:微波源。daq:数据收集板。spincore:位模式发生器。
[0041]
图4表示计数器的光响应性的变动。(a)表示作为nd荧光的激光激发功率的函数的、i1至i6的各计数器的光子数。(b)2组计数器、即(i1、i6)、(i2、i5)和(i3、i4)间的光子计数之差分别表示i1、i2和i3的函数。实线是针对数据的2次多项式近似。
[0042]
图5表示实时高速温度测量法的开发和描绘(characterization)结果。(a)伴随荧光强度的人为现象的整个200秒内的所有计数器(上)的光子计数的时间分布以500ms的采样率变化。nd-nv中心的对应的推算温度分布表示了无计数器校准(中央)和有计数器校准(下)这两种情况。灰色:每1秒的t
nv
。红色:34秒的相邻平均。(b)表示相对于显微镜对物加热器(t
obj
)的温度的阶梯变化的周围气温(t
air
、上)、检测出的总光子数(中央)和t
nv
(下)的时间分布。插入图是在19秒的时间常数下过渡温度上升0.7℃的曲线特写的图。灰色:每1秒的t
nv
、红色:34秒的相邻平均、蓝色:t
obj
。(c)38至140分钟之间的t
nv
(上)和(t
nv-t
obj
)的rms(下)的特写图。精度为0.3℃且用实线表示。
[0043]
图6表示nd标记线虫蠕虫的显微镜照片。a为dic,b为绿色,c为红色共焦点荧光,d为它们的综合图像。
[0044]
图7表示环境温度变化中的线虫的生物体内温度测量结果。(a)表示内部幼虫附近的蠕虫的nd的综合照片。黄色的箭头表示在温度测量中使用的nd。显示在下部的黑影是铜线微波线性天线。(b)nd的cw-odmr波谱。(c)表示环境变化中的光子数和t
nv
的时间分布。插入图表示每隔4秒频繁地再配置的光子计数的特写图。每大约1分钟,观察到较大的位置修正。灰色:每1秒的t
nv
,红色:34秒的相邻平均,蓝色:t
obj
。(d)表示测量后的综合照片。(e)表示相对于温度变化的(t
nv-t
obj
)的rms。精度为0.6℃且用实线表示。
[0045]
图8表示fccp的生化学刺激引起的线虫的温度上升。a为fccp表示刺激中的光子数(上)和t
nv
(下)。蓝色虚线是根据对照实验推算出的基线。插入图表示减去基线后的t
nv
。b表示a中的1-5表示的多个时刻拍摄到的明视野与红色荧光的结合照片。
具体实施方式
[0046]
在本说明书中,关于“含有”和“包含”这样的表述,包括“含有”、“包含”、“实质上包含”和“仅包含”这样的概念。
[0047]
本发明在其一个方式中,涉及一种基于无机荧光颗粒的光学检测磁共振来测量对象物的温度的方法,该方法包括:(a)对包含无机荧光颗粒的对象物照射频率彼此不同的多种微波的步骤;(b)分别用不同的光子计数器测量照射各种微波时的无机荧光颗粒的荧光强度的步骤;(c)基于光子计数器间的脉冲测量数的误差来修正荧光强度的步骤;和(d)基于得到的修正值来计算对象物的温度的步骤(在本说明书中,有时也表示为“本发明的测量方法”)。以下对此进行说明。
[0048]
1.基于光学检测磁共振的温度测量
[0049]
本发明的测量方法是基于无机荧光颗粒的光学检测磁共振(以下,有时也表示为“odmr”)测量对象物的温度的方法。odmr如下所述。
[0050]
无机荧光颗粒吸收共振频率的微波而表现出电子自旋共振。其中,在电子自旋共振时,具有在电子激发状态下无辐射的能量失活增大的特性。因此,在照射微波时,与不照射微波时相比,荧光量减少。关于金刚石的nv中心,在外部磁场为零磁场的情况下,电子自旋共振在频率f为2.87ghz时产生。
[0051]
图1的(a)是表示odmr波谱的一例的曲线图。图1的(b)是表示odmr波谱的峰值的温度依赖性的一例的曲线图。如图1的(a)的曲线图g1所示,可知在照射频率f为2.87ghz附近的微波时,荧光量衰减0.03程度。峰(极小值)分为2个是结晶应变带来的效果。第1频率f1和第2频率f2分别表示荧光量成为极小值的频率。第2频率f2大于第1频率f1。图1的(b)所示的曲线图的横轴表示温度t,纵轴表示odmr波谱峰的频率。温度t表示无机荧光颗粒的周围温度。曲线g2表示相对于温度t的变化的第2频率f2的变化。曲线g3表示相对于温度t的变化的第1频率f1的变化。如曲线图g2和g3所示,可知odmr波谱峰因周围的温度变化而位移。因此,能够基于该峰位移来测量温度。
[0052]
2.步骤(a)
[0053]
在步骤(a)中,对包含无机荧光颗粒的对象物照射彼此不同的频率的多种微波。
[0054]
无机荧光颗粒只要具有电子自旋活性即可,没有特别限制。具体而言,例如可举出金刚石、碳化硅、氧化锌、2维物质(例如六方晶系氮化硼等)等。其中,优选可举出金刚石(其中,纳米尺寸(平均粒径小于1000nm)的金刚石(纳米金刚石))。
[0055]
金刚石可以是单晶或多晶中的任一种。作为合成金刚石,可以举出通过cvd法、高温高压法、爆炸法等合成的金刚石。另外,作为金刚石,可以举出i型、ii型(iia型、iib型等)等的金刚石。
[0056]
金刚石的形状没有特别限定。作为形状,例如可举出颗粒、薄膜、片等。尺寸根据形状而不同,例如为颗粒时,平均粒径例如能够为1nm~500nm。平均粒径优选为10~200nm,更优选为30~150nm程度。
[0057]
金刚石优选为包含nv中心(通过使作为杂质含有的氮原子与碳原子缺失的空穴以适当的位置关系结合而形成的发光中心)的金刚石(含有nv中心的金刚石)。nv中心可以是天然包含的,也可以是人工导入的。人工导入nv中心的方法没有特别限制,例如可以举出在注入氮原子后进行退火处理的方法、在金刚石的化学气相合成(cvd)时导入氮原子的方法
等。
[0058]
金刚石也能够是进行了表面修饰的金刚石。表面修饰的方法没有特别限制,例如能够根据需要在强氧化条件下对金刚石进行处理而将表面的碳转换为羧基,或者将金刚石还原而导入羟基,或者通过公知的方法或按照公知的方法导入其他官能团(氨基、硫醇基等),经由其将各种分子、物质连结而进行表面修饰。作为表面修饰分子,没有特别限制,例如可举出聚甘油、聚乙烯甘油等水溶性高分子、蛋白质、肽、核酸、医药化合物等各种低分子化合物等。
[0059]
无机荧光颗粒可以是单独1种,也可以是2种以上的组合。
[0060]
对象物是温度测量的对象,没有特别限制。作为对象物,优选可举出细胞、微生物、类器官等。这些测量对象内部是动态环境,所以在进行实时温度测量时,会引起要测量的光子数的变动等,这会引起温度测量值的伪值。依照本发明的测量方法,即使对于这样的对象物,也能够以更高的精度进行温度测量。
[0061]
作为细胞,没有特别限制,例如可举出血管内皮细胞、内皮前体细胞、干细胞(例如,源自骨髓的干细胞、源自脂肪组织的干细胞、间充质干细胞、多能干细胞(ips细胞、es细胞等)等)、肌细胞(骨骼肌细胞、平滑肌细胞、心肌细胞)、肌前体细胞(例如,心肌前体细胞、成肌细胞等)、免疫细胞(t细胞等)、神经细胞等。
[0062]
作为微生物,只要是肉眼看不见的生物、或者肉眼看不见但无法判别生物体的结构的生物即可,没有特别限制,例如可举出细菌、单细胞生物、浮游生物、幼虫、线虫等。
[0063]
作为类器官,可以举出脑类器官、小脑类器官、内耳类器官、甲状腺类器官、胸腺类器官、精巢类器官、肝脏类器官、脾脏类器官、肠类器官、上皮类器官、肺类器官、肾脏类器官、胚胎等。
[0064]
包含无机荧光颗粒的对象物有无机荧光颗粒存在于对象物内部的情况或附着于外部的情况,优选为前者。前者的情况下,由对象物内部的环境造成的测量噪声的影响较大,但如果是本发明的测量方法,则在该情况下也能够以更高的精度进行温度测量。包含无机荧光颗粒的对象物能够通过各种方法得到。例如,在对象物为细胞的情况下,通过使无机荧光颗粒与细胞接触,能够使无机荧光颗粒进入细胞。
[0065]
对象物中的无机荧光颗粒的量能够根据对象物的种类、无机荧光颗粒的种类等适当决定。例如在体长1mm程度的线虫的情况下,导入1只线虫的无机荧光颗粒的量例如为1~100ng。
[0066]
包含无机荧光颗粒的对象物被配置成能够进行激发光照射、微波(micro-light)照射和荧光收集,以便能够进行本发明的温度测量。具体而言,配置在例如图3所示的装置中的物镜上的试样台上。
[0067]
在本发明的测量方法中,照射的微波是频率彼此不同的多种微波。
[0068]
微波的频率通常为9ghz以下,从表示设想的odmr波谱的峰两侧的线性近似的频率范围中选择(参照图2)。该频率范围优选根据无机荧光颗粒和对象物各自的种类,在测量前预先决定。微波的(频率)的种类通常为偶数种,从测量精度、测量效率等观点出发,优选为2~10种,更优选为4~10种,进一步优选为6~8种,特别优选为6种。odmr波谱峰的单侧的各微波的频率优选被设定为所测量的荧光量与在该峰的相反侧的对应的各微波的频率下所测量的荧光量为相同程度(参照图2)。即,在图2中,优选将频率f1设计成所测量的荧光强度
(i1)与在对应的频率(f6)下测量的荧光强度(l6)为相同程度。odmr波谱峰的单侧的各微波间的频率之差(例如图2的x)优选为1~5mhz。
[0069]
各频率的微波各自的每1次的照射时间没有特别限制,从测量精度、测量效率等观点出发,例如为10μs~1000μs,优选为30~300μs,更优选为50~200μs。各微波的照射时间优选为相同程度,例如相对于最短的照射时间的最长的照射时间优选为例如200%以下、150%以下、120%以下、110%以下。
[0070]
各频率的微波通常反复照射。例如,在图2的例子中,按照频率f1、频率f2、频率f3、频率f4、频率f5、频率f6的顺序照射微波后,接着按照频率f1、频率f2、频率f3、频率f4、频率f5、频率f6的顺序照射微波,重复该循环。另外,通过使该重复持续一定时间(例如1分钟以上、5分钟以上、10分钟以上、20分钟以上、30分钟以上、60分钟以上、2小时以上、5小时以上、8小时以上),能够测量对象物的温度的随时间变化。
[0071]
微波的照射使用适当的微波源进行。各频率的微波的反复照射例如能够通过准备各频率的多个微波源,将它们与切换装置连结,以在规定时间内依次切换微波源的方式进行工作来执行。另外,从微波源产生的微波通常通过放大器被放大后照射到对象物。
[0072]
在步骤(a)中,也能够对包含无机荧光颗粒的对象物施与刺激。在对象物为细胞、微生物、类器官等的情况下,当由于刺激施与而产生温度变化时,能够测量其温度变化。刺激的种类没有特别限制,例如可举出培养条件(例如温度、ph、光条件等)的变化、被检测物质的添加等。作为被检测物质,没有特别限制,例如可举出抗体、蛋白质、核酸、生理活性物质、囊泡、细菌、病毒、多肽、半抗原、治疗药剂、治疗药剂的代谢物等。
[0073]
3.步骤(b)
[0074]
在步骤(b)中,分别用不同的光子计数器测量照射各种微波时的无机荧光颗粒的荧光强度。
[0075]
微波照射时的无机荧光颗粒的荧光强度通常如下方式进行测量:在对无机荧光颗粒持续照射该颗粒的激发光的状况下照射微波,对于该微波(频率f1、f2
……
)的照射时刻的荧光(荧光l1、l2
……
),测量其强度(i1、i2
……
)。激发光的波长根据无机荧光颗粒的种类而不同,能够适当设定。例如,在使用含有nv中心的金刚石的情况下,激发光的波长例如为490~580nm,优选为520~560nm。另外,荧光的波长也根据无机荧光颗粒的种类而不同。例如,在使用含有nv中心的金刚石的情况下,荧光的波长例如为637~800nm。激发光的照射和荧光的检测例如如下方式进行:在激发中,使用典型的激发强度的连续波激光,将显微镜物镜用于激发和荧光收集这两者,提取荧光(例如通过分色分束器等分束器、长通滤光片等滤光片等),根据需要,将荧光与作为针(pin hole)发挥功能的光纤结合,或者使用针孔,利用雪崩光电二极管等光电二极管或其他光学检测器检测荧光。
[0076]
对于照射各种微波时的无机荧光颗粒的荧光强度,分别用不同的光子计数器测量。即,对于各种微波(频率f1、f2
……
)的照射时刻的荧光(荧光l1、l2
……
),用不同的光子计数器(荧光l1的强度为计数器1,荧光l2的强度为计数器2
……
)测量其强度。作为光子计数器,没有特别限制,能够使用各种计数器。作为光子计数器,可以利用在1个独立的测量器内仅存在1个的计数器,也可以利用在测量器内存在多个的各计数器。另外,也能够并用多个测量器来准备所需数量(=微波的种类数)的计数器。通过用不同的光子计数器(荧光l1的强度为计数器1,荧光l2的强度为计数器2
……
)进行测量,得到照射各种微波时的无机荧
光颗粒的荧光强度(i1、i2
……
)。
[0077]
荧光强度可以是绝对值,也可以是相对值。
[0078]
作为测量对象的无机荧光颗粒通常为1个颗粒,但也能够对多个颗粒平行(并行)地进行测量。在测量中,在无机荧光颗粒移动的情况下,通过适当地追踪无机荧光颗粒,能够持续追踪作为测量对象的颗粒,由此能够以更高的精度测量温度的随时间变化。追踪的方法没有特别限制,能够利用公知的追踪技术来追踪颗粒。
[0079]
4.步骤(c)
[0080]
在步骤(c)中,基于光子计数器间的脉冲测量数的误差来修正荧光强度。
[0081]
本发明人发现,在多个光子计数器之间存在光电计数响应性的差异(来自光子的脉冲的测量数的误差),这会引起在细胞、个体水平那样的动态环境下进行实时温度测量时的温度测量值的伪值。因此,通过修正该误差,能够以更高的精度进行温度测量。
[0082]
优选预先测量光子计数器间的脉冲测量数的误差。误差的测量没有特别限制,例如能够如下进行。将温度测量中采用的频率的多种微波以阶梯增加的多个(例如3~20、4~15、6~12)激光强度分别照射到无机荧光颗粒单体,对于各微波(频率f1、f2
……
)的照射时刻的荧光(荧光l1、l2
……
),用不同的光子计数器(荧光l1的光子数为计数器1,荧光l2的光子数为计数器2
……
)测量其光子数(p1、p2
……
)。基于测量值,计算对应的2个光子计数器间的测量值的误差(在相同条件下测量出的光子数之差)。另外,“对应的2个光子计数器”是指针对在温度测量时设想的odmr波谱的峰两侧的对应的频率(参照图2。f1与f6对应,f2与f5对应,f3与f4对应)进行测量的2个计数器(计数器1与计数器6对应,计数器2与计数器5对应,计数器3与计数器4对应)。此外,如图4所示的表示测量值误差的曲线图能够通过基于上述测量值进行例如多项式拟合等而得到。
[0083]
基于上述误差,对在步骤(b)中得到的荧光强度进行修正。修正的方法没有特别限制,例如,从2个对应的荧光强度(参照图2。i1与i6对应,i2与i5对应,i3与i4对应)中的任一个荧光强度的测量值减去误差量,或者从任一个荧光强度的测量值加上误差量,由此能够得到修正值(修正值c1、c2
…
)。
[0084]
步骤(c)具体而言例如包括如下步骤:从2个对应的荧光强度中的任一个荧光强度的测量值中减去光子计数器间的脉冲测量数的误差的预先测量的值,或者将光子计数器间的脉冲测量数的误差的预先测量的值加入到任一个荧光强度的测量值中。
[0085]
5.步骤(d)
[0086]
在步骤(d)中,基于得到的修正值,计算对象物的温度。
[0087]
对象物的温度的计算没有特别限制,能够通过公知的方法或按照公知的方法进行。如果是使用4种微波的情况,则例如能够按照专利文献1中记载的方法计算温度。另外,例如在使用6种微波的情况下,能够根据与6种各频率对应的6种修正值,针对将值为相同程度的对应的2个修正值(c1-c6、c2-c5、c3-c4)作为一组的情况下的两组组合(c1-c6与c2-c5的组合、c2-c5与c3-c4的组合、和c1-c6与c3-c4的组合),分别按照例如专利文献1所记载的方法计算温度,将其平均值作为最终的测量值。具体而言,例如能够按照后述的实施例(“1.温度测量方法”)中记载的方法和式子进行计算。
[0088]
在使用6种微波的情况下,步骤(d)具体而言,例如,包括将步骤(c)中得到的修正值代入下式来计算发光中心处的温度变化(δt
nv
)的步骤:
[0089][0090][0091][0092][0093]
[式中:α表示发光中心(nv)的温度依赖性。δω表示从微波的低频侧起第1个与第3个、或者第4个与第6个之间的频率差。i1~i6表示在6种微波照射下分别得到的修正值。]。
[0094]
另外,关于温度,通过取一定时间的平均值,能够进行更高精度的测量。各频率的微波通常被反复照射(例如,在图2的例子中,按照频率f1、频率f2、频率f3、频率f4、频率f5、频率f6的顺序照射微波后,接着按照频率f1、频率f2、频率f3、频率f4、频率f5、频率f6的顺序照射微波,重复该循环),例如,能够将根据一定时间(例如0.1~180秒、0.3~120秒、1~100秒、3~100秒、10~80秒、20~50秒)内的各循环计算出的温度的平均(例如相邻平均、移动平均等)作为温度测量值。
[0095]
通过利用上述技术,还能够进行高精度地实时的纳米级的热事件的测量、个体的代谢测量、脂肪燃烧等健康食品的效果试验、由药引起的代谢变化的热测量等。
[0096]
本发明的测量方法能够利用包括(a)微波照射装置、(b)光子计数器、(c)修正荧光强度的运算部、和(d)计算温度的运算部的温度测量装置(在本说明书中,有时也表示为“本发明的测量装置”)来执行。
[0097]
关于微波照射装置和光子计数器,如上所述。
[0098]
修正荧光强度的运算部和计算温度的运算部可以是1个运算部,也可以是不同的运算部。
[0099]
修正荧光强度的运算部获取与由光子计数器测量出的荧光强度有关的信息,基于光子计数器间的脉冲测量数的误差进行修正。计算温度的运算部,获取与所得到的修正值有关的信息,计算温度。这些运算部中的处理内容如上所述,通过预先存储的计算机程序来执行。
[0100]
本发明的测量装置优选还包括颗粒追踪系统。作为该系统,能够使用利用了公知的颗粒追踪技术的系统(例如压电平台等)。
[0101]
本发明的测量装置还能够是包括配置包含无机荧光颗粒的对象物的试样台、显微镜物镜、荧光照射装置、显示计算出的温度信息的显示部等,仅利用这些装置就能够执行本发明的测量方法的全合一型装置。
[0102]
(实施例)
[0103]
以下,基于实施例对本发明进行详细说明,但本发明并不限定于这些实施例。
[0104]
1.温度测量方法
[0105]
对实施例中的odmr温度测量法进行说明。装置的概略图如图3所示。激发使用典型的激发强度为ca.5kw
·
cm-2
的连续波532nm激光。将数值孔径1.4的油浸显微镜物镜用于激发和荧光收集这两者。利用分色分束器(semrock,ff560-fdi01)和长通滤光片(semrock,
blp01-561r或blp01-635r-25)过滤nv荧光,除去了残留的绿色激光散射。接着,将荧光与作为针孔发挥功能的光纤(thorlabs,1550hp,纤芯直径约10μm)耦合。光纤耦合荧光由雪崩光电二极管(apd,perkin elmer spcm aqrh-14)最终检测出。试样载置于能够进行光栅扫描和颗粒追踪的压电台上。apd输出被供给到分别具有4个脉冲计数器(daq-1bnc,national instruments)和2个脉冲计数器(daq-2bnc,national instruments)的2个数据收集板。6点测量以外的所有光子计数测量由daq板(usb-6343bnc)进行。为了测量荧光光谱,使用装备有液氮冷却电荷耦合元件摄像机的光谱仪(princeton,lnccd)。通过将光纤尾纤分割系统插入光纤线,同时执行光谱测量和颗粒追踪,防止了由颗粒的运动引起的色像差。
[0106]
为了执行cw和多点这两个odmr测量,在具有250ns的开关时间的sp6t开关(general microwave,f9160)上连接有1个独立型微波源(rohde&schwarz,smb100a)和5个usb驱动微波源(usg-lf44,texio)。接着,将其放大(mini-circuit,zhl-16w-43+),传送至置于盖玻片(25μm的细铜线)上的微波线性天线,用在中央开孔的细胞培养皿密封。当考虑天线的输入功率和发送功率以及基于有限元法(comsol)的电磁场模拟时,通常的微波激发功率作为磁场强度被推算为5[a/m]。在cw-odmr测量中,使用sp6t开关和门宽为200μs的位模式生成器(spincore,pbesr-pro-300),使两个门共用的apd检测以为微波照射的接通和断开进行门控。然后继续100μs的激光遮挡时间,以2khz的重复速率施与i
plon
和i
ploff
。另外,在实施例中未施加外部磁场。在多点odmr测量中,apd检测对6个门全部共用的门宽为100μs,之后对持续5μs的间隔的各个微波频率进行了门控。将得到的6个频率下的光子数输入下式,计算出nv中心的温度推算值(t
nv
)。
[0107][0108][0109][0110][0111]
[式中,α表示nv中心的温度依赖性,为-74khz
·
℃-1
。]
[0112]
2.6基于点测量和温度变化的odmr峰位移
[0113]
为了在生物体内实现纳米金刚石量子温度测量法,我们开发了基于包括高速颗粒追踪能力和高精度温度推算协议的共焦点荧光显微镜的实时生物体内温度测量系统(参照上述“1.温度测量方法”和图3)。在颗粒追踪中,系统沿着xyz方向测量荧光强度,每次使焦点回到各次的荧光最大值。再配置通常花费2.8秒,每隔4秒反复进行。
[0114]
高精度量子温度测量基于nd的氮空穴(nv)中心的光学检测出的磁共振(odmr)线的温度依赖峰位移的检测。特别是,我们采用了以相对于odmr峰对称地定位的6个频率来测量荧光强度的多点odmr测量协议。关于6个点中的4个频率点处的荧光强度,能够提供按照上述“1.温度测量方法”所示的式子的3组温度推算,最后通过取它们的平均来给出温度推算值。实验上,从频率选择器以100μs的脉冲宽度和5μs的间隔依次输出6个频率。这些被时序控制的微波脉冲串被传送至在细胞培养皿上制作的微波天线。在培养皿上配置有nd或nd
标记的线虫蠕虫。
[0115]
代替以前报告(专利文献1)的4点而选择6点的优点在于提高温度精度。与在相同的光子束中选择4点的情况相比,在6点分析中,一边执行3遍4点分析一边每1秒使用2/3的光子数,因此能够减少测量噪声(下述式)。
[0116][0117]
实际上,如果增加频率点的数量,则也得到与odmr的光谱形状有关的详细信息。这有助于温度分布的详细分析。在该研究中使用了移动平均。但是,如卡尔曼滤波那样的更高级的数据推算也是有效的。
[0118]
我们发现,为了在动态环境下实现实时监测,校正各脉冲计数器的光子计数响应性是重要的。发现各计数器具有《5%的非常小的光响应性的差异(参照图4)。图4的(a)表示作为激发激光输出的函数的6个频率(i1~i6)处的nv荧光的计数值。理想的是,i1、i2和i3必须表现出与对应的i4、i5和i6相同的响应性梯度。图4的(b)将它们的差(i1-i6、i2-i5和i3-i4)分别表示为i1、i2或i3中的任一光子数的函数。因此,在以下的试验中,执行了修正该偏差(误差)的计数校准。
[0119]
首先,我们对贴附于盖玻片的nd进行温度测量(参照图3)。如图5的(a)所示,尽管实际的温度没有变化,光子数的阶梯变化也引起nv中心的温度推算值的伪值。通过在实验中使用的光子计数的整个范围内校正i1~i6(i2~i5和i3~i4),能够大幅度地抑制噪声和漂移。通过这些计数器校准,温度测量不受光子数的变动的影响。
[0120]
接着,通过使显微镜物镜(t
obj
)的温度在20~40℃的范围内阶梯地变化,评价了温度测量的规格(精度、准确度、时间分辨率、稳定性)(图5的(b))。最初从44.0℃开始,降低到40.2℃。然后,在40.7分钟将温度稍微提高到40.9℃。重要的是,t
nv
如图5的(b)的插入图所示,能够明确地检测出仅0.7℃这样小的温度变化。该温度转变在实用的玻尔兹曼拟合中以19秒的特性时间常数发生,在约1.5分钟内完成。t
obj
与t
nv
之间的时间差为1.2分钟,这证实了纳米金刚石温度计能够实时地检测出1℃以下的过渡温度变化。
[0121]
在35℃以下的低温范围内,t
nv
与t
obj
之间出现差异。该差异由于没有足以使t
obj
完全热化的等待时间,因此与温度计的精度无关。反而,这正确地反映了盖玻片的表面的实际的温度。这是因为,散热根据傅立叶定律与室温的差成比例。达到完全的热平衡状态需要1小时以上。
[0122]
当对显微镜的物镜进行加热时,与降低温度相比,会产生大幅的变动和焦点位置的漂移。因此,为了表明温度计的可靠性,在207分钟切断加热器的电源后,在218分钟接通加热器的电源,使其为35℃。在该急速的热事件的期间,系统能够一边显示正确的温度推算值一边追踪nd位置。由于在35~45℃的范围内阶梯地变化,所以当前的温度测量的精度根据34秒的积分时间而被决定为0.16℃,该精度以均方根计小于0.3度(图5的(c))。因此,灵敏度为实时的这种小的实际精度是当前的纳米级温度计的显著特征,这对于生物学的在体用途来说是重要的里程石。
[0123]
3.活线虫内的温度测量
[0124]
由于确立了实时动作的可靠且准确的温度测量,因此我们对活虫的局部的温度监测进行了测试。作为用于标记线虫的nd,使用其表面被聚甘油涂敷的、高度水溶性的纳米金
刚石(对粒径中央值为100nm的纳米金刚石(adams nanotechnology)的表面进行聚甘油涂敷处理而成的纳米金刚石)。通过对性腺的显微注射将这些nd导入虫中,培养一晚以等待nd被吸收到细胞中。对已标记的虫实施麻醉,移至天线一体型培养皿的微波天线的附近。将它们夹在琼脂垫与充满缓冲液的盖玻片之间。
[0125]
图6的a~d分别表示带标签的蠕虫的dic(微分干涉对比)、绿色、红色共焦点荧光以及它们的合成图像。nd分散于图像内的全部区域,因此能够测量各种不同部分的蠕虫的odmr信号。在活虫中,nd以根据延时图像测量的200nm/min程度的典型的速度,在温度观测中连续地移动。在以下的实验中,一边测量局部温度一边持续追踪这些nd。
[0126]
图7的(a)到(b)表示了由胚胎附近的箭头指示的单个nd的合并显微镜照片和cw-odmr波谱。odmr的对比度由于本底荧光而通常在蠕虫中变弱。通常,与盖玻片上的0.88相比,在蠕虫中得到0.9~0.94的odmr对比度。由此,推算出本底荧光的强度为nd荧光的0.6~1.0倍。图7的(c)是表示显微镜-对物加热器的温度变化的过程中的1个小时的t
nv
的时间分布的图。t
obj
最初被设定为34.0℃(在该时刻rt=21.5℃)。在5分钟,关闭加热器,然后使t
nv
向rt逐渐减少。在38.7分钟,打开加热器,调整为29.5℃。t
nv
(红)的测量曲线与t
obj
(蓝)非常一致。该在体测量的精度和准确度分别为
±
0.39℃(积分时间34秒)和《0.6℃(图7的(e))。
[0127]
4.由线虫的药剂刺激引起的产热响应检测
[0128]
为了证实本温度测量法在生物体内发热研究中的适用性,测量了被作为线粒体解偶联剂的fccp(羰基氰基-三氟甲氧基苯腙)刺激时的蠕虫的内部温度。图8的a表示蠕虫被fccp刺激时的蠕虫的内部温度的时间分布。测量开始后,t
nv
连续减少,但这实际上是基线漂移,这在在体中被频繁观察到。6分钟后,将少量的60μm fccp溶液添加到培养基中。在10分钟至18分钟之间,t
nv
的基线漂移在下降和恢复中分别以4秒和12秒这样的短转变时间急剧地转变(shift down)。这主要是因为追踪系统错误地捕捉到具有稍微不同的odmr峰的附近的nd(参照图8的b)。在24分钟(添加fccp后18分钟)温度逐渐上升,在40~50分钟达到最大约3℃。在25分钟至35分钟之间,实际反映于温度分布的光子数存在较强的变动。在此期间,由于蠕虫移动,所以nd的位置大幅地变动。确实,位于图像的下部的胚胎在该期间后移动(图8的b)。但是,我们的系统能够用温度信息追踪nd。仅28分钟至30分钟之间的2分钟,nd超过追踪的可调整范围,失去nd位置。但是,我们能够通过宽视野荧光成像找到相同的nd,能够将焦点置于nd,这使得t
nv
的连续的监测成为可能的。在60~65分钟期间,可见发热反应结束。65分钟后,t
nv
的基线漂移与光子数的减少同步地上升。关于这一点,已知伴随着温度上升,促进由热引起的非辐射缓和,nd的荧光减少。相反,由于温度降低,荧光量增大。从这一点来看,荧光强度与温度信息成反相关关系。但是,荧光强度也受到生物体试样的透射率、折射率的时间变化的影响,所以有时也不一定观察到相关关系。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1