一种动物组织全谱代谢组学分析方法
本发明涉及代谢组学检测技术领域,具体而言,涉及一种动物组织全谱代谢组学分析方法。
背景技术:
代谢组学是指利用色谱、光谱及其联用技术来系统分析生物体系受到外部刺激或内部扰动而引起的内源性小分子代谢产物的变化,而小分子代谢产物作为基因表达的终端,具有将基因水平的微小变化在生物化学水平表型放大的作用。
代谢组学通常包括4个方面的研究策略:代谢靶标分析,主要针对某个或某些已知的组分利用特有的分析模式对其进行有针对性的提取及分析;代谢轮廓分析,主要针对假设过程或通路中系列的已知待测组分的定性及定量分析,而该过程的重要意义还在于可以对“盲筛”模式的一般代谢组学结果进行补充和验证;代谢组学理论上是指对样本中的所有符合定义的小分子代谢产物进行无差别的表征,通常所研究代谢组学的主要目的也在这个层次,但以目前的分析手段还难以达到其最终目标。代谢指纹/足迹分析是以总代谢谱图代表生物体或特定组织、细胞的代谢模式,在分析时往往利用模式识别方法对其整体轮廓进行识别而非针对某一类物质进行分离及表征。
哺乳动物组织结构众多,且结构复杂,分泌的代谢物也非常复杂。目前已有的动物组织代谢组学检测方法只针对个别种类的组织,而对于更多种类的组织中存在的代谢物情况的了解尚不清楚,并且也无法去比较不同类型的组织中代谢物的种类和含量。
鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于提供一种动物组织全谱代谢组学分析方法以解决上述技术问题。
本申请可这样实现:
本申请提供一种动物组织全谱代谢组学分析方法,包括以下步骤:
将由待测样品得到的强极性提取液和弱极性提取液均以超高效液相色谱-四极杆-静电场轨道阱傅里叶转换质谱进行分离和测定,根据分析结果鉴定出组织中的代谢化合物。
在可选地实施方式中,动物组织全谱代谢组学分析方法中不使用标准品。
在可选地实施方式中,动物为哺乳动物。
在可选的实施方式中,强极性提取液的提取过程所用的第一提取试剂为强极性有机试剂。
在可选的实施方式中,强极性有机试剂包括甲醇、乙腈-水的混合溶液或甲醇-乙腈-水的混合溶液。
在可选地实施方式中,第一提取试剂为甲醇-乙腈-水的混合溶液。
在可选地实施方式中,第一提取试剂为甲醇、乙腈和水以体积比为1.5-2.5:1.5-2.5:1混合的混合溶液。
在可选地实施方式中,强极性提取液经以下方式得到:
用上述第一提取试剂提取待测样品,第一次固液分离,收集第一上清液。
在可选地实施方式中,第一提取试剂与待测样品的用量比为1ml:50-200mg。
在可选地实施方式中,第一提取试剂与待测样品于-5℃至0℃的条件下匀浆处理,静置3-6min,再于10000-16000g的条件下离心处理3-6min。
在可选的实施方式中,弱极性提取液的提取过程所用的第二提取试剂为弱极性有机试剂。
在可选的实施方式中,弱极性有机试剂包括甲醇-二氯甲烷混合溶液或三氯甲烷。
在可选地实施方式中,甲醇-二氯甲烷混合溶液中,二氯甲烷的体积不低于甲醇的体积。
在可选地实施方式中,甲醇与二氯甲烷的体积比为1:2.5-3.5。
在可选地实施方式中,弱极性提取液经以下方式得到:
用上述第二提取试剂提取第一次固液分离得到的沉淀,第二次固液分离,收集第二上清液。
在可选地实施方式中,第二提取试剂与沉淀的体积相同。
在可选地实施方式中,第二提取试剂与沉淀于-5℃至0℃的条件下匀浆处理,静置3-6min,再于10000-16000g的条件下离心处理3-6min。
在可选的实施方式中,进行分离和测定前,将强极性提取液和弱极性提取液进行预冷。
在可选地实施方式中,预冷于-25至-15℃的条件下进行0.5-2h。
在可选地实施方式中,预冷后于3-6℃的条件下恒温保持20-40min,再进行分离和测定。
在可选的实施方式中,分离和测定过程中,质谱条件包括a至d中的至少一种:
a.加热电喷雾离子源,分别采用正、负模式采集;正离子模式下的电压均为3.6-4.4kv,负离子模式下的电压均为3.15-3.85kv;
b.离子传输管温度为315-385℃;
c.鞘气压力分别为45-55psi和22.5-27.5psi,辅助气压力均为13.5-16.5arb,辅助气加热温度均为288-352℃;
d.扫描模式为fullms,仪器分辨率为70000,-dd/ms2,分辨率为17500,nce15-30-45ev,扫描范围为50-1000m/z。
在可选的实施方式中,分离和测定过程中,强极性提取液采用的色谱柱包括waters-hilic色谱柱和hsst3色谱柱,弱极性提取液采用的色谱柱包括hsst3色谱柱。
在可选地实施方式中,分离和测定过程中所用的色谱柱的柱长均为100-120mm,内径均为1.8-2.4mm,填料粒径均为1.5-2μm。
在可选的实施方式中,当用hsst3色谱柱分离和测定强极性提取液时:
正模式采集过程中,流动相a为乙腈,流动相b为水,流动相a的洗脱梯度为:0-0.5min,3vt%;0.5-8min,3-70vt%;8-13min,70-85vt%;13-13.1min,85-100vt%;13.1-17.5min,100vt%;17.5-17.6min,100-3vt%;17.6-21min,3vt%;
负模式采集过程中,流动相a为乙腈,流动相b为水,流动相a的洗脱梯度为:0-0.5min,3vt%;0.5-8min,3-70vt%;8-15min,70-90vt%;15-15.1min,90-100vt%;15.1-18min,100vt%;18-18.1min,100-3vt%;18.1-21min,3vt%。
在可选地实施方式中,hsst3色谱柱分离和测定强极性提取液的过程中,正模式采集时,流动相a和流动相b中均含有0.04-0.06vt%甲酸;负模式采集时,流动相b中含有4.5-5.5mmol/l甲酸铵。
在可选的实施方式中,当用waters-hilic色谱柱分离和测定强极性提取液时:
正模式采集过程中,流动相a为乙腈与水以体积比为94:6-96:4的混合液,流动相b为乙腈与水以体积比为0.9-1.1:0.9-1.1的混合液,流动相a的洗脱梯度为:0-0.5min,95vt%;0.5-12min,95-75vt%;12-12.1min,75-95vt%;12.1-15min,95vt%;
负模式采集过程中,流动相a为乙腈与水以体积比为94:6-96:4的混合液,流动相b为乙腈与水以体积比为0.9-1.1:0.9-1.1的混合液,流动相a的洗脱梯度为:0-0.5min,95vt%;0.5-12min,95-75vt%;12-14min,75vt%;14-14.1min,95vt%;14.1-17min,95vt%。
在可选地实施方式中,waters-hilic色谱柱分离和测定强极性提取液的过程中正模式采集时,流动相a和流动相b中均含有4.5-5.5mmol/l甲酸铵以及0.08-0.12vt%甲酸;负模式采集时,流动相a和流动相b中均含有4.5-5.5mmol/l甲酸铵。
在可选的实施方式中,当用hsst3色谱柱分离和测定弱极性提取液时:
正模式采集过程中,流动相a为乙腈,流动相b为水,流动相a的洗脱梯度为:0-1min,20vt%;1-3min,20-70vt%;3-8min,70vt%;8-8.1min,70-20vt%;8.1-11min,20vt%;
负模式采集过程中,流动相a为乙腈,流动相b为水,流动相a的洗脱梯度为:0-0.5min,20vt%;0.5-2min,20-70vt%;2.5-7min,70-80vt%;7-7.1min,80-100vt%;7.1-10min,100vt%;10-10.1min,100-20vt%;10.1-13min,20vt%。
在可选地实施方式中,hsst3色谱柱分离和测定弱极性提取液的过程中,正模式采集时,流动相a和流动相b中均含有0.04-0.06vt%甲酸;负模式采集时,流动相b中含有4.5-5.5mmol/l甲酸铵。
在可选的实施方式中,结果的分析包括:将分离和测定的结果结合母离子、二级碎片离子信息、保留时间信息与数据库进行匹配。
在可选地实施方式中,分析所用软件包括thermofisherscientificq-exactiveplussystemxcalibur软件和化合物分析软件。
在可选地实施方式中,还包括,在鉴定出组织中的代谢化合物之后,采用thermoxcaliburqualbrowser软件确定数据采集情况。
本申请的有益效果包括:
本申请以超高效液相色谱-四极杆-静电场轨道阱傅里叶转换质谱技术为基础,建立了细胞中代谢组学分析方法,鉴定组织中的代谢化合物,操作简单、不依赖标准化合物,无需标准品的提取和制备,节约时间成本和经济成本。该过程中共测定有由待测样品得到的强极性提取液和弱极性提取液,测定结果覆盖面广,所测得的物质种类较为齐全,与原始样品中真实所含情况几乎一致,不仅能够测出同一动物不同组织的代谢物情况,而且还能比较不同动物的组织中代谢物的种类和含量。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
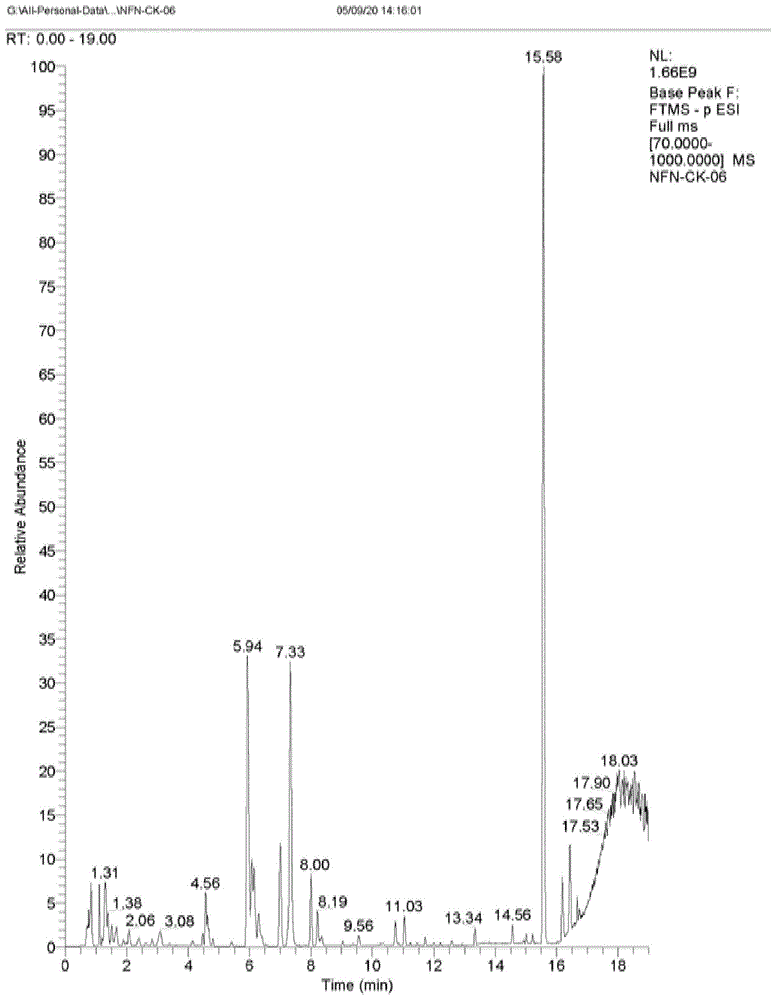
图1为实施例1中鸡肌肉组织代谢组测定液质联用总离子流图(负离子);
图2为实施例1中不同处理组鸡肌肉代谢组主成分分析图(基于小分子代谢物);
图3为实施例2中大鼠肝脏代谢组测定液质联用总离子流图(负离子);
图4为实施例2中大鼠肝脏代谢组测定液质联用瞬时质谱图;
图5为实施例3中小鼠肌肉组织代谢组测定液质联用总离子流图(正离子);
图6为实施例3中小鼠肝脏代谢组测定液质联用总离子流图(负离子);
图7为实施例3中小鼠肌肉组织代谢组测定液质联用瞬时质谱图(正离子);
图8为实施例3中小鼠肝脏代谢组测定中的液质联用顺时质谱图(负离子);
图9为实施例3中不同处理组小鼠肌肉组织代谢组测定pca分析图;
图10为实施例3中不同处理组小鼠肝脏代谢组主成分分析图(基于小分子代谢物)。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本申请提供的动物组织全谱代谢组学分析方法进行具体说明。
发明人发现,目前的代谢组学检测方法仅能针对各别种类的组织,不能准确有效地测定出多个不同类型组织中代谢物的种类和含量。鉴于此,发明人经长期研究,创造性地提出:将待测样品先进行强极性和弱极性双重提取,并将所得的强极性提取液和弱极性提取液均进行超高效液相色谱-四极杆-静电场轨道阱傅里叶转换质谱进行分离和测定。经试验验证,按此方法所得的测定结果覆盖面广,所测得的物质种类较为齐全,与原始样品中真实所含情况几乎一致,不仅能够测出同一动物不同组织的代谢物情况,而且还能比较不同动物的组织中代谢物的种类和含量。
可参照地,本申请提出的动物(优选为哺乳动物)组织全谱代谢组学分析方法包括以下步骤:将由待测样品得到的强极性提取液和弱极性提取液均以超高效液相色谱-四极杆-静电场轨道阱傅里叶转换质谱进行分离和测定,根据分析结果鉴定出组织中的代谢化合物。
在操作过程中,可以将强极性提取液和弱极性提取液以不同的进样批次分别独立地以超高效液相色谱-四极杆-静电场轨道阱傅里叶转换质谱进行分离和测定。但也不排除可根据检测仪器的可操作性,将强极性提取液和弱极性提取液同时进样并独立地进行分离和测定。
可参考地,强极性提取液的提取过程所用的第一提取试剂为强极性有机试剂,例如可包括甲醇、乙腈-水的混合溶液或甲醇-乙腈-水的混合溶液。
在优选地实施方式中,第一提取试剂为甲醇-乙腈-水的混合溶液。在更优地实施方式中,第一提取试剂为甲醇、乙腈和水以体积比为1.5-2.5:1.5-2.5:1(优选为2:2:1)混合的混合溶液。该比例下的甲醇-乙腈-水的混合溶液可提取出动物组织中基本所有的强极性成分。
在可选地实施方式中,强极性提取液例如可经以下方式得到:用上述第一提取试剂提取待测样品,第一次固液分离,收集上清液(定义为第一上清液)。
具体的,可以是将第一提取试剂与待测样品于-5℃至0℃(优选为冰浴,约0℃)的条件下匀浆处理(匀浆处理可通过研磨方式进行),随后静置3-6min(如3min、4min、5min或6min等),再于10000-16000g(如10000g、12000g、15000g或16000g等)的条件下离心处理3-6min(如3min、4min、5min或6min等)。
其中,第一提取试剂与待测样品的用量比可以为1ml:50-200mg,如1ml:50mg、1ml:100mg、1ml:150mg或1ml:200mg等。
第一次固液分离后,得到第一上清液和沉淀物,第一上清液即作为强极性提取液,沉淀物用于获得弱极性提取物。
可参考地,弱极性提取液的提取过程所用的第二提取试剂为弱极性有机试剂,例如可以为甲醇-二氯甲烷混合溶液,也可为其它弱极性试剂,如三氯甲烷等。
在优选地实施方式中,第二提取试剂为甲醇-二氯甲烷混合溶液,其中,二氯甲烷的体积不低于甲醇的体积。在更优地实施方式中,甲醇与二氯甲烷的体积比为1:2.5-3.5(优选为1:3)。该比例下的甲醇-二氯甲烷混合溶液可提取出动物组织中基本所有的弱极性成分。
在可选地实施方式中,弱极性提取液例如可经以下方式得到:用上述第二提取试剂提取第一次固液分离得到的沉淀,第二次固液分离,收集第二次固液分离得到的上清液(定义为第二上清液)。该第二上清液即为弱极性提取液。
具体的,可以是将第二提取试剂与第一次固液分离得到的沉淀于-5℃至0℃(优选为冰浴,约0℃)的条件下匀浆处理(匀浆处理可通过研磨方式进行),静置3-6min(如3min、4min、5min或6min等),再于10000-16000g(如10000g、12000g、15000g或16000g等)的条件下离心处理3-6min(如3min、4min、5min或6min等)。
其中,第二提取试剂与第一次固液分离得到的沉淀的体积相同。
值得说明的是,上述第一提取试剂和第二提取试剂在与待测样品或沉淀混合前,可先进行预冷,该预冷温度例如可以不高于5℃,优选不高于0℃。所得的强极性提取液可以于3-6℃暂存,弱极性提取液可以于0℃暂存。
进一步地,在进行分离和测定前,先将上述所得的强极性提取液和弱极性提取液进行预冷。可参照地,此预冷过程可以于-25至-15℃(如-15℃、-20℃或-25℃等)的条件下进行0.5-2h(如0.5h、1h、1.5h或2h等)。
进一步地,将于-25至-15℃的条件下预冷后的提取液于3-6℃(如3℃、4℃、5℃或6℃等)的条件下恒温保持20-40min(如20min、30min或40min等),再进行分离和测定。上述过程实现了提取液低温除杂及升温复溶,无需干燥即可获得待测样品。
在一些实施方式中,上机分离测定前,还可将待上机的提取液进行过滤除杂,例如可过滤孔直径为0.22μm的滤膜。
本申请中,分离和测定过程中,质谱条件包括以下a至d中的至少一种:
a.加热电喷雾离子源,分别采用正、负模式采集;正离子模式下的电压均可以为3.6-4.4kv(如3.6v、4kv或4.4kv等),负离子模式下的电压均可以为3.15-3.85kv(如3.15kv、3.5kv或3.85kv等)。
b.离子传输管温度可以为315-385℃(如315℃、350℃或385℃等)。
c.鞘气压力可以分别为45-55psi(如45psi、50psi或55psi等)和22.5-27.5psi(如22.5psi、25psi或27.5psi等),辅助气压力均可以为13.5-16.5arb(如13.5arb、15arb或16.5arb等),辅助气加热温度均可以为288-352℃(如288℃、320℃或352℃等)。
d.扫描模式为fullms,仪器分辨率为70000,-dd/ms2,分辨率为17500,nce15-30-45ev,扫描范围可以为50-1000m/z。其中,nce代表碰撞能。
值得说明的是,本申请中上述超高效液相色谱-四极杆-静电场轨道阱傅里叶转换质谱进行分离和测定过程使用的分析仪器、分离测定原理以及其它未公开的参数条件等均可参照现有技术,在此不做过多赘述。
在可选的实施方式中,分离和测定过程中,强极性提取液采用的色谱柱例如可以但不仅限于包括waters-hilic色谱柱和hsst3色谱柱,也即其可以仅采用waters-hilic色谱柱和hsst3色谱柱这两种色谱柱,也可在此基础上再采用其它色谱柱。该过程是将强极性提取液分别独立地用waters-hilic色谱柱和hsst3色谱柱进行两次分离和检测,得到两个检测结果,该两个结果综合起来即为强极性提取液中所含的代谢物情况。弱极性提取液采用的色谱柱例如可以但不仅限于包括hsst3色谱柱,也可在此基础上采用其它色谱柱,该结果即为弱极性提取液中所含的代谢物情况。将强极性提取液的代谢物情况与弱极性提取液的代谢物情况综合起来即为待测样品中所有代谢物的结果。
值得说明的是,通过发明人大量试验得出:采用waters-hilic色谱柱和hsst3色谱柱对强极性提取液进行分离测定,采用hsst3色谱柱对弱极性提取液进行分离测定,即可使测定结果具有较广的覆盖面,所测得的物质种类较为齐全,能够准确体现和反映出原始样品中代谢物的真实情况。
可参考地,强极性提取液和弱极性提取液使用的waters-hilic色谱柱和hsst3色谱柱的柱长均可以为100-120mm(优选100mm),内径均可以为1.8-2.4mm(优选为2.1mm),填料粒径均可以为1.5-2μm(优选为1.7μm)。当然,上述色谱柱的柱长、内径等也可采用其它规格。
在可选的实施方式中,当用hsst3色谱柱分离和测定强极性提取液时:
正模式采集过程中,流动相a可以为乙腈,流动相b可以为水,流动相a的洗脱梯度可以为:0-0.5min,3vt%;0.5-8min,3-70vt%;8-13min,70-85vt%;13-13.1min,85-100vt%;13.1-17.5min,100vt%;17.5-17.6min,100-3vt%;17.6-21min,3vt%;对应地,在同一洗脱时间段中,流动相b的洗脱浓度即为100vt%减去流动相a的体积百分数,下同。
负模式采集过程中,流动相a可以为乙腈,流动相b可以为水,流动相a的洗脱梯度可以为:0-0.5min,3vt%;0.5-8min,3-70vt%;8-15min,70-90vt%;15-15.1min,90-100vt%;15.1-18min,100vt%;18-18.1min,100-3vt%;18.1-21min,3vt%。
较佳地,hsst3色谱柱分离和测定强极性提取液的过程中,正模式采集时,流动相a和流动相b中均可含有0.04-0.06vt%(优选为0.05vt%)甲酸;负模式采集时,流动相b中可含有4.5-5.5mmol/l(优选为5mmol/l)甲酸铵,以降低或避免洗脱峰出现拖尾现象。
在可选的实施方式中,当用waters-hilic色谱柱分离和测定强极性提取液时:
正模式采集过程中,流动相a为可以乙腈与水以体积比为94:6-96:4(优选为95:5)的混合液,流动相b可以为乙腈与水以体积比为0.9-1.1:0.9-1.1(优选为1:1)的混合液,流动相a的洗脱梯度可以为:0-0.5min,95vt%;0.5-12min,95-75vt%;12-12.1min,75-95vt%;12.1-15min,95vt%。
负模式采集过程中,流动相a可以为乙腈与水以体积比为94:6-96:4(优选为95:5)的混合液,流动相b可以为乙腈与水以体积比为0.9-1.1:0.9-1.1(优选为1:1)的混合液,流动相a的洗脱梯度可以为:0-0.5min,95vt%;0.5-12min,95-75vt%;12-14min,75vt%;14-14.1min,95vt%;14.1-17min,95vt%。
较佳地,waters-hilic色谱柱分离和测定强极性提取液的过程中正模式采集时,流动相a和流动相b中均可含有4.5-5.5mmol/l(优选为5mmol/l)甲酸铵以及0.08-0.12vt%(优选为0.1vt%)甲酸;负模式采集时,流动相a和流动相b中均可含有4.5-5.5mmol/l(优选为5mmol/l)甲酸铵。
在可选的实施方式中,当用hsst3色谱柱分离和测定弱极性提取液时:
正模式采集过程中,流动相a可以为乙腈,流动相b可以为水,流动相a的洗脱梯度可以为:0-1min,20vt%;1-3min,20-70vt%;3-8min,70vt%;8-8.1min,70-20vt%;8.1-11min,20vt%。
负模式采集过程中,流动相a可以为乙腈,流动相b可以为水,流动相a的洗脱梯度可以为:0-0.5min,20vt%;0.5-2min,20-70vt%;2.5-7min,70-80vt%;7-7.1min,80-100vt%;7.1-10min,100vt%;10-10.1min,100-20vt%;10.1-13min,20vt%。
较佳地,hsst3色谱柱分离和测定弱极性提取液的过程中,正模式采集时,流动相a和流动相b中均可含有0.04-0.06vt%(优选为0.05vt%)甲酸;负模式采集时,流动相b中可含有4.5-5.5mmol/l(优选为5mmol/l)甲酸铵。
进一步地,结果的分析包括:将分离和测定的结果结合母离子、二级碎片离子信息、保留时间信息与数据库进行匹配,鉴定组织中的代谢化合物。
在此过程中,分析所用软件例如可以但不限于包括thermofisherscientificq-exactiveplussystemxcalibur软件和化合物分析软件(cd)。
进一步地,在鉴定出组织中的代谢化合物之后,还可采用thermoxcaliburqualbrowser软件确定数据采集情况。随后再并用化合物分析软件分析出提取液中化合物的差异。
值得说明的是,本申请提供的动物组织全谱代谢组学分析方法中不使用标准品,不依赖标准化合物,无需标准品的提取和制备,操作简单,节约时间成本和经济成本。该方法可鉴定筛选检测典型的生理代谢物,可有效应用于多种哺乳动物代谢组分析,有利于进一步开展生理代谢等相关研究。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供一种动物组织全谱代谢组学分析方法,其包括如下步骤:
(1)将冷冻的鸡肌肉组织、肝脏组织、淋巴组织分别称重后按照100mg/ml的量加第一提取试剂(甲醇:乙腈:水体积比为2:2:1),0℃下匀浆后静置5min,13000g离心5min,取上清液在4℃暂存作为强极性提取液;将沉淀加相同体积的第二提取试剂(甲醇:ch2cl2体积比为1:3),0℃下匀浆5min,13000g离心5min,取上清液在0℃暂存作为弱极性提取液;将两份上清液在-20℃下预冷1h后置于5℃下恒温保持30min,过0.22微米滤膜待上机分析。
(2)将步骤(1)所得的待测样品通过超高效液相色谱-四极杆-静电场轨道阱傅里叶转换质谱进行分离和测定。其中强极性提取液用waters-hilic柱和hsst3色谱柱分析,弱极性提取液用hsst3色谱柱分析。watershsst3和hilic色谱柱分析中色谱柱长度均为100mm,内径为2.1mm,填料粒径为1.7μm。超高效液相色谱采用不同流动相a和流动相b及梯度如下:
质谱的条件为:加热电喷雾离子源,分别采用正、负模式采集;正离子模式下的电压均为4.00kv,负离子模式下的电压均为3.50kv。离子传输管温度为350℃。鞘气压力分别为50psi和25psi,辅助气压力均为15arb,辅助气加热温度均为320℃。扫描模式为fullms,仪器分辨率为70000,-dd/ms2,分辨率为17500,nce15-30-45ev,扫描范围为50-1000m/z。
(3)利用thermofisherscientificq-exactiveplussystemxcalibur软件和化合物分析软件cd,结合母离子、二级碎片离子信息、保留时间信息与数据库进行匹配,鉴定组织中的代谢化合物;通过软件thermoxcaliburqualbrowser确定数据采集情况。
(4)利用cd软件分析提取液中化合物的差异。
上述过程不使用标准品。
本实施例中就同一组织设置有不同的处理组作为待测样品,处理组一为空白(以ck表示),处理组二为活体鸡经哒螨灵2mg/kg(体重)灌胃(以a表示),处理组三为哒螨灵2mg/kg(体重)+溴虫腈2mg/kg(体重)灌胃,以(ac表示),处理组四溴虫腈2mg/kg(体重)灌胃(以c表示)。
每个处理组均平行试验8次,各组所用的活体鸡的体重无明显差异,每组每天灌胃处理1次,共处理1个月,1个月后将试验所用的鸡解剖,取肌肉组织按上述(1)至(4)的过程进行测定。其结果请参照图1和图2。
其中,图1为处理组三鸡肌肉组织代谢组测定液质联用总离子流图(负离子),该图结果表明:本实施例提供的方法所测得的提取物成分复杂,出峰较多,所建立方法峰形辨识度较高,分布均匀,有助于非靶向代谢组中更多化合物的检出和鉴定,所优化的方法,耗时短,提高分析效率。
图2为不同处理组鸡肌肉代谢组主成分分析图(基于小分子代谢物),该图结果表明:本实施例所建立的检测及数据处理方法能将不同处理组的样品明显的区分开,说明建立的方法适合代谢组分析。
实施例2
本实施例提供一种动物组织全谱代谢组学分析方法,其包括如下步骤:
(1)将冷冻的大鼠肌肉组织、脑组织、肝脏组织分别称重后按照100mg/ml的量加第一提取试剂(甲醇:乙腈:水体积比为2:2:1),0℃下匀浆后静置4min,11000g离心4min,取上清液在4℃暂存作为强极性提取液;将沉淀加相同体积的第二提取试剂(甲醇:ch2cl2体积比为1:3),0℃下匀浆4min,11000g离心4min,取上清液在0℃暂存作为弱极性提取液;将两份上清在-20℃下预冷1h后置于5℃下恒温保持30min,过0.22微米滤膜待上机分析。
(2)将步骤(1)所得的待测样品通过超高效液相色谱-四极杆-静电场轨道阱傅里叶转换质谱进行分离和测定。其中强极性提取液用waters-hilic柱和hsst3色谱柱分析,弱极性提取液用hsst3色谱柱分析。watershsst3和hilic色谱柱分析中色谱柱长度均为100mm,内径为2.1mm,填料粒径为1.7μm。超高效液相色谱采用不同流动相a和流动相b及梯度同实施例1。
质谱的条件同实施例1。
(3)利用thermofisherscientificq-exactiveplussystemxcalibur软件和化合物分析软件cd,结合母离子、二级碎片离子信息、保留时间信息与数据库进行匹配,鉴定组织中的代谢化合物;通过软件thermoxcaliburqualbrowser确定数据采集情况。
(4)利用cd软件分析提取液中化合物的差异。
上述过程不使用标准品。
其结果以大鼠肝脏组织代谢组分结果为例,请参照图3和图4。
其中,图3为大鼠肝脏代谢组测定液质联用总离子流图(负离子),该图结果表明:本实施例提供的方法所测得的提取物成分复杂,出峰较多,所建立方法峰形辨识度较高,分布均匀,有助于非靶向代谢组中更多化合物的检出和鉴定,所优化的方法,耗时短,提高分析效率。
图4为大鼠肝脏代谢组测定液质联用瞬时质谱图,该图结果同样表明:本实施例提供的方法所测得的提取物成分复杂,出峰较多,所建立方法峰形辨识度较高,分布均匀,有助于非靶向代谢组中更多化合物的检出和鉴定,所优化的方法,耗时短,提高分析效率。
实施例3
本实施例提供一种动物组织全谱代谢组学分析方法,其包括如下步骤:
(1)将冷冻的小鼠肌肉组织、肝脏组织、脑组织分别称重后按照200mg/ml的量加第一提取试剂(甲醇:乙腈:水体积比为2:2:1),0℃下匀浆后静置6min,15000g离心6min,取上清液在4℃暂存作为强极性提取液;将沉淀加相同体积的第二提取试剂(甲醇:ch2cl2体积比为1:3),0℃下匀浆6min,15000g离心6min,取上清液在0℃暂存作为弱极性提取液;将两份上清在-15℃下预冷2h后置6℃下恒温保持40min,过0.22微米滤膜待上机分析。
(2)将步骤(1)所得的待测样品通过超高效液相色谱-四极杆-静电场轨道阱傅里叶转换质谱进行分离和测定。其中强极性提取液用waters-hilic柱和hsst3色谱柱分析,弱极性提取液用hsst3色谱柱分析。watershsst3和hilic色谱柱分析中色谱柱长度均为100mm,内径为2.1mm,填料粒径为1.7μm。超高效液相色谱采用不同流动相a和流动相b及梯度同实施例1。
质谱的条件同实施例1。
(3)利用thermofisherscientificq-exactiveplussystemxcalibur软件和化合物分析软件cd,结合母离子、二级碎片离子信息、保留时间信息与数据库进行匹配,鉴定组织中的代谢化合物;通过软件thermoxcaliburqualbrowser确定数据采集情况。
(4)利用cd软件分析不同种类细胞中脂质化合物的差异。
上述过程不使用标准品。
本实施例中就小鼠肌肉组织和小鼠肝脏组织分别设置有不同的处理组作为待测样品。其中,小鼠肌肉代谢组的处理组一为空白(以ck表示),处理组二为活体小鼠经烯酰吗啉5mg/kg(体重)灌胃(以d表示),处理组三为吡虫啉2mg/kg体重)灌胃(以w表示),处理组四为烯酰吗啉5mg/kg(体重)+吡虫啉2mg/kg(体重)灌胃处理以(wd表示)。
小鼠肝脏代谢组的处理组一为空白(以ck表示),处理组二为活体小鼠经哒螨灵2mg/kg(体重)灌胃(以a表示),处理组三为哒螨灵2mg/kg(体重)+溴虫腈2mg/kg(体重)灌胃(以ac表示),处理组四为溴虫腈2mg/kg(体重)灌胃(以c表示)。
每个处理组均平行试验8次,各组所用的活体小鼠的体重无明显差异,每组每天灌胃处理1次,共处理1个月,1个月后将试验所用的小鼠解剖,取肌肉组织和肝脏组织按上述(1)至(4)的过程进行测定。其结果请参照图5至10。
其中,图5和图6分别为小鼠肌肉组织代谢组和小鼠肝脏代谢组测定液质联用总离子流图(正离子),结果表明:本实施例提供的方法所测得的提取物成分复杂,出峰较多,所建立方法峰形辨识度较高,分布均匀,有助于非靶向代谢组中更多化合物的检出和鉴定,所优化的方法,耗时短,提高分析效率。
图7和图8分别为小鼠肌肉组织代谢组和小鼠肝脏代谢组测定液质联用瞬时质谱图(正离子),结果表明:图谱所得信息多,分辨率高,有利于化合物的鉴定。
图9为不同处理组小鼠肌肉组织代谢组测定pca分析图,图10为不同处理组小鼠肝脏代谢组主成分分析图,也即pca分析图(基于小分子代谢物),结果表明:本实施例所建立的检测及数据处理方法能将不同处理组的样品明显的区分开,说明建立的方法适合代谢组分析。
实施例4
本实施例提供一种动物组织全谱代谢组学分析方法,其包括如下步骤:
(1)将冷冻的鸡肌肉组织、肝脏组织、淋巴组织分别称重后按照50mg/ml的量加第一提取试剂(乙腈:水体积比为2:1),0℃下匀浆后静置3min,10000g离心5min,取上清液在3℃暂存作为强极性提取液;将沉淀加相同体积的第二提取试剂(甲醇:ch2cl2体积比为1:3),0℃下匀浆3min,10000g离心5min,取上清液在0℃暂存作为弱极性提取液;将两份上清液在-25℃下预冷0.5h后置于3℃下恒温保持25min,过0.22微米滤膜待上机分析。
(2)将步骤(1)所得的待测样品通过超高效液相色谱-四极杆-静电场轨道阱傅里叶转换质谱进行分离和测定。其中强极性提取液用waters-hilic柱和hsst3色谱柱分析,弱极性提取液用hsst3色谱柱分析。watershsst3和hilic色谱柱分析中色谱柱长度均为120mm,内径为1.8mm,填料粒径为1.75μm。超高效液相色谱采用不同流动相a和流动相b及梯度同实施例1。
质谱的条件为:加热电喷雾离子源,分别采用正、负模式采集;正离子模式下的电压均为4.4kv,负离子模式下的电压均为3.15kv。离子传输管温度为315℃。鞘气压力分别为45psi和22.5psi,辅助气压力均为13.5arb,辅助气加热温度均为288℃。扫描模式为fullms,仪器分辨率为70000,-dd/ms2,分辨率为17500,nce15-30-45ev,扫描范围为50-1000m/z。
(3)利用thermofisherscientificq-exactiveplussystemxcalibur软件和化合物分析软件cd,结合母离子、二级碎片离子信息、保留时间信息与数据库进行匹配,鉴定组织中的代谢化合物;通过软件thermoxcaliburqualbrowser确定数据采集情况。
(4)利用cd软件分析提取液中化合物的差异。
上述过程不使用标准品。
实施例5
本实施例提供一种动物组织全谱代谢组学分析方法,其包括如下步骤:
(1)将冷冻的鸡肌肉组织、肝脏组织、淋巴组织分别称重后按照50mg/ml的量加第一提取试剂(纯甲醇),0℃下匀浆后静置3min,16000g离心3min,取上清液在6℃暂存作为强极性提取液;将沉淀加相同体积的第二提取试剂(三氯甲烷),0℃下匀浆3min,16000g离心3min,取上清液在0℃暂存作为弱极性提取液;将两份上清液在-25℃下预冷0.5h后置于4℃下恒温保持20min,过0.22微米滤膜待上机分析。
(2)将步骤(1)所得的待测样品通过超高效液相色谱-四极杆-静电场轨道阱傅里叶转换质谱进行分离和测定。其中强极性提取液用waters-hilic柱和hsst3色谱柱分析,弱极性提取液用hsst3色谱柱分析。watershsst3和hilic色谱柱分析中色谱柱长度均为100mm,内径为2.4mm,填料粒径为2μm。超高效液相色谱采用不同流动相a和流动相b及梯度同实施例1。
质谱的条件为:
a.加热电喷雾离子源,分别采用正、负模式采集;正离子模式下的电压均为4.00kv,负离子模式下的电压均为3.85kv;b.离子传输管温度为385℃;c.鞘气压力分别为55psi和27.5psi,辅助气压力均为16.5arb,辅助气加热温度均为352℃;d.扫描模式为fullms,仪器分辨率设置为70000,-dd/ms2,分辨率17500,nce15-30-45ev,扫描范围50-1000m/z。
(3)利用thermofisherscientificq-exactiveplussystemxcalibur软件和化合物分析软件cd,结合母离子、二级碎片离子信息、保留时间信息与数据库进行匹配,鉴定组织中的代谢化合物;通过软件thermoxcaliburqualbrowser确定数据采集情况。
(4)利用cd软件分析提取液中化合物的差异。
上述过程不使用标准品。
综上,本申请以超高效液相色谱-四极杆-静电场轨道阱傅里叶转换质谱技术为基础,建立了细胞中代谢组学分析方法,鉴定组织中的代谢化合物,操作简单、不依赖标准化合物,无需标准品的提取和制备,节约时间成本和经济成本。该过程中同时测定有由待测样品得到的强极性提取液和弱极性提取液,测定结果覆盖面广,所测得的物质种类较为齐全,与原始样品中真实所含情况几乎一致,不仅能够测出同一动物不同组织的代谢物情况,而且还能比较不同动物的组织中代谢物的种类和含量。
以上仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!