一种检测氟氯氰菊酯的试纸条及方法与流程
1.本发明涉及一种检测氟氯氰菊酯的试纸条及方法,具体涉及一种用于检测氟氯氰菊酯的胶体金试纸条,其特别适用于果蔬中氟氯氰菊酯残留的检测。
背景技术:
2.氟氯氰菊酯(cyfluthrin)是一种杀虫活性较高的拟除虫菊酯类杀虫剂,其对害虫的作用方式以触杀、胃毒作用为主,对多种鳞翅目害虫和某些地下害虫有良好的防效,被广泛应用于果蔬、茶叶和烟草中。但由于长期过量使用,其污染、残留所造成的环境问题已受到广泛关注。我国国家标准gb 2763规定了蔬菜及部分水果中氟氯氰菊酯的最大残留限量,因此建立相应农产品中氟氯氰菊酯的检测方法势在必行。
3.目前已报道的检测氟氯氰菊酯的方法主要是气相色谱法、气相色谱
‑
质谱法、高效液相色谱法、液相色谱
‑
质谱法等仪器方法。这些方法均须在实验室条件下操作,样品前处理繁琐费时,还需配备昂贵的仪器设备,检测成本较高、耗时长、操作复杂,在实际应用过程中有很大的限制性,难以满足大量样品和现场样品快速检测的需要。因此,开发一种简单快速、适用于果蔬中氟氯氰菊酯残留的胶体金试纸条,可满足大量样品现场筛选和监控,能够更好地满足我国食品监管部门等开展检测工作。
技术实现要素:
4.本发明的目的在于提供一种能够检测果蔬中氟氯氰菊酯残留的胶体金试纸条,并且提供一种高效、准确、简便、适于现场监控和大量样本筛查的检测方法。
5.本发明所提供的检测氟氯氰菊酯的试纸条,包括样品吸收垫、结合物释放垫、反应膜、吸水垫和底板;所述反应膜上具有包被有氟氯氰菊酯半抗原
‑
载体蛋白偶联物的检测线和包被有羊抗鼠抗抗体的质控线;所述结合物释放垫上喷涂有氟氯氰菊酯单克隆抗体
‑
胶体金标记物。
6.所述氟氯氰菊酯单克隆抗体是以氟氯氰菊酯半抗原
‑
载体蛋白偶联物作为免疫原制备获得。
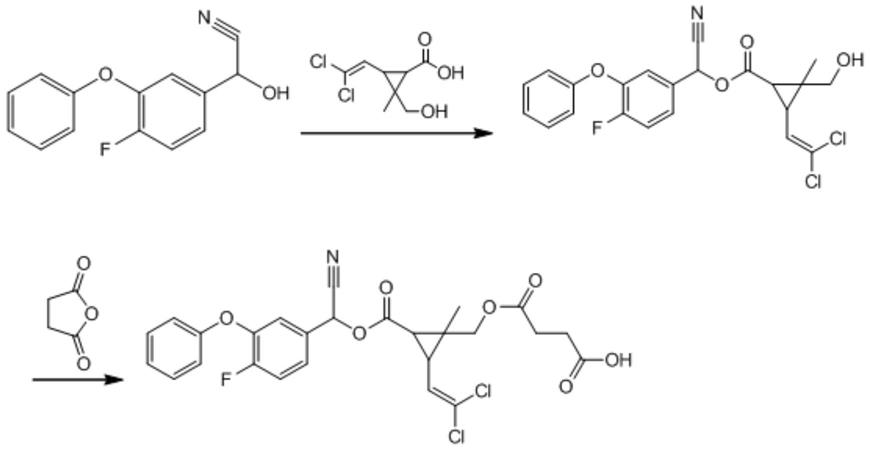
7.所述氟氯氰菊酯半抗原
‑
载体蛋白偶联物由氟氯氰菊酯半抗原与载体蛋白偶联得到,所述载体蛋白为牛血清白蛋白、卵清蛋白、血蓝蛋白、甲状腺蛋白或人血清白蛋白,所述氟氯氰菊酯半抗原是通过羟基二氯菊酸在吡啶中与二氯亚砜形成酰氯,再与(alpha s)
‑4‑
氟
‑
alpha
‑
羟基
‑3‑
苯氧基
‑
苯乙腈缩合成酯,然后与琥珀酸酐进行酯化反应得到,其分子结构式为:
[0008][0009]
所述样品吸收垫、结合物释放垫、反应膜、吸水垫依次粘贴在底板上,所述结合物释放垫1/3~1/2被覆盖于样品吸收垫下。
[0010]
所述底板可为pvc底板或其他硬质不吸水的材料;所述样品吸收垫可为吸滤纸或滤油纸;所述结合物释放垫可为玻璃棉或聚酯材料;所述吸水垫为吸水纸;所述反应膜可为硝酸纤维素膜或醋酸纤维素膜。
[0011]
本发明的另一个目的是提供一种制备上述试纸条的方法,其包括步骤:
[0012]
1)制备喷涂有氟氯氰菊酯单克隆抗体
‑
胶体金标记物的结合物释放垫;
[0013]
2)制备具有包被有氟氯氰菊酯半抗原
‑
载体蛋白偶联物的检测线和包被有羊抗鼠抗抗体的质控线的反应膜;
[0014]
3)将1)和2)制备好的结合物释放垫、反应膜与样品吸收垫、吸水垫和底板组装成试纸条。
[0015]
具体地说,步骤包括:
[0016]
1)通过羟基二氯菊酸在吡啶中与二氯亚砜形成酰氯,再与(alpha s)
‑4‑
氟
‑
alpha
‑
羟基
‑3‑
苯氧基
‑
苯乙腈缩合成酯,然后与琥珀酸酐进行酯化反应,制备氟氯氰菊酯半抗原;
[0017]
2)将氟氯氰菊酯半抗原与载体蛋白偶联,制备氟氯氰菊酯半抗原
‑
载体蛋白偶联物;
[0018]
3)用氟氯氰菊酯半抗原
‑
载体蛋白偶联物免疫小鼠,将小鼠脾细胞和小鼠骨髓瘤细胞通过融合、筛选,得到分泌氟氯氰菊酯单克隆抗体的杂交瘤细胞株;
[0019]
4)提取小鼠igg免疫健康山羊,得到羊抗鼠抗抗体;
[0020]
5)分别将氟氯氰菊酯半抗原
‑
载体蛋白偶联物和羊抗鼠抗抗体包被于反应膜的检测线(t)和质控线(c)上;
[0021]
6)用柠檬酸三钠与氯金酸反应制备胶体金;
[0022]
7)将制备的氟氯氰菊酯单克隆抗体加入到制备的胶体金中,得到氟氯氰菊酯单克隆抗体
‑
胶体金标记物;
[0023]
8)将氟氯氰菊酯单克隆抗体
‑
胶体金标记物喷涂在结合物释放垫上,37℃烘1h后取出,置于干燥环境中保存备用;
[0024]
9)将样品吸收垫用含0.5%牛血清白蛋白、ph为7.2、0.1mol/l的磷酸盐缓冲液浸泡2h,37℃下烘干2h;
[0025]
10)在底板上按顺序粘贴上样品吸收垫、结合物释放垫、反应膜、吸水垫,结合物释放垫从起始端有1/3区域被样品吸收垫覆盖。最后切成3mm宽的小条,加塑料盒,真空包装,4~30℃条件下保存12个月。
[0026]
本发明的另一个目的是提供一种应用上述试纸条检测果蔬中氟氯氰菊酯残留的
方法,它包括步骤:
[0027]
(1)样品前处理;
[0028]
(2)用试纸条进行检测;
[0029]
(3)分析检测结果。
[0030]
本发明的氟氯氰菊酯快速检测试纸条采用高度特异性的抗体抗原反应及免疫层析分析技术,将氟氯氰菊酯单克隆抗体
‑
胶体金标记物固定于结合物释放垫上,样品中的氟氯氰菊酯在流动过程中与结合物释放垫上的氟氯氰菊酯单克隆抗体
‑
胶体金标记物结合,形成药物
‑
抗体
‑
胶体金标记物。样本中的药物与反应膜检测线上的氟氯氰菊酯半抗原
‑
载体蛋白偶联物竞争结合氟氯氰菊酯单克隆抗体
‑
胶体金标记物,根据检测线红色条带深浅来判断待测样品液中是否含有氟氯氰菊酯残留。
[0031]
检测时,样品经处理后滴入试纸条卡孔内,当氟氯氰菊酯在样品中的浓度低于检测限或为零时,单克隆抗体
‑
胶体金标记物在层析过程中会与固定在反应膜上的氟氯氰菊酯半抗原
‑
载体蛋白偶联物结合,在检测线(t)和质控线(c)上各出现一条红色条带,且t线显色比c线显色深或与c线显色一致;如果氟氯氰菊酯在样品中的浓度等于或高于检测限,单克隆抗体
‑
胶体金标记物会与氟氯氰菊酯全部结合,从而在t线处因为竞争反应不会与氟氯氰菊酯半抗原
‑
载体蛋白偶联物结合而不出现红色条带或比c线显色浅。如图3所示。
[0032]
阴性:当质控线(c)显示出红色条带,检测线(t)同时也显示出红色条带,且(t)线颜色接近或深于(c)线时,判为阴性。
[0033]
阳性:当质控线(c)显示出红色条带,而检测线(t)不显色或(t)线颜色浅于(c)线时,判为阳性。
[0034]
无效:当质控线(c)不显示出红色条带,则无论检测线(t)显示出红色条带与否,该试纸条均判为无效。
[0035]
本发明的试纸条具有灵敏度高、特异性强、成本低、操作简单、检测时间短、适合各种单位使用、储存简单、保质期长的优点。用本发明试纸条检测氟氯氰菊酯残留的方法简便、快速、直观、准确、适用范围广、成本低、易推广使用。
附图说明
[0036]
图1为氟氯氰菊酯半抗原合成图。
[0037]
图2为试纸条剖面结构示意图。
[0038]
图3为试纸条检测结果判定图。
具体实施方式
[0039]
下面结合具体的实施例来进一步阐述本发明。应理解,这些实施例仅用于说明本发明,而不用来限制本发明的范围。
[0040]
实施例1检测氟氯氰菊酯的试纸条的制备
[0041]
该试纸条的制备方法主要包括以下步骤:
[0042]
1)制备喷涂有氟氯氰菊酯单克隆抗体
‑
胶体金标记物的结合物释放垫;
[0043]
2)制备具有包被有氟氯氰菊酯半抗原
‑
载体蛋白偶联物的检测线和包被有羊抗鼠抗抗体的质控线的反应膜;
[0044]
3)将1)和2)制备好的结合物释放垫、反应膜与样品吸收垫、吸水垫和底板组装成试纸条。
[0045]
下面分步详细叙述:
[0046]
1、氟氯氰菊酯半抗原的合成(合成路线见附图1)
[0047]
取羟基二氯菊酸2.5g,加吡啶50ml溶解,加二氯亚砜1.53g,室温搅拌2h,直接蒸干,得到红色油状物;加二氯甲烷100ml溶解,加(alpha s)
‑4‑
氟
‑
alpha
‑
羟基
‑3‑
苯氧基
‑
苯乙腈2.4g,加三乙胺2ml,室温搅拌3h,停止反应,加水80ml震荡,静置,分去水相,有机相无水硫酸钠干燥,蒸干,上硅胶柱,用体积比为3:1的石油醚
‑
乙酸乙酯混合溶液洗脱分离,得到中间体化合物1.25g。
[0048]
取中间体化合物1.25g,加乙腈100ml溶解,加三乙胺3ml充分搅拌,加琥珀酸酐0.55g,加热回流反应4h,停止反应,旋蒸,除去乙腈和三乙胺,得到粗品,加水100ml,用1mol/l hcl调节ph值到6,加乙酸乙酯70ml
×
3,萃取三次,合并有机相,蒸干,上硅胶柱,用体积比为10:1的二氯甲烷
‑
甲醇混合溶液洗脱分离,得到琥珀酸氟氯氰菊酯0.64g,即为氟氯氰菊酯半抗原。
[0049]
2、免疫原的制备
[0050]
取氟氯氰菊酯半抗原21mg,加n,n
‑
二甲基甲酰胺(dmf)1ml溶解,加三乙胺20μl,加氯甲酸异丁酯133μl,冷却至0~5℃,反应3h,得到半抗原溶液a液;取牛血清白蛋白(bsa)50mg,加0.05mol/l cb缓冲液溶解,得到b液;将a液滴加到b液中,4℃反应8h,用0.02mol/l pbs缓冲液透析纯化3天,每天换液3次,得到氟氯氰菊酯半抗原
‑
bsa偶联物,即为免疫原,
‑
20℃保存。
[0051]
3、包被原的制备
[0052]
取氟氯氰菊酯半抗原12mg,加二甲基亚砜(dmso)1ml溶解,加n
‑
羟基丁二酰亚胺(nhs)10mg、1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(edc)12mg,室温反应3h,得到半抗原溶液a液;取卵清蛋白(ova)50mg,加0.05mol/l pb缓冲液溶解,得到b液;将a液滴加到b液中,4℃反应8h,用0.02mol/l pbs缓冲液透析纯化3天,每天换液3次,得到氟氯氰菊酯半抗原
‑
ova偶联物,即为包被原,
‑
20℃保存。
[0053]
4、氟氯氰菊酯单克隆抗体的制备
[0054]
(1)动物免疫
[0055]
将步骤2得到的免疫原注入balb/c小鼠体内,免疫剂量为150μg/只,使其产生抗血清。
[0056]
(2)细胞融合和克隆化
[0057]
取免疫balb/c小鼠脾细胞,按8:1(数量配比)比例与sp2/0骨髓瘤细胞融合,采用间接竞争elisa测定细胞上清液,筛选阳性孔。利用有限稀释法对阳性孔进行克隆化,直到得到稳定分泌单克隆抗体的杂交瘤细胞株。
[0058]
(3)细胞冻存和复苏
[0059]
将杂交瘤细胞用冻存液制成1
×
106个/ml的细胞悬液,在液氮中长期保存。复苏时取出冻存管,立即放入37℃水浴中速融,离心去除冻存液后,移入培养瓶内培养。
[0060]
(4)单克隆抗体的制备与纯化
[0061]
增量培养法:将杂交瘤细胞置于细胞培养基中,在37℃条件下进行培养,用辛酸
‑
饱和硫酸铵法将得到的培养液进行纯化,得到单克隆抗体,
‑
20℃保存。
[0062]
所述细胞培养基为向rpmi1640培养基中添加小牛血清和碳酸氢钠,使小牛血清在细胞培养基中的终浓度为20%(质量分数),使碳酸氢钠在细胞培养基中的终浓度为0.2%(质量分数);所述细胞培养基的ph为7.4。
[0063]
5、羊抗鼠抗抗体的制备
[0064]
以羊作为免疫动物,以鼠源抗体为免疫原对无病原体羊进行免疫,得到羊抗鼠抗抗体。
[0065]
6、氟氯氰菊酯单克隆抗体
‑
胶体金标记物的制备
[0066]
(1)胶体金的制备
[0067]
用双蒸去离子水将1%氯金酸稀释成0.01%(质量分数),取100ml置于锥形瓶中,用恒温电磁搅拌器加热至沸腾,在持续高温、持续搅拌下加入2.5ml 1%柠檬酸三钠,继续匀速搅拌加热至溶液呈透亮的红色时停止,冷却至室温后用去离子水恢复到原体积,4℃保存。制备好的胶体金外观纯净、透亮、无沉淀和漂浮物,在日光下观察颜色为酒红色。
[0068]
(2)氟氯氰菊酯单克隆抗体
‑
胶体金标记物的制备
[0069]
在磁力搅拌下,用0.2mol/l碳酸钾溶液调胶体金的ph值至7.2,按每毫升胶体金溶液中加入20~50μg抗体的标准向胶体金溶液中加入上述氟氯氰菊酯单克隆抗体,继续搅拌混匀30min;静置10min后加入10%bsa,使其在胶体金溶液中的终浓度为1%,静置10min。12000r/min、4℃离心40min,弃上清液,沉淀用复溶缓冲液洗涤两次,用体积为初始胶体金体积1/10的复溶缓冲液将沉淀重悬,置4℃备用。
[0070]
复溶缓冲液:含bsa的质量分数为0.1%~0.3%、吐温
‑
80的质量分数0.05%~0.2%、ph 7.2的0.02mol/l磷酸盐缓冲液。
[0071]
7、结合物释放垫的制备
[0072]
将结合物释放垫浸泡于含0.5%bsa、ph 7.2、0.5mol/l的磷酸盐缓冲液中,均匀浸湿1h,37℃烘3h备用。用isoflow喷膜仪将制备好的氟氯氰菊酯单克隆抗体
‑
胶体金标记物均匀喷涂在结合物释放垫上,每1cm结合物释放垫喷涂0.01ml氟氯氰菊酯单克隆抗体
‑
胶体金标记物后,置于37℃环境中(湿度<20%)60min后取出,置于干燥环境(湿度<20%)中保存备用。
[0073]
8、样品吸收垫的制备
[0074]
将样品吸收垫置于含0.5%牛血清白蛋白、ph为7.2、0.1mol/l的磷酸盐缓冲液中浸泡2h,37℃下烘干2h备用。
[0075]
9、反应膜的制备
[0076]
将氟氯氰菊酯半抗原
‑
卵清蛋白偶联物包被到反应膜上构成检测线,将羊抗鼠抗抗体包被在反应膜上构成质控线。
[0077]
包被过程:用磷酸缓冲液将氟氯氰菊酯半抗原
‑
卵清蛋白偶联物稀释到1mg/ml,用isoflow点膜仪将其包被于硝酸纤维素膜上的检测线(t线),包被量为1.0μl/cm;用0.01mol/l、ph 7.4的磷酸盐缓冲液将羊抗鼠抗抗体稀释到200μg/ml,用isoflow点膜仪将其包被于硝酸纤维素膜上的质控线(c线),包被量为1.0μl/cm。将包被好的反应膜置于37℃条件下干燥2h,备用。
[0078]
10、试纸条的组装
[0079]
根据附图2所示试纸条剖面结构,将样品吸收垫(1)、结合物释放垫(2)、反应膜(3)、吸水垫(4)依次按顺序粘贴在pvc底板(7)上;结合物释放垫从起始端有1/3区域被样品吸收垫覆盖,结合物释放垫的末端与反应膜的始端相连,反应膜的末端与吸水垫的始端相连,样品吸收垫的始端与pvc底板的始端对齐,吸水垫的末端与pvc底板的末端对齐;所述反应膜上有检测线(5)和质控线(6),检测线(t线)和质控线(c线)均为与所述试纸条的长相垂直的条状带;检测线位于靠近结合物释放垫的末端的一侧;质控线位于远离结合物释放垫的末端的一侧;将试纸条用机器切成3mm宽的小条,装在特制的塑料制卡中,4~30℃的环境中贮存,有效期12个月。
[0080]
实施例2果蔬中氟氯氰菊酯的检测
[0081]
1、样品前处理
[0082]
取新鲜样品擦去泥土,剪碎成小于1cm见方的碎片;称取(1.00
±
0.05)g样品至15ml离心管中,加入5ml磷酸盐缓冲液,盖上盖子,手动振荡30s,静置1min,取上层清液作为待测样本液。
[0083]
2、用试纸条检测
[0084]
用微量移液器吸取待测样本液70μl垂直滴于加样孔中;液体流动开始计时,反应10min,判定结果。
[0085]
3、分析检测结果
[0086]
阴性(-):t线显色比c线显色深或与c线显色一致,表示样品中氟氯氰菊酯浓度低于检测限,如图3a、3b。
[0087]
阳性(+):t线显色比c线显色浅或t线不显色,表示样品中氟氯氰菊酯浓度等于或高于检测限,如图3c、3d。
[0088]
无效:未出现c线,表明不正确的操作过程或试纸条已变质失效,如图3e、3f。
[0089]
实施例3样品检测实例
[0090]
1、检测限试验
[0091]
取空白韭菜、结球甘蓝、花椰菜、大白菜、菠菜、茄子、苹果、梨、橙样本,在其中分别添加氟氯氰菊酯至终浓度为0.05mg/kg、0.1mg/kg、0.2mg/kg,取试纸条进行检测,每个样本重复测定三次。
[0092]
用试纸条检测韭菜、结球甘蓝、花椰菜、大白菜、菠菜、茄子、苹果、梨、橙样本时,当其中无氟氯氰菊酯和其添加浓度为0.05mg/kg时,试纸条上显示出t线显色比c线显色深或与c线显色一致,呈阴性;当其中氟氯氰菊酯添加浓度为0.1mg/kg、0.2mg/kg时,试纸条上显示出t线显色比c线显色浅或t线不显色,呈阳性,表明本试纸条对果蔬中氟氯氰菊酯的检测限为0.1mg/kg。
[0093]
2、假阳性率、假阴性率试验
[0094]
取空白韭菜、结球甘蓝、花椰菜、大白菜、菠菜、茄子、苹果、梨、橙样本及添加氟氯氰菊酯至终浓度为0.1mg/kg的阳性韭菜、结球甘蓝、花椰菜、大白菜、菠菜、茄子、苹果、梨、橙样本各20份,用3个批次生产的试纸条分别进行检测,计算其阴阳性率。
[0095]
结果表明:用3个批次生产的试纸条检测阳性样本时,结果全为阳性,可知阳性符合率为100%,假阴性率为0;检测阴性样本时,结果全为阴性,可知阴性符合率为100%,假阳性率为0。说明本发明的检测氟氯氰菊酯的试纸条可以对果蔬样本中氟氯氰菊酯残留进
行快速检测。
[0096]
3、特异性试验
[0097]
用本试纸条检测10mg/kg甲氰菊酯、氯氟氰菊酯、氰戊菊酯、氟氰戊菊酯、联苯菊酯、氯菊酯、氯氰菊酯、溴氰菊酯、醚菊酯等其他拟除虫菊酯类杀虫剂时,试纸条上显示出t线显色比c线显色深或与c线显色一致,呈阴性,说明本试纸条对这些药物无交叉反应。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1