一种检测小分子物质的通用型适配体胶体金侧向层析试纸
1.本发明涉及一种检测小分子物质的通用型适配体胶体金侧向层析试纸,属于分析化学、医药、环境、食品安全检测和纳米生物传感等领域。
背景技术:
2.侧流层析分析技术是一种基于纸张的检测平台,用于检测靶标,由于其在几分钟内提供结果的潜力引起研究者极大地兴趣。因为其具有低成本和易于开发生产的特点,侧流层析分析技术已被确定用于现场检测应用,并广泛应用于各种领域,包括生物医学、食品安全、质量控制以及环境卫生。侧流层析分析技术可以应用一系列生物样本,包括尿液、唾液、汗液、血清、血浆和血液。因此,提高了侧流层析分析技术的应用价值。侧流层析分析技术有两种模式,即竞争型和三明治型,对于低分子量的化合物(如真菌毒素等)通常采用的是竞争型。人工抗原和物种特异性抗免疫球蛋白抗体或适配体互补链和人工设计的核酸链通常喷洒在消化纤维素膜(nc)上分别作为t线和c线。t线的信号强度与分析物的浓度成反比。无论待检样本中是否含有检测目标物,c线都具有可见的独立信号。近年来,越来越多的研究人员重视通过侧流层析分析技术检测小分子物质,但是现有使用侧流层析分析技术对卡那霉素和ota进行检测的研究寥寥无几,因此本文设计了一种检测小分子物质的通用型核酸适配体试纸条,对小分子物质,特别是卡那霉素和ota进行检测。
3.核酸适配体是一种经过体外筛选技术
‑
指数富集的配体系统进化技术(systematic evolution ofligands by exponential enrichment,selex),得到的一小段结构化的寡核苷酸序列(rna或dna),可以与相应的靶标分子(蛋白质,病毒,细菌,细胞,重金属离子等)进行高亲和力和强特异性的结合,为化学生物学界和生物医学界提供了一种新的高效快速识别的研究平台。
4.基于核酸适配体标记的胶体金侧向层析试纸,具有长期稳定、检测时间短、成本低、操作简单、快速等优点,是现场快速检测多种目标物的理想方法。现有核酸适配体胶体金侧向层析试纸条的设计,通常在t线上喷涂的是核酸链
‑
链霉亲和素复合物,随着检测目标物的改变,需要重新制备特定的复合物及喷涂制备硝酸纤维素膜,导致现有的侧向层析试纸条的通用型差。
5.目前,基于适配体识别卡那霉素或ota的胶体金侧向层析试纸研究较少。在文献(biosensors&bioelectronics,2015,71(15):230
‑
242.)中,采用了dna功能化的金纳米球(aunps
‑
dna)作为探针,采用磁性微球(mms)快速分离卡那霉素适配体的互补链(cdna),将cdna作为检测目标,应用于试纸条上,根据cdna的检测浓度转换为卡那霉素的检测浓度,以此来完成卡那霉素的定性以及定量检测,检测限达到4.96nmol/l(s/n=3)。该试纸条需要借助mms,且对卡那霉素的检测转化为对cdna的检测,较为复杂,不利于产品的稳定生产和应用的重复性。
6.在文献(journal ofchromatography b,2016,1022:102
‑
108.)中,开发了一种基于核酸适配体的侧向层析试纸条,该试纸条采用竞争结合模式,用于现场快速检测黄芪中
的ota。竞争反应发生在固定在试纸条上的dna探针(测试区)和样品中的靶标(ota)之间,两者竞争结合aunps
‑
apt偶联物。该试纸条t线的颜色与样品中ota的浓度成负相关。基于该方法,可在15min内完成ota的检测,检测线为1ng/ml。该试纸条将适配体偶联到aunps上,不利于样品中ota对适配体的竞争,产品稳定性差,且设计较为复杂通用性差。
7.目前,已开发的核酸适配体胶体金侧向层析试纸,针对某个特定的目标物,试纸条上的探针需要反复优化设计,通用性差,检测灵敏度有待提高。
技术实现要素:
8.[技术问题]
[0009]
现有核酸适配体胶体金侧向层析试纸条的设计,通常在t线上喷涂的是链霉亲和素
‑
核酸链复合物,针对某个特定的检测目标物,需要重新制备链霉亲和素
‑
核酸链复合物,及重新喷涂制备硝酸纤维素膜,导致现有的侧向层析试纸条通用性不佳,试纸条的制备成本高。
[0010]
[技术方案]
[0011]
本发明采用aunps@polya
‑
dna偶联物作为探针,该偶联物是采用polya作为锚定块,将polya
‑
dna锚定在纳米金粒子上制备的。核酸试纸条的检测区域(t线)喷涂链霉亲和素,控制区域(c线)喷涂与aunps@polya
‑
dna偶联物的dna部分互补的核酸链,构建了通用型的试纸条。该试纸条在t线喷涂的链霉亲和素,以及在c线喷涂的链霉亲和素
‑
核酸链复合物无需改变,仅改变polya
‑
dna上与适配体互补的部分,即可检测另一种物质,为以后的检测提供了方便。
[0012]
本发明所使用的适配体,是在已报道的适配体核酸链的基础上增加5个t碱基,这5个核酸碱基用于辅助杂交。探针上有15个碱基与适配体核酸链互补。生物素化的适配体核酸链与探针结合后,探针才能进一步与t线上的链霉亲和素结合。当存在小分子物质时,小分子物质与探针竞争结合适配体核酸链,抑制了探针与适配体核酸链的杂交,从而抑制了t线的显色,实现了快速检测。
[0013]
本发明提供的核酸适配体胶体金侧向层析试纸条的通用性体现在硝酸纤维素膜的制备和探针的设计上,即在制备针对不同的小分子物质的胶体金试纸条时,硝酸纤维素膜上的t线和c线无需变动,仅需变更小分子物质相应的核酸适配体和金标垫上的aunps@polya
‑
dna偶联物,针对不同的小分子物质,核酸适配体与探针中的polya
‑
dna与核酸适配体互补的片段做相应的变动。
[0014]
本发明提供一种基于适配体和aunps@polya
‑
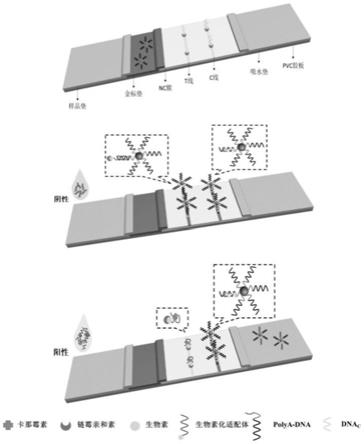
dna偶联物的通用型胶体金侧向层析试纸条检测卡那霉素,该试纸条一般是由样品垫、结合垫(金标垫)、硝酸纤维素膜(nc膜)、吸水垫和pvc胶板组成。
[0015]
所述试纸条的检测原理为:采用竞争法检测小分子物质,当样品溶液中不含小分子物质时,5’端生物素化的核酸适配体与aunps@polya
‑
dna探针结合,进而在t线上被链霉亲和素捕获形成aunps@polya
‑
dna
‑
apt复合物,由于aunps的积累,在t线可以观察到一个清晰地深红色带,检测结果为阴性。当待测溶液中含有小分子物质时,小分子物质与5’端生物素化的核酸适配体结合,核酸适配体不能与aunps@polya
‑
dna探针结合,导致探针在t线区域的积累降低,t线较浅或不显色,检测结果为阳性。t线区域上的颜色强度与小分子物质的
浓度呈负相关。无论样品溶液中有没有小分子物质,aunps
‑
dna探针都可以在c线区域被dnac捕获进而显色。
[0016]
本发明的第一个目的是提供一种通用型胶体金侧向层析试纸条,所述试纸条含有核酸适配体、探针polya
‑
dna和链霉亲和素
‑
生物素
‑
dnac。
[0017]
在一种实施方式中,所述探针polya
‑
dna含有polya片段、与dnac互补的片段和与小分子物质的核酸适配体互补的片段。
[0018]
在一种实施方式中,所述核酸适配体的5’端经生物素标记;所述核酸适配体可与待测的小分子物质特异性结合。
[0019]
在一种实施方式中,所述链霉亲和素
‑
生物素
‑
dnac是将链霉亲和素与5’端经生物素标记的dnac等体积混合,在3~5℃孵育0.8~1.2h制备得到的。
[0020]
在一种实施方式中,所述dnac的核苷酸序列如seq id no.5所示。
[0021]
在一种实施方式中,所述链霉亲和素浓度为2.5mg/ml,所述dnac浓度为250μm。
[0022]
在一种实施方式中,所述小分子物质包括但不限于卡那霉素或ota。
[0023]
在一种实施方式中,所述核酸适配体为经过体外筛选技术
‑
指数富集的配体系统进化技术得到的寡核苷酸序列。
[0024]
在一种实施方式中,所述试纸条包括样品垫、结合垫(金标垫)、硝酸纤维素膜(nc膜)、吸水垫和pvc胶板;所述pvc底板上依次黏贴样品垫、金标垫、nc膜和吸水垫;所述nc膜上依次设有检测区和控制区,且检测区和控制区之间的距离为4~6mm;所述检测区上有链霉亲和素,控制区上有链霉亲和素
‑
生物素
‑
dnac;所述金标垫上含有aunps@polya
‑
dna偶联物。
[0025]
在一种实施方式中,所述样品垫与金标垫间重叠部位长度为1~2mm,样品垫置于金标垫上方;金标垫与nc膜间重叠部位长度为1~2mm,金标垫置于nc膜上方;nc膜与吸水垫间重叠部位长度为1~3mm,吸水垫置于nc膜上方。
[0026]
在一种实施方式中,所述aunps@polya
‑
dna偶联物是将探针polya
‑
dna锚定在纳米金粒子上得到的。
[0027]
在一种实施方式中,所述纳米金粒子的粒径为13~17nm;所述polya
‑
dna的浓度为80~120μm。
[0028]
本发明的第二个目的是提供一种快速检测小分子物质的方法,所述方法是采用上述胶体金侧向层析试纸条进行测试,将待测溶液与小分子物质核酸适配体混合孵育后吸取50
‑
100μl滴加到样品垫上,孵育3~5min,用肉眼进行定性分析或使用胶体金试纸定量分析仪根据标准曲线进行定量分析。
[0029]
在一种实施方式中,所述标准曲线的制备方法为将小分子物质的标准溶液稀释至不同浓度后,将不同浓度的稀释液与5’端经生物素标记的核酸适配体混合,再滴加到样品垫上,孵育3~5min,使用胶体金试纸定量分析仪进行定量分析,将数据进行拟合得到标准曲线。
[0030]
在一种实施方式中,所述混合孵育的时间为15~25min。
[0031]
在一种实施方式中,所述核酸适配体与待测溶液的体积比为1:99。
[0032]
在一种实施方式中,所述核酸适配体的初始浓度为0.1~1.0μm。
[0033]
本发明的第三个目的是提供上述通用型胶体金侧向层析试纸条的制备方法,所述
方法具体步骤如下:
[0034]
(1)将样品垫和金标垫切割后加入pbs浸泡并干燥。
[0035]
(2)将探针aunps@polya
‑
dna喷涂在金标垫上并干燥。
[0036]
(3)在nc膜的检测区喷涂链霉亲和素,控制区喷涂链霉亲和素
‑
生物素
‑
dnac,检测区和喷涂区之间距离固定在5mm,35~39℃干燥2h。
[0037]
(4)将步骤(1)~(3)制备完成的样品垫、金标垫、nc膜和吸水垫依次粘贴在pvc板上即可得到检测卡那霉素的胶体金侧向层析试纸条。
[0038]
在一种实施方式中,所述aunps@polya
‑
dna偶联物是将探针polya
‑
dna作为锚定块,将polya
‑
dna锚定在纳米金粒子上得到的;所述探针polya
‑
dna含有polya片段、与dnac互补的片段和与小分子物质的核酸适配体互补的片段;所述纳米金粒子的粒径为13~17nm。
[0039]
在一种实施方式中,所述polya
‑
dna的浓度为80~120μm。
[0040]
在一种实施方式中,所述dnac的核苷酸序列如seq id no.5所示。
[0041]
在一种实施方式中,所述样品垫与金标垫间重叠部位长度为1~2mm,样品垫置于金标垫上方;金标垫与nc膜间重叠部位长度为1~2mm,金标垫置于nc膜上方;nc膜与吸水垫间重叠部位长度为1~3mm,吸水垫置于nc膜上方。
[0042]
本发明的有益效果:
[0043]
(1)本文发明制备了高灵敏度、高特异性的一种基于适配体的通用型胶体金侧向层析试纸条。该试纸条对卡那霉素、ota检测反应灵敏(肉眼检测限分别为15ng/ml、10ng/ml,读数仪检测限分别为0.3ng/ml、0.18ng/ml)、快速(20min)、检测结果重复性高。
[0044]
(2)本发明所提出的检测方法实现了小分子物质(本发明为卡那霉素和ota)的高灵敏比色检测。在5
‑
250ng/ml的浓度范围内,t/c线与卡那霉素的浓度呈现良好的线性关系,检出限为0.3ng/ml。在1
‑
250ng/ml的浓度范围内,t/c线与卡那霉素的浓度呈现良好的线性关系,检出限为0.18ng/ml。
[0045]
(3)本发明构建的试纸条,检测区和控制区喷涂的链霉亲和素和核酸链无需改变,制备试纸条时仅仅需要改变胶体金
‑
核酸偶联物即可检测另一种物质,从而提高了喷涂制备硝酸纤维素膜的通用型,简化制备过程,降低试纸条成本。
[0046]
(4)该试纸条可通过观察检测区的颜色变化,肉眼可以实现小分子物质的定性检测,使用胶体金定量分析仪可实现定量分析。
[0047]
(5)该试纸条的核酸适配体的设计中,通过在3’端增加多个t碱基以增加适配体与探针的结合效率,提高灵敏度,降低了核酸适配体的用量,减少成本。
附图说明
[0048]
图1是试纸条的结构示意图和检测原理图。
[0049]
图2是金纳米颗粒的表征:(a)aunps的tem图像;(b)aunps的吸收光谱。
[0050]
图3是用试纸条对不同浓度卡那霉素标准溶液的检测图;从左到右的浓度依次为0、0.5、5、15、25、50、150、250和400ng/ml。
[0051]
图4是在标准检测液中,不同浓度卡那霉素时t线比c线的相对强度(t/c)标准曲线图;从左到右的浓度依次为0、1、10、50、100、250和500ng/ml。
[0052]
图5是用试纸条对不同浓度ota标准溶液的检测图。
[0053]
图6是在标准检测液中,不同浓度ota时t线比c线的相对强度(t/c)标准曲线图。
[0054]
图7是用试纸条对不同浓度卡那霉素的蜂蜜样品的检测图。
[0055]
图8是不同序列的核酸链对卡那霉素相应信号的影响。
具体实施方式
[0056]
实施例一:基于核酸适配体的卡那霉素快速检测试纸条的制备
[0057]
具体步骤为:
[0058]
1.适配体序列和探针的设计
[0059]
为了确保生物素化的适配体能与探针上的核酸结合并且在t线区域能被sa捕获,选择不同序列的核酸链(polya
‑
dna
(20)
,polya
‑
dna
(15)
,polya
‑
dna
(5+10)
,polya
‑
dna
(5+5)
,polya
‑
dna
(10+5)
)与aunps偶联(如表1所示)。选用的相应的适配体浓度为0.5μm,加入相同浓度的卡那霉素(150ng/ml)。结果如图8所示,当在适配体序列的3’端连接多个t碱基时,能明显增加信号强度,信号最高可增强6倍,当应用核苷酸序列如seq id no.2的核酸探针链polya
‑
dna
(10+5)
时,对卡那霉素相应信号的变化(δt/c值)最大。因此,实验中应用的为探针链polya
‑
dna
(10+5)
。
[0060]
表1卡那霉素适配体通用型lfs所用核酸序列
[0061][0062]
(带下划线或加粗的序列表示互补序列;加粗斜体序列表示适配体部分序列或其互补序列,加粗序列表示适配体延伸序列或其互补序列。)
[0063]
polya
‑
dna的设计:polya
‑
dna有三个功能区。第一个功能区是polya,其作为锚定块,将polya
‑
dna锚定在金纳米粒子上;第二个功能区是与dnac互补的区域,该区域无需特定的序列要求,与dnac互补即可;第三个功能区是与核酸适配体部分互补的区域,辅助杂交。同时,要保证polya
‑
dna自身序列不能互补。
[0064]
dnac的设计:如表1、表2中所示,dnac序列划线处与polya
‑
dna互补,并在3’端连有
5个a碱基。
[0065]
表2卡那霉素快速检测试纸条的dna序列
[0066][0067]
(带下划线或加粗的序列表示互补序列;加粗序列表示适配体部分序列或其互补序列,加粗斜体序列表示适配体延伸序列或其互补序列。)
[0068]
表3 ota快速检测试纸条的dna序列
[0069][0070]
(带下划线或加粗的序列表示互补序列;加粗序列表示适配体部分序列或其互补序列;加粗斜体序列表示适配体延伸序列或其互补序列。)
[0071]
2.金纳米粒子(aunps)的制备及功能化
[0072]
(1)aunps的制备
[0073]
实验用于合成和储备纳米材料的玻璃器皿均用于王水(盐酸:硝酸=3:1)浸泡12h,用超纯水洗涤干净后使用。
[0074]
aunps的制备采用的是柠檬酸钠还原法。具体如下:
[0075]
1)将100ml 0.01%的haucl4加入250ml锥形瓶中,加热搅拌至溶液暴沸,保持1~2min。
[0076]
2)向锥形瓶中迅速加入2ml 1%的柠檬酸三钠溶液,继续加热搅拌。溶液的颜色由浅黄色逐渐变为深紫色最后变成酒红色,保持加热10min,制备得到粒径15nm的aunps,将其冷却至室温后,4℃冷藏备用。
[0077]
(2)aunps功能化
[0078]
1)将5
‑
15μl 100μm的polya
‑
dna加入1ml步骤(1)中制备得到的aunps(10nm)中混合均匀,然后加入20μl 500mm的柠檬酸缓冲液(ph 3.0)。混合均匀后,在室温下孵育3min。
[0079]
2)孵育完成后,加入60μlph 7.6的500mm hepes缓冲液,调整aunps溶液的ph为中性,然后在室温下孵育5
‑
10min。
[0080]
3)孵育完成后10000r/min离心20min,去上清,向沉淀物中加入重悬液复溶,10000r/min、20min重复离心三次除去未反应的核酸,最终加入400μl重悬液获得功能化的aunps,即探针aunps@polya
‑
dna,4℃冷藏备用。
[0081]
用透射电子显微镜分别对步骤(1)制备的aunps和步骤(2)制备的aunps@polya
‑
dna进行表征,结果如图2所示,制备的粒径15nm的aunps在520nm处有单一的特征吸收峰,当与polya
‑
dna结合时,最大吸收波长移至530nm,初步证明polya
‑
dna成功修饰了aunps。
[0082]
重悬液的组成:20mm na3po4,5%bsa,10%蔗糖,0.25%吐温
‑
20。
[0083]
3.链霉亲和素
‑
生物素
‑
dnac的制备
[0084]
(1)100μl 2.5mg/ml的链霉亲和素与100μl 250μm 5’端经生物素标记的dnac混合并在4℃下孵育1h,获得混合液。
[0085]
(2)使用超滤管(mwco 30kda)处理混合液,6000r/min 20min离心三次,重悬于300μl 10mm pbs中,获得链霉亲和素
‑
生物素
‑
dnac,4℃储存备用。
[0086]
4.核酸适配体试纸条的组装
[0087]
(1)将样品垫和结合垫(金标垫)切成适当尺寸,加入10mm pbs浸泡30min,然后在45℃下干燥。
[0088]
(2)将步骤1中制备得到的探针aunps@polya
‑
dna均匀的喷涂在结合垫上,37℃干燥2h。
[0089]
(3)在nc膜上用三维喷点仪器以0.9μl/cm的速度均匀喷涂链霉亲和素和步骤2制备的链霉亲和素
‑
生物素
‑
dnac,分别作为检测区(t线)和控制区(c线),检测区和控制区之间的距离固定在5mm,37℃干燥2h。
[0090]
(4)将步骤(1)~(3)制备完成的样品垫、结合垫、nc膜、吸水垫按图1依次粘贴在pvc板上,将组装好的试纸条均匀切割为4mm的宽度,放入分装袋中,密封保存。
[0091]
实施例二:用试纸条对卡那霉素标准溶液的测定
[0092]
(1)卡那霉素标准溶液的制备
[0093]
卡那霉素标准溶液用runningbuffer(4
×
ssc,ph 7)分别稀释终浓度为0.5、5、15、25、50、150、250和400ng/ml。用超纯水将核苷酸序列如seq id no.1所示的卡那霉素适配体稀释至0.5μm。
[0094]
(2)卡那霉素核酸试纸条检测标准曲线的建立:
[0095]
将步骤(1)中99μl不同浓度的卡那霉素标准溶液与1μl卡那霉素适配体溶液混合孵育20min,混合反应后将混合液滴加入到样品垫进行检测,反应3min后测定(t/c)相对信号强度,建立(t/c)相对光信号强度与不同卡那霉素浓度之间对应关系的标准曲线。
[0096]
结果如图3所示,当卡那霉素浓度为15ng/ml时,试纸条上t线的颜色能与不含卡那霉素的溶液(0ng/ml卡那霉素)的试纸条上的t线的颜色有明显的差异;在卡那霉素浓度为5~250ng/ml时t线颜色随卡那霉素浓度的增高而减弱,在卡那霉素浓度为250ng/ml时t线颜色基本没有变化,因此肉眼检测下限为15ng/ml,上限为250ng/ml。
[0097]
胶体金试纸定量分析仪读取不同浓度卡那霉素的相对强度,得到如图4所示(t/c)相对光信号强度与卡那霉素浓度的变化关系曲线,最低检测线为0.3ng/ml。其中在5~250ng/ml浓度范围内,(t/c)相对光信号强度与浓度存在线性关系,线性回归方程为y=
‑
0.1637x+0.4341,r2=0.9819,式中y为(t/c)相对光信号强度,x为卡那霉素的浓度的log函数(ng/ml)。
[0098]
实施例三:用试纸条对ota标准溶液的测定
[0099]
(1)ota标准溶液的制备
[0100]
ota标准溶液用running buffer(4
×
ssc,ph7)分别稀释终浓度为1、10、50、100、
250和500ng/ml。用超纯水将核苷酸序列如seq id no.1所示的ota适配体稀释至0.5μm。
[0101]
(2)ota核酸试纸条检测标准曲线的建立:
[0102]
将步骤(1)中99μl不同浓度的ota标准溶液与1μl ota适配体溶液混合孵育20min,混合反应后将混合液滴加入到样品垫进行检测,反应3min后测定(t/c)相对信号强度,建立(t/c)相对光信号强度与不同ota浓度之间对应关系的标准曲线。
[0103]
结果如图5所示,当ota浓度为10ng/ml时,试纸条上t线的颜色能与不含ota的溶液(0ng/ml ota)的试纸条上的t线的颜色有明显的差异;在ota浓度为1~250ng/ml时t线颜色随ota浓度的增高而减弱,在ota浓度为250ng/ml时t线颜色基本没有变化,因此肉眼检测下限为10ng/ml,上限为250ng/ml。
[0104]
胶体金试纸定量分析仪读取不同浓度ota的相对强度,得到如图6所示(t/c)相对光信号强度与ota浓度的变化关系曲线,最低检测线为0.18ng/ml。其中在1~250ng/ml浓度范围内,(t/c)相对光信号强度与浓度存在线性关系,线性回归方程为y=
‑
0.151x+0.4371,r2=0.9794,式中y为(t/c)相对光信号强度,x为ota的浓度的log函数(ng/ml)。
[0105]
实施例四:蜂蜜样品中卡那霉素残留的检测
[0106]
利用蜂蜜模拟样品来测试回收率,步骤为:
[0107]
(1)aunps@polya
‑
dna溶液预处理:将制备储藏的aunps@polya
‑
dna添加0.8~1.4μl体积至试纸条金标垫上,存储于4℃。
[0108]
(2)样品预处理:将蜂蜜样本稀释10倍,0.22μm微孔滤膜过滤。在蜂蜜中加入不同浓度的卡那霉素(50、150、250ng/ml);
[0109]
(3)蜂蜜中卡那霉素的回收率测定:取实施例1中核苷酸序列如seq id no.1所述的卡那霉素适配体(0.5μm)1μl与步骤(2)中含不同浓度卡那霉素的蜂蜜溶液99μl混合孵育20min,混合反应后再采用试纸条进行检测。
[0110]
应用实施例一制备得到的核酸适配体试纸条检测牛奶中卡那霉素的含量,结果如表4和图7所示。
[0111]
表4蜂蜜样品中卡那霉素残留的检测
[0112][0113]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1