一种获知贵金属增强荧光探针最佳精确距离的方法
1.本发明属于纳米粒子/量子点复合材料技术领域,涉及一种获知贵金属增强荧光探针最佳精确距离的方法,特别涉及一种贵金属纳米粒子表面等离子共振来提高量子点荧光强度的方法。
背景技术:
2.以贵金属纳米粒子的表面等离子共振来提高荧光材料的荧光强度,在光电子器件和生物医学领域具有广阔的前景。这些应用大多数都要求且受益于贵金属可控的表面等离子体激源共振(lspr)特性。即当光入射到贵金属纳米粒子上时,若入射光的频率与贵金属纳米粒子传导的电子整体振动频率匹配,则纳米粒子将对光子能量产生强烈的吸收作用,从而发生表面等离子体共振。在此过程中,若荧光材料与贵金属纳米粒子表面直接接触,会由于内部非辐射能量转移的影响,使贵金属纳米结构在增强荧光辐射的同时伴随淬灭效应。因此,通过在贵金属纳米粒子与荧光材料之间加入一层绝缘或半导体介质层,可有效抑制淬灭效应的同时,也会对吸附在其表面的荧光材料的信号起到放大作用。
3.近年来,人们通常都使用超薄的二氧化硅层作为绝缘隔层,一是因为该绝缘隔层可有效减弱荧光材料与贵金属纳米粒子直接接触时引起的荧光淬灭效应;另外,二氧化硅绝缘层也可在一定程度上增加探针对生物分子的吸附作用。
技术实现要素:
4.本发明的第一目的是为了克服现有技术的不足,提供一种获知贵金属增强荧光探针最佳距离的方法。
5.本发明一种获知贵金属增强荧光探针最佳距离的方法,具体包括如下:
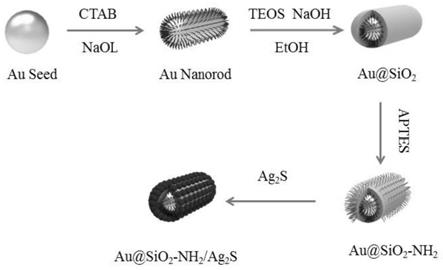
6.步骤(1)、通过分子结合力的方法制备一定壳层厚度的二氧化硅@金纳米颗粒;
7.在纳米金粒子溶液中加入表面活性剂,调节ph至10~11,混合均匀;然后在缓慢搅拌下继续加入一定用量的正硅酸乙酯
‑
乙醇溶液,构建在纳米金粒子周围形成均匀的3~25nm二氧化硅壳层厚度的二氧化硅@金纳米胶体溶液。
8.所述金纳米颗粒的形状为棒状,或球状;
9.作为优选,纳米金粒子采用纳米金棒,纳米金棒的长度为58~64nm,直径为18~23nm,最大吸收波长为770~790nm。
10.作为优选,所述表面活性剂采用十六烷基三甲基溴化铵(ctab),但不限于此;
11.作为优选,所述正硅酸乙酯
‑
乙醇溶液为正硅酸乙酯(teos)与乙醇的混合液;
12.作为优选,搅拌时间为22~24h;
13.作为优选,采用氨水调节ph值。
14.步骤(2)、通过分子结合力的方法,在二氧化硅壳层表面修饰氨丙基三乙氧基硅烷
15.将3
‑
氨丙基三乙氧基硅烷(aptes)添加到上述二氧化硅@金纳米胶体溶液中,并在室温下反应2~3h,接着在20~50℃加热1~3h,离心收集,洗涤得到氨丙基三乙氧基硅烷修
饰的二氧化硅@纳米金胶体溶液。
16.所述3
‑
氨丙基三乙氧基硅烷(aptes)与二氧化硅@金纳米胶体溶液的体积比为1:1000;
17.作为优选,离心参数如下:转速为7000rpm,时间为10min;
18.作为优选,采用乙醇和蒸馏水洗涤三遍;
19.作为优选,二氧化硅壳层表面修饰氨丙基三乙氧基硅烷的温度为30℃,时间为24h。
20.步骤(3)、将不同密度的ag2s量子点包覆在氨丙基三乙氧基硅烷修饰的二氧化硅@纳米金胶体溶液中二氧化硅表面,采用表面等离子体共振技术,使得ag2s量子点与纳米金之间的等离子体共振耦合,以达到荧光强度最大化,获知量子点与纳米金之间的最佳初步距离l1,以及量子点包覆在二氧化硅表面的最优密度。
21.作为优选,量子点包覆在二氧化硅表面的温度为20~25℃,时间为4~5h。
22.作为优选,ag2s量子点的密度为1.5~12.5ng/ml。
23.步骤(4)、不同链长dna耦合金纳米颗粒和ag2s量子点
[0024]4‑
1将金纳米颗粒与羟基标记的dna1(sh
‑
dna)混合孵育24h
‑
30h后,加入0.1%sds、1m nacl、ph=7.4的0.1m pb缓冲溶液,在30℃下再温育24h
‑
30h,得到dna1
‑
aunp;
[0025]4‑
2在ag2s qds生长溶液中加入硫代磷酸化的dna2,在90℃下反应12h,获得dna2
‑
ag2s qds。其中ag2s qds生长溶液由巯基丙酸、硝酸银构成,其ph=7.5。
[0026]4‑
3将dna1
‑
au np、dna2
‑
ag2s qds、pb缓冲液(0.01m,ph=7.4)中,然后在上述溶液中添加不同链长的dna3,在37℃下孵育2h。
[0027]
其中dna2
‑
ag2s qds以步骤3获知的量子点最优密度与dna1
‑
au np进行结合,达到荧光增强的效应。
[0028]4‑
4采用表面等离子体共振技术,利用ag2s量子点及金棒纳米粒子的等离子体特征峰耦合,可以达到荧光强度最大化,根据荧光强度进一步获知ag2s量子点与纳米金之间的最佳精确距离。
[0029]
所述的dna1与dna3满足碱基互补配对原则;dna2与dna3满足碱基互补配对原则;
[0030]
所述的dna3链长l2满足l1
‑
a<l2<l1+a,a为根据经验设定的参数。
[0031]
本发明的第二个目的是提供一种前列腺癌快速检测试剂盒,包括近红外ag2s量子点荧光探针;该近红外ag2s量子点荧光探针,包括dna耦合金纳米颗粒和dna耦合ag2s量子点。其中dna2
‑
ag2s qds采用量子点最优密度与dna1
‑
au np进行结合。
[0032]
作为优选,所述的前列腺癌标志物为pca3。
[0033]
dna耦合金纳米颗粒的制备过程是将金纳米颗粒与羟基标记的dna1(sh
‑
dna)混合孵育24h
‑
30h后,加入0.1%sds、1m nacl、ph=7.4的0.1m pb缓冲溶液,在30℃下再温育24h
‑
30h,得到dna1
‑
au np;
[0034]
dna耦合ag2s量子点的制备过程是在ag2s qds生长溶液中加入硫代磷酸化的dna2,在90℃下反应12h,获得dna2
‑
ag2s qds。其中ag2s qds生长溶液由巯基丙酸、硝酸银构成,其ph=7.5。
[0035]
在荧光强度最大化的二氧化硅厚度基础上,发现前列腺癌标志物pca3的序列恰好与优选的二氧化硅厚度匹配,因此进一步将该近红外ag2s量子点荧光探针用于开发了前列
腺癌标志物快速检测试剂盒。
[0036]
与现有技术相比,本发明的有益效果至少在于:
[0037]
1)本发明利用二氧化硅包覆金棒的方法,获得在水溶液中分散良好且形貌均一的金棒纳米颗粒@二氧化硅,同时可调控正硅酸乙酯的含量来获得厚度递增的金纳米颗粒@二氧化硅,厚度在3~25nm范围内可调;波长红移2~32nm。
[0038]
2)本发明利用不同密度量子点包覆金棒@二氧化硅,使得量子点与纳米颗粒之间的等离子体共振耦合,以达到荧光强度最大化。
[0039]
3)本发明在荧光强度最大化的二氧化硅厚度基础上,利用不同链长dna来精确调控金属纳米粒子与量子点之间的距离,进一步达到荧光强度最大化并提供一种前列腺快速检测试剂盒。
[0040]
4)本发明的金属纳米粒子表面等离子共振来提高荧光材料的发光信号结构新颖,易于制备,成本低廉,可被广泛应用于光电子器件,生物检测和医学等领域。
附图说明
[0041]
图1是实施例1是金纳米棒@二氧化硅,再用量子点包覆金纳米棒@二氧化硅棒示意图。
[0042]
图2是实施例1不同厚度金纳米棒@二氧化硅的紫外图。
[0043]
图3是实施例1金纳米棒的tem图。
[0044]
图4是实施例1不同金纳米棒@二氧化硅(a:3nm;b:5nm;c:8nm;d:10nm;e:25nm)标尺为:50nm。
[0045]
图5是实施例1不同金纳米棒@二氧化硅复合量子点的tem图(a:8nm b:25nm)。
[0046]
图6是实施例1金纳米棒@二氧化硅(8nm)复合不同量子点密度的tem图(a:1.5ng/ml,b:10.4ng/ml)。
[0047]
图7是实施例1量子点和金纳米棒@二氧化硅(8nm)复合量子点的荧光强度对比图。
[0048]
图8是实施例1不同dna链长对量子点的荧光强度对比图以及tem图(a:荧光强度对比图,b:5.33
±
0.18nm,c:6.64
±
0.26nm,d:7.98
±
0.31nm,e:9.29
±
0.16nm,f:10.65
±
0.28nm)。
具体实施方式
[0049]
下面结合具体实施例对本发明做进一步的分析。
[0050]
本发明一种获知贵金属增强荧光探针最佳距离的方法,具体包括如下:
[0051]
步骤(1)、通过分子结合力的方法制备一定壳层厚度的二氧化硅@金纳米颗粒;
[0052]
在纳米金粒子溶液中加入表面活性剂,调节ph至10~11,混合均匀;然后在缓慢搅拌下继续加入一定用量的正硅酸乙酯
‑
乙醇溶液,构建在纳米金粒子周围形成均匀的3~25nm二氧化硅壳层厚度的二氧化硅@金纳米胶体溶液。
[0053]
所述金纳米颗粒的形状为棒状,或球状;
[0054]
作为优选,纳米金粒子采用纳米金棒,纳米金棒的长度为58~64nm,直径为18~23nm,最大吸收波长为770~790nm。
[0055]
作为优选,所述表面活性剂采用十六烷基三甲基溴化铵(ctab),但不限于此;
[0056]
作为优选,所述正硅酸乙酯
‑
乙醇溶液为正硅酸乙酯(teos)与乙醇的混合液;
[0057]
作为优选,搅拌时间为22~24h;
[0058]
作为优选,采用氨水调节ph值。
[0059]
步骤(2)、通过分子结合力的方法,在二氧化硅壳层表面修饰氨丙基三乙氧基硅烷
[0060]
将3
‑
氨丙基三乙氧基硅烷(aptes)添加到上述二氧化硅@金纳米胶体溶液中,并在室温下反应2~3h,接着在20~50℃加热1~3h,离心收集,洗涤得到氨丙基三乙氧基硅烷修饰的二氧化硅@纳米金胶体溶液。
[0061]
所述3
‑
氨丙基三乙氧基硅烷(aptes)与二氧化硅@金纳米胶体溶液的体积比为1:1000;
[0062]
作为优选,离心参数如下:转速为7000rpm,时间为10min;
[0063]
作为优选,采用乙醇和蒸馏水洗涤三遍;
[0064]
作为优选,二氧化硅壳层表面修饰氨丙基三乙氧基硅烷的温度为30℃,时间为24h。
[0065]
步骤(3)、将不同密度的ag2s量子点包覆在氨丙基三乙氧基硅烷修饰的二氧化硅@纳米金胶体溶液中二氧化硅表面,采用表面等离子体共振技术,使得ag2s量子点与纳米金之间的等离子体共振耦合,以达到荧光强度最大化,获知量子点与纳米金之间的最佳初步距离l1,以及量子点包覆在二氧化硅表面的最优密度。
[0066]
作为优选,量子点包覆在二氧化硅表面的温度为20~25℃,时间为4~5h。
[0067]
作为优选,ag2s量子点的密度为1.5~12.5ng/ml。
[0068]
步骤(4)、不同链长dna耦合金纳米颗粒和ag2s量子点
[0069]4‑
1将金纳米颗粒与羟基标记的dna1(sh
‑
dna)混合孵育24h
‑
30h后,加入0.1%sds、1m nacl、ph=7.4的0.1m pb缓冲溶液,在30℃下再温育24h
‑
30h,得到dna1
‑
aunp;
[0070]4‑
2在ag2s qds生长溶液中加入硫代磷酸化的dna2,在90℃下反应12h,获得dna2
‑
ag2s qds。其中ag2s qds生长溶液由巯基丙酸、硝酸银构成,其ph=7.5。
[0071]4‑
3将dna1
‑
au np、dna2
‑
ag2s qds、pb缓冲液(0.01m,ph=7.4)中,然后在上述溶液中添加不同链长的dna3,在37℃下孵育2h。
[0072]
其中dna2
‑
ag2s qds以步骤3获知的量子点最优密度与dna1
‑
au np进行结合,达到荧光增强的效应。
[0073]4‑
4采用表面等离子体共振技术,利用ag2s量子点及金棒纳米粒子的等离子体特征峰耦合,可以达到荧光强度最大化,根据荧光强度进一步获知ag2s量子点与纳米金之间的最佳精确距离。
[0074]
所述的dna1与dna3满足碱基互补配对原则;dna2与dna3满足碱基互补配对原则;
[0075]
所述的dna3链长l2满足l1
‑
a<l2<l1+a,a为根据经验设定的参数。
[0076]
一种前列腺癌快速检测试剂盒,包括近红外ag2s量子点荧光探针;该近红外ag2s量子点荧光探针,包括dna耦合金纳米颗粒和dna耦合ag2s量子点。其中dna2
‑
ag2s qds采用量子点最优密度与dna1
‑
aunp进行结合。
[0077]
作为优选,所述的前列腺癌标志物为pca3。
[0078]
dna耦合金纳米颗粒的制备过程是将金纳米颗粒与羟基标记的dna1(sh
‑
dna)混合孵育24h
‑
30h后,加入0.1%sds、1m nacl、ph=7.4的0.1m pb缓冲溶液,在30℃下再温育
24h
‑
30h,得到dna1
‑
au np;
[0079]
dna耦合ag2s量子点的制备过程是在ag2s qds生长溶液中加入硫代磷酸化的dna2,在90℃下反应12h,获得dna2
‑
ag2s qds。其中ag2s qds生长溶液由巯基丙酸、硝酸银构成,其ph=7.5。
[0080]
如前所述,鉴于现有技术的不足,经长期研究和大量实践,本发明的技术方案创新有以下四点:(1)金棒表面等离子体共振可以增强量子点荧光强度;(2)金棒@二氧化硅,超薄的二氧化硅层作为绝缘隔层,有效减弱了量子点和金棒直接接触引起的荧光淬灭。(3)对于二氧化硅厚度的调控也是对金棒最大吸收波长的调控。(4)用不同dna链长精确调控金属纳米粒子与量子点的距离并提供一种前列腺快速检测试剂盒。(5)金属纳米粒子表面等离子共振来提高荧光材料的荧光强度,可被广泛应用于光学器件、生物检测和传感等领域。
[0081]
较为详细的讲,本发明通过二氧化硅与金棒纳米颗粒形成核壳结构,首先采用不同壳层厚度的金棒纳米金颗粒以及不同量子点密度量子点验证荧光增强的最佳距离和最优量子点密度。以此选择dna来精确调控最佳距离并提供一种前列腺快速检测试剂盒。如下将对该技术方案、其实施过程及原理等作进一步的解释说明。
[0082]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
[0083]
本发明实施例之中的一个方面提供了金属纳米粒子表面等离子共振来提高荧光材料的荧光强度的制备方法,其包括:
[0084]
通过分子结合力的方法,形成均匀的二氧化硅壳层。
[0085]
通过分子结合力的方法,使二氧化硅壳层表面修饰氨丙基三乙氧基硅烷。
[0086]
通过二氧化硅厚度的调控,将不同密度量子点包覆在二氧化硅表面,使得量子点与纳米颗粒之间的等离子体共振耦合,以达到荧光强度最大化。
[0087]
通过dna链长精确调控金属纳米粒子与量子点之间的距离,进一步达到荧光强度最大化并提供一种前列腺快速检测试剂盒。
[0088]
本发明对所述不同二氧化硅厚度参数进行调控,通过改变正硅酸乙酯的用量,控制金棒表面壳层厚度。通过壳层以及不同链长dna,防止金棒在增强荧光辐射时伴有猝灭效应。实现了金属纳米粒子表面等离子共振来提高荧光材料的荧光强度。
[0089]
所述纳米金颗粒指纳米金棒,但不限于此。例如,所述纳米金颗粒还可以适用于其他各种不同形貌、大小的纳米级颗粒。
[0090]
本发明的制备方法简单可控,通过二氧化硅厚度和不同链长dna,以及不同密度量子点等可调参数,可获得金属纳米粒子表面等离子共振来提高量子点的荧光强度。
[0091]
以下对本发明的技术方案作进一步的解释说明,但其中的实验条件和设定参数不应视为对本发明基本技术方案的局限。并且本发明的保护范围不限于下述的实施例。
[0092]
实施例1:不同形貌的纳米金用于金属纳米粒子表面等离子共振来提高量子点的荧光强度。
[0093]
以纳米金棒为例,在本发明的典型实施案例中,本发明可通过如下技术方案实现:
[0094]
(1)制备波长为780nm的纳米金棒:纳米金棒的合成是根据经典的种子生长法,主
要有2个步骤,包括:
[0095]
第一,晶种的合成:将5ml的氯金酸(0.5mm)溶液与5ml的十六烷基三甲基溴化铵(0.2m)溶液混合,快速注入0.6ml的硼氢化钠(10mm)溶液,剧烈搅拌(1200rpm)2min后得到黄褐色溶液,在室温下静置0.5h。
[0096]
第二,纳米金棒生长液的配置:称取9g的十六烷基三甲基溴化铵和1.234g的油酸钠于250ml的去离子水中溶解1h。在30℃条件下,往混合液中加入18ml的硝酸银溶液(1mm)和250ml的氯金酸(1mm)溶液,静置15min,溶液由黄色变为无色。然后开磁力搅拌(700rpm)90min。之后加入1.5ml的盐酸(37wt%)溶液,磁力搅拌(400rpm)15min后,加入1.25ml的抗坏血酸(64mm)溶液,剧烈搅拌(1200rpm)30s,快速加入50μl的上述晶种溶液,剧烈搅拌(1200rpm)30s后停止搅拌,将反应液置于30℃条件下静置12h。
[0097]
图3是金纳米棒的tem图。
[0098]
(2)不同厚度的au nrs@sio2的合成。
[0099]
使用去离子水通过离心(6500rpm,10min)洗涤10ml制备的au nrs 2次。除去上清液,并通过添加去离子水将沉淀稀释至10ml。向上述溶液中添加40μl ctab(1mm)和40μl的氨水(0.1m),以将溶液的ph调节至10.6。将溶液混合20min后,在30min的间隔下,在缓慢搅拌下,加入3次2μl,4μl,6μl,10μl,15μl,20μl的20%teos乙醇溶液注射液,然后将溶液在室温下混合24h。
[0100]
图2是不同厚度金棒@二氧化硅的紫外图。
[0101]
图4是不同金棒@二氧化硅(a:3nm;b:5nm;c:8nm;d:10nm;e:25nm)标尺为:50nm。
[0102]
(3)二氧化硅壳层表面修饰氨丙基三乙氧基硅烷。
[0103]
将10μlaptes添加到10ml金棒@二氧化硅的胶体溶液中,并将乙醇分散体在室温下反应3h,然后在50℃加热1h。然后,通过以7000rpm离心10min收集所得氨丙基三乙氧基硅烷修饰的金棒@二氧化硅,并用乙醇和蒸馏水洗涤三遍。
[0104]
(4)不同密度ag2sqds包覆金棒@二氧化硅。
[0105]
将100μl(1.5
‑
10.4ng/ml)ag2s qds的水溶液添加到400μl金棒@二氧化硅的胶体溶液中,通过添加双蒸馏水使胶体溶液的最终体积达到2ml。将水分散体在室温下至少反应5h,以获得ag2s qds修饰的金棒@二氧化硅。量子点与纳米金之间的等离子体共振耦合,以达到荧光强度最大化,获知量子点与纳米金之间的大致距离为8nm,以及量子点包覆在二氧化硅表面的最优密度为10.4ng/ml。
[0106]
图1是金棒@二氧化硅,再用ag2s qds包覆金棒@二氧化硅示意图。
[0107]
图5是不同金棒@二氧化硅复合量子点的tem图。(a:8nm b:25nm)。
[0108]
图6是金棒@二氧化硅(8nm)复合不同量子点密度的tem图。
[0109]
图7是量子点和金棒@二氧化硅(8nm)复合量子点的荧光强度对比图。
[0110]
(5)不同链长dna耦合dna
‑
金棒和dna
‑
ag2s qds。
[0111]5‑
1制备dna标记的au nrs(dna
‑
au nrs)。
[0112]
首先,将平均长宽比为3.0的0.7mlaunrs稀释至1ml,并离心几次,与74μl和100μm sh
‑
dna1(tttcttatttc
‑
c3
‑
sh)混合。dna1孵育24h后,将155μl的0.1%sds,32.5μl的1m nacl和155μl的0.1m pb缓冲溶液(ph=7.4)添加到aunrs和dna1溶液中。在30℃下再温育24h后,将产物在6500rpm下离心10min,然后重新分散在pb缓冲液中以备后用。
[0113]5‑
2制备dna标记的ag2s qds(dna
‑
ag2s qds)。
[0114]
根据上述ag2s qds的制备方法,首先获得ph=7.5的生长溶液:硝酸银0.6mmol和巯基丙酸1000μl。然后取800μl生长溶液,并加入硫代磷酸化的dna2(100μm)(g*g*g*g*g*g*g*g*g*g*aaagtcagcagcc,即末端10个碱基硫代磷酸化修饰),在90℃下反应12h,获得dna2
‑
ag2s qds。使用amicon
‑
ultra离心过滤器(截留分子量为3000da)用去离子水洗涤获得的dna2
‑
ag2s qds,并在4℃的黑暗环境中存储。
[0115]5‑
3将0.02nm dna1
‑
au nr和20μl 10.4ng/ml dna2
‑
ag2s qds添加到2ml pb缓冲液(0.01m,ph=7.4)中,然后在上述溶液中添加不同链长的dna3(分别是taagaaaggctgct;aataagaaaggctgctga;ttgaaataagaaaggctgctgactaa;aattgaaataagaaaggctgctgactaagg),在37℃下孵育2h。将产物以8000rpm离心10min,然后重新分散在pb缓冲液中以备进一步使用。
[0116]5‑
4通过荧光强度检测可知dna链长为8.16nm,荧光强度达到最大。前列腺癌标志物pca3链长正好在8.16nm左右,即可认为近红外ag2s量子点荧光探针可用于前列腺癌标志物快速检测。
[0117]
图8是不同dna链长对量子点的荧光强度对比图以及tem图。
[0118]
综上所述,本发明通过金纳米颗粒表面包覆二氧化硅颗粒,形成金棒纳米@二氧化硅核壳结构。再基于量子点及金棒纳米粒子的等离子体特征峰耦合,可以达到荧光强度最大化。本发明通过二氧化硅与金棒纳米颗粒形成核壳结构,首先采用不同壳层厚度的金棒纳米金颗粒以及不同量子点密度量子点验证荧光增强的最佳距离和最优量子点密度。以此选择dna来精确调控最佳精准距离。
[0119]
应当指出,以上所述本发明的具体实施方式,并不构成对本发明保护范围的限定。任何根据本发明的技术构思所作出的各种其他相应的改变与变形,均应包含在本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1