一种电化学生物传感器及其应用
1.本发明涉及一种电化学生物传感器及其应用,具体涉及基于电诱导电活性染料以及蛋白的空间位阻效应构建均相电化学生物传感器,及其应用于血清中识别雌激素受体(er)、孕激素受体(pr)、人表皮生长因子受体-2(her-2)和细胞增殖生物标志物(ki-67)四种生物标志物以及应用于血清中乳腺癌分型检测的方法。
背景技术:
2.现有技术中,基于基因芯片、免疫组化、基因组学等检测手段识别雌激素受体(er)、孕激素受体(pr)、人表皮生长因子受体-2(her-2)和细胞增殖生物标志物(ki-67)四种生物标志物的方法都存在明显的不足。要么只能对一些关键分子进行定性和半定量研究。关键分子与临床信息之间的相互关系无法实时显示,难以准确揭示肿瘤进展过程,难以在宏观形态上综合评价肿瘤侵袭行为。更重要的是,这些技术需要从体内提取和处理肿瘤细胞或组织标本,失去了原发肿瘤的三维信息,侵入性检测方法可能导致肿瘤转移。
3.尽管本领域研究人员专注于在同一系统上检测单个或多个生物标志物,但目前还没有同时检测四种生物标志物以在血清中通过检测her2、er、pr和ki67来分析乳腺癌分子类型的电化学平台。
技术实现要素:
4.针对现有技术存在的上述不足,本发明的目的在于提供一种电化学生物传感器及其应以获得高灵敏度检测结果,特别是同时检测血清中的雌激素受体(er)、孕激素受体(pr)、人表皮生长因子受体-2(her-2)和细胞增殖生物标志物(ki-67)四种生物标志物并进行乳腺癌分子分型诊断。
5.为了解决上述技术问题,本发明采用如下技术方案:一种电化学生物传感器,其特征在于,采用多孔uio-66-nh2作为纳米容器负载电活性碱性染料-nr、tb、tmb和mg,具体为nr@uio-66 、tb@uio-66、tmb@uio-66、mg@uio-66)。进一步,其制备方法包括:(1)uio-66-nh2的制备:将215 mg氨基对苯二甲酸和75 mg氯化锆溶解在20 ml dmf和1.5 ml乙酸的混合溶液中,超声15分钟;将混合溶液转移到反应器中,在120℃的高温下水热反应8小时;反应结束后,自然冷却至室温的uio-66-nh2产物干燥,10000rpm离心10min。然后用无水乙醇洗涤产物并真空干燥;(2)吸附电活性染料:取5mguio-66-nh2纳米颗粒分别与25 ml染料-nr、tb、tmb和mg混合物的溶液将20 mg/l的浓度(每种染料10 mg/l)混合,得到nr@uio-66 、tb@uio-66、tmb@uio-66、mg@uio-66;在25℃下吸附三小时后,吸附剂被分离,uv-vis进行光谱分析以确定染料浓度;(3)修饰抗体:将1 ml的0.1 m edc(1-乙基-(3-二甲基氨基丙基)碳酰二亚胺)分别加入1 ng/ml的200 ul her2、er、ki67和pr抗体溶液中(用pbs溶液稀释原液得到);edc与
抗体的羧基反应,在室温下30分钟内产生活性酯中间体;之后,将0.1m nhs(n-羟基琥珀酰亚胺)和0.015 g nr@uio-66 、tb@uio-66、tmb@uio-66、mg@uio-66;重新悬浮到上述相应的溶液中,使 uio-66-nh2在4℃搅拌16小时;然后将溶液离心,再分别用0.01 m pbs洗涤六次;离心后,未反应的基团用bsa(牛血清蛋白)溶液封闭,用pbs缓冲液洗涤,得到her2-antibody@nr@uio-66、er-antibody@tb@uio-66、ki67-antibody@tmb@uio-66、pr
ꢀ‑
antibody@mg@uio-66探针;最后将上述四种uio-66探针混合后放入冰箱冷藏备用。
6.本发明还提供一种电化学生物传感器的应用,采用上述电化学生物传感器用于血清中识别雌激素受体(er)、孕激素受体(pr)、人表皮生长因子受体-2(her-2)和细胞增殖生物标志物(ki-67)四种生物标志物。
7.进一步,用于血清中识别所述四种生物标志物的方法,包括如下步骤:(1)将ito电极逐渐放入洗涤剂溶液(8g/l)、异丙醇、丙酮和超纯水中20分钟,确保电极表面清洁干净;然后将ito电极浸入氢氧化钠溶液(1mm)中,室温浸泡5小时,使电极表面带负电;再次用超纯水超声20分钟,用氮气吹干,保存备用;(2)混合10 μl四种不同浓度的染料@mof材料样品,加入100pg/ml her2、er、pr和ki67四种目标蛋白,混合液37℃孵育60分钟;离心后,再分散于等体积的pbs溶液中,然后加入三电极体系(氯化银作为参比电极,铂丝作为对电极,ito作为工作电极),以-0.3 v,200 s为周期进行扫描;再利用电化学工作站测量ito电极表面的dpv信号,观察蛋白质浓度对swv信号的影响;(3)将10ul含有所述四种生物标志物的血清样品稀释在90ul的0.01m pbs溶液中,进行检测,电化学测量程序与上述四种生物标志物检测的程序一致。
8.相比现有技术,本发明具有如下有益效果:1、本发明提供的基于电诱导电活性染料和蛋白质的空间位阻的新型电化学均相生物传感平台,用于同时检测血清中的四种参数指标;采用多孔uio-66-nh2作为纳米容器负载电活性碱性染料-nr、nb、tmb和mg(染料与uio-66纳米材料之间的表面力为∏-∏)(nr@uio 、tb@uio、tmb@uio、mg@uio)。由于碱性染料与ito电极(表面带负电)之间的相互吸引力小于染料与mof材料表面的相互作用,在均相溶液中,ito表面不会吸附或吸附少量阳离子染料的量。在ito电极上施加负电压后,由于负电压可以吸收正电荷,负电压与正电荷之间的作用力大于染料与mof材料表面的相互作用力,在均质溶液中,因此ito电极的负电压会吸引表面大量的阳离子染料。由于抗体修饰在mof材料表面,在均相溶液中,当施加负电压的ito电极吸附正电荷染料时,材料表面的抗体会形成位阻,减慢染料的扩散数量,减小到达 ito 表面的速度。当抗体与目标蛋白连接时,空间位阻变大,染料扩散速度更慢。同时,到达ito表面的阳离子染料数量减少,导致电化学信号减弱。差分脉冲伏安法(dpv)电流强度的变化取决于ito电极表面的阳离子染料的数量,而ito电极表面的阳离子数量取决于电阻的大小,电阻的大小与靶蛋白数量呈正相关。将位阻与阳离子染料的数量联系起来实现了无需固定化对癌症生物标志物的电化学检测。
9.2、该电化学生物传感器检测灵敏度高,灵敏度高达pg/ml,响应时间为分钟。并且,本发明免固定化电化学生物传感方法在实际样品中也具有良好的传感性能。与其他传感策略相比,该电化学平台只需要一个抗体探针,信号不改变,反应只需一步,时间更短,操作步骤简单。它为乳腺癌分型分析提供了一种快速、灵敏的方法。
10.综上所述,与传统的基因芯片和免疫组化技术相比,乳腺癌类型的诊断和治疗从组织转移到体液,这意味着每种类型的乳腺癌的诊断和治疗都未来可以在细胞、基因和分子水平上实现无创、实时、动态、多组分、定量、长期精准监测,能够及时有效地反映各类乳腺癌相关生物分子的变化,检测人血清分子水平表达,提取利用生物信息学技术分析信息,为肿瘤分子分型、体内病程监测、体内基因治疗追踪、体内药物疗效评价、个体化诊断提供新的支撑平台。这在乳腺癌分型诊断上具有重大突破和意义。并且采用小型便携式电化学传感器,可作为普通医疗机构临床检测的常规设备。此外,使用小型便携式电化学传感设备检测体液中的临床标准乳腺癌分型生物标志物进行乳腺癌分型诊断意味着使用组织分型将不再是临床上的唯一途径。这将通过体液诊断的方法大大提高四种生物标志物的检测效率。
附图说明
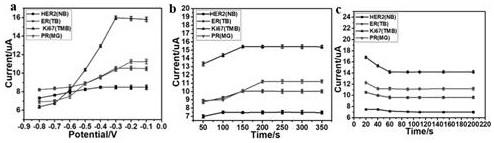
11.图1中,(a)为负电压对实验条件影响的优化,(b)为施加负电压的时间,(c)为蛋白质抗体孵育时间。a-c:10 pg/ml her2、er、ki67 和 pr 的dpv,误差线是三个连续测量的标准偏差。
12.图2中,(a)电化学生物传感器的dpv响应,用于在0
ꢀ‑ꢀ
0.035 ng/ml 的浓度范围内同时分析 her2、er、ki67和pr。(b)为对应于panel的her2、er、ki67和pr各自的校准曲线。
具体实施方式
13.下面将结合实施例及附图对本发明作进一步说明。
14.一种电化学生物传感器及其应用,具体包括:1.1 试剂和材料。
15.2-氨基对苯二甲酸 (》98%)、氯化锆 (zrcl4,≥99.9%)、n,n-二甲基甲酰胺 (dmf)、乙醇、中性红 (nr)、氯化甲苯 (tb)、四甲基联苯胺 (tmb)、孔雀石绿 ( mg)。所有试剂均购自 adamas reagent(中国上海)。 水溶液使用来自 millipore 系统的超纯水 (≥18 mω cm-1) 制备。 所有试剂均购自阿拉丁试剂公司。兔抗人pr多克隆抗体、兔抗人er多克隆抗体、兔抗人ki67多克隆抗体和兔抗人her2多克隆抗体购自上海生工生物技术有限公司。 来自重庆大学肿瘤医院(中国重庆)的乳腺癌人血清样本。
16.1.2 设备所有电化学免疫测定测量均在 chi 842c 电化学工作站(中国上海)上进行。 autolab 电化学工作站(metrohm,荷兰)用于 dpv 实验。实验采用传统的三电极系统:分别为ito工作电极、ag/agcl参比电极和铂丝对电极。在所有电化学实验之前测量系统的开路或静止电位,以防止自组装单层中与电位相关的突然变化。重庆大学分析测试中心x射线衍射(xrd)透射电子显微(tem)图像/傅里叶变换红外光谱(ft-ir)表征及重庆大学大型设备共享基金。
17.1.3 uio-66-nh2的制备首先,将 215 mg 氨基对苯二甲酸和 75 mg 氯化锆溶解在 20 ml dmf 和 1.5 ml 乙酸的混合溶液中,超声 15 分钟。接下来,将混合溶液转移到反应器中,在120℃的高温下水热反应8小时。反应结束后,自然冷却至室温的uio-66-nh2产物干燥,10000rpm离心
10min。然后用无水乙醇洗涤产物并真空干燥。
18.1.4吸附电活性染料5mg uio-66-nh2纳米颗粒和25 ml染料-nr、nb、tmb和mg混合物的溶液将20 mg/l的浓度(每种染料10 mg/l)混合以评估纳米颗粒的选择性和分离行为。在25℃下吸附三小时后,吸附剂被分离,uv-vis进行光谱分析以确定染料浓度。
19.1.5 修饰抗体。
20.将 1 ml 体积的 0.1 m edc(1-乙基-(3-二甲基氨基丙基)、碳酰二亚胺分别加入 1 ng/ml 的 200 ul her2、er、ki67 和 pr 抗体溶液中;edc与抗体的羧基反应,在室温下30分钟内产生活性酯中间体;之后,将 0.1m nhs 和 0.015 g nr@uio-66、tb@uio-66、tmb@uio-66 和 mg@uio-66重新悬浮到上述相应的溶液中,使 uio-66和氨基分别在4℃搅拌16小时;接下来,将溶液离心,然后分别用0.01 m pbs洗涤六次;离心后,未反应的基团用bsa(牛血清蛋白)溶液封闭,用pbs缓冲液洗涤,得到her2-antibody@nr@uio-66、er-antibody@tb@uio-66、ki67-antibody@tmb@uio-66、pr
ꢀ‑
antibody@mg@uio-66 探针;最后将上述四种uio-66探针混合后放入冰箱冷藏备用。
21.1.6 电化学测量1.6.1 ito电极负电荷的清洗和改性首先,将ito电极逐渐放入洗涤剂溶液(8g/l)、异丙醇、丙酮和超纯水中20分钟,确保电极表面清洁干净;然后将ito电极浸入氢氧化钠溶液(1mm)中,室温浸泡5小时,使电极表面带负电;然后再次用超纯水超声20分钟,用氮气吹干,保存备用。
22.1.6.2 四种生物标志物,即雌激素受体(er)、孕激素受体(pr)、人表皮生长因子受体-2(her-2)和细胞增殖生物标志物(ki-67)的同时检测和乳腺癌的分型。
23.首先混合10 μl四种不同浓度的染料@mof材料样品,加入四种目标蛋白,混合液37℃孵育60分钟;离心后,再分散于等体积的pbs溶液中,然后加入三电极体系(氯化银作为参比电极,铂丝作为对电极,ito作为工作电极),以-0.3 v,200 s为周期进行扫描。最后,利用电化学工作站测量ito电极表面的dpv信号,探讨蛋白质浓度对swv信号的影响。
24.1.7 电化学生物传感器在人血清中的分析应用将10ul乳腺癌患者血清样品(已通过人类伦理认证)稀释在90ul的0.01m pbs溶液中。并且电化学测量程序与上述四种生物标志物检测的程序一致。
25.2结果与讨论2.1 四种标志物同时检测及乳腺癌类型检测原理:参见图1,为电化学均相检测的工作原理。本发明提出了一种电感应电活性染料信号。目标形成阻抗及其传感策略可归因于碱性染料与 ito 电极之间的相互作用(表面带负电)吸引效应与染料与表面相互作用力差异的比较mof 材料和抗体靶向蛋白质前后的位阻变化,导致扩散到 ito 表面的染料数量发生变化。由于碱性染料与ito电极(表面带负电)之间的相互吸引力小于染料与mof材料表面的相互作用,在均相溶液中,ito表面不会吸附或吸附少量阳离子染料的量。在ito电极上施加负电压后,由于负电压可以吸收正电荷,负电压与正电荷之间的作用力大于染料与mof材料表面的相互作用力,在均质溶液中,由于ito电极的负电压会吸引表面大量的阳离子染料。值得注意的是,由于抗体被mof材料表面的氨基修饰,在均相溶液中,当施加负电压的ito电极吸附正染料时,材料表面的抗体会形
成位阻,减慢染料的扩散。到达 ito 表面的速度。当抗体与目标蛋白连接时,空间位阻变大,染料扩散速度更慢。同时,到达ito表面的阳离子染料数量减少,导致电化学信号减弱。结果表明,差分脉冲伏安法(dpv)电流强度的变化取决于ito电极表面阳离子染料的数量,而ito电极表面阳离子的数量取决于其尺寸位阻,从而实现无固定的癌症生物标志物的电化学。该检测方法实现了对雌激素受体(er)、孕激素受体(pr)、人表皮生长因子受体-2(her-2)和细胞增殖生物标志物(ki-67)四种生物标志物的灵敏检测的电化学简单、快速、灵敏的均相检测。
26.2.2 实验条件优化为了确定灵敏度分析的最佳条件,确定了用于同时检测使用染料作为响应信号的多种生物标志物蛋白质的分析参数。由于负电压的大小、施加时间和孵育时间对电化学响应信号有直接影响,首先研究了负电压、施加负电压的时间、蛋白质抗体孵育时间的影响。
27.从-0.1 到-0.8 v 检查负电压的影响。图中显示了负电压对电化学响应信号的影响。可以看出,四种生物标志物蛋白的响应峰值电流随着负电压值的增大先增大后减小,直至峰值电流最大。
28.图1显示了电化学生物传感器和生物标志物靶标之间孵育时间的影响。乳腺癌类型her2、er、ki-67和pr(nr、tb、tmb和mg)的电流信号随着孵育时间的增加而增加,并在100分钟、150分钟、200分钟和150分钟时达到变化值。
29.为了实现电化学生物传感器的最佳性能,优化了一些实验参数,主要是抗体和抗原之间的孵育时间。因此,还优化了每种类型生物标志物蛋白的表达,因为每种抗体和抗原的反应时间不一致。
30.实验结果表明,负电压为-0.3 v,施加负电压时间为200 s,蛋白抗体孵育时间为60 min。免疫传感系统产生的电流响应信号最大。
31.2.3 电化学生物传感器的电化学检测的性能在优化条件下,如图 2a所示,四个nr、tb、tmb和 mg(氧化峰电位分别为
ꢀ‑
0.6 v,-0.25 v,0.3 v 和 0.8 v)作为 dpv 的响应信号峰其中四个峰显着且独立,窄而尖锐,尽管金属离子会生成合金并产生新的峰,但不影响检测结果。与空白样品相比dpv 电流峰强度明显减小,这可能是由于越多的目标分析物阻碍了更多的电活性分子到达电极表面,从而降低了 dpv电流强度。结果表明,电化学生物传感器可以同时检测一个系统的四种生物标志物。
32.最后需要说明的是,以上实施例仅用以说明本发明的技术方案而非限制技术方案,本领域的普通技术人员应当理解,那些对本发明的技术方案进行修改或者等同替换,而不脱离本技术方案的宗旨和范围,均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1