一种检测ATP的荧光比率传感器及其制备方法与应用
一种检测atp的荧光比率传感器及其制备方法与应用
技术领域
1.本发明涉及荧光比率传感器领域。更具体地,涉及一种检测atp的荧光比率传感器及其制备方法与应用。
背景技术:
2.atp在细胞内发挥着重要的作用,参与了蛋白合成,信号交流,细胞运动等多种生命过程。多种病理学现象中都观察到了atp水平的异常化。因此,检测细胞内atp水平对于了解atp相关的生理学和病理学过程有着重要的作用。
3.由于细胞内各个细胞器和细胞位点所发生的生物化学反应不同,生物化学反应的剧烈程度不同,atp在各个细胞器和细胞位点的浓度水平表现出差异性。此外,atp相关的生理学和病理学过程大多涉及到多个细胞器和多个细胞位点。因此,如果想要全面的了解一个atp过程,必须赋予传感器较高的空间分辨率,同时能够实现细胞内多细胞位点的同步检测。目前的纳米颗粒传感器存在空间漂移等问题,降低了纳米颗粒传感器的空间分辨率和检测准确性。
4.基于此,需要开发出一种多细胞位点的atp高分辨检测传感器,为探究atp相关生理学和病理学过程提供有效的工具。
技术实现要素:
5.本发明的一个目的在于提供一种检测atp的荧光比率传感器,该荧光比率传感器对atp具有良好的比率响应,优异的选择性,可逆性以及光稳定性,可以实现单细胞内不同位点atp的高空间分辨检测。
6.本发明的第二个目的在于提供一种检测atp的荧光比率传感器的制备方法。
7.本发明的第三个目的在于提供上述荧光比率传感器的应用。
8.为达到上述目的,本发明采用下述技术方案:
9.第一方面,本发明提供一种检测atp的荧光比率传感器,所述荧光比率传感器的结构中包括单根硅纳米线,包裹在所述单根硅纳米线表面的异硫氰酸荧光素@sio2壳层,以及修饰在壳层表面的罗丹明b二亚乙基三胺荧光分子。
10.本发明选择了两种对atp敏感的荧光分子,其中一种为异硫氰酸荧光素(fitc),fitc的荧光强度随atp浓度增加而降低,另一种为罗丹明b二亚乙基三胺(rho-n3h5),其荧光强度随atp浓度的增加而上升。
11.可选的,所述修饰为通过共价键结合。
12.可选的,所述单根硅纳米线的直径为100-300nm,长度为60-70μm。
13.第二方面,本发明提供了一种检测atp的荧光比率传感器的制备方法,该方法包括如下步骤:
14.(1)将羟基化硅纳米线分散在水溶液中,加入异硫氰酸荧光素-氨丙基三乙氧基硅烷和正硅酸乙酯,避光搅拌,减压抽滤,得到表面包裹异硫氰酸荧光素@sio2壳层的硅纳米
线;
15.(2)将步骤(1)获得的硅纳米线进行羧基功能化处理,然后通过共价键结合的方式修饰罗丹明b二亚乙基三胺,得到所述检测atp的荧光比率传感器。
16.进一步的,在步骤(1)中,所述羟基化硅纳米线的制备包括如下步骤:制备硅纳米线阵列,对其表面进行羟基化处理,随后将单根硅纳米线从硅纳米线阵列上剥离,得到羟基化硅纳米线。
17.进一步的,所述硅纳米线阵列可以通过银离子辅助化学刻蚀法制备。
18.根据本发明的具体实施方式,利用ag
+
辅助的化学刻蚀方法制备硅纳米线阵列的步骤是将清洗洁净的硅片放置在硝酸银、氢氟酸和水的混合溶液中浸泡,浸泡时间例如但不限于8-10min,使硅片上沉积一层银颗粒;再在氢氟酸、双氧水和水的混合溶液中刻蚀得到硅纳米线阵列,所述硅纳米线阵列中硅纳米线的平均长度60-70μm,平均直径在100-300nm。所述刻蚀温度为40-60℃,时间为60-70min。
19.进一步的,所述对硅纳米线阵列表面进行羟基化处理是将硅纳米线阵列浸泡在浓硫酸和双氧水混合溶液中,加热回流,清洗干净后,浸泡在水、氨水和30%双氧水的混合溶液中,清洗干净后,干燥得到羟基化的硅纳米线阵列。
20.根据本发明的具体实施方式,上述羟基化处理过程中,加热回流的时间为1-2h;浸泡的时间为3-10h;所述浓硫酸和双氧水的体积比为3-5:1,所述浓硫酸为浓度为18.4mol/l。所述h2o、30%h2o2和氨水的体积比为5:1:1。
21.进一步的,根据本发明的具体实施方式,所述羟基化硅纳米线与异硫氰酸荧光素-氨丙基三乙氧基硅烷的反应,是取一定量的羟基化硅纳米线分散在水溶液中(例如,分散浓度0.2mg/ml),调节体系ph(例如,ph调节至10-11),随后加入一定体积的异硫氰酸荧光素-氨丙基三乙氧基硅烷溶液,避光搅拌30min后,以30min时间间隔分三次加入20%正硅酸乙酯甲醇溶液,继续避光搅拌过夜,得到表面包裹异硫氰酸荧光素@sio2壳层的硅纳米线。可选的,羟基化硅纳米线分散液与异硫氰酸荧光素-氨丙基三乙氧基硅烷溶液体积比为5ml:20-80μl。
22.进一步的,在步骤(2)中,所述羧基功能化处理是将步骤(1)获得的硅纳米线分散在pbs缓冲溶液中,加入羧基乙基硅烷三醇钠溶液,避光搅拌,减压抽滤,得到羧基功能化处理的表面包裹异硫氰酸荧光素@sio2壳层的硅纳米线。
23.根据本发明的具体实施方式,步骤(1)获得的硅纳米线在pbs缓冲液中的分散浓度为0.2mg/ml。所述硅纳米线分散液与羧基乙基硅烷三醇钠溶液(25wt.%)的体积比为5ml:60μl。
24.进一步的,在步骤(2)中,所述通过共价键结合的方式修饰罗丹明b二亚乙基三胺是将羧基功能化处理的表面包裹异硫氰酸荧光素@sio2壳层的硅纳米线分散在水溶液中,加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺和n-羟基琥珀酰亚胺磺酸钠盐溶液,预活化,然后加入罗丹明b二亚乙基三胺,避光反应,得到所述检测atp的荧光比率传感器。
25.根据本发明的具体实施方式,所述通过共价键结合的方式修饰罗丹明b二亚乙基三胺是将一定量的羧基功能化处理的表面包裹异硫氰酸荧光素@sio2壳层的硅纳米线分散在水溶液中(例如,分散浓度为0.2mg/ml),加入一定体积的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺和n-羟基琥珀酰亚胺磺酸钠盐溶液,预活化30分钟,然后加入一定浓度的罗丹明b
二亚乙基三胺,避光反应24小时,减压抽滤,真空干燥,得到所述检测atp的荧光比率传感器。可选的,所述羧基功能化处理的表面包裹异硫氰酸荧光素@sio2壳层的硅纳米线分散液与1-乙基-(3-二甲基氨基丙基)碳酰二亚胺和n-羟基琥珀酰亚胺磺酸钠盐溶液的体积比为5ml:200μl。其中,1-乙基-(3-二甲基氨基丙基)碳酰二亚胺和n-羟基琥珀酰亚胺磺酸钠盐溶液中,1-乙基-(3-二甲基氨基丙基)碳酰二亚胺的浓度为10mg/ml,n-羟基琥珀酰亚胺磺酸钠的浓度为10mg/ml。
26.进一步的,所述异硫氰酸荧光素-氨丙基三乙氧基硅烷是将异硫氰酸荧光素溶解在乙醇溶液中,加入氨丙基三乙氧基硅烷,避光搅拌,得到异硫氰酸荧光素-氨丙基三乙氧基硅烷。根据本发明的具体实施方式,所述异硫氰酸荧光素在乙醇溶液中的溶解浓度为2mg/ml;所加入的氨丙基三乙氧基硅烷与乙醇溶液的体积比为1:100;反应的搅拌速度为1000-1500rpm;反应时间为4-5h。
27.进一步的,所述罗丹明b二亚乙基三胺是将罗丹明b溶解在乙醇溶液中,加入二亚乙基三胺,80-90℃剧烈回流,得到罗丹明b二亚乙基三胺。
28.第二方面,本发明提供上述荧光比率传感器在检测单细胞内atp浓度中的应用。
29.进一步的,所述应用包括单细胞内不同位点atp浓度的同步检测。
30.根据本发明的具体实施方式,在进行单细胞内不同位点atp浓度检测时,包括如下步骤:
31.(1)将所述荧光比率传感器置于不同atp浓度的环境中,利用共聚焦荧光显微镜成像,获得不同atp浓度下的荧光比率值,以atp浓度为横坐标,以荧光比率值为纵坐标建立荧光比率值随atp浓度变化的体外标准曲线,其中,荧光比率值=橙色荧光强度/绿色荧光强度;
32.(2)将所述传感器的选择性,光稳定性,循环可逆性进行相关测试,评估其应用于细胞内atp检测的可行性;
33.(3)将所述荧光比率传感器与细胞共孵育,利用共聚焦荧光显微镜成像,判断所述荧光比率传感器与细胞的空间位置关系;
34.(4)根据(3)中的判据,观察孵育进细胞内的荧光比率传感器,找出荧光比率传感器同时穿过细胞核和细胞质的样品,获得单细胞内细胞核和细胞质区域的荧光比率值;
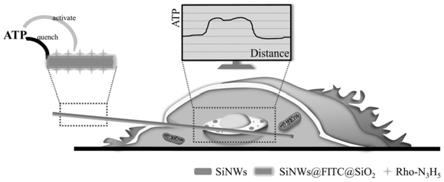
35.(5)根据体外标准曲线和步骤(4)获得的荧光比率值得到单细胞内细胞核和细胞质区域的atp浓度。
36.进一步的,通过细胞核染色区分单细胞内细胞质和细胞核部分,该传感器实现了细胞核和细胞质区域atp水平的高空间分辨检测。
37.进一步的,利用共聚焦荧光显微镜对本发明的荧光比率传感器的绿色荧光和橙色荧光的荧光强度进行成像,使用波长为488nm和561nm的激光器,使用的二向色镜为402/488/561nm,使用的滤波片为515/30nm和585/65nm。
38.本发明利用共聚焦荧光显微镜对荧光比率传感器在细胞内不同细胞位点的荧光强度进行成像并获得荧光比率值。不同的荧光比率值代表不同的atp浓度,通过检测本发明荧光比率传感器不同位置处的荧光比率值,得到不同细胞位置的atp水平分布。
39.本发明的有益效果如下:
40.本发明检测atp的荧光比率传感器以单根硅纳米线为基底,能够利用同一材料,同
时检测单细胞内细胞核和细胞质区域的atp水平。同时,采用荧光比率值作为检测指标,能够有效消除荧光分子分布不均所引起的误差。由于一维纳米结构具有微米级长度,测试过程中传感器的空间漂移小,极大提高了传感器的空间分辨率,能更加准确地测量单细胞内特定细胞位点处的atp水平和变化,同时,能够实现在不同细胞活动中,不同细胞位点atp水平的高分辨检测。
41.本发明检测atp的荧光比率传感器的制备方法简单,可进行批量生产。
附图说明
42.下面结合附图对本发明的具体实施方式作进一步详细的说明。
43.图1示出基于单根硅纳米线检测atp的荧光比率传感器的结构以及工作原理示意图。
44.图2示出硅纳米线阵列的扫描电镜图。
45.图3示出sinws,sinws@fitc@sio2和sinws@fitc@sio
2-rho的透射电镜图。
46.图4示出sinws,sinws@fitc@sio2和sinws@fitc@sio
2-rho的共聚焦图像。
47.图5示出检测atp的荧光比率传感器在不同atp浓度下的共聚焦图像。
48.图6示出检测atp的荧光比率传感器荧光比率值随atp浓度的体外标准曲线。
49.图7示出检测atp的荧光比率传感器对atp的选择性。
50.图8示出检测atp的荧光比率传感器的光稳定性。
51.图9示出检测atp的荧光比率传感器的循环可逆性。
52.图10示出检测atp的荧光比率传感器在细胞内和细胞外的共聚焦图像。
53.图11示出检测atp的荧光比率传感器在单细胞内高空间分辨检测不同细胞位点处的atp浓度图。
具体实施方式
54.为了更清楚地说明本发明,下面结合优选实施例和附图对本发明做进一步的说明。附图中相似的部件以相同的附图标记进行表示。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
55.本发明检测atp的荧光比率传感器是以单根硅纳米线(sinws)为基底,在所述单根硅纳米线表面包裹异硫氰酸荧光素@sio2壳层(fitc@sio2),以及在壳层表面修饰罗丹明b二亚乙基三胺荧光分子(rho-n3h5)得到的(sinws@fitc@sio
2-rho),可用于单细胞内atp的检测,具体工作原理如图1所示,将所述荧光比率传感器与细胞进行共孵育后,观察荧光比率传感器在单细胞内的位置,同时测量单细胞内不同细胞位点的荧光比率值,即可计算出不同细胞位点的atp浓度。
56.下述实施例详述了检测atp的荧光比率传感器的制备方法及单细胞atp水平检测的方法。
57.实施例1检测atp的荧光比率传感器的制备
58.一、制备羟基化的硅纳米线阵列
59.裁取1
×
1cm的n型硅片,分别用丙酮、乙醇、去离子水超声清洗5min。将硅片正面朝上,浸泡在0.153g的硝酸银、40ml的氢氟酸、140ml的去离子水的混合溶液中,浸泡8min;取
出硅片后,清洗干净,加入40ml氢氟酸、4ml双氧水、136ml的去离子水混合液中,在50℃的温度下,刻蚀60min。取出刻蚀后的硅片,浸泡在王水中1h,去除多余的银离子,得到硅纳米线阵列;将硅纳米线阵列在扫描电子显微镜下观察,结果如图2所示:硅纳米线的平均长度在70μm。
60.羟基化处理是将硅纳米线阵列浸泡在浓硫酸:双氧水(15ml:5ml)的溶液中,加热回流1h,随后将纳米线阵列清洗干净后,浸泡在h2o:30%h2o2:nh3·
h2o=10ml:2ml:2ml(v/v/v)的混合溶液中3h,随后清洗干净并放于真空烘箱中干燥,得到羟基化的硅纳米线阵列。
61.二、sinws@fitc@sio2的制备
62.制备异硫氰酸荧光素-氨丙基三乙氧基硅烷(fitc-aptes):取10mg fitc,分散在5ml无水乙醇溶液中,超声溶解完全后,向以上溶液中加入50μl氨丙基三乙氧基硅烷试剂(aptes),避光条件下,1000rpm搅拌下反应4小时。
63.用刮刀将羟基化的硅纳米线从硅纳米线阵列上剥离下来,分散在水溶液,分散质量为1mg/ml,得到羟基化硅纳米线分散液。取1ml羟基化硅纳米线分散液,加入4ml去离子水,随后利用0.1m naoh调节体系的ph至10-11。随后快速加入20μl fitc-aptes,反应30分钟后,继续向体系中分三次,以30分钟的时间间隔加入35μl,35μl,30μl的20%正硅酸乙酯(teos)甲醇溶液,继续反应18小时,得到sinws@fitc@sio2。通过减压过滤去除未反应的试剂和乙醇溶液,用大量无水乙醇清洗sinws@fitc@sio2表面,至洗液无色透明为止。最后,通过超声将洗净后的sinws@fitc@sio2分散在5ml的1x pbs溶液中,得到sinws@fitc@sio2分散液。
64.三、检测atp的荧光比率传感器的制备
65.取5ml sinws@fitc@sio2分散液,加入60μl羧基乙基硅烷三醇钠水溶液(25wt.%),1000rpm避光反应4小时,通过减压过滤,将所得表面羧基功能化的sinws@fitc@sio2再分散在水溶液中。
66.利用1m hcl调节溶液体系ph至6-7,随后向溶液中加入200μl新配的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc),n-羟基琥珀酰亚胺磺酸钠盐(nhss)溶液(10mg/ml,mes缓冲溶液,ph=6.0),预反应30分钟后,加入100μm罗丹明b二亚乙基三胺(rho-n3h5),继续1000rpm条件下避光反应24小时,得到检测atp的荧光比率传感器。减压过滤,将检测atp的荧光比率传感器再分散在2ml 1x pbs,得到sinws@fitc@sio
2-rho储备液。
67.实施例2检测atp的荧光比率传感器的制备
68.一、制备羟基化的硅纳米线阵列。
69.裁取1
×
2cm的n型硅片,分别用丙酮、乙醇、去离子水超声清洗10min。将硅片正面朝上,浸泡在0.153g的硝酸银、40ml的氢氟酸、140ml的去离子水的混合溶液中,浸泡9min。取出硅片后,清洗干净,加入40ml氢氟酸、4ml双氧水、136ml的去离子水混合液中,在50℃的温度下,刻蚀60min。取出硅片,浸泡在王水中2h,去除多余的银离子,得到硅纳米线阵列;将硅纳米线阵列在扫描电子显微镜下观察,结果如图2所示:纳米线的平均长度在70μm。
70.羟基化处理是将硅纳米线阵列浸泡在浓硫酸:双氧水(30ml:10ml)的溶液中,加热回流1h,随后将氧化后的硅纳米线阵列清洗干净后,浸泡在h2o:30%h2o2:nh3·
h2o=20ml:4ml:4ml(v/v/v)的混合溶液中8h,随后清洗干净并放于真空烘箱中干燥,得到羟基化的硅纳米线阵列。
71.二、sinws@fitc@sio2的制备
72.制备fitc-aptes:取10mg fitc,分散在5ml无水乙醇溶液中,超声溶解完全后,向上溶液中加入50μl氨丙基三乙氧基硅烷试剂(aptes),避光条件下,1000rpm搅拌下反应4小时。
73.用刮刀将羟基化的硅纳米线从硅纳米线阵列上剥离下来,分散在水溶液中,分散质量为1mg/ml,得到羟基化硅纳米线分散液。取1ml羟基化硅纳米线分散液,加入4ml去离子水,利用0.1m naoh调节体系的ph至10-11之间。随后快速加入20μl fitc-aptes,反应30分钟后,继续向体系中分三次,以30分钟的时间间隔加入35μl,35μl,30μl的20%teos甲醇溶液,继续反应24小时,得到sinws@fitc@sio2。通过减压过滤除去未反应的试剂和乙醇溶液,用大量无水乙醇清洗sinws@fitc@sio2表面,至洗液无色透明为止。最后,通过超声将洗净后的sinws@fitc@sio2分散在5ml的1x pbs溶液中,得到sinws@fitc@sio2分散液。
74.三、检测atp的荧光比率传感器的制备
75.取5ml sinws@fitc@sio2分散液,加入60μl羧基乙基硅烷三醇钠水溶液(25wt.%),1000rpm避光反应4小时,通过减压过滤,将所得表面羧基功能化的sinws@fitc@sio2再分散在水溶液中。
76.利用1m hcl调节溶液体系ph至6.0,随后向溶液中加入200μl新配的edc,nhss溶液(10mg/ml,mes缓冲溶液,ph=6.0),预反应30分钟后,加入100μm rho-n3h5,继续1000rpm条件下避光反应24小时,得到硅纳米线atp荧光传感器。减压过滤,去除未反应的试剂和溶剂,将硅纳米线atp荧光传感器分散在2ml 1x pbs,得到sinws@fitc@sio
2-rho储备液。
77.取以上羟基化硅纳米线,sinws@fitc@sio2和sinws@fitc@sio
2-rho分散液样品,滴加在铜网上制备tem样品,结果如图3所示。可以观察到,sinws表面平滑;在修饰上fitc@sio2层后,其表面变得粗糙;继续修饰羧基乙基硅烷三醇钠(25wt.%)以及rho-n3h5后,所得sinws@fitc@sio
2-rho表面较sinws@fitc@sio2平整,但较sinws粗糙。
78.在共聚焦荧光显微镜下观察,得到sinws,sinws@fitc@sio2,sinws@fitc@sio
2-rho的荧光成像如图4所示,仅有sinws@fitc@sio
2-rho的绿色荧光和橙色荧光通道都检测出荧光信号,表明sinws@fitc@sio
2-rho表面成功修饰了fitc@sio2和rho-n3h5。利用共聚焦荧光显微镜对荧光比率传感器在不同atp浓度下的绿光,橙光通道的荧光强度进行成像,结果如图5所示:随着atp浓度的增加,绿色荧光强度下降,橙色荧光强度增强,荧光比率值上升。其中,荧光比率值=橙色荧光强度/绿色荧光强度。
79.实施例3检测atp的荧光比率传感器在单细胞atp检测中的应用
80.将实施例2制备的检测atp的荧光比率传感器置于不同的atp浓度条件下,利用共聚焦荧光显微镜对荧光比率传感器绿光,橙光通道同时进行成像,成像时,使用波长为488nm,561nm的激光器,使用的二向色镜为402/488/561nm,使用的滤波片为515/30nm和585/65nm。选取荧光比率传感器为感兴趣区域,进行数据采集,以荧光比率传感器全部位点处的橙光荧光强度和绿光荧光强度的荧光比率值的平均值,作为在该atp浓度下的荧光比率值。设置atp浓度为0,2,4,6,8,10mm,分别采集6个浓度下该荧光比率传感器的荧光比率值。以atp浓度作为横坐标,以荧光比率值作为纵坐标,建立荧光比率值随atp变化的体外标准曲线,如图6所示,结果表明atp浓度越大,荧光比率值越大。
81.进一步的,对该荧光比率传感器对atp的选择性进行了检测。选取atp的类似物
adp,amp,ctp,utp,gtp进行选择性测试。其中atp,adp,amp的测试浓度为10mm,ctp,utp,gtp的测试浓度为2mm。如图7所示,仅有atp分子能够显著增强该荧光比率传感器的荧光比率值,表现出优异的选择性。
82.后续的,对该荧光比率传感器的光稳定性进行了评估。分别选取4mm和8mm的atp分子激活该荧光比率传感器后,采用488nm和561nm的激光器连续照射10min,并记录该荧光比率传感器在不同时间下的平均荧光比率值,如图8所示。可以发现,连续辐照10分钟,该传感器的平均荧光比率值变化不明显,表明该传感器具有较好的光稳定性。
83.此外,对该荧光比率传感器的循环可逆性进行了测定。分别改变该荧光比率传感器外体系atp浓度为2mm和4mm,记录不同atp浓度下该荧光比率传感器的平均荧光比率值,并结合拟合曲线,得到atp浓度计算值,结果记录在图9中。可以发现,在反复改变荧光比率传感器外体系atp浓度为2mm和4mm时,该荧光比率传感器的平均荧光比率值相应改变,且atp计算值在2mm和4mm附近波动,表现出较好的循环可逆性。
84.为了更好的分辨该荧光比率传感器与细胞的空间位置关系,我们分别对细胞外,细胞内的荧光比率传感器进行共聚焦成像。如图10所示,在相同的实验条件下,观察到细胞内的荧光比率传感器表现出橙色的荧光,而细胞外的荧光比率传感器表现出绿色的荧光。这是因为细胞内的atp能够很好激活rho-n3h5的荧光,同时淬灭fitc的荧光,使该荧光比率传感器表现的更多的是rho-n3h5的荧光,表现为橙色。通过该种方法,可以快速区别细胞内和细胞外的荧光比率传感器。
85.将检测atp的荧光比率传感器与细胞进行共孵育24-36h后,利用商用蓝色细胞核染料hoechst 33342进行染色,在共聚焦显微镜下观察,结果如图11所示,其中,图11中蓝色部分为hoechst 33342蓝色标记的细胞核,白色虚线代表通过明场像勾勒的细胞膜,第一行为共聚焦图像,第二行图表代表的是atp浓度与荧光比率传感器轴向距离的对应图,其中1,2,3,4点分别代表对应共聚焦图像中的1,2,3,4点。可以观察到细胞核区域的atp浓度要高于细胞质内atp浓度,近细胞核区域的atp浓度要高于远细胞核区域的atp浓度。
86.通过以上实验说明能够利用本发明的荧光比率传感器对单细胞内不同细胞位点处atp进行检测,得到了单细胞内不同细胞位点的atp水平。
87.显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1