一种参鹿补片中乙酸、乙二醇的检测和溯源方法与流程
1.本发明涉及分析检测技术领域,尤其涉及一种参鹿补片中乙酸、乙二醇的检测和溯源方法。
背景技术:
2.参鹿补片是由墨旱莲、淫羊藿、女贞子(酒制)、红参、续断、狗脊 、玉竹、熟地黄、锁阳、鸡血藤、鹿肉、党参、麸炒白术、仙鹤草14味中药饮片加以淀粉、糊精等辅料精制加工而成的中药复方制剂,再以二氧化硅、巴代等薄膜包衣材料制成薄膜包衣片,其为采用铝塑包装的薄膜衣片,主要包材为pvc、铝箔和冷铝,除去薄膜衣后显褐色,味涩、微苦。
3.参鹿补片所用药材饮片在加工炮制、贮存过程中,易受环境或空气中的乙酸发酵菌等因素影响产生乙酸,其原辅料、包材中也可引入乙二醇,而其现行质量标准(ybz01452015)中无乙酸、乙二醇的相关质控要求,由于参鹿补片配方组成复杂,所用原辅料等干扰影响因素多,为此急需建立一种能够有效检测参鹿补片中乙酸和乙二醇的含量,并对其所用原辅材料、包材进行有效溯源的监测方法。
4.乙二醇(ethylene glycol,eg),又名甘醇、1,2-亚乙基二醇,乙二醇具有一定的毒性,能引起贫血症、巨红血球症,出现新生颗粒性白血球,引起中枢神经障碍。乙二醇单乙醚除对眼和呼吸道有刺激性外,尚可引起肝、肾、肺损害,血液系统改变,并有生殖毒性和致畸性,乙二醇乙醚乙酸酯毒性很大,可能引起生殖功能紊乱。乙酸,也叫醋酸、冰醋酸,属于低毒类,吸入后对鼻、喉和呼吸道有刺激性,对眼有强烈刺激作用。长期反复接触会引起眼睑水肿、结膜充血、慢性咽炎、支气管炎,还会导致皮肤干燥、脱脂和皮炎。
5.已经报道的乙二醇和乙酸的检测主要集中于塑料制品、牙膏及化妆品、废水、涂料、血液及生物组织等领域,采用的主要是气相色谱法或者气相色谱 / 质谱联用方法,而截至目前,国内外尚未见有采用气相色谱
ꢀ‑ꢀ
质谱联用方法同时测定参鹿补片中乙二醇和乙酸任何文献报道和专利。
6.申请号为cn 112578070 a的专利公开了一种测定海水中乙二醇含量的气相色谱-质谱检测方法。该方法通过将海水样品经正己烷萃取后用气相色谱质谱分析,采用保留时间和碎片离子定性,采用外标法定量,达到了准确测定海水中乙二醇含量的目的,但是该方法测定的是海水中的乙二醇,并且没有同时测定乙酸的含量。
7.文献“气相色谱
ꢀ‑
质谱联用法测定巴洛沙星中乙酸残留量,天津药学,李华龙,2008年 8月 第 20卷第 4期”中公开了采用气象色谱-质谱联用法测定巴洛沙星中残留溶剂乙酸,通过扫描(scan)方式确定乙酸与甲醇酯化反应生成的醋酸甲酯色谱峰的保留时间,再用选择离子监测(sim)方式检测醋酸甲酯,检测质核比(m/z)分别为 29、42、43、59 和 74时的总离子流强度,用于巴洛沙星的质量控制,但是该方法仅测定了巴洛沙星中乙酸的残留量,而对于同时检测参鹿补片中乙酸和乙二醇的残留量,该文献中并未涉及。
技术实现要素:
8.有鉴于此,本发明提供了一种参鹿补片中乙酸、乙二醇的检测和溯源方法,可以同时检测乙酸和乙二醇,有效消除药品、辅料及包材中其它多种物质的干扰,并且大大提高了检测的准确性且缩短了检测时间,简化了检测工艺,在降低检测成本的同时提高了检测效率。
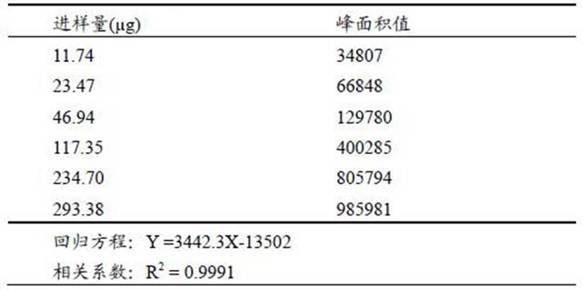
9.一种参鹿补片中乙酸、乙二醇的检测和溯源方法,包括以下步骤:(1)样品前处理精密称定0.54~0.66g样品于试管中,精密加入20ml甲醇,超声萃取,萃取液经滤膜过滤后供气相色谱-质谱检测;(2)仪器条件1)气相色谱条件以agilent hp-innowax(60m*0.32mm*0.25um)为色谱柱,以he为载气,柱流速:1.0ml/min,进样1ul,分流比100:1;进样口温度:220℃;程序升温:初始温度40℃,保持0.5min,2℃/min 升至110℃保持0.5min,15℃/min升至150℃保持2min,20℃升至250℃,保持0.5min;2)质谱条件ei电离方式,电离能量:70ev,离子源温度230℃,四级杆温度150℃,溶剂切除时间3.5min;采集方式:选择离子监测,乙酸的定量离子、定性离子分别为43、60、乙二醇定量离子、定性离子分别为:31、33; (3)建立标准曲线取适量乙酸标准物质,精密称定,甲醇溶解并定容,配制成2.347mg/ml的标准储备液,4℃密封储存;量取一定体积的标准储备液,经水稀释,配制成 1.1735 mg/ml的标准中间液,4℃密封储存;分别量取适量标准中间液,经水稀释,配制成0.011735、0.02347、0.04694、0.11735、0.2347、0.293375 mg/ml的系列标准工作液;分别量取 1 ml系列标准工作液,进样量为1μl,供气相色谱-质谱检测;取适量乙二醇标准物质,精密称定,甲醇溶解并定容,配制成0.655mg/ml的标准储备液,4℃密封储存;量取一定体积的标准储备液,经水稀释,配制成 0.3275 mg/ml的标准中间液,4℃密封储存;分别量取适量标准中间液,经水稀释,配制成0.003275、0.00655、0.0131、0.03275、0.0655、0.081875 mg/ml的系列标准工作液;分别量取 1 ml系列标准工作液,进样量为1μl,供气相色谱-质谱检测;将上述配制的浓度为2.347mg/ml的乙酸标准储备液和浓度为0.655mg/ml的乙二醇标准储备液混合,得到混合对照母液;依照“(2)仪器条件”分析上述溶液,以目标物定量离子的峰面积为纵坐标,以相应的浓度为横坐标绘制标准曲线;(4)含量计算计算出样品中乙酸和乙二醇对应的峰面积,根据标准曲线定量计算,得出样品中乙酸和乙二醇的含量。
10.优选的,所述步骤(1)中所述滤膜的孔径为0.22μm。
11.优选的,步骤(1)中所述样品包括制剂、原辅料和包材。
12.优选的,将所述包材剪成0.5cm
×
0.5cm的碎片。
13.优选的,步骤(1)中所述超声时间为15 min。
14.优选的,该方法中乙酸的检出限为0.04μg/ml,乙二醇的检出限为0.05μg/ml。
15.线性关系考察:分别精密量取步骤(2)中所述的浓度为2.347mg/ml的乙酸标准储备液和浓度为0.655mg/ml的乙二醇标准储备液,分别用甲醇稀释至6个浓度梯度,乙酸浓度依次为0.011735、0.02347、0.04694、0.11735、0.2347、0.293375mg/ml,乙二醇浓度依次为0.003275、0.00655、0.0131、0.03275、0.0655、0.081875 mg/ml,按照步骤(1)的气象色谱质谱条件测定峰面积,以进样量(
µ
g)为横坐标,峰面积为纵坐标,绘制标准曲线并进行回归分析,结果表明乙酸、乙二醇在相应的范围内线性关系良好。结果见表2和表3,图3和图4。
16.表2乙酸线性关系考察结果表3乙二醇线性关系考察结果精密度试验:将步骤(2)中的混合对照母液用20ml甲醇稀释,按照步骤(1)中的气相色谱质谱的参数设置,连续进样6次,测定峰面积,表面仪器精密度良好,结果见表4和表5。
17.表4乙酸精密度试验结果
表5乙二醇精密度试验结果重现性试验:取参鹿补片6份(批号:201203),研细,精密称定,加20ml甲醇,超声15min,按照上述步骤(1)中的气相色谱质谱的参数设置,进行分析测定,结果表明乙酸、乙二醇重现性良好。结果见表6和表7。
18.表6 乙酸烷重现性结果
表7乙二醇重现性结果加样回收率试验:精密称取已知含量参鹿补片9份(批号:201203),研细,精密称定,每三份各精密加入步骤(2)中所述混合对照溶液,800
µ
l、1000
µ
l和1200
µ
l,然后加20ml甲醇,超声15min,按照上述步骤(1)中的气相色谱质谱的参数设置,进行分析测定,计算回收率结果,结果表明乙酸和乙二醇按本标准试验,回收率良好,结果见表8和表9。
19.表8乙酸回收率试验结果(n = 9)表9乙二醇回收率试验结果(n = 9)
为了避免参鹿补片及其原辅材料、包装材料等所含(参鹿补片干扰图见5,包材干扰图见图6,辅料干扰图见图7)的糠醛、糠醇、5-甲基糠醛、乙醛酸甲酯、羟基丙酮、乙醛、异丁醛、2-乙酰基呋喃、2.3-丁二酮、2-甲基四氢呋喃-3-酮、丙酮、乙酸甲酯、乙酸乙酯、甲醇、丁酮、异丙醇、乙醇、乙酸丙酯、正丙醇、甲苯、乙酸丁酯、2-己酮、正丁醇、环戊酮、异戊醇、正戊醇、环己酮、壬醛等34种有关物质的干扰,对前处理条件以及色谱、质谱条件进行了优化和筛选。
20.1 前处理条件的优化筛选:1.1萃取溶剂的考察:选用甲醇、乙醇、乙酸乙酯、正己烷4 种不同极性的溶剂对2种化合物进行试验。结果表明,采用甲醇作为提取溶剂时的不仅回收率更高,且干扰相对较小,故最终采用甲醇作为提取溶剂。
21.1.2 超声溶剂用量及次数的考察:通过选择不同体积的甲醇 (10、20、30、40 ml)进行试验,超声5分钟、10分钟、15 分钟和20分钟进行比较,结果显示,用20 ml 提取溶剂超声提取15分钟的回收率已达到分析要求。
22.2 色谱条件的优化:考察了3 种不同极性的毛细管柱,分别是以hp-1,db-35以及hp-innowax毛细管色谱柱,结果db-35 柱样品中的其他组分对测定组分有干扰,未能完全分离,而hp-1 和hp-innowax柱均能很好的分离各组分,但在峰形上hp-innowax柱更佳。
23.此外由于供试品溶液中组分较多,且在hp-innowax柱上5-羟甲基糠醛以及糠醇对乙二醇有很强的干扰,故试验程序升温在2℃/min 升至110℃保持0.5min后,又以15℃/min
升至150℃保持2min,总共运行了46min,以保证供试品溶液中乙酸和乙二醇的的分离的分离。
24.与现有技术相比,本发明具有以下有益效果:本发明提供的参鹿补片中乙酸和乙二醇的检测和溯源方法,可以同时检测乙酸和乙二醇的含量,且大大缩短检测时间,简化检测工艺,同时可以同时排除至少34种杂质对检测结果的干扰,并且本发明在降低检测成本的同时提高了检测效率;本技术采用气相色谱质谱检测方法结合液液萃取的方法,即可准确检测出参鹿补片中乙酸和乙二醇的含量及来源,为监控并追溯参鹿补片中乙酸和乙二醇的残留量提供指导,可以更好的避免参鹿补片中乙酸和乙二醇的引入及残留,从而保障临床用药的安全。
附图说明
25.图1是本发明实施例1混合对照溶液的总离子流色谱图;图2是本发明实施例1供试品溶液的总离子流色谱图;图1和图2中1是乙酸,2是乙二醇;图3是本发明实施例1乙酸标准曲线;图4是本发明实施例1乙二醇标准曲线;图5为参鹿补片干扰总离子流色谱图;图6为包材干扰总离子流色谱图;图7为辅料干扰总离子流色谱图。
具体实施方式
26.为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行清楚、完整的描述。显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施例,都属于本发明所保护的范围。
27.下述实施例中所述试验方法或测试方法,如无特殊说明,均为常规方法;所述原料和助剂,如无特殊说明,均从常规商业途径获得,或以常规方法制备,涉及的wt%为质量分数。
28.实施例1一种参鹿补片中乙酸、乙二醇的检测和溯源方法,具体包括以下步骤:1)取参鹿补片10片,将其研磨成粉末,过四号筛,备用;2)采用sartorius bt 25s型十万分之一电子天平精密称定0.6g样品,置于50ml的三角瓶中,加入20ml甲醇萃取液,室温下超声萃取15min;3)提取液经0.22μm滤膜过滤后采用气相色谱 / 质谱仪进行检测;以agilent hp-innowax(60m*0.32mm*0.25um)为色谱柱,以he为载气,柱流速:1.0ml/min,进样1ul, 分流比100:1;进样口温度:220℃;程序升温:初始温度40℃,保持0.5min,2℃/min 升至110℃保持0.5min,15℃/min升至150℃保持2min,20℃升至250℃保持0.5min;ei电子轰击源,电子轰击能量:70ev,离子源温度230℃,四级杆温度150℃,溶剂切除时间3.5min;采集方式:选择离子监测,离子监测如表1:
表1所述参鹿补片购买厂家江西药都仁和制药有限公司,每片重0.31g(相当于饮片1.1g),12片/板
×
8板/盒。
29.将上述步骤(1)中的参鹿补片平均分6组,分别为a1、a2,a3、a4、a5、a6,采用包材盛装。其中a1、a2,a3先检测,然后将a4、a5、a6在加速试验条件下(40℃、相对湿度90%)放置1个月后,再按照上述方法检测。
30.所述包材为:聚氯乙烯与铝箔泡罩包装,外加冷铝,学名分别为:聚氯乙烯固体药用硬片、药用铝箔,两者组合成成泡罩包装,外加冷铝为:聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片。
31.实施例21)取14味药材、辅料粉末、未酒制的女贞子、素片和包衣片,并磨碎过四号筛,备用;2)采用sartorius bt 25s型十万分之一电子天平精密称定0.6g样品,置于三角瓶中,加入20ml甲醇萃取液,室温下超声萃取15min;3)提取液经0.22μm滤膜过滤后采用气相色谱 / 质谱仪进行检测;气相色谱 / 质谱仪参数设置同实施例1。
32.所述14味药材分别为依次为:墨旱莲 、淫羊藿 、女贞子(酒制)、红参、续断 、狗脊 、玉竹 、熟地黄、锁阳、鸡血藤、鹿肉、党参、麸炒白术、仙鹤草,所述辅料粉末为淀粉、糊精、二氧化硅、巴代。
33.实施例31)取包材样品,将其剪碎成0.5cm
×
0.5cm的碎片,混合均匀;2)准确称取0.6g样品,加入20ml甲醇萃取,在室温下超声萃取15 min;3)提取液经滤膜过滤后采用气相色谱 / 质谱仪进行检测;气相色谱 / 质谱仪参数设置同实施例1。
34.所述包材包括pvc、铝箔、冷铝。
35.实施例4取实施例1所述参鹿补片对应的包材,均匀分成6组,分别为b1、b2,b3、b4、b5、b6,其中b1、b2,b3先检测,然后将b4、b5、b6在加速试验条件下(40℃、相对湿度90%)放置1个月后,在按照实施例1的方法检测。
36.实施例5取不同产地或供应商来源的实施例2所述14味药材及方法检测。
37.对实施例1-5进行乙酸和乙二醇含量测定的结果表10:表10样品测定结果(mg/g)
综合上述结果分析可见,参鹿补片中检出的乙酸和乙二醇,其含量分别在0.26~6.78mg/g和0.025~0.058mg/g之间。经对中药材饮片、包衣材料和药包材分析发现,其主要来源于饮片中,含量分别在0.16~12.25mg/g和0~0.002mg/g之间。其中乙酸主要来源于中药饮片,其中以麸炒白术(12.25mg/g)、党参(9.04 mg/g)、墨旱莲(8.914 mg/g)具多;而乙二醇则显示包衣片检出1.15mg/g,其素片中则未检出。对于不同产地来源的药材饮片,其乙酸的含量存在较大的差异,有的甚至高达86.15mg/g,最大相差118倍之多。因此,控制参鹿补片中乙酸的引入,应重点把控中药材饮片中的残留,尤其是麸炒白术、党参、墨旱莲、续断、
狗脊、熟地黄等六种中药饮片;而乙二醇则应主要控制包衣材料中的引入。
38.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1