一种硅纳米线生物传感器及其制备方法和应用
1.本发明属于生物传感器技术领域,具体涉及一种硅纳米线生物传感器及其制备方法和应用。
背景技术:
2.生物传感器能够将各种生化反应转换成可测量的电学、光学等信号,属于典型的多学科交叉领域。在生物传感器研究中,器件设计与传感策略一直成为该领域的研究热点,开发具有高灵敏度、时效性、兼具可制造性的生物传感器具有重要的科学价值和应用前景。
3.硅 纳 米 线 场 效 应 管 ( silicon nanowire field-effect transistor, sinw-fet) 生物传感器是一种基于电场效应调节电流的电压控制型半导体器件,通过在源极和漏极之间的硅纳米线(sinw)表面修饰改性,紧接着固定生物分子的探针,从而利用探针结合互补的生物分子对硅纳米线通道电导的改变,使得场效应管源漏极电流发生变化,最终实现对生物分子的检测。具有超高灵敏度、高特异性、免标记、即时响应等优点,且较传统检测方法能达到更低的检测限,有助于疾病的早期诊断。
4.目前大多数癌症治疗方法仅依靠组织活检,组织活检是一种侵袭性检查,需要从患者体内获取病变组织进行病理性检测,但只能提供癌症的静态信息。液体活检是通过采集患者血液进行检测的一种无创检测方法,可以提供当前癌症的实时信息,这有助于实现对癌症的动态监控。有研究发现mirna序列可以作为癌症标志物,但是由于全血样本溶液中带电的目标生物分子因为异性相吸而会被溶液中携带相反电荷的离子包围,在一定长度之外,目标生物分子形成的静电场会被相反电荷的离子所削弱,导致目标分子电荷场效应无法影响到 sinw 内部载流子的分布,进而产生德拜屏蔽效应;而且全血样本中其他生物大分子会非特异吸附在硅纳米线表面,因此直接在全血样本中检测目标物对传感器的检测能力提出很大的挑战。
5.由于德拜屏蔽效应的影响,高离子强度的血液样品中生物分子的检测灵敏度大大降低甚至不能检测,极大阻碍了 sinw-fet 生物传感器的实际应用。为了进一步实现传感器在全血样本中对特异性标志物的检测,提高sinw-fet生物传感器的灵敏度,目前有采用去盐法[lloret n,frederiksen r s,moller t c,et al.effects of buffer composition and dilution on nanowire field-effect biosensors. nanotechnology, 2013,24(3):35501.]、适配子替代法[maehashi k, katsura t, kerman k , et al. label-free protein biosensor based on aptamer-modified carbon nanotube field-effect transistors[j]. analytical chemistry, 2007, 79(2):782-787.]、裁剪抗体法[elnathan r, kwiat m, pevzner a, et al. biorecognition layer engineering: overcoming screening limitations of nanowire-based fet devices.[j]. nano letters, 2012, 12(10):5245.]等,但这些方法耗时长、检测特异性不高,准确性低。
[0006]
因此,基于在全血样本中检测目标物存在的挑战,本发明开发了一种硅纳米线生物传感器及其制备方法和应用。
技术实现要素:
[0007]
为解决上述技术问题,本发明的目的在于提供一种硅纳米线生物传感器及其制备方法和应用。该种基于硅纳米线的生物传感器通过克服德拜屏蔽效应,提高检测灵敏度,进而实现硅纳米线场效应管生物传感器在全血样本中对目标物的准确检测。
[0008]
现有技术中为了克服德拜屏蔽效应,通常有两种方式,一是增加德拜长度,例如稀释法、去盐法、目标蛋白提纯法等;二是缩短目标分子与硅纳米线之间的距离,例如抗体裁减法、适配子替代法等。然而,经发明人研究发现,现有技术致力于对待测样本本身进行前处理或改造修饰在硅纳米线上的探针分子,不但费时费力而且成本高,另外,大分子蛋白质等非目标分子会非特异性吸附在硅纳米线表面,造成硅纳米线场效应管生物传感器在进行目标物检测时,出现干扰信号,且信号不稳定甚至被屏蔽,进而导致灵敏度和特异性均较低,影响检测结果的准确性。
[0009]
本发明人摒弃了已为习知的上述改进手段,经研究发现,不同分子量的聚乙二醇具有不同的长度,通过将不同分子量的聚乙二醇固定在硅纳米线表面,然后再键合探针分子,低分子量的聚乙二醇链较短,可以缩短目标分子与硅纳米线之间的距离,进而克服德拜屏蔽效应,提高检测灵敏度;高分子量的聚乙二醇链较长,通过空间位阻现象可以避免全血样本中非特异性蛋白等物质吸附在硅纳米线表面而造成信号干扰,进而提高检测的特异性和准确度。由此,创造了本发明。
[0010]
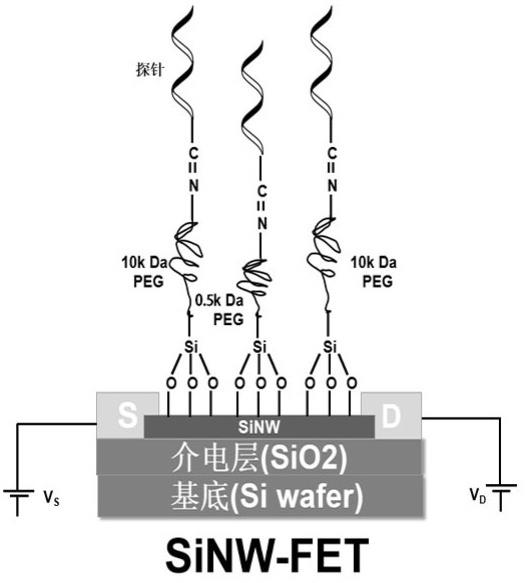
为实现上述目的,本发明采用如下技术方案:一种硅纳米线生物传感器的制备方法,包括以下步骤:s1:获得羟基化硅纳米线场效应管;s2:将不同分子量且两端分别带有硅烷基和氨基的改性聚乙二醇与所述羟基化硅纳米线场效应管进行交联反应,得到改性聚乙二醇修饰的硅纳米线场效应管;s3:将末端带有羧基的单链dna探针利用脱水缩合反应偶联于所述改性聚乙二醇修饰的硅纳米线场效应管上,即得到所述硅纳米线生物传感器。
[0011]
本发明首先对硅纳米线场效应管进行表面处理,使得硅纳米线表面富含羟基;再对其表面修饰两端分别含硅烷化基团和氨基基团的改性聚乙二醇,改性聚乙二醇一端的硅烷化基团会发生水解并与硅纳米线表面的羟基共价交联形成稳定的si-o键,进而将聚乙二醇固定在硅纳米线表面。为了避免德拜屏蔽效应以及全血样本中其他蛋白和小分子物质对检测灵敏度和特异性的干扰,本技术同时添加不同分子量的改性聚乙二醇,高分子量的改性聚乙二醇链较长,通过空间位阻现象阻止全血样本中非特异性蛋白吸附在硅纳米线表面,减少干扰;低分子量的改性聚乙二醇可以缩短目标分子与硅纳米线之间的距离,进而克服德拜屏蔽效应,提高检测灵敏度。然后将末端带有羧基的单链dna探针与改性聚乙二醇另一端的氨基发生脱水缩合,使单链dna探针固定在硅纳米线上,进而得到硅纳米线生物传感器。利用单链dna探针与目标待测物之间的碱基互补配对,可以改变硅纳米线通道的电导,使得场效应管源漏极电流发生变化,进而实现对全血样本中目标待测物的准确检测。
[0012]
优选的,s1中对硅纳米线场效应管进行氧等离子体表面处理,得到所述羟基化硅纳米线场效应管。
[0013]
优选的,所述硅纳米线场效应管是(111)型soi硅片。soi(silicon-on-insulator)硅片是指绝缘衬底上的硅,即在顶层硅和背衬底之间引入了一层埋氧化层,共分为3层,分
别为硅基底、氧化硅层和顶层硅。基于soi结构的晶体管能够提升时脉,减少检测过程中的电流漏电,进而提高检测准确度。
[0014]
优选的,所述硅纳米线场效应管的纳米线阵列以15
×
8叉指结构呈现,且纳米线尺寸大小为50~120nm。
[0015]
优选的,s1中用无水乙醇和去离子水依次冲洗硅纳米线场效应管表面,并且在氧等离子体处理之前进行吹干和烘干。
[0016]
s2中所述不同分子量的改性聚乙二醇包括分子量不低于10k da的高分子量的改性聚乙二醇,可以为10k da,15k da,20k da,25k da,30k da等;以及分子量不超过10k da的低分子量的改性聚乙二醇,可以为8k da,6k da,4k da,2k da,1k da,0.5k da等。优选的,s2中所述改性聚乙二醇的分子量分别为10 k da和0.5 k da。
[0017]
优选的,所述10 k da的改性聚乙二醇浓度为30~40μm;所述0.5 k da的改性聚乙二醇浓度为2~4μm。
[0018]
优选的,所述10 k da的改性聚乙二醇与0.5 k da的改性聚乙二醇的体积比为4:1,以合理控制硅纳米线表面所接枝的链的长短,进而控制目标待测分子与硅纳米线表面的距离。
[0019]
优选的,s2中进行所述交联反应的条件为,于室温条件下浸泡过夜。
[0020]
1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)常用于羧基活化,提高探针和改性聚乙二醇的偶联效率,促进羧基和氨基发生脱水缩合反应。s3中所述脱水缩合反应的活化偶联剂为n-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐。
[0021]
优选的,s3中所述单链dna探针的浓度为1~10μm;n-羟基琥珀酰亚胺(nhs)浓度为0.2~0.8mm,1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)的浓度为0.8~3.2mm;所述单链dna探针与nhs,edc的体积比为4:5:5。
[0022]
ssc缓冲液即柠檬酸钠缓冲液,是分子生物学上最为标准的印迹及分子杂交处理液。优选的,s3中在ssc缓冲液中进行所述脱水缩合反应。
[0023]
本发明还提供一种由上述制备方法制备而得的硅纳米线生物传感器。
[0024]
本发明进一步提供上述硅纳米线生物传感器在检测全血样本中mirna的应用。
[0025]
本技术所述单链dna探针的种类不限,可根据具体的待测目标物质种类而决定。优选的,所述单链dna探针序列为5
’‑
hooc-aaccacaca acctactacctca-3’,可以与全血样本中序列为5
’‑ꢀ
ugaguaguagguugugugguu-3’的mirna进行碱基互补配对,从而定性或定量检测全血样本中的mirna。
[0026]
本发明首先通过硅烷化在硅纳米线表面接枝不同分子量的改性聚乙二醇,再通过脱水缩合反应将末端携带羧基的dna探针稳定的固定在硅纳米线上。通过不同分子量的聚乙二醇调节dna探针到硅纳米线表面的距离,进而克服德拜屏蔽效应,提高检测灵敏度,而且高分子量的聚乙二醇起到空间位阻作用,避免其他蛋白质或小分子核酸等杂物吸附在硅纳米线表面造成干扰,进而提高检测特异性和准确度。
[0027]
本发明硅纳米线生物传感器的检测原理为:含有待测分子的溶液流经硅纳米线表面时,探针分子能够特异性捕获待测分子,待测目标分子携带大量的电荷,导致在硅纳米线周围形成电场效应,可改变硅纳米线内部的载流子分布情况,产生类似于栅压电场的作用,
并引起硅纳米线电导和电流的改变,电流变化在一定范围内与待测分子浓度呈线性相关,因此本发明生物传感器可以实现对生物分子的定性、定量检测。
[0028]
与现有技术相比,本发明的有益效果如下:1、本发明针对硅纳米线表面的羟基,利用改性聚乙二醇末端的硅烷基团与硅纳米线表面的羟基发生反应,进而将改性聚乙二醇固定在硅纳米线表面。并且所固定的改性聚乙二醇分子量不同,高分子量的改性聚乙二醇可以通过位阻作用避免检测过程中非目标分子非特异性吸附在硅纳米线表面,提高检测的特异性和准确度;低分子量的改性聚乙二醇缩短了待测分子到硅纳米线表面的距离,有效解决德拜屏蔽问题,进而提高检测灵敏度。
[0029]
2、本发明制备的硅纳米线生物传感器应用范围广,可以用于直接检测全血样本中的目标物,进而用于癌症筛查、遗传工程等。
附图说明
[0030]
图1 本发明羟基化硅纳米线场效应管示意图。
[0031]
图2 本发明改性聚乙二醇修饰的硅纳米线场效应管示意图。
[0032]
图3 本发明硅纳米线生物传感器示意图。
[0033]
图4实施例2硅纳米线生物传感器未添加目标待测物时的电流图。
[0034]
图5实施例2硅纳米线生物传感器对10pm mirna的电流响应图。
[0035]
图6实施例3硅纳米线生物传感器对10pm mirna的特异性响应图。
[0036]
图7实施例1制备得到的硅纳米线生物传感器对不同浓度目标mirna的归一化电流响应函数图。
[0037]
图8对比例1制备得到的硅纳米线生物传感器对不同浓度目标mirna的归一化电流响应函数图。
[0038]
图9对比例2制备得到的硅纳米线生物传感器对不同浓度目标mirna的归一化电流响应函数图。
具体实施方式
[0039]
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
[0040]
本技术实施例的改性聚乙二醇购自苏州诺德派森医药科技公司,末端含羧基的单链dna探针以及mirna购自上海生工生物工程有限公司。单链dna探针序列为5
’‑
hooc-aaccacaca acctactacctca-3’,所述目标待测物mirna序列为5
’‑
ugaguaguagguugugugguu-3’。
[0041]
实施例1一种硅纳米线生物传感器,通过以下步骤进行制备:(1)硅纳米线的表面处理首先将硅纳米线场效应管用无水乙醇冲洗1分钟,再用去离子水冲洗1分钟,将硅纳米线表面清洗干净,随后用氮气吹干30s,再放入50℃的真空干燥箱里烘干15分钟。接着采用氧等离子清洗机对硅纳米线场效应管芯片进行氧等离子体处理(70w,5分钟),以增加硅纳米线场效应管表面的硅羟基,改善芯片表面亲水性,如图1所示。
[0042]
(2)硅纳米线表面修饰改性聚乙二醇用无水乙醇将10k da和0.5k da的改性聚乙二醇分别稀释为30μm和2μm的浓度,然后以4:1的体积比混合得到混合溶液,将硅纳米线场效应管芯片在上述混合溶液中室温浸泡过夜,使改性聚乙二醇的硅烷化基团和硅纳米线表面的羟基反应,再用去离子水冲洗未反应的改性聚乙二醇,如图2所示。
[0043]
(3)单链dna探针的活化取150mm nacl和15mm柠檬酸钠,配置成ph 7.2,10mmol/l的ssc缓冲溶液,于4℃下保存备用。用上述10mmol/l 的ssc缓冲溶液配置成1μm的单链dna探针溶液,0.8mm 的edc,0.2mm的nhs,并以4:5:5的体积比室温活化30分钟。
[0044]
(4)固定探针取活化好的100μl单链dna探针滴加到修饰了改性聚乙二醇的硅纳米线表面,室温孵育 1小时,待探针末端的羧基和改性聚乙二醇的氨基完全反应,然后用ph7.2的ssc缓冲液冲洗3次,缓冲液的单次用量为100
µ
l,洗去尚未结合的dna探针,然后用氮气吹干,即将单链dna探针固定在硅纳米线上,从而得到硅纳米线生物传感器,如图3所示。
[0045]
实施例2一种硅纳米线生物传感器用于检测mirna,包括如下步骤:(1)硅纳米线的表面处理首先将硅纳米线场效应管用无水乙醇冲洗1分钟,再用去离子水冲洗1分钟,将硅纳米线表面清洗干净,随后用氮气吹干30s,再放入50℃的真空干燥箱里烘干15分钟。接着采用氧等离子清洗机对硅纳米线场效应管芯片进行氧等离子体处理(70w,5分钟),以增加硅纳米线场效应管表面的硅羟基,改善芯片表面亲水性。
[0046]
(2)硅纳米线表面修饰改性聚乙二醇用无水乙醇将10k da和0.5k da的改性聚乙二醇分别稀释为40μm和4μm的浓度,然后以4:1的体积比混合得到混合溶液,将硅纳米线场效应管芯片在上述混合溶液中室温浸泡过夜,使改性聚乙二醇的硅烷化基团和硅纳米线表面的羟基反应,再用去离子水冲洗未反应的改性聚乙二醇。
[0047]
(3)单链dna探针的活化取150mm nacl和15mm柠檬酸钠,配置成ph 7.4,10mmol/l的ssc缓冲溶液,于4℃下保存备用。用上述10mmol/l 的ssc缓冲溶液配置成10μm的单链dna探针溶液,3.2 mm 的edc,0.8mm的nhs,并以4:5:5的体积比室温活化30分钟。
[0048]
(4)固定探针取活化好的100μl单链dna探针滴加到硅纳米线表面,室温孵育2小时,待探针末端的羧基和改性聚乙二醇的氨基完全反应,然后用ph 7.4的ssc缓冲液冲洗3次,缓冲液的单次用量为100
µ
l,洗去尚未结合的dna探针,然后用氮气吹干,即将单链dna探针固定在硅纳米线上,从而得到硅纳米线生物传感器。
[0049]
(5)检测基准线电流向所制备的硅纳米线生物传感器中滴加100μl的全血和去离子水混合溶液静置30min,随后在源漏极之间添加2v电压,串联接入型号为keysight 2450的电流检测装置,测量源漏极之间的电流,并作为基准电流,如图4所示。
[0050]
(6)mirna杂交用去离子水和全血混合溶液作为稀释液(模拟人体血液环境)配置浓度为10pm 的mirna。取100μl的mirna溶液滴加硅纳米线生物传感器表面,于37℃下杂交孵化2h。并使用keysight 2450型电流检测装置实时检测源漏极之间的电流变化,结果如图5所示。
[0051]
参照图3,搭建硅纳米线生物传感器用于检测mirna的平台,以硅纳米线场效应管为传输通道。在硅纳米线上键合不同分子量的改性聚乙二醇,然后将单链dna探针以肽键的形式固定在硅纳米线表面。引入待测mirna后,通过碱基互补配对原则进行杂交,进而引起硅纳米线电流的改变,从而根据电流变化定量检测不同浓度的mirna。
[0052]
图4和5表示了向本实施例制备的硅纳米线生物传感器加入全血和去离子水混合溶液后的基准电流变化以及由全血和去离子水混合溶液配成的10pm的mirna的电流变化。从图5中可以看出,当引入mirna后,电流出现了明显的上升趋势,表明本实施例所制得的硅纳米线生物传感器可以用于检测全血样本中的mirna。
[0053]
实施例3本实施例单链dna探针序列为5
’‑
hooc-aaccacaca acctactacctca-3’,目标待测mirna序列为5
’‑
ugaguaguagguugugugguu-3’,完全不匹配的mirna序列为:5`-u agc uua uca gac uga ugu uga-3’,只有一个碱基配对的mirna序列为5
’‑
u gag gua gua ggu ugu aug guu-3’,只有两个碱基配对的mirna序列为5
’‑
u gag gua gua agu ugu guu guu-3’。
[0054]
一种硅纳米线生物传感器的特异性识别方法,包括如下步骤:(1)采用与实施例2相同的方法制备得到硅纳米线生物传感器。
[0055]
(2)检测基准线电流向所制备的硅纳米线生物传感器中滴加100μl的全血和去离子水混合溶液静置30min,随后在源漏极之间添加2v电压,串联接入型号为keysight 2450的电流检测装置,测量源漏极之间的电流,并作为基准电流。
[0056]
(3)检测完全不匹配的mirna、只有一个碱基配对的mirna,只有两个碱基配对的mirna用去离子水和全血混合溶液作为稀释液(模拟人体血液环境)配置成浓度均为10pm的完全不匹配的mirna,只有一个碱基配对的mirna,只有两个碱基配对的mirna。分别取100μl的上述mirna溶液滴加到硅纳米线生物传感器表面,于37℃下杂交孵化1h。并使用keysight 2450型电流检测装置实时检测源漏极之间的电流变化。
[0057]
(4)检测目标待测mirna用去离子水和全血混合溶液作为稀释液(模拟人体血液环境)配置浓度为10pm 的目标待测mirna。取100μl的目标mirna溶液滴加到步骤(5)硅纳米线生物传感器表面,于37℃下杂交孵化1h。并使用keysight 2450型电流检测装置实时检测源漏极之间的电流变化。
[0058]
图6为硅纳米线生物传感器的特异性识别结果,从图中可以看出,当只加入完全不匹配的mirna时,电流没有明显变化,只有一个碱基配对的mirna以及只有两个碱基配对的mirna加入后,电流有少许上升,随后加入10pm的互补mirna后,电流上升明显。表明本技术所制备的硅纳米线生物传感器只对特定的mirna具有识别性,且具有很好的选择性。
[0059]
对比例1与实施例1唯一不同的是,步骤(2)中只添加高分子量(10k da)的改性聚乙二醇。
[0060]
对比例2与实施例1唯一不同的是,步骤(2)中只添加低分子量(0.5k da)的改性聚乙二醇。
[0061]
使用实施例1、对比例1和对比例2所制备的硅纳米线生物传感器检测不同浓度的目标mirna,检测过程如下:s1. 用去离子水和全血混合溶液作为稀释液(模拟人体血液环境)配置成浓度分别为10 ‑
16 m、10 ‑
15 m、10
ꢀ‑
14 m、10
ꢀ‑
13 m、10
ꢀ‑
12 m、10
ꢀ‑
11 m的目标mirna。
[0062]
s2. 分别取100μl的上述mirna溶液滴加到实施例1、对比例1和对比例2制备的硅纳米线生物传感器表面,于37℃下杂交孵化1h。并使用keysight 2450型电流检测装置实时检测源漏极之间的电流变化。记录电流变化值,并进行归一化处理,结果分别如图7、图8和图9所示。
[0063]
实施例1,对比例1和对比例2的硅纳米线生物传感器对目标mirna的检测限d如下表1所示:其中,d=3n/s;d-检测限;n-线性斜率;s-标准偏差。
[0064]
表1序号检测限(d)实施例10.1fm对比例110fm对比例21fm从图7-图9的归一化电流响应拟合曲线中可以看出,电流响应随待测物浓度增加而呈线性变化,表明采用本发明的方法制备得到的硅纳米线生物传感器可以实现对生物分子的定性、定量检测。
[0065]
从表1可以看出,实施例1的检测限明显低于对比例1和对比例2,表明本发明在硅纳米线表面同时键合不同分子量的聚乙二醇既可以明显克服德拜屏蔽效应,又能防止非特异性蛋白等干扰物吸附在硅纳米线表面,进而减少信号干扰,提高了检测灵敏度。
[0066]
本文中,各个优选方案仅仅重点描述的是与其他方案的不同,各个优选方案只要不冲突,都可以任意组合,组合后所形成的实施例也在本说明书所公开的范畴之内,考虑到本文简洁,本文就不再对组合所形成的实施例进行单独描述。
[0067]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1