一种电化学生物传感器及其制备方法和应用
1.本技术属于生物检测技术领域,特别涉及一种电化学生物传感器及其制备方法和应用。
背景技术:
2.循环肿瘤细胞(ctcs)是恶性肿瘤发展过程中在外周血中传播和生存的肿瘤细胞。灵敏和准确地检测ctcs对于诊断肿瘤转移、监测术后患者的肿瘤复发和转移、患者预后和选择个体化治疗至关重要。因此,寻找一种可以灵敏且实时的方法检测ctcs具有非常重要的研究意义。目前,如荧光测量、光电化学生物传感器、比率检测、流式细胞仪、质谱、比色分析等检测方法存在耗时长、成本高、灵敏度相对较低等缺点。电化学生物传感器是一种结合了生物传感和电化学分析技术的分析模式,与其他检测方法相比,它具有操作简单、检测及时、成本低廉、灵敏度高、选择性好等优点而倍受关注。
3.酶具有专一性、高效性、高灵敏度、反应条件温和等优点。酶级联催化放大反应是由前一步酶反应激发后一步酶反应的多酶协同反应模式。电化学酶传感器是通过酶促反应实现目标物电化学检测的方法。基于酶级联反应的电化学生物传感器利用多酶级联催化反应实现检测信号放大,成为最具潜力的检测技术之一。yan等制备了一种微米级dna花包埋葡萄糖氧化酶和辣根过氧化物酶的双酶电化学生物传感器,其用于检测癌外泌体和凝血酶检测,其检测限分别为1.02
×
103个/μl和12.77fm。jeong等使用多壁碳纳米管支持的抗体结合葡萄糖氧化酶和辣根过氧化物酶作为电化学信号放大探针检测癌胚抗原,检出限为4.4pg/ml。kim等报道了由胆固醇氧化酶和辣根过氧化物酶组成的双酶纳米颗粒用于胆固醇检测的电化学传感器,检出限0.0018mg/ml。与单酶催化放大相比,基于酶级联放大体系的电化学传感器,由于多酶联合作用展现了更高的催化效率,从而使电化学传感器呈现出更高的灵敏性和选择性而被越来越多的应用于生物传感领域的研究。然而,酶级联放大体系生物传感器的研制过程中仍存在酶的负载基质在实现高负载率的同时,往往影响传感电极界面的电子传输效率、酶的活性等问题,并且现有基于酶级联放大体系的电化学传感体系中酶-酶之间电子传输距离过短,在“三明治”结构中实现较大目标物(例如肿瘤细胞等)检测面临挑战等问题。
技术实现要素:
4.1.要解决的技术问题
5.针对酶级联放大体系生物传感器的研制过程中,酶的负载基质影响传感电极界面的电子传输效率、酶的活性,以及现有的基于酶级联放大的电化学传感体系中酶-酶之间电子传输距离过短,在“三明治”结构中无法实现较大目标物检测等问题,本技术提供了一种电化学生物传感器及其制备方法和应用。
6.2.技术方案
7.为了达到上述的目的,本技术提供了一种电化学生物传感器,包括工作电极、参比
电极、对电极和电解质溶液;所述工作电极包括依次层叠的捕获电极、循环肿瘤细胞和信号放大探针,所述捕获电极依次负载壳聚糖-多壁碳纳米管复合薄膜、葡萄糖氧化酶和适配体;所述参比电极为饱和ag/agcl电极,所述对电极为铂电极;所述电解质溶液为含葡萄糖的铁氰化钾溶液。
8.本技术提供的另一种实施方式为:所述工作电极为玻碳电极,所述玻碳电极表面负载多壁碳纳米管-壳聚糖复合薄膜、葡萄糖氧化酶和适配体,所述玻碳电极、所述循环肿瘤细胞和所述信号放大探针构成三明治结构:玻碳电极/多壁碳纳米管-壳聚糖/葡萄糖氧化酶/适配体/循环肿瘤细胞/抗体-聚苯乙烯微球-辣根过氧化酶,即gce/mwcnts-cs/god/apt/ctcs/anti-epcam-ps-hrp;所述信号放大探针为anti-epcam-ps-hrp探针,所述捕获电极包括gce/mwcnts-cs/god/apt,所述电解质溶液为含葡萄糖的铁氰化钾溶液,所述anti-epcam-ps-hrp探针与所述捕获电极的god在所述含葡萄糖的铁氰化钾溶液中构成双酶级联反应信号放大体系。
9.本技术还提供一种根据所述的电化学生物传感器的制备方法,所述方法包括如下步骤:
10.(1)采用多壁碳纳米管-壳聚糖复合薄膜、葡萄糖氧化酶和适配体制备工作电极的电极捕捉界面;(2)制备信号放大探针;(3)采用所述电极捕捉界面捕获循环肿瘤细胞后,与信号放大探针构建三明治结构工作电极,饱和ag/agcl电极为参比电极,铂电极为对电极,电解质溶液为含葡萄糖的铁氰化钾溶液得到电化学生物传感器。
11.本技术提供的另一种实施方式为:所述电极捕捉界面制备包括对玻碳电极进行预处理,通过层层修饰依次在所述玻碳电极上修饰多壁碳纳米管、壳聚糖、葡萄糖氧化酶、戊二醛、牛血清白蛋白和适配体;将壳聚糖粉溶解于乙酸溶液中,在室温下制得壳聚糖溶液,并将多壁碳纳米管加入壳聚糖溶液中制备了壳聚糖-多壁碳纳米管混合溶液;将所述葡萄糖氧化酶掺杂到所述壳聚糖-多壁碳纳米管混合溶液后,将靶向ctc的适配体经1-乙基-(3-二甲基氨基丙基)碳酰二亚胺edc和n-羟基琥珀酰亚胺nhs进行活化,通过戊二醛连接到壳聚糖膜表面,逐步修饰得到gce/mwcnts-cs/god/apt。
12.本技术提供的另一种实施方式为:将信号放大探针制备包括在羧基聚苯乙烯微球上修饰上辣根过氧化酶hrp和抗体anti-epcam;所述羧基聚苯乙烯微球用edc和nhs进行羧基活化处理后,经anti-epcam和hrp修饰到所述羧基聚苯乙烯微球表面,制得探针anti-epcam-ps-hrp。
13.本技术还提供一种对制备的电化学生物传感器的应用,其特征在于:将所述电化学生物传感器应用于循环肿瘤细胞检测。
14.本技术提供的另一种实施方式为:所述电化学生物传感器是基于葡萄糖氧化酶和辣根过氧化酶的双酶级联反应,放大检测体系电化学信号对应于循环肿瘤细胞的浓度变化而实现循环肿瘤细胞的检测。
15.本技术提供的另一种实施方式为:将捕捉界面修饰完成的电极与细胞进行捕捉孵育,捕捉孵育完成后,在所述捕捉电极上滴加探针anti-epcam-ps-hrp作为工作电极,饱和ag/agcl电极为参比电极,铂电极为对电极,在含有葡萄糖的铁氰化钾溶液作为电解质溶液中记录和检测电化学信号;根据循环肿瘤细胞溶液浓度与电化学信号的对应关系实现对循环肿瘤细胞的检测。
16.本技术提供的另一种实施方式为:根据循环肿瘤细胞溶液浓度与电化学信号的对应关系,循环肿瘤细胞溶液的浓度与微分脉冲伏安法dpv峰值电流y的线性关系曲线为y=13.941lgc+17.438,其中c为循环肿瘤细胞溶液的浓度。
17.本技术提供的另一种实施方式为:所述循环肿瘤细胞检测线性范围为10cells/ml~106cells/ml,检测限为3cells/ml。
18.3.有益效果
19.与现有技术相比,本技术提供的电化学生物传感器及其制备方法和应用的有益效果在于:
20.本技术提供的电化学生物传感器,为基于双酶级联反应的电化学生物传感器。
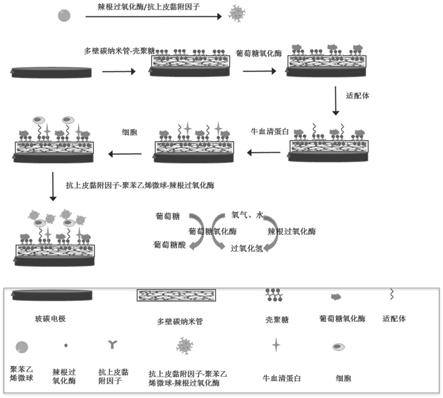
21.本技术提供的电化学生物传感器,采用多壁碳纳米管和壳聚糖复合膜负载葡萄糖氧化酶和适配体作为捕捉界面,实现酶高活性、高负载的同时,提高电极界面的电子传输效率;构建三明治结构gce/mwcnts-cs/god/apt/ctcs/anti-epcam-ps-hrp体系,克服了酶级联放大体系的电化学传感体系中酶-酶之间电子传输距离过短,无法在三明治结构中实现肿瘤细胞的检测等问题。
22.本技术提供的电化学生物传感器,解决现有的电化学生物传感器对于ctcs检测灵敏度较低、检测限较高、难以满足临床要求的问题。
23.本技术提供的电化学生物传感器的应用于ctcs的检测,检测范围为10cells/ml~106cells/ml,检测限为3cells/ml,进一步推动电化学生物传感器对于ctcs的临床检测研究和应用。
24.本技术提供的电化学生物传感器的应用,采用多壁碳纳米管和壳聚糖复合膜负载葡萄糖氧化酶和适配体捕捉界面,实现对于酶的高活性、高负载率;构建三明治结构gce/mwcnts-cs/god/apt/ctcs/anti-epcam-ps-hrp体系,提高了灵敏度和选择性,实现了双酶级联反应催化的信号放大应用于远距离传感检测。
25.本技术提供的电化学生物传感器的应用,通过双酶级联反应实现信号放大体系,实现了ctcs的高灵敏性、高选择性、高特异性检测,对于肿瘤患者的早期诊断和预后评估提供了一条新途径。
附图说明
26.图1是本技术的电化学生物传感器制备过程示意图;
27.图2是本技术的电化学生物传感器不同阶段阻抗图和循环伏安图;
28.图3是是本技术的电化学生物传感器不同浓度ctcs对应的dpv电信号和检测ctcs的线性曲线。
具体实施方式
29.在下文中,将参考附图对本技术的具体实施例进行详细地描述,依照这些详细的描述,所属领域技术人员能够清楚地理解本技术,并能够实施本技术。在不违背本技术原理的情况下,各个不同的实施例中的特征可以进行组合以获得新的实施方式,或者替代某些实施例中的某些特征,获得其它优选的实施方式。
30.参见图1~3,本技术提供一种电化学生物传感器,包括工作电极、参比电极、对电
极和电解质溶液;所述工作电极包括依次层叠的捕获电极、循环肿瘤细胞和信号放大探针,所述捕获电极依次负载壳聚糖-多壁碳纳米管复合薄膜、葡萄糖氧化酶和适配体;所述参比电极为饱和ag/agcl电极,所述对电极为铂电极;所述电解质溶液为含葡萄糖的铁氰化钾溶液。
31.进一步地,所述工作电极为玻碳电极,所述玻碳电极表面负载多壁碳纳米管-壳聚糖复合薄膜、葡萄糖氧化酶和适配体,所述玻碳电极、所述循环肿瘤细胞和所述信号放大探针构成三明治结构gce/mwcnts-cs/god/apt/ctcs/anti-epcam-ps-hrp;所述信号放大探针为anti-epcam-ps-hrp探针,所述捕获电极包括gce/mwcnts-cs/god/apt,所述电解质溶液为含葡萄糖的铁氰化钾溶液,所述anti-epcam-ps-hrp探针与所述捕获电极的god在所述含葡萄糖的铁氰化钾溶液中构成双酶级联反应信号放大体系。
32.本技术还提供一种根据所述的电化学生物传感器的制备方法,所述方法包括如下步骤:
33.(1)采用多壁碳纳米管-壳聚糖复合薄膜、葡萄糖氧化酶和适配体制备工作电极的电极捕捉界面;(2)制备信号放大探针;(3)采用所述电极捕捉界面捕获循环肿瘤细胞后,与信号放大探针构建三明治结构工作电极,饱和ag/agcl电极为参比电极,铂电极为对电极,电解质溶液为含葡萄糖的铁氰化钾溶液得到电化学生物传感器。
34.进一步地,所述电极捕捉界面制备包括对玻碳电极进行预处理,通过层层修饰依次在所述玻碳电极上修饰多壁碳纳米管、壳聚糖、葡萄糖氧化酶、戊二醛、牛血清白蛋白和适配体;将壳聚糖粉溶解于乙酸溶液中,在室温下制得壳聚糖溶液,并将多壁碳纳米管加入壳聚糖溶液中制备了壳聚糖-多壁碳纳米管混合溶液;将所述葡萄糖氧化酶掺杂到所述壳聚糖-多壁碳纳米管混合溶液后,将靶向ctc的适配体经1-乙基-(3-二甲基氨基丙基)碳酰二亚胺edc和n-羟基琥珀酰亚胺nhs进行活化,通过戊二醛连接到壳聚糖膜表面,逐步修饰得到gce/mwcnts-cs/god/apt。
35.具体地,(1)将一定浓度的多壁碳纳米管和壳聚糖混合液,葡萄糖氧化酶、戊二醛和牛血清蛋白混合液,适配体溶液通过层层组装的方式修饰在玻碳电极上,制得gce/mwcnts-cs/god/apt结构的修饰电极。
36.(2)探针的制备:对羧基聚苯乙烯微球进行羧基活化处理。在聚苯乙烯微球上修饰抗上皮黏附因子和辣根过氧化酶。
37.(3)电化学生物传感器的构建:使用修饰后的电极对细胞进行捕捉孵育,滴加探针于电极上,构建gce/mwcnts-cs/god/apt/cell/anti-epcam-ps-hrp的“三明治”结构工作电极-细胞-探针电化学生物传感器。
38.(4)该电化学生物传感器对于ctcs的检测:检测方式用传统的三电极体系,包含工作电极,参比电极,对电极,含有葡萄糖的铁氰化钾溶液作为电解质溶液,chi760e电化学工作站记录和检测电化学信号。根据ctcs浓度与dpv峰值电流的对应关系实现对ctcs的检测。
39.步骤(1)中,多壁碳纳米管-壳聚糖溶液的浓度为1~5%(g/ml),用量是10μl。葡萄糖氧化酶、戊二醛、牛血清蛋白的浓度分别是1~5%(m/v)、2.5%(v/v)、2.5%(m/v)。apt、edc、nhs的浓度分别为10~30mg/ml、20mg/ml、20mg/ml。
40.步骤(3)中,羧基聚苯乙烯微球的用量是20μl。edc、nhs的用量分别是18mg、27mg anti-epcam和hrp的浓度分别是1~5μg/ml,anti-epcam和hrp的浓度比为1:10。
41.解决现有的酶级联电传感技术酶活性低、负载率低,无法实现高灵敏实现ctc等较大目标物检测问题,为电化学生物传感器用于ctcs检测提供了重要的诊断工具。
42.进一步地,将信号放大探针制备包括在羧基聚苯乙烯微球上修饰上辣根过氧化酶hrp和抗体anti-epcam;所述羧基聚苯乙烯微球用edc和nhs进行羧基活化处理后,经anti-epcam和hrp修饰到所述羧基聚苯乙烯微球表面,制得探针anti-epcam-ps-hrp。
43.本技术还提供一种对制备的电化学生物传感器的应用,将所述电化学生物传感器应用于循环肿瘤细胞检测。
44.进一步地,所述电化学生物传感器是基于葡萄糖氧化酶和辣根过氧化酶的双酶级联反应,放大检测体系电化学信号对应于循环肿瘤细胞的浓度变化而实现循环肿瘤细胞的检测。
45.进一步地,将捕捉界面修饰完成的电极与细胞进行捕捉孵育,捕捉孵育完成后,在所述捕捉电极上滴加探针anti-epcam-ps-hrp作为工作电极,饱和ag/agcl电极为参比电极,铂电极为对电极,在含有葡萄糖的铁氰化钾溶液作为电解质溶液中记录和检测电化学信号;根据循环肿瘤细胞溶液浓度与电化学信号的对应关系实现对循环肿瘤细胞的检测。
46.进一步地,根据循环肿瘤细胞溶液浓度与电化学信号的对应关系,循环肿瘤细胞溶液的浓度与微分脉冲伏安法dpv峰值电流y的线性关系曲线为y=13.941lgc+17.438,其中c为循环肿瘤细胞溶液的浓度。
47.进一步地,所述循环肿瘤细胞检测线性范围为10cells/ml~106cells/ml,检测限为3cells/ml。
48.实施例
49.电化学生物传感器的制备方法,具体实施过程如图1所示:
50.工作电极的制备:将100mg壳聚糖粉溶解于10ml 1.0%(v/v)乙酸溶液中,在室温下超声搅拌3h,制得壳聚糖溶液。用2mg纯化的多壁碳纳米管在200μl壳聚糖溶液中超声3h制备了壳聚糖-多壁碳纳米管溶液。酶混合液中包含葡萄糖氧化酶、戊二醛、牛血清蛋白且浓度分别是1%(m/v)、2.5%(v/v)、2.5%(m/v)。适配体在使用之前需要用1-乙基-(3-二甲基氨基丙基)碳酰二亚胺和n-羟基琥珀酰亚胺进行活化1h。取10μl mwcnts-cs混合液滴加在经过预处理的玻碳电极上,在室温下自然干燥形成一层mwcnts-cs膜。然后取5μl god、2.5μl ga、2.5μl bsa混合液滴加在电极上,在室温下自然干燥。将5μl apt、2.5μledc、2.5μl nhs且浓度分别为10μm、20mg/ml、20mg/ml的混合液先活化1h,随后滴加至电极表面孵育20h。用pbs(ph=7.0)的缓冲溶液进行冲洗电极去除非特异性吸附,再用bsa封闭非特异性活性位点30min,冲洗后备用。
51.探针的制备:在羧基聚苯乙烯微球上修饰辣根过氧化酶和抗体。取20μl羧基聚苯乙烯微球用pbs缓冲溶液(ph=7.0)离心清洗,分别称取18mg edc和27mg nhs固体对溶解在800μl pbs(ph=7.0)的缓冲溶液中的羧基聚苯乙烯微球(浓度是5%(m/v))进行羧基活化处理。anti-epcam(1μg/ml)和hrp(10mg/ml)在羧基聚苯乙烯微球的pbs缓冲溶液(ph=7.0)中在25℃下搅拌震荡6h,5000rpm下离心3min并清洗去除未结合的hrp和anti-epcam。
52.电化学生物传感器的构建:使用修饰后的玻碳电极与细胞在37℃下孵育1h后,用pbs(ph=7.0)的缓冲溶液进行冲洗后,在该玻碳电极上滴加8μl探针并孵育1h成功构建gce/mwcnts-cs/god/apt/cell/anti-epcam-ps-hrp的三明治电极-细胞-探针结构的电化
学生物传感器。
53.该电化学生物传感器对于ctcs的检测:检测方式用传统的三电极体系,工作电极多壁碳纳米管和壳聚糖复合膜负载葡萄糖氧化酶和适配体构建的捕捉界面捕获循环肿瘤细胞后,与所述信号放大探针构建三明治结构的工作电极,饱和ag/agcl电极为参比电极,铂电极为对电极,电解质溶液为含有葡萄糖(1mm)的铁氰化钾溶液。chi760e电化学工作站记录和检测dpv电化学信号。根据ctcs浓度与dpv峰值电流的对应关系实现对ctcs的检测。电化学生物传感器的组装过程通过阻抗和循环伏安谱进行表征,如图2所示。根据ctcs浓度的dpv峰值电流的对应关系,计算ctcs的浓度取对数与dpv峰值电流y的线性关系曲线为y=13.941lgc+17.438,(c为ctcs的浓度),检测范围为10cells/ml~106cells/ml,检测限为3cells/ml(s/n=3),(如图3所示)。
54.图2中a为玻碳电极;b为玻碳电极/多壁碳纳米管-壳聚糖;c为玻碳电极/多壁碳纳米管-壳聚糖/葡萄糖氧化酶;d为玻碳电极/多壁碳纳米管-壳聚糖/葡萄糖氧化酶/适配体;e为玻碳电极/多壁碳纳米管-壳聚糖/葡萄糖氧化酶/适配体/循环肿瘤细胞;f为玻碳电极/多壁碳纳米管-壳聚糖/葡萄糖氧化酶/适配体/循环肿瘤细胞/抗体-聚苯乙烯微球-辣根过氧化酶。
55.研究双酶级联反应的信号放大体系,研究双酶级联反应电化学生物传感技术应用于ctcs检测,为电化学生物传感器构建研究提供了基础,为循环肿瘤细胞检测提供了重要的诊断工具,在癌症的早期诊断和临床分析方面极具价值。
56.尽管在上文中参考特定的实施例对本技术进行了描述,但是所属领域技术人员应当理解,在本技术公开的原理和范围内,可以针对本技术公开的配置和细节做出许多修改。本技术的保护范围由所附的权利要求来确定,并且权利要求意在涵盖权利要求中技术特征的或范围所包含的全部修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1