一种抗酪氨酸磷酸酶抗体测定试剂盒的制作方法
1.本发明涉及生物分析技术领域,尤其涉及一种抗酪氨酸磷酸酶抗体测定试剂盒。
背景技术:
2.1型糖尿病患者在发病前体内已存在多种自身抗体如酪氨酸磷酸酶抗体、酪氨酸磷酸酶抗体和胰岛素自身抗体等,胰岛β细胞和免疫损害往往需要经历数年时间,从而有一个较长的临床前驱期。anti-ia-2在糖尿病前期和1型糖尿病患者中的阳性率为50%-75%,年轻初发患者中的阳性率更高,并与初发病进展的速度有关。儿童anti-ia-2阳性提示很快发生临床症状明显的1型糖尿病。
3.酪氨酸磷酸酶(ia-2)是1型糖尿病的一个主要靶抗原,且特异度高。检测ia-2自身抗体对于1型糖尿病的诊断、鉴别诊断、治疗监控和预测具有重要的临床意义。目前国际上建立的方法有免疫荧光法、放射免疫法、酶联免疫吸附试验(elisa)、时间分辩荧光免疫分析法和放射配体检测法。免疫荧光法,操作较复杂,需要昂贵的荧光显微镜,只能进行定性检测,分析结果的客观性不足;elisa等方法因在包被过程中遮蔽了抗原表位或抗体不能充分与其反应,致使灵敏度降低。多次国际标准化评估显示,放射配体检测法具有高灵敏度和特异度,是检测ia-2自身抗体最有效的方法。然而,放射配体检测ia-2自身抗体影响因素众多,只有在严格的质量控制情况下才能得到理想的结果,还存在放射性污染的问题。
技术实现要素:
4.本发明旨在至少克服上述现有技术的缺点与不足其中之一,提供一种抗酪氨酸磷酸酶抗体测定试剂盒。本发明目的基于以下技术方案实现:
5.一种抗酪氨酸磷酸酶抗体测定试剂盒,包括彼此独立的试剂1和试剂2,其中:
6.所述试剂1由稳定剂和防腐剂置于ph为6.5~7.5的缓冲液中组成;
7.所述试剂2由牛血清白蛋白、表面活性剂、防腐剂和包被有酪氨酸磷酸酶抗原胶乳颗粒置于ph为6~8的缓冲液中组成。
8.优选地,所述稳定剂包括氯化钠、和/或氯化钾。
9.优选地,所述防腐剂包括叠氮钠、procline300、山梨酸钾、苯甲酸钠、亚硝酸钠中的一种或多种。
10.优选地,所述缓冲液包括柠檬酸钠、2-吗啉乙磺酸、4-羟乙基哌嗪乙磺酸、三羟甲基氨基甲烷或pbs缓冲液。
11.优选地,所述表面活性剂包括吐温20、吐温40、吐温60、吐温80、曲拉通x-100中的一种或多种。
12.优选地,所述试剂1包括柠檬酸钠50~150mmol/l,氯化钠0.05~0.3mol/l,防腐剂0.01~0.06wt%;
13.所述试剂2包括柠檬酸钠50~150mmol/l,牛血清白蛋白0.5~2wt%,吐温20 0.5~2wt%,防腐剂0.01~0.06wt%,包被有酪氨酸磷酸酶抗原胶乳颗粒0.2~3wt%。
14.优选地,所述试剂1包括柠檬酸钠100mmol/l,氯化钠0.15mol/l,防腐剂0.03wt%;
15.所述试剂2包括柠檬酸钠100mmol/l,牛血清白蛋白1wt%,吐温20 1wt%,防腐剂0.03wt%,包被有酪氨酸磷酸酶抗原胶乳颗粒1wt%。
16.优选地,本发明提供的一种抗酪氨酸磷酸酶抗体测定试剂盒,还包括校准品,所述校准品包含50wt%人血清、25~100mmol/l缓冲剂、2~10wt%保护剂、0.05~0.3mol/l氯化钠、0.01~0.06wt%防腐剂、靶值浓度范围为450~600iu/ml的抗酪氨酸磷酸酶抗体。
17.优选地,本发明提供的一种抗酪氨酸磷酸酶抗体测定试剂盒,还包括质控品,所述质控品包含50wt%人血清、25~100mmol/l缓冲剂、2~10wt%保护剂、0.05~0.3mol/l氯化钠、0.01~0.06wt%防腐剂、抗酪氨酸磷酸酶抗体,所述抗酪氨酸磷酸酶抗体的水平1目标浓度范围为3~100iu/ml,所述抗酪氨酸磷酸酶抗体的水平2目标浓度范围为100~300iu/ml。
18.优选地,所述校准品和/或质控品的性状为冻干粉。
19.优选地,所述缓冲剂的ph为6.0~8.0。
20.优选地,所述试剂1和2按照体积比1.5~5:1进行免疫凝集反应。
21.本发明可至少取得如下有益效果其中之一:
22.本发明的试剂盒采用胶乳免疫比浊法为检测原理测定血清抗酪氨酸磷酸酶抗体,在反应体系中,样本中的抗酪氨酸磷酸酶抗体和包被有酪氨酸磷酸酶抗原胶乳颗粒相结合,形成不溶性免疫复合物,使反应液产生浑浊,可根据浊度吸光度变化计算样本中的抗酪氨酸磷酸酶的活性。与目前临床使用试剂盒相比,特异性、灵敏度、准确性一致,且本发明的试剂盒适用于各种生化分析仪上大批量测定,不需要昂贵的检测仪器,检测时间短、操作方便、检测成本低、无放射性污染,适合临床推广使用。
具体实施方式
23.下面将对本发明的实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
24.检验原理:
25.在反应体系中,样本中的抗酪氨酸磷酸酶抗体和包被有酪氨酸磷酸酶抗原胶乳颗粒相结合,形成不溶性免疫复合物,使反应液产生浑浊,可根据浊度吸光度变化计算样本中的抗酪氨酸磷酸酶的活性。
26.实施例1试剂盒的制备
27.一.试剂1和试剂2
28.1.试剂主要原料
29.抗酪氨酸磷酸酶抗体测定试剂盒(胶乳免疫比浊法)的主要原料是包被有酪氨酸磷酸酶抗原的胶乳颗粒,经过对国内外厂家的调研和筛选,选择了两个厂家的产品,分别为北京百尚利德和北京华元山水生物科技有限公司。
30.缓冲液及ph值:
31.缓冲体系ph值
tris-hcl(三羟甲基氨基甲烷)7.5pbs(nah2po4·
na2hpo4·
12h2o)7.5柠檬酸钠6.5hepes(4-羟乙基哌嗪乙磺酸)7.5mes(2-吗啉乙磺酸)6.5
32.2.实验仪器及条件
33.全自动生化分析仪(型号olympus au400)
34.检验方法:终点法检验温度:37℃
35.检验波长:600nm比色杯光径:1cm
36.以水作为空白对照
37.3.实验方法
38.每种缓冲液各取60ml,作为试剂1使用,另外,每种缓冲液各取20ml,分别加入包被有酪氨酸磷酸酶抗原胶乳颗粒0.2ml,充分混匀,作为试剂2使用。
39.试剂1:样品:试剂2的体积比=135:15:45,按照比例加入试剂1和125iu/ml的抗酪氨酸磷酸酶样品混匀,37℃反应5分钟,加入试剂2混匀,30秒后在600nm下读取吸光度值a1,5分钟后读取吸光度值
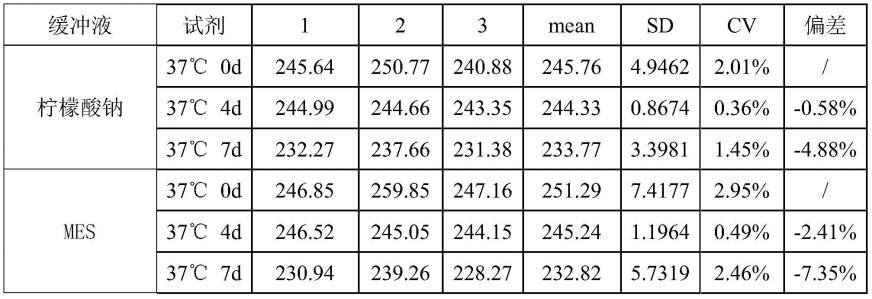
△
a2。计算a=a2-a1,
△
a应≥0.01;用纯化水代替样本检测试剂空白,a≤2.0。
40.1)定标数据:
41.缓冲体系柠檬酸钠pbsmeshepestris-hcl0-0.0162-0.0165-0.0162-0.0162-0.01758.80.04170.03940.04130.03980.041483.60.19350.10340.19620.11260.11671860.50930.22350.48030.24920.2974323.90.88140.38020.88020.49500.4651412.301.07490.58871.06610.54010.5304abs0.56720.60730.61410.57690.6078
42.2)试验数据:
43.缓冲体系柠檬酸钠pbsmeshepestris-hclph值6.57.56.57.57.5测试1262.32213.47262.00238.01251.11测试2261.58282.55246.87225.71257.93测试3243.15220.58242.39231.53277.05测试4262.06256.31254.29227.78284.50测试5260.63277.46260.07263.47276.85测试6238.45212.71252.35282.88230.12测试7257.57238.48247.68261.52282.66测试8240.14239.61256.26246.14227.67测试9258.38256.49256.94251.68264.16测试10249.58263.78242.87216.76285.07
均值253.39246.14252.17244.55263.71sd9.631725.31556.939720.519021.6480cv3.80%10.28%2.75%8.39%8.21%
44.分析试验数据,5种缓冲体系中,缓冲液为mes、柠檬酸钠时,测值的cv比较接近,且均值小于其他种类缓冲液的cv值,说明缓冲液为mes、柠檬酸钠时,anti-ia-2样品的重复性最好,需做进一步研究确定试剂缓冲体系。
45.3)37℃加速试验:
46.将mes、柠檬酸钠缓冲体系下配制的试剂,分别做37℃加速稳定性。分别在0天、4天、7天检测,重复测定对比厂家质控品3次,计算cv值及均值与0天的偏差,观察不同缓冲液体系下试剂稳定性。
[0047][0048]
通过3次试验数据可以看出,mes缓冲液配制的试剂测试样品,随着时间的变化,偏差逐渐增大,而柠檬酸钠缓冲液配制的试剂检测样品,随着时间的变化,偏差变化不大,对比可知,柠檬酸钠缓冲液配制的试剂稳定性最好,因此anti-ia-2试剂选择ph值为6.5的柠檬酸钠缓冲体系。
[0049]
4.试剂1、试剂2的配制
[0050]
(1)试剂试剂1按照以下方法进行配制:柠檬酸钠100mmol/l,氯化钠0.15mol/l,防腐剂0.03wt%;按以上配比称取好原料后加入纯水中,搅拌速度为100r/min,搅拌时间为30min,即得。
[0051]
(2)试剂试剂2按照以下方法进行配制:柠檬酸钠100mmol/l,牛血清白蛋白1wt%,吐温-20 1wt%,防腐剂0.03wt%,包被有酪氨酸磷酸酶抗原胶乳颗粒1wt%;按以上配比称取好原料后加入纯水中,搅拌速度为100r/min,搅拌时间为30min,即得。
[0052]
以上防腐剂选用叠氮钠。
[0053]
二.校准品、质控品
[0054]
1.缓冲液及ph值的选择
[0055]
[0056][0057]
试验方法:
[0058]
每种缓冲液各取10ml,分别加入抗酪氨酸磷酸酶抗体2500iu充分混匀。1)试验数据:
[0059][0060]
4种缓冲体系中,缓冲液为tris-hcl时,在3个ph范围下,测值的cv比较接近,且均小于其他种类缓冲液的cv值,说明缓冲液为tris-hcl时,anti-ia-2样品的重复性最好,因此选择tris-hcl为anti-ia-2校准品质控品缓冲体系。
[0061]
2)37℃加速试验:
[0062]
将tris-hcl缓冲体系下的3个ph梯度配制的样品,分别做37℃加速稳定性。分别在0天、4天、7天检测,重复测定tris-hcl缓冲体系下的3个ph值下配制的样品3次,计算cv值及
均值与0天的偏差,观察不同ph下样品稳定性。
[0063][0064]
通过3次试验数据可以看出,3个ph下样品变化呈现一致的趋势,即37℃放置随着时间的变化,偏差逐渐增大,对比可知,当ph值为7.5时,配制的anti-ia-2样品稳定性最好,因此anti-ia-2校准品、质控品选择ph值为7.5的tris-hcl缓冲体系。
[0065]
2.校准品、质控品的配制
[0066]
1)校准品包含50%人血清、50mmol/l缓冲剂、5%保护剂、0.15mol/l氯化钠、0.03%防腐剂、靶值浓度范围为450~600iu/ml的抗酪氨酸磷酸酶抗体。按照以上配比称取原料后,加入纯水中,搅拌速度为100r/min,搅拌时间为30min,即得。
[0067]
2)质控品包含50%人血清、50mmol/l缓冲剂、5%保护剂、0.15mol/l氯化钠、0.03%防腐剂、抗谷氨酸脱羧酶抗体,所述抗酪氨酸磷酸酶抗体的水平1目标浓度范围为3~100iu/ml,所述抗酪氨酸磷酸酶抗体的水平2目标浓度范围为100~300iu/ml。按照以上配比称取原料后,加入纯水中,搅拌速度为100r/min,搅拌时间为30min,即得。
[0068]
以上防腐剂选用叠氮钠。
[0069]
校准品、质控品的冻干参数设置如下:
[0070] 设定温度(℃)设定时间(min)持续时间(min)预冻-45 300升华干燥第1阶段-3030180升华干燥第2阶段-2030180升华干燥第3阶段-1030300升华干燥第4阶段-530180升华干燥第5阶段030180解析干燥第1阶段53060解析干燥第2阶段153060解析干燥第3阶段3030180
[0071]
为了提高校准品、质控品冻干后外观,加入5%海藻糖作为保护剂及赋形剂。校准品、质控品冻干后为致密饼状,且满足产品技术要求。
[0072]
三.试剂盒的组成
[0073][0074][0075]
实施例2试剂盒的检测方法
[0076]
一、检测方法
[0077]
1.试剂准备
[0078]
液体双试剂开瓶即用,试剂开瓶后在2℃~8℃条件下贮存可以稳定30天。校准品、质控品使用前需用1.00ml的纯化水复溶,置10℃~30℃30分钟,使冻干物完全溶解后,轻轻混合即可作为原校准品溶液和质控品溶液使用。用纯化水将原校准品溶液按下表稀释(体积比),稀释成六个浓度梯度,稀释方法如下:
[0079]
序号123456纯化水:原液1:015:17:13:11:10:1
[0080]
2.参数设置
[0081]
检验方法:终点法检验温度:37℃
[0082]
检验波长:600nm比色杯光径:1cm
[0083]
以水作为空白对照
[0084]
3.检验步骤
[0085][0086][0087]
4.校准程序
[0088]
采用多点定标校正。
[0089]
5.质控程序
[0090]
每天对样本进行检测之前,须进行质量控制,以保障测试系统的稳定性。质控品测定结果应在允许范围内。
[0091]
6.计算
[0092][0093]
7.参考区间
[0094]
血清:≤10iu/ml
[0095]
本参考区间通过本公司对200例正常人群样本验证,采取正态分布方法,在95%置信区间下获得,由于地理、人种、性别及年龄等差异,建议各实验室建立自己的参考区间。
[0096]
二、产品性能指标
[0097]
1.空白限:试剂盒的空白限≤2iu/ml。
[0098]
2.准确度:测试国际标准物质(编号:who 97/550),重复检测3次,测试结果的相对偏差不超过
±
10%。
[0099]
3.线性:
[0100]
在[3,500]iu/ml区间内,线性相关系数r≥0.990;
[0101]
在[3,100]iu/ml区间内,线性绝对偏差不超过
±
10iu/ml;
[0102]
在(100,500]iu/ml区间内,线性相对偏差不超过
±
10%。
[0103]
4.精密度:
[0104]
测试高、低两浓度样本,其结果的变异系数cv≤10%。
[0105]
随机抽取三批试剂盒,测试同一份样本,批间相对极差(r)≤10%。
[0106]
校准品、质控品瓶间变异系数cv≤10%。
[0107]
5.质控品赋值有效性:质控品检测结果应在其质控范围内。
[0108]
6.干扰能力的评价
[0109]
若标本中含有以下浓度的干扰物,对检测结果无显著影响:
[0110]
胆红素≤20mg/dl、血红蛋白≤5g/l、抗坏血酸≤20mg/dl、甘油三酯≤15mmol/l、脂肪乳剂≤750mg/dl、类风湿因子≤500iu/ml。
[0111]
对于超出试剂盒线性范围的样本采用生理盐水稀释后测定,报告结果乘以稀释倍数,但样本稀释倍数应不大于5倍。
[0112]
实施例3对实施例1的试剂盒进行检测
[0113]
按照实施例2的检测方法及产品性能指标对实施例1的试剂盒进行检测。
[0114]
1.空白限
[0115][0116]
试剂盒的空白限符合≤2iu/ml的要求。
[0117]
2.准确度
[0118] 123标定浓度范围结论水平199.5498.1497.66100
±
10合格水平2206.64211.90200.52200
±
20合格
[0119]
3.线性范围
[0120]
配制标准样品,每个浓度的样本用实施例1中的试剂盒测定3次取平均值,对测定值进行相关分析。本实验验证的抗酪氨酸磷酸酶抗体分析测量范围为0~500u/ml,r=1.0000,结果见下表。
[0121][0122]
4.精密度
[0123]
用实施例1中制备的试剂测定批内精密度。选择低值和高值两个水平的质控血清作为评价样本,批内精密度:在较短的时间内及稳定的条件下连续重复测定10次,记录每次的测定结果并计算均值、标准差(sd)、变异系数(cv)。
[0124]
12345678910平均值sdcv50.6648.4051.3749.5648.0152.1048.5051.4951.3250.9950.241.492.97%207.79206.66197.75200.65196.81193.75204.01196.38204.02193.69200.155.212.60%
[0125]
试剂盒的批内cv最高为2.97%,符合试剂≤10%的要求。
[0126]
校准品、质控品瓶间变异系数的测定方法同上。
[0127][0128][0129]
校准品、质控品瓶间变异系数符合试剂≤10%的要求。
[0130]
5.质控品赋值有效性
[0131] 123质控范围结论水平150.6950.4648.3249.97(39.98~59.96)iu/ml合格水平2204.87199.18194.95199.97(159.98~239.96)iu/ml合格
[0132]
6.效期稳定性评价
[0133]
对2℃-8℃留样产品第14个月进行实验监测,其各项指标均符合要求。
[0134]
具体数据如下:
[0135]
批号:sa01810101生产日期:2018.04.04有效期至:2019.04.03检测时间:2019.06.10
[0136][0137][0138]
7.复溶稳定性评价
[0139]
对2℃-8℃留样校准品、质控品在近效期做复溶稳定性检测,其各项指标均符合要
求。具体数据如下:
[0140]
1)一批产品的校准品、质控品第9天复溶测定数据(对照组):
[0141]
批号:sa01810101生产日期:2018.04.04有效期至:2019.04.03复溶日期:2019.03.29检测时间:2019.03.29
[0142][0143][0144]
2)一批产品的校准品、质控品起始时间复溶,2℃~8℃条件下密闭贮存9天测定数据:
[0145]
批号:sa01810101生产日期:2018.04.04有效期至:2019.04.03复溶日期:2019.03.20检测时间:2019.03.29
[0146][0147][0148]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1