一种精确控制药物分子的装置及方法与流程
本发明涉及医疗器械制造技术领域,更具体地,涉及一种精确控制药物分子的装置及方法。
背景技术:
近年来,随着生物工程、细胞工程和基因工程技术重要性的提升,它们在国民经济发展中的作用也越来越大。
在这些工程技术中,如细胞核移植、细胞内药物注射、胚胎注射以及细胞杂交等细胞操作技术,需要对细胞进行药物注射,注射的基本工具是玻璃微针,即将药物注入玻璃微针内,然后通过精确定位以及位移调整系统,将针尖刺入细胞实现药物的微量注射,而过程中需要根据施加不同药物剂量的理疗效果的精确对比,确定出“最佳剂量”。注射用玻璃微针的长径比较大,注射时需要克服较大的阻力,若是传统的人工操作,则出现难以控制操作压力的问题。因此,在现代细胞学与分子生物学领域中,如何高效便捷地对细胞进行定量的药物注射成为了当前的研究热点。
目前,细胞药物定量控制注射的方法主要有两种:
1.利用气动装置在细胞注射器中实现药物的定量注射。在这个过程中,需要工作人员手动调节和显微观察同时进行,主要依靠操作者的技术去实现,因此该方法存在着控制药物分子剂量的精度较差、效率较低及成本较高的问题。
2.依靠微流体系统实现药物定量注射。本方法控制药物剂量的精度较高,但其制造成本也很高,难以达到产业化的要求。
因此,研究一种操作方法简单、工作效率高且又能从药物分子级别实现药物用量精确控制的装置具有十分重要的意义。
技术实现要素:
为克服现有技术操作不方便,且对药物的控制剂量精度较差,而能实现药物剂量精确控制的技术又具有生产成本高的弊端,本发明提供了一种精确控制药物分子的装置及方法,达到操作便捷、生产成本低且精确控制药物分子用量的目的。
为了达到上述技术效果,本发明的技术方案如下:
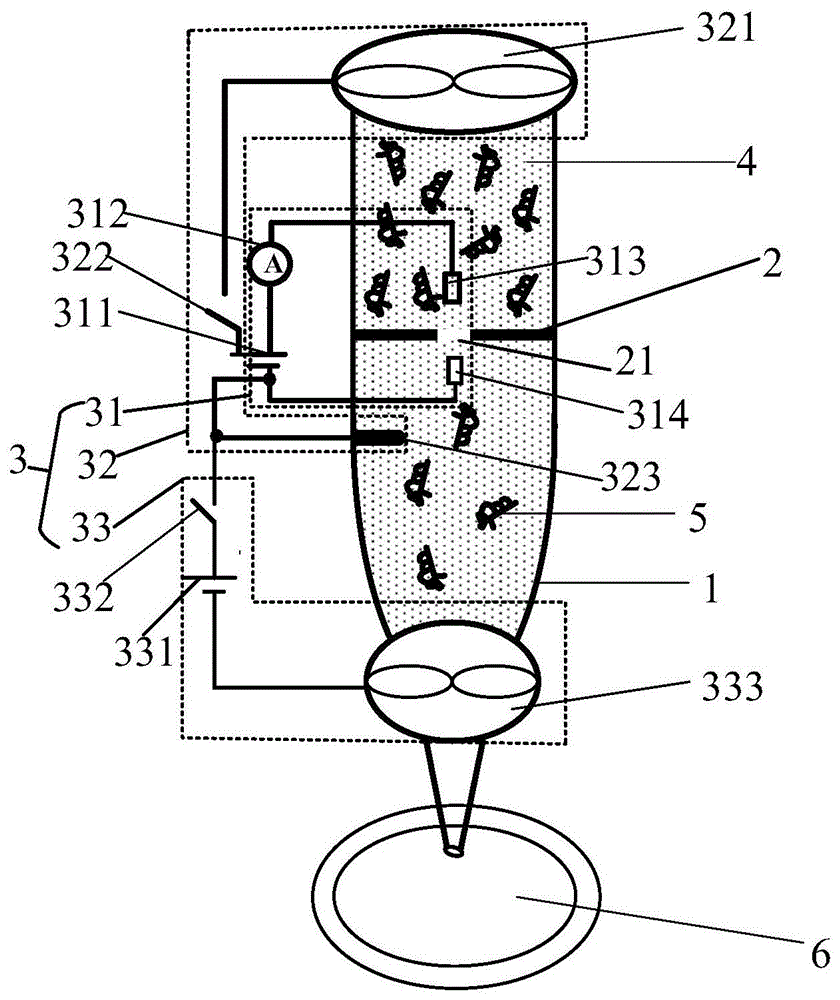
一种精确控制药物分子的装置,所述装置包括筒状玻璃针1、纳米孔芯片2及控制驱动电路3;所述控制驱动电路3包括用于统计药物分子5数量的计数测量电路31、用于驱动药物分子5穿过纳米孔芯片2的第一驱动电路32及用于驱动药物分子5注入待检测细胞6的第二驱动电路33;所述纳米孔芯片2采用阳极键合的现有方法水平固定于玻璃针1的内侧壁上:玻璃针1的内侧壁和金属材质的纳米孔芯片2的边缘接触,在加热通入直流电后,纳米孔芯片2的边缘牢固地连接到玻璃针1的内侧壁上;玻璃针1的内腔填充有电解质溶液4,电解质溶液4内溶解有药物分子5。
优选地,所述玻璃针1呈上粗下细状,包括上端筒11及下端筒12,所述上端筒11呈空心圆柱状,直径为2~5mm;所述下端筒12呈上粗下细的空心圆台状,下端筒12尖端的口径为1~10μm。
优选地,所述纳米孔芯片2为硅芯片、氮化硅芯片、二氧化硅芯片中的任意一种;在纳米孔芯片2的中心处打出纳米孔21的技术可以为聚焦离子束、高能电子束、激光中的任意一种,所述纳米孔21的直径为10~200nm。
优选地,所述玻璃针1上设有微泵,所述微泵包括用于驱动药物分子5穿过纳米孔21的第一驱动微泵321及用于驱动药物分子5注入待检测细胞6的第二驱动微泵333;所述第一驱动微泵321设置于玻璃针1的顶端;所述第二驱动微泵333设置于下端筒12上,与下端筒12尖端的距离不超过下端筒12竖直高度的1/3。
优选地,所述计数测量电路31包括第一电源311、电流测量装置312及第一电极313、第二电极314,第一电极313、第二电极314与纳米孔21的中心位于同一条轴线上,便于电流测量装置312能够准确测量药物分子5穿过纳米孔21时的测量电流i;设置于纳米孔芯片2上方的第一电极313通过电流测量装置312电连接第一电源311的正电位端,设置于纳米孔芯片2下方的第二电极314电连接第一电源311的负电位端,所述电流测量装置312为皮安级电流表,当任意一个药物分子5通过纳米孔芯片2的纳米孔21时,所述电流测量装置312的读数下降,使所述电流测量装置312的读数下降的电流为阻塞电流idown,计数测量电路31在玻璃针1的内腔填充电解质溶液4后,成为闭合导通的回路,药物分子5未通过纳米孔21时,电流测量装置312的读数为不变的初态电流i0,当任意一个药物分子通过纳米孔21时,测量电流i会由原来的初态电流i0下降为阻塞电流idown,当该药物分子5通过纳米孔21后,测量电流i将由阻塞电流idown恢复为初态电流i0,因此,工作人员通过观察所述电流测量装置312的电流读数,记录测量电流i下降的次数,即可对通过纳米孔21的药物分子5的数目进行准确计数,从而进一步精确控制药物分子的用量。
优选地,所述第一驱动电路32包括第一开关322及设置于玻璃针1内腔的微阀323,第一驱动微泵321通过第一开关322电连接第一电源311的正电位端,第一电源311的负电位端电连接微阀323的一端,当第一开关322闭合后,第一驱动电路32导通,第一驱动微泵321及设置于玻璃针1内腔的微阀323启动,由于第一驱动微泵321设置于玻璃针1的上端,所以第一驱动微泵321通过第一开关322电连接第一电源311的正电位端,第一驱动微泵321发力,电解质溶液4中的离子带动药物分子5向下运动,到达纳米孔21的上方,进一步依次穿过纳米孔21;而断开第一开关322后,第一驱动电路32无法构成闭合回路,电解质溶液4中的离子无法运动,药物分子5也停止向下运动。
优选地,所述第二驱动电路33包括有第二电源331及第二开关332,微阀323的一端还通过第二开关332连接第二电源331的正电位端,第二电源331的负电位端电连接第二驱动微泵333的一端;当闭合第二开关332后,第二驱动电路33导通,第二驱动微泵333及微阀323启动,由于第二驱动电路33中第二驱动微泵321相对微阀323的位置与第一驱动微泵321相对微阀323的位置相反,第二驱动微泵333设置于玻璃针1的下端,所以第二驱动微泵333通过第二开关332电连接第二电源331的负电位端,第二驱动微泵333发力,电解质溶液4中的离子带动已穿过纳米孔21后的药物分子5继续往下运动,利用玻璃针1的尖端将药物分子5输送至待检测的细胞6内。
优选地,所述第一电源311、第二电源331的电压均为100~300mv。
本发明还提出一种精确控制药物分子的方法,所述方法通过上述精确控制药物分子的装置实现,包括如下步骤:
s1.利用注射针将含有药物分子5的电解质溶液4注入玻璃针1的内腔;
s2.闭合第一驱动电路32的第一开关322,第一驱动微泵321与微阀323开启,第一驱动微泵321与微阀323共同驱动电解质溶液4,并带动药物分子5向下穿过纳米孔21;
s3.观察电流测量装置312的读数,并记录电流测量装置312读数下降的次数作为穿过纳米孔21的药物分子5的个数;
s4.当通过纳米孔21的药物分子5的个数达到所需药物分子5的数目时,断开第一驱动电路32的第一开关322,第一驱动微泵321与微阀323停止工作,处于纳米孔21上方未穿过纳米孔21的药物分子5停止向下运动;
s5.闭合第二驱动电路33的第二开关332,第二驱动微泵333与微阀323开启,第二驱动微泵333与微阀323共同驱动电解质溶液4,并带动已穿过纳米孔21的药物分子5向下运动,利用玻璃针1的尖端将药物分子5输送至待检测的细胞6内。
与现有技术相比,本发明技术方案的有益效果是:
(1)本发明提出的装置采用计数测量电路,从观察电流变化的角度出发,通过初态电流与阻塞电流的对比,记录阻塞电流出现的次数即为通过纳米孔药物分子的个数,从分子级别上实现对细胞定量药物注射的精确控制,从而确定最佳理疗效果的药物用量。
(2)本发明提出的装置仅利用控制驱动电路就可以实现精确控制药物分子过孔的数量,无需利用显微镜等其它制造成本高的辅助装置,且操作简单,对工作人员的操作技术要求不苛刻,能够有效提高生产效率。
附图说明
图1为本发明提出的精确控制药物分子装置的整体结构示意图。
图2为本发明提出的精确控制药物分子装置的玻璃针结构示意图。
图3为本发明提出的纳米孔芯片的结构示意图。
图4为本发明提出的精确控制药物分子的方法流程图。
图5为本发明提出的装置使用过程中测量电流图。
具体实施方式
附图仅用于示例性说明,不能理解为对本专利的限制;
为了更好说明本实施例,附图某些部件会有省略、放大或缩小,并不代表实际产品的尺寸;
对于本领域技术人员来说,附图中某些公知结构及其说明可能省略是可以理解的。
下面结合附图和实施例对本发明的技术方案做进一步的说明。
实施例1
如图1所示的一种精确控制药物分子的装置整体结构示意图,装置包括筒状玻璃针1、纳米孔芯片2及控制驱动电路3;控制驱动电路3包括用于统计药物分子5数量的计数测量电路31、用于驱动药物分子5穿过纳米孔芯片2的第一驱动电路32及用于驱动药物分子5注入待检测细胞6的第二驱动电路33。
参加图1-图3,其中图2表示的玻璃针1的结构示意图,玻璃针1呈上粗下细状,包括上端筒11及下端筒12,上端筒11呈空心圆柱状,直径为2~5mm,所述下端筒12呈上粗下细的空心圆台状,下端筒12尖端的径向距离为1~10μm,上端筒11的直径可以取距离范围的两个端点,下端筒12尖端的径向距离也可以取径向距离范围的两个端点,在本实施例中,上端筒11的直径为3mm,下端筒12尖端的口径为8μm。
图3表示纳米孔芯片的结构示意图,纳米孔芯片2为硅芯片,在纳米孔芯片2的中心处打出纳米孔21的技术为聚焦离子束,纳米孔21的直径为10~200nm,纳米孔21的直径可以取直径范围的两个端点,在本实施例中,纳米孔21的直径为50nm。纳米孔芯片2水平内嵌于玻璃针1的内侧壁上,纳米孔芯片2嵌入玻璃针1的内侧壁采用阳极键合的现有方法,相互重叠的玻璃针1的内侧壁和金属材质的纳米孔芯片2在加热时通入直流电后,纳米孔芯片2牢固地连接到玻璃针1的内侧壁上;玻璃针1的内腔填充有电解质溶液4,玻璃针1上设有微泵,微泵通过电解质溶液4、控制驱动电路3的第一驱动电路32及第二驱动电路33,驱动药物分子穿过纳米孔芯片2,并注入待检测的细胞6内,在本实施例中,药物分子5为氧化锌量子点,待检测的细胞6为人表皮癌细胞。
玻璃针1上设有微泵,微泵包括用于驱动药物分子5穿过纳米孔21的第一驱动微泵321及用于驱动药物分子5注入待检测细胞6的第二驱动微泵333;第一驱动微泵321设置于玻璃针1的顶端;第二驱动微泵333设置于下端筒12上,与下端筒12尖端的距离不超过下端筒12竖直高度的1/3,在本实施例中,为保证药物分子5顺利注入细胞6,第二驱动微泵333与下端筒12尖端的距离为下端筒12竖直高度的1/3。
计数测量电路31包括第一电源311、电流测量装置312及第一电极313、第二电极314,所述第一电极313、第二电极314与纳米孔21的中心位于同一条轴线上,便于准确测量到药物分子5穿过纳米孔21时的测量电流i;设置于纳米孔芯片2上方的第一电极313通过电流测量装置312电连接第一电源311的正电位端,置于纳米孔芯片2下方的第二电极314电连接第一电源311的负电位端,电流测量装置312为皮安级电流表,当任意一个药物分子5通过纳米孔芯片2的纳米孔21时,电流测量装置312的读数下降,使电流测量装置312的读数下降的电流为阻塞电流idown。
计数测量电路31在玻璃针1的内腔填充电解质溶液4后,成为闭合导通的回路,药物分子5未通过纳米孔21时,电流测量装置312的读数为不变的初态电流i0,当任意一个药物分子通过纳米孔21时,测量电流i会由原来的初态电流i0下降为阻塞电流idown,当该药物分子5通过纳米孔21后,测量电流i将由阻塞电流idown恢复为初态电流i0,因此,工作人员通过观察电流测量装置312的电流读数,记录测量电流i0下降的次数,即可对通过纳米孔21的药物分子数进行准确计数,从而进一步精确控制药物分子的数量。
第一驱动电路32包括第一开关322及设置于玻璃针1内腔的微阀323,第一驱动微泵321通过第一开关322电连接第一电源311的正电位端,第一电源311的负电位端电连接微阀323的一端,当第一开关322闭合后,第一驱动电路32导通,第一驱动微泵321及设置于玻璃针1内腔的微阀323启动,由于第一驱动微泵321设置于玻璃针1的上端,所以第一驱动微泵321通过第一开关322电连接第一电源311的正电位端,第一驱动微泵321发力,电解质溶液4中的离子受正电位端的激发,带动药物分子5向下运动,到达纳米孔21的上方,进一步依次穿过纳米孔21,而断开第一开关322,则第一驱动电路32无法构成闭合回路,电解质溶液4中的离子无法运动,药物分子5也停止向下运动。
第二驱动电路33包括第二电源331及第二开关332,微阀323的一端还通过第二开关332连接第二电源331的正电位端,第二电源331的负电位端电连接第二驱动微泵333的一端;当闭合第二开关332后,第二驱动电路33导通,第二驱动微泵333及微阀323启动,由于第二驱动微泵333设置于玻璃针1的下端,第二驱动电路33中第二驱动微泵321相对微阀323的位置与第一驱动微泵321相对微阀323的位置相反,所以第二驱动微泵333通过第二开关332电连接第二电源331的负电位端,第二驱动微泵333发力,电解质溶液4中的离子受反向负电位的激发,带动已穿过纳米孔21后的药物分子5继续往下运动,利用玻璃针1的尖端将药物分子5输送至待检测的细胞6内。第一电源311、第二电源331的电压均为100~300mv,电压可取值包括范围的两个端点,在本实施例中,第一电源311与第二电源331的电压均为200mv。
实施例2
本发明还提出一种精确控制药物分子的方法,该方法通过上述精确控制药物分子的装置实现,方法的流程图如图4所示,共包括如下步骤:
s1.利用注射针将含有药物分子5的电解质溶液4注入玻璃针1的内腔,注入电解质溶液4的目的是为了之后控制驱动电路3服务,确保开关闭合之后,由于电解质溶液4的存在,控制驱动电路3可以导通,从而使装置玻璃针1的内部药物分子5的运动走向可以受控制驱动电路3的控制。
s2.闭合第一驱动电路32的第一开关322,第一驱动微泵321与微阀323开启,第一驱动微泵321与微阀323共同驱动电解质溶液4,并带动药物分子5向下穿过纳米孔21;当第一开关322闭合后,第一驱动电路32导通,第一驱动微泵321及设置于玻璃针1内腔的微阀323启动,由于第一驱动微泵321设置于玻璃针1的上端,所以第一驱动微泵321通过第一开关322电连接第一电源311的正电位端,第一驱动微泵321发力,电解质溶液4中的离子受正电位的激发,带动药物分子5向下运动,到达纳米孔21的上方,进一步依次穿过纳米孔21。
s3.观察电流测量装置312的读数,并记录电流测量装置312读数下降的次数作为穿过纳米孔21的药物分子5的个数;
如图5所示的装置使用过程中的测量电流图,计数测量电路31在玻璃针1的内腔填充电解质溶液4后,成为闭合导通的回路,药物分子5未通过纳米孔21时,电流测量装置312的读数为初态电流i0,一直持续到ts时刻,当任意一个药物分子5通过纳米孔21时,测量电流i由原来的初态电流i0下降为阻塞电流idown,参见图5,初态电流i0下降为阻塞电流idown的初始测量时刻为ts,当该药物分子5通过纳米孔21后,测量电流i将由阻塞电流idown恢复为初态电流i0,由阻塞电流idown恢复为初态电流i0的测量时刻为tz,阻塞电流idown从ts到tz的持续时间为一个药物分子5通过纳米孔21的时间,工作人员通过观察电流测量装置312的电流读数,记录测量初态电流i0下降的次数,即可对通过纳米孔21的药物分子数进行准确计数,从而进一步精确控制药物分子的数量。
s4.当通过纳米孔21的药物分子5的个数达到所需药物分子5的数目时,断开第一驱动电路32的第一开关322,第一驱动微泵321与微阀323停止工作,处于纳米孔21上方未穿过纳米孔21的药物分子5停止向下运动;
s5.闭合第二驱动电路33的第二开关332,第二驱动微泵333与微阀323开启,第二驱动微泵333与微阀323共同驱动电解质溶液4,并带动已穿过纳米孔21的药物分子5向下运动,利用玻璃针1的尖端将药物分子5输送至待检测的细胞6内。
当闭合第二开关332后,第二驱动电路33导通,第二驱动微泵333及微阀323启动,由于第二驱动电路33中第二驱动微泵321相对微阀323的位置与第一驱动微泵321相对微阀323的位置相反,第二驱动微泵333设置于玻璃针1的下端,所以第二驱动微泵333通过第二开关332电连接第二电源331的负电位端,第二驱动微泵333发力,电解质溶液4中的离子受反向负电位的激发,带动已穿过纳米孔21后的药物分子5继续往下运动,利用玻璃针1的尖端将药物分子5输送至待检测的细胞6内。
相同或相似的标号对应相同或相似的部件;
附图中描述位置关系的用于仅用于示例性说明,不能理解为对本专利的限制;
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!