基于医疗图像的心源性栓塞型中风风险预测系统和方法与流程
本申请主张提交于2016年3月1日的美国临时申请号62/301,861的权益,其公开内容通过引用以其整体被并入到本文中。
背景技术:
本发明涉及患者特定的中风风险预测,并且更特别地涉及基于医疗图像的患者特定的心源性栓塞型中风风险预测。
中风在美国中是成人残疾的主要原因以及死亡的第五主要原因。有两种类型的中风,出血性和缺血性,其中发生的中风近似13%为出血性并且87%为缺血性。缺血性中风又可以是栓塞型(~20%)或血栓型(~80%)类型。在栓塞型中风中,血凝块或血小板碎片形成在人体中的某处(通常是心脏)并且运送到大脑,其在大脑处阻塞小血管。在血栓型中风中,血凝块形成在向大脑供给血液的动脉内部。
由于较大颅内动脉阻塞和较大的缺血性脑容积,栓塞型中风比非栓塞型中风不成比例地更加致残。已估算出45-50%的栓塞型中风发生在具有心房纤颤(afib)的心脏中。此外,已估算出2011年美国中大约230万到320万人受心房纤颤影响,并且基于流行病学数据,到2050年,患有心房纤颤的患者的未来推测可能超过1200万。
关于针对心源性栓塞型中风患者的风险预测的当前临床实践是大量的,并且包括详细病史、体检(包括针对杂音的心脏听诊和针对心律不齐的评估)、神经成像、心电图以及实验室和超声心动图数据。然而,从这样的评估提取的风险指标受限于具有大的方差的简单统计指示符,其通常是基于临床纵向数据。该风险预测方法存在多种缺点,包括时间可塑性(即,不确定性)和大范围的这些指标,以及弱/降低的患者特异性。
技术实现要素:
本发明提供了一种用于患者特定的缺血性中风风险的预测的方法和系统。本发明的实施例提供基于对左心房(la)和左心耳(laa)的自动化分析的缺血性中风风险预测。
在本发明的一个实施例中,从患者的医疗图像数据提取左心房(la)和左心耳(laa)测量结果。基于从患者的医疗图像数据提取的la和laa测量结果,使用患者特定的心功能计算模型来计算针对患者的la和laa的导出度量。基于提取出的la和laa测量结果以及针对患者的la和laa计算出的导出度量,使用经训练的基于机器学习的分类器来计算针对患者的中风风险分值,其中将提取出的la和laa测量结果以及针对患者的la和laa计算出的导出度量作为特征输入到经训练的基于机器学习的分类器。
通过参考以下详细描述和附图,本发明的这些和其它优点对本领域技术人员将是清楚的。
附图说明
图1图示出根据本发明的实施例的基于医疗图像的患者特定的缺血性中风风险预测的方法;
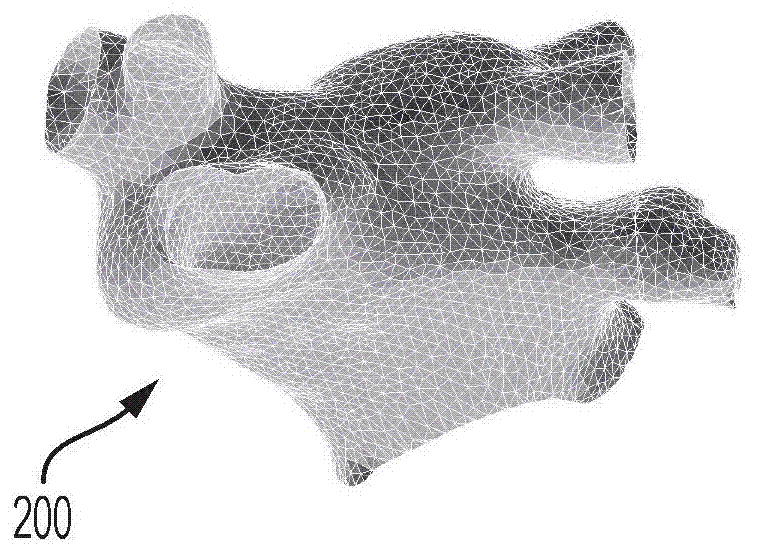
图2图示出从ct数据分割的左心房(la)的示例性三角形网格;
图3图示出根据本发明的实施例的基于部分的左心房(la)模型;
图4图示出la中的仿真血流的示例;
图5图示出其中在la的表面上视觉化血液动力学特征区域的示例性特征图;以及
图6是能够实现本发明的计算机的高级框图。
具体实施方式
本发明涉及基于对医疗图像中的左心房(la)和左心耳(laa)的自动化分析的患者特定的缺血性中风风险预测。数字图像经常包括一个或多个对象(或形状)的数字表示。在本文中经常在识别和操纵对象方面描述对象的数字表示。这样的操纵是在存储器或计算机系统的其它电路/硬件中完成的虚拟操纵。相应地要理解的是,可以使用存储在计算机系统内或通过网络系统可用的数据在计算机系统内执行本发明的实施例。
本发明的实施例提供基于对la和laa的自动化分析的针对患者的缺血性中风风险预测。虽然心房纤颤、心房扑动、窦房结功能障碍/心房停搏、心律失常、房间隔瘤以及chiari网都与左心房血栓相关联,但是laa被认为是主要形成地点。针对这样的形成的机理涉及到由于低效的血液排出(例如,与病理性收缩模式相关联)导致的血液在laa中的停滞。本发明的实施例提供了使用基于与laa相关联的特征的生物指标以及包括药物治疗类型的“外因”生物指标的患者特定的缺血性(心源性栓塞型)中风风险分层。与laa相关联的特征可以包括形态特征、血液动力学特征和通过机器学习算法检测到的“隐藏”变量。本发明的实施例依赖于计算建模来揭露在laa血栓形成和栓塞型中风最终风险中起作用的各种因素。本发明的实施例利用患者特定的解剖和计算建模来确定laa血栓形成的公知风险因素,包括chads2分值、la容积、左心室射血分数(lvef)和稠密自发性回声造影(sec)等级,以及感兴趣的新的因素,包括laa形态复杂性(例如,laa波瓣数目)和相对停留时间(rrt)。
图1图示出根据本发明的实施例的基于医疗图像的患者特定的缺血性中风风险预测的方法。在步骤102处,接收患者的医疗图像数据。可以使用任何类型的医疗成像模态获取医疗图像数据,所述医疗成像模态诸如磁共振成像(mri)、计算机断层扫描(ct)、c形臂ct(dynact)、3d超声心动图(echo)、三维旋转血管造影术、超声(us)等,如果心脏在医疗图像数据中可见的话。在有优势的实现中,医疗图像数据包括三维(3d)和/或4d(3d+时间)医疗图像数据。可以直接地从图像获取设备接收医疗图像数据,所述图像获取设备诸如mri扫描器、ct扫描器、c形臂图像获取设备、或us扫描器,或者可以通过加载先前存储的患者的医疗图像数据来接收医疗图像数据。除了医疗图像数据之外,也可以接收患者的临床测量结果。例如,可以接收诸如患者的心电图(ecg)测量结果和/或压力带测量结果的临床数据。可以从患者的ecg测量结果提取诸如粗糙纤颤波、心房扑动和/或多源性房性心动过速(mat)的ep特征。
在步骤104处,从患者的医疗图像数据提取la和laa测量结果。特别地,可以通过生成la的患者特定的解剖模型从患者的医疗图像数据提取患者特定的la和laa的解剖/形态。为了生成患者特定的la解剖模型,使用医疗图像数据(例如,3decho、mri、ct、dynact)来生成la的分割,其或者被明确地表示为网格(例如,三角形网格),或者例如通过有符号或无符号的距离函数或水平集被暗含地表示。图2图示出从ct数据分割的la的示例性三角形网格200。可以生成对应于给定时间戳的单个网格,或者可以生成覆盖心动周期的全部或部分的网格序列,从而捕获la的室壁运动。在可能的实现中,仅在医疗图像数据中分割la。在其它可能的实现中,可以生成左心(即,la和左心室)的更完整的分割或者整个心脏的分割。除了患者的解剖/形态之外,还可以提取其它la和laa测量结果,诸如血液动力学或电生理学信息。例如,可以从患者的多普勒回声图像和/或相衬mri(pc-mri)图像提取诸如血流速度测量结果之类的血液动力学信息。可以从患者的ecg并且通过针对患者个性化计算ep模型来提取电生理学(ep)测量结果。可以将la中的神经和/或纤维建模为la的解剖模型的部分。
在有优势的实施例中,可以通过使用多部分心房模型在医疗图像数据中分割la来生成la的解剖模型。图3图示出根据本发明的实施例的基于部分的左心房(la)模型。如图3的图像(a)中所示,基于部分的la模型300包括la腔体302、左心耳(laa)304和四个主要肺静脉(pv)306、308、310和312。四个主要pv是左下pv312、左上pv310、右下pv308和右上pv306。laa304的形状接近于倾斜的圆锥,并且pv306、308、310和312每一个都具有管状结构。每个la部分302、304、306、308、310和312相比于整体la结构都为简单得多的解剖结构,并且因而可以使用基于模型的方法来检测和分割。根据有优势的实施例,可以首先使用边缘空间学习(msl)框架一起分割la腔体302和laa304。msl的思想不是直接地在整个相似度变换参数空间中学习整块的分类器,而是在边缘空间上递增地学习分类器。特别地,可以将每个心腔的检测分成三个问题:位置估计、位置取向估计和位置取向比例估计。基于针对这些估计问题中的每一个的带注释的训练数据来训练分离的分类器。每个分类器可以是基于带注释的训练数据训练出的概率推进树(pbt)分类器。使用较低维的边缘空间中的分类器来有效地修剪搜索空间。该对象定位阶段导致对象(例如,心腔)的估计出的变换(位置、取向和比例)。在自动对象定位之后,将对象的平均形状模型与估计出的变换对准以取得对象形状的粗略估计。然后使该形状局部地变形以拟合对象边界。可以使用主动形状模型(asm)来使非刚性形状的初始估计在图像证据和形状先验的指导下变形。然而,如在常规asm应用中使用的,基于非学习的一般性边界检测器由于复杂的背景和弱的边缘而在心腔变形中无法有效地工作。替代地,可以使用基于学习的边界检测器来开发更多的图像证据以实现鲁棒的边界检测。在发布于2011年3月29日且题为“systemandmethodforsegmentingchambersofaheartinathreedimensionalimage(用于在三维图像中分割心腔的系统和方法)”的美国专利号7,916,919、美国公开的专利申请号2010/0040272和美国公开的专利申请号2012/0022843中描述了关于基于msl的心腔分割的附加细节,这些专利通过引用被并入到本文中。一旦分割了la腔体302和laa304,就基于已分割的la腔体302使用受到统计形状约束的基于msl的分割来分割其余的la部分306、308、310和312。
一旦在医疗图像数据中分割了la部分,就将它们组合成统一的网格模型。图3的图像(b)示出包括la腔322、laa324和pv326、328、330和332的统一的la网格320。在美国专利号8,644,576和美国专利号8,724,881中描述了关于用于基于部分的心房分割的方法的附加细节,这些专利通过引用以其整体被并入到本文中。在可能的实现中,也可以或者整体地或者使用采用基于msl的分割的基于部分的方法来类似地分割右心房(ra),并且可以将la和ra模型组合成双心房网格。可以在心房网格的网格顶点上对诸如sa节点、巴克曼氏束(bb)、界嵴和梳状肌(pm)之类的心房解剖结构加标记。
可以基于历史观察对针对la的纤维取向建模。在可能的实现中,可以假定心房组织是各项同性的,并且传播在所有方向中是等可能的。替换地,如果在活的有机体内的扩散张量(dt)mr图像可用,那么可以将患者的心肌纤维的dtmr图像通过图像配准直接地映射到解剖模型。在该情况下,将dtmr图像非线性地配准到其中分割la模型的医疗图像。使用所产生的变换来使dtmr图像中的张量场朝着解剖模型变形。一旦将张量配准到解剖模型就可以使用有限应变方法来对张量重取向,在peyrat等人的“acomputationalframeworkforthestatisticalanalysisofcardiacdiffusiontensors:applicationtoasmalldatabaseofcaninehearts”(ieeetmi,26(11):1500–1514,2007)中描述了所述有限应变方法的细节,该文献通过引用被并入到本文中。还可能的是,纤维架构图谱可用,并使用标准图像配准技术将该图谱配准至患者特定的解剖la模型。
局部心房壁厚度是不均匀的,其值范围在0.8mm与3mm之间。可以从高分辨率mri图像提取区域心房壁厚度,但是针对整个心房提取心房壁厚度可能是耗时的。用以生成具有不均匀壁厚度的心房模型的替换方式是使用来自患者的心房图像的水平集二值化来执行网格增厚(针对未摘除区域)。
如果可以在医疗图像中识别组织纤维化(例如,瘢痕组织),那么该信息也被包括在患者特定的解剖la模型中。例如,可以使用de-mri图像数据来分割瘢痕组织和边界区组织。可以在de-mri图像上使用mr扫描器的坐标加上de-mri图像中的图像信息和3d解剖模型之间的相关性来刚性地配准la的3d解剖模型。然后可以采用具有可信度先验和空间正则化的期望最小化算法来分割瘢痕和边界区组织。该方法对活的有机体上的多模态图像有效,并且为了增加的鲁棒性向噪声添加平滑约束。使用具有两种模式的高斯混合模型来对健康组织和瘢痕组织建模。在给定了三类分割的情况下,可以估计混合模型的参数,从其导出置信值λ。从模型中拒绝具有λ<0.5的顶点并且将其分类为边界区。边界区是环绕表示愈合组织的瘢痕组织的区。为了增加的鲁棒性和规则性,采用马尔科夫随机域来根据近邻顶点的状态拒绝顶点。此外,永不拒绝距当前瘢痕估计比nmm更远的顶点,假定仅能够在接近瘢痕处发现边界区的话。可以采用图割算法来估计组织类型之间的平滑界面。采用使用k均值算法或类似算法获得的粗糙分类来初始化图割算法,并且对图割算法进行迭代直到收敛为止(例如,当混合模型的参数不再改变时)。然后将分割出的瘢痕组织和环绕的边界区映射到la的容积网格表示。
返回图1,在步骤106处,基于在步骤104中提取的la和laa测量结果使用患者特定的心功能计算模型来针对la和laa计算导出度量。心功能计算模型可以包括对壁机构和以完全耦合或解耦的方式的电信号传播的建模。在下面更详细地描述的有优势的实施例中,患者特定的计算ep模型可以利用用于电生理学的格子玻尔兹曼方法(lbm-ep)来仿真la中的电信号传播。可以使用整个心脏、仅左心(即,la和左心室)、仅心房(即,la和右心房)或仅la来完成这点。如果在步骤104中生成的解剖模型包括少于整个心脏,那么可以将降低维度的模型用于缺失的解剖组件以便使实现ep计算。可以将比如心房纤颤之类的病理学ep情况包括在患者特定的计算模型中并且用于生成相关联的病理学壁运动学,其可以用在步骤108的风险分值预测中。此外,可以使用患者特定的计算ep模型针对la和laa中的每个点计算诸如电激活时间和动作潜在持续时间之类的仿真ep值,并且可以基于所述仿真ep值来计算导出ep参数。示例性导出ep参数可以包括混沌去极化模式和持续转子存在。在可能的实现中,仿真ep值可以用于生成用于患者的仿真ecg信号,并且可以从所述仿真ecg信号提取诸如粗糙纤颤波、心房扑动和/或多源性房性心动过速(mat)之类的导出特征。可以在步骤108中将仿真ep值和/或导出ep参数输入为用于基于机器学习的风险分值预测的特征。
患者特定的计算ep模型是la电生理学计算模型,通过基于测量出的患者的ep数据估计患者特定的计算ep模型参数来对其进行个性化,所述参数表示la组织的组织性质。患者特定的la计算ep模型仿真la中的电信号传播。根据有优势的实现,计算ep模型使用用于电生理学的格子玻尔兹曼方法(lbm-ep)来使用多细胞模型解算患者特定的la解剖上的单域组织模型。在该方法中,使用患者特定的la解剖模型来计算用于电生理学计算的笛卡尔栅格域。首先在环绕la解剖模型的边界框中生成具有均匀网格间隔或可能地具有不相等且空间上变化的间隔的笛卡尔栅格。可以由用户定义栅格间隔,或者可以在系统中固定栅格间隔。然后如下从患者特定的解剖模型计算水平集表示。针对栅格的每个节点x,计算到解剖模型网格的最短距离,并将其指派给该节点。在有优势的实施例中,通过正距离来定义心肌层内的节点,并且通过负距离定义不在心肌层内的节点。也可以利用相反的约定而无需任何修改。照此对心肌层、心内膜和心外膜处的节点、以及与对心房激励的传导来说重要的心房解剖接口有关的其它节点加标记。例如,可以对对应于sa、bb、界嵴、梳状肌和附属器的笛卡尔栅格上的患者特定的解剖模型的节点加标记。还通过附加的水平集信息在域中报告可得到的瘢痕和边界区,并且可以将针对这样的区域的传导性设定成预定降低值或设定成零。使用光栅化技术将纤维取向f(x)映射到每个节点,或者从映射的心内和心外区直接地重新计算纤维取向f(x)。将诸如离子电流电导c(x)之类的细胞模型参数指派到每个节点x。
la的计算ep模型使用用于电生理学的格子玻尔兹曼方法(lbm-ep)计算出la内的每个节点处的跨膜电势。计算ep模型根据单域方程计算出随时间的跨膜电势的变化v(x,t):
其中,r(x,t)是描述引起动作电势的细胞机理的反应项,c(x)是局部离子电流电导,d(x)是通过(1-ρ)f(x)f(x)t+ρid定义的各向异性(横向各项同性)矩阵,ρ为跨纤维扩散率和纤维扩散率之间的比(通常ρ=0.11–0.25)。使用完全各项同性的张量d(x)用于心肌纤维架构的改进的特性也是可能的。
反应项r(x,t)的选择取决于所使用的心脏电生理学细胞模型。根据本发明的有优势的实施例,可以使用多细胞ep模型来对心房的ep建模。为了描述心房ep上的组织的非同质性效应,可以对与各种心房解剖结构有关的lbm-ep解算器的计算域中的笛卡尔节点加标签,并对所述笛卡尔节点指派不同细胞模型和/或电导率值。在示例性实现中,可以使用在courtemanche等人的“ionicmechanismsunderlyinghumanatrialactionpotentialproperties:insightsfromamathematicalmodel”(am.j.physiol.275,h301-h321(1998))中描述的courtemanche-ramirez-nattel(crn)人体心房细胞模型作为心房细胞模式。crn心房细胞模型以35个静态参数和21个常微分方程为特征来描述12个离子通道、对应的门控变量和离子浓度。
使用用于电生理学的格子玻尔兹曼方法(在本文中称为lbm-ep)来解算方程(1)。lbm-ep是用以解算单域电生理学方程的高度可并行化算法。在题为“methodandsystemforfastpatient-specificcardiacelectrophysiologysimulationsfortherapyplanningandguidance(用于针对疗法规划和引导的快速患者特定的心脏电生理学仿真的方法和系统)”的美国公开的专利申请号2013/0226542中更详细地描述了lbm-ep算法,所述专利通过引用以其整体被并入到本文中。与标准有限元方法相反,lbm-ep不明确地解算反应扩散方程,而是计算笛卡尔栅格上的粒子的“移动”,从其显现出反应扩散行为。粒子在一定概率上可以根据固定方向(或连接性)移动。该算法包括两个逐节点的步骤:流动(streaming),其使粒子从一个节点跳到另一个;以及碰撞,其处理质量保存和边界条件。可以在数学上示出的是,该简单算法再现了反应扩散方程的动力学。为了使用lbm-ep计算心脏电生理学,将域边界表示为水平集并对组织各向异性建模。在窦性节律中,可以采用隔膜处的周期性刺激来计算心电图模型以模拟快速传导的his束。
由于lbm-ep方法是完全逐节点的并且时间积分是显式的,因此可以局部地完成计算并且因而该方法容易地适用于高度平行架构。在有优势的实施例中,可以在介入期间在一个或多个通用图形处理单元(gpgpu)上实现该方法,其使实现近实时且精确的心脏电生理学计算。在该实施例中,该方法可以被优化成完全地得益于gpgpu的计算功率。例如,可以执行自适应计算块聚合来在计算功率和存储器带宽之间取得平衡。也可以实现自适应时步方法来计及电流ep动力学,尤其是在窦性节律区域中。例如,可以在正发生快速前向传播时使用小的时步,可以在不反应期期间使用较大时步,并且可以在去极化状态期间使用甚至更大的时步。也可以实现自适应网格细化技术来在存在厚壁结构(例如,心室)和薄壁结构(例如,心房)的情况下降低整体计算工作量。可以出于更好的灵活性将模型与模型库对接。
可以将la的计算ep模型与软组织中的电势传播的边界元模型相耦合以便计算产生自仿真心脏电生理学的ecg。这允许将患者的体表ecg测量结果映射回到心房模型以用于计算ep模型的个性化。心房的计算ep模型在每个时步处在计算域上针对患者特定的解剖模型的每个节点计算隔膜电势。基于隔膜电势v(x,t)使用封闭形式表达在计算域的每个节点处计算细胞外电势φe(ω定义计算域;|ω|是其中的元素数):
其中,λ是恒定扩散各向异性比,
其中,r是由x和积分点n定义的向量,而sb和sh分别是躯干和心外膜表面。可以将躯干处的体表电势
需要个性化la的计算ep模型以便对于特定患者是预测性的。基于患者的ep测量结果(诸如侵入性心脏ep图或体表电势图)来个性化la的计算ep模型。在示例性实施例中,首先使患者的电生理学(ep)数据与患者特定的心房解剖模型融合。患者的ep数据可以包括针对患者获取的侵入性心脏ep图和/或体表电势测量结果。体表电势测量结果是在患者躯干上的电势的测量结果,并且可以是指使用体表标测(bsm)或使用患者的躯干上的ecg引线的患者的ecg测量结果(例如,12个引线ecg测量结果)获取的体表电势图。通过测量心脏中的各点处随时间的电势(例如,使用导管映射系统或导管篮子系统)来侵入性地生成侵入性心脏图。为了使用侵入性心脏ep图个性化计算ep模型,将心脏ep数据配准至患者特定的心房解剖模型。
为了将体表电势测量结果(例如,使用bsm或ecg测量结果获取的体表电势图)融合到患者特定的心房解剖模型,将体表测量结果映射到被配准至患者特定的心房解剖模型的患者特定的躯干模型。可以例如在介入开始时获取患者的躯干的3d图像,并且可以从所述3d图像使用诸如图割之类的分割算法来分割患者的躯干的三角形网格。在其中不能够获取3d躯干图像的情况中,可以使用2dmri侦查图像来生成躯干模型。在该情况下,可以例如使用图割自动地提取2d侦查图像中的可见躯干的轮廓。然后可以基于所述2d侦查图像使用仿射变换来配准所存储的3d躯干图谱以匹配从2d侦查图像提取的躯干轮廓。该配准算法为了于增加的鲁棒性运用侦查图像位置(轴向、矢状和冠状)并且最小化局部极小的风险。一旦对躯干建模,就可以使用扫描器坐标将患者特定的躯干模型自动地配准至心脏模型。将从其处测量了体表电势的引线位置映射到躯干模型。例如,可以自动地或者使用用户定义的标志来映射引线位置。然后可以将体表电势测量结果投影回到患者特定的躯干解剖模型。
一旦将患者特定的躯干模型配准到了患者特定的心房解剖模型,就可以使用躯干中的扩散电模型来描述心脏和躯干之间的耦合关系。如上所述,可以通过首先从心房上的隔膜电势推断出细胞外电势并且然后使用边界元方法(bem)解算泊松方程来从心脏电势计算躯干上的电势。可以通过线性关系
使用患者的ep测量结果来个性化计算域的节点处的多细胞模型参数和电导率值。对于特定于心房的详细多细胞模型(诸如具有35个参数的crn心房细胞模型),可以使用模型降阶法来降低计算成本和模型参数数目。例如,可以通过动作电势(ap)流形学习来构建降阶模型以降低学习回归模型遵循的模型参数数目以便在降低的ap流形中预测参数。这加速了个性化过程,因为要估计的参数越多,正演解算器所需的迭代数目越大。
在一个实施例中,可以基于通过使用计算ep模型执行仿真生成的仿真ep数据与患者的ep测量结果的比较使用反问题法来执行计算ep模型的个性化。特别地,可以将个性化用公式表示为具有以下目标的优化问题:最小化使用计算ep模型计算出(仿真出)的激活时间与在测量出的患者ep数据中的激活时间之间在计算域的所有节点上(即,在患者特定的心房解剖模型的所有节点上)的逐点差异。为了增加的估计收敛和对局部极小的鲁棒性,可以采用由粗到细策略。在由粗到细策略中,首先针对整个la估计参数值(例如,电导率
在另一实施例中,可以利用机器学习方法来基于患者的ep测量结果估计la计算ep模型的个性化参数。在线下训练阶段中,使用具有不同参数值的计算ep模型创建激活图或其它ep测量结果的大数据库。利用高级非线性流形学习技术来训练回归函数,并且在给定了测量出的患者ep数据的局部激活图的情况下,通过应用经训练的回归函数来回归多细胞模型参数和电导率的局部值来在线地估计个性化参数。
心功能的计算模型还可以包括对血流的建模。可以在通过分割出的la网格给定其边界的域内使用计算流体动力学(cfd)执行la中的血流的建模/仿真。计算域可以是静态的或动态的。对于静态域,可以在la壁上施加零速度(对应于无滑移)边界条件。对于动态域,可以使用流固相互作用(fsi)框架来实现la壁与流体域(血流)之间的耦合。可以使用单向fsi来执行la壁与血流之间的fsi耦合,其中针对每个时步事先(例如,基于在4d(3d+时间)医疗图像数据中观察到的壁运动)来规定壁的运动,并且无滑移速度边界条件迫使流体(血液)以所规定的壁速度移动。在题为“methodandsystemforcomprehensivepatient-specificmodelingoftheheart(用于全面地患者特定的心脏建模的方法和系统)”的美国专利申请号8,682,626中更详细地描述了这样的方法,所述专利通过引用以其整体被并入到本文中。替换地,可以使用双向fsi公式化,其中将壁建模为可变形材料,赋予其对应于心房组织的材料性质,并且在组织与血液之间的壁处交换力和/或速度信息。实现这样的公式化的示例性方式是使用液压来生成针对可变形固体的牵引力边界条件,并且使用固体壁的位置和运动学作为针对流体(血液)的边界条件。cfd可以使用针对动量和质量守恒的标准纳维叶斯托克斯方程或者从比如格子玻尔兹曼方法(lbm)的替换公式化来仿真la中的血流。图4图示出la中的仿真血流的示例。特别地,图4示出从la中的cfd计算获得的血液速度向量402。可以在图4中所示的仿真血流中观察到laa404内的降低的循环。
根据本发明的有优势的实施例,使用患者特定的心功能计算模型来执行特定于la(且尤其是特定于laa)的血液动力学的生成分析(即,生成特征)。这可以包括主要血液动力学变量的统计特性(例如,均值),诸如血液速度和压力和/或特定于la和/或laa的导出参数。导出参数是指从计算出/仿真出的血液动力学计算出的参数或指标。导出参数/指标的示例可以直接地涉及血液动力学指标、能量或压力指标或特定laa流指标。血液动力学指标可以包括在la中的(或者在可能的实现中,仅在laa中的)基于壁切变应力(wss)的指标(例如,时间上平均的、空间平均wss(tasmwss),时间上平均的、空间最大wss,时间上平均的、空间第99百分位wss)、低壁切变区域(lsa)、低切变浓度指数(lsci)、低切变指数(lsi)、高切变区域(hsa)、sci(=hsa中的tasmwss/laa中的tasmwss)、平均、最大和第99百分位wss空间梯度(wssg)和/或平均震荡切变指数(osi)。能量和压力相关指标可以包括laa中的能量损耗、laa的压力损耗系数、动能比(ker)和/或粘性耗散比(vdr)。其它更多的特定laa流指标可以包括相对停留时间(rrt)、流内浓度指数(ici)和/或涡流长度(vl)。可以基于时间段(例如,心动周期)内的血液动力学仿真针对分割出的la网格上的每个点计算导出参数和主要血液动力学参数的统计学特性(例如,平均速度和/或平均压力)。然后可以将这样的血液动力学特征映射在分割出的la的表面上,如图5中所示。图5图示出其中在la的表面上视觉化血液动力学特征域的示例性特征图500。可以在laa上增强这样的特征域。也可以针对分割出的la网格的每个点计算诸如激活时间和动作电势持续时间之类的、使用计算ep模型计算出的ep特征。
返回到图1,在步骤108处,基于从医疗图像数据提取的la和laa测量结果和使用心功能计算模型计算出的度量来计算预测缺血性(栓塞型)中风风险的风险分值。使用步骤104中从医疗图像数据提取的la和laa测量结果和步骤106中使用心功能计算模型计算出的la和laa度量作为特征,并且使用基于机器学习的方法来基于那些特征计算中风风险分值。在示例性实施例中,可以使用深度学习来训练深度神经网络,其学习从输入特征到针对患者的中风风险分值的映射。在离线训练阶段中基于训练图像和地真值的数据库来训练深度神经网络。对于特定患者,将从医疗图像数据提取的测量特征(例如,形态特征)和使用心功能计算模型计算出的计算特征(例如,血液动力学特征和ep特征)输入到经训练的深度神经网络,并且经训练的深度神经网络基于所输入的特征来计算针对该患者的中风风险分值。要理解的是,本发明不限于深度学习,并且也可以使用其它类型的机器学习。
被输入到经训练的基于机器学习的分类器的测量特征可以包括形态(解剖)特征,其包括但不限于lv容积、laa容积和laa波瓣数目。测量特征还可以包括从医疗图像数据提取的血液动力学测量结果,诸如速度测量结果和左心室射血分数(lvef)测量结果以及患者的ep测量结果。也可以在医疗图像数据中测量稠密自发性回声造影(sec)等级并将其输入作为特征。计算出的特征可以包括仿真血液动力学特征,诸如血液动力学参数的统计学特性(例如,血液速度和压力)以及导出度量,所述导出度量包括导出血液动力学指标、能量和压力相关的指标和上面描述的其它更多特定laa相关的流指标。可以针对la中的所有网格点或针对laa中的所有网格点输入所述血液动力学特征中的每一个。计算出的特征还可以包括仿真ep特征(诸如针对la中的所有点或laa中的所有点的电激活时间和动作电势持续时间)以及导出ep特征(诸如混沌去极化模式和持续转子存在、粗糙纤颤波、心房扑动和/或多源性房性心动过速(mat))。可以使用诸如深度学习之类的基于机器学习的技术来使与特征列表相关联的“隐藏”参数的编码自动化。另外,可以针对患者计算诸如chads2分值之类的传统临床风险因素并将其作为特征输入到经训练的基于机器学习的分类器。替换地,经训练的基于机器学习的分类器可以在没有传统临床风险分值的情况下计算风险分值,并且可以将通过经训练的基于机器学习的分类器计算出的风险分值与传统风险分值(例如,chads2分值)相结合从而产生综合风险分值。
在有优势的实施例中,还可以在特征列表中包括分子信息以用于中风风险分值的基于机器学习的计算。例如,可以添加指示转变生长因子beta1(tgf-beta1)的存在的特征,该因子已被证明会增加afib易感性。在有优势的实施例中,还可以在特征列表中包括针对患者的药物信息以用于中风风险分值的基于机器学习的计算。
在步骤110处,输出中风风险分值以及提取与导出数据的视觉化。通过经训练的基于机器学习的分类器来计算针对患者的风险分值,并例如通过在计算机系统的显示器上显示该风险分值并将针对患者的风险分值存储在计算机系统的存储器或储存器中来输出该风险分值。此外,可以在计算机系统的显示器上视觉化并显示一个或多个相关特征/度量。例如,可以通过将对应于计算出的rrt值的彩图映射到提取出的la3d解剖模型并将la模型与彩图一起显示在显示设备上来视觉化la内的停滞(例如,高rrt)区域的3d视图。也可以类似地显示其它特征。
在本发明的实施例中,可以使用图1的方法来规划和测试各种治疗的疗效以查看治疗是否降低了患者的中风风险。例如,可以使用图1的方法来计算针对患者的初始中风风险分值。然后可以使用心功能计算模型来仿真各种afib治疗过程,诸如肺部静脉导管隔离,并且然后重新计算仿真心功能和计算出的更新的特征,可以从所述仿真心功能和计算出的更新的特征计算出更新的风险分值。可以将更新的风险分值与初始中风风险分值相比较以确定已仿真的afib治疗是否将会降低患者的中风风险。在美国专利申请公开号2016/0058520中描述了关于使用心房计算ep模型来仿真afib治疗的附加细节,该专利通过引用以其整体被并入到本文中。类似地,还可以使用计算模型来测试各种laa闭合设备或各种烧蚀疗法对患者的中风风险分值的影响。还可以将计算模型扩展至解决可能影响与例如阀设备疗法等有关的决策的心脏中的其它血栓形成源。
可以使用公知的计算机处理器、存储器单元、存储设备、计算机软件和其它组件在计算机上实现用于患者特定的缺血性中风风险预测的上述方法。在图6中图示出这样的计算机的高级框图。计算机602包含处理器604,其通过执行定义计算机602的总体操作的计算机程序指令来控制这样的操作。可以将计算机程序指令存储在存储设备612(例如,磁盘)中并在期望执行计算机程序指令时将其加载到存储器610中。因而,可以通过存储在存储器610和/或储存器612中的计算机程序指令来定义图1的方法的步骤,并由执行计算机程序指令的处理器604来控制所述步骤。可以将诸如ct扫描设备、c形臂图像获取设备、mr扫描设备、超声设备等的图像获取设备620连接到计算机602以将图像数据输入到计算机602。将图像获取设备620和计算机602实现为一个设备是可能的。图像获取设备620和计算机602通过网络无线地通信也是可能的。在可能的实施例中,计算机602可以相对于图像获取设备620远程地定位并且可以执行作为服务器或基于云的服务的部分的方法步骤。计算机602还包括一个或多个网络接口606以用于经由网络与其它设备通信。计算机602还包括使实现用户与计算机602的交互的其它输入/输出设备608(例如,显示器、键盘、鼠标、扬声器、按钮等)。可以与作为注释工具的一组计算机程序结合地使用这样的输入/输出设备608以注释从图像获取设备620接收到的容积。本领域技术人员将认识到的是,实际计算机的实现也可以包含其它组件,并且图6是出于说明性目的的这样的计算机的某些组件的高级表示。
可以使用以客户端服务器关系来操作的计算机来实现用于医疗图像合成的上述方法。通常,在这样的系统中,客户端计算机距服务器计算机远程地定位并且经由网络进行交互。可以通过在相应客户端和服务器计算机上运行的计算机程序来定义和控制客户端服务器关系。
前述具体实施方式应被理解为在每个方面都是说明性和示例性的而不是限制性的,并且不应从具体实施方式来确定本文中公开的发明的范围,而是从如根据由专利法允许的完整幅度所解释的权利要求来确定其范围。应理解的是,本文中描述和示出的实施例仅为对本发明的原理的说明,并且本领域技术人员可以实现各种修改而不脱离本发明的范围和精神。本领域技术人员可以实现各种其它特征组合而不脱离本发明的范围和精神。
- 还没有人留言评论。精彩留言会获得点赞!