一种小麦胚乳蛋白体面积的测定方法与流程
本发明涉及小麦胚乳蛋白体的测试技术,特别是一种小麦胚乳蛋白体面积的测定方法。
背景技术:
蛋白质是小麦胚乳重要的构成成分之一,其组分和含量的高低直接决定了面粉的加工品质。在小麦胚乳发育过程中蛋白质在一种被称为蛋白体的细胞器中积累,蛋白体的发育状况与外界环境密切相关,如干旱、低温、高温、氮肥等。在这些外界因素处理下蛋白体的发育进程不同、积累量不同、形态不同,因此在农学领域如何准确快速地定量细胞中蛋白体的积累量即相对面积显得尤为重要。
前人关于小麦蛋白体这类细胞器的相对面积的计算主要依靠photoshop,image-proplus,imagej等软件。然而使用这些软件分析相对面积的流程复杂,例如需要使用photoshop软件进行图像预处理包括去噪点、去污点、给细胞器人为着色等,同时image-proplus和imagej这类软件还需要事先设定标尺,测量时根据需要选择标尺,操作过程容易出现标尺错误,使结果产生偏差,不方便初学者使用。
技术实现要素:
本发明的目的在于提供一种操作简便、分析科学合理、结果精确可靠的小麦胚乳蛋白体面积的测定方法。
实现本发明目的的技术解决方案为:一种小麦胚乳蛋白体面积的测定方法,包括以下步骤:
步骤1、利用显微镜ccd配套软件imageview对待分析的小麦胚乳显微镜图像进行二值化处理,通过调整二值化数值获得最佳的蛋白体识别度;
步骤2、调整步骤1所得二值化图像的颜色位数,然后通过分水岭功能实现对小麦胚乳蛋白体的区域识别及统计,在统计结果中去除细胞壁噪音后获得显微镜图像中蛋白体的像素值;
步骤3、将步骤2所得蛋白体像素值与原始小麦胚乳显微镜图像的总像素值进行比值计算,完成对小麦胚乳蛋白体相对面积的测定。
进一步地,步骤1所述通过调整二值化数值获得最佳的蛋白体识别度,具体为:
调整二值化数值,根据照片明亮度增加或降低二值化的数值,使图片上蛋白体全部完整显示。
进一步地,步骤2中所述调整步骤1所得二值化图像的颜色位数,具体选择颜色位数为24位。
进一步地,步骤2中所述通过分水岭功能实现对小麦胚乳蛋白体的区域识别及统计,具体如下:
调用分水岭功能,将计数设置对话框的调整参数设置如下:拟合选择“不拟合”,孔洞选择“是”,风格选择“填充”,颜色1选择“黄色”,方法选择“是”,颜色2选择“黑色”,类型选择“序号”,面积和周长选择颜色位数为24位;点击确定完成区域识别及统计,在统计后的显微结构图中,被处理分析的区域呈现颜色1选择的黄色,不同区域以不同数字列出。
进一步地,步骤2中所述在统计结果中去除细胞壁噪音后获得显微镜图像中蛋白体的像素值,具体为:
将统计结果导出至excel表格中,在excel表格中得到所有分析区域的面积数值;观察统计后的显微结构图,并与原始显微结构图对比,将非蛋白体区域即非圆形的区域对应的编号删除,得出净蛋白体区域的面积像素值。
进一步地,步骤3所述将步骤2所得蛋白体像素值与原始小麦胚乳显微镜图像的总像素值进行比值计算,完成对小麦胚乳蛋白体相对面积的测定,公式如下:
ds=s/s
其中,ds为小麦胚乳蛋白体相对面积,s为原始小麦胚乳显微镜图像的总像素值,s为步骤2所得蛋白体像素值。
本发明与现有技术相比,其显著优点为:(1)实施过程操作简单不需要设定标尺,对使用者的要求不高,仅在imageview软件中简单操作即可完成,适合初学者使用;(2)计算蛋白体相对面积采用的是像素值,精确度更高,至像素级别;(3)计算蛋白体相对面积时仅需删除细胞壁干扰,全程都是可视化操作,更加高效、快速。
附图说明
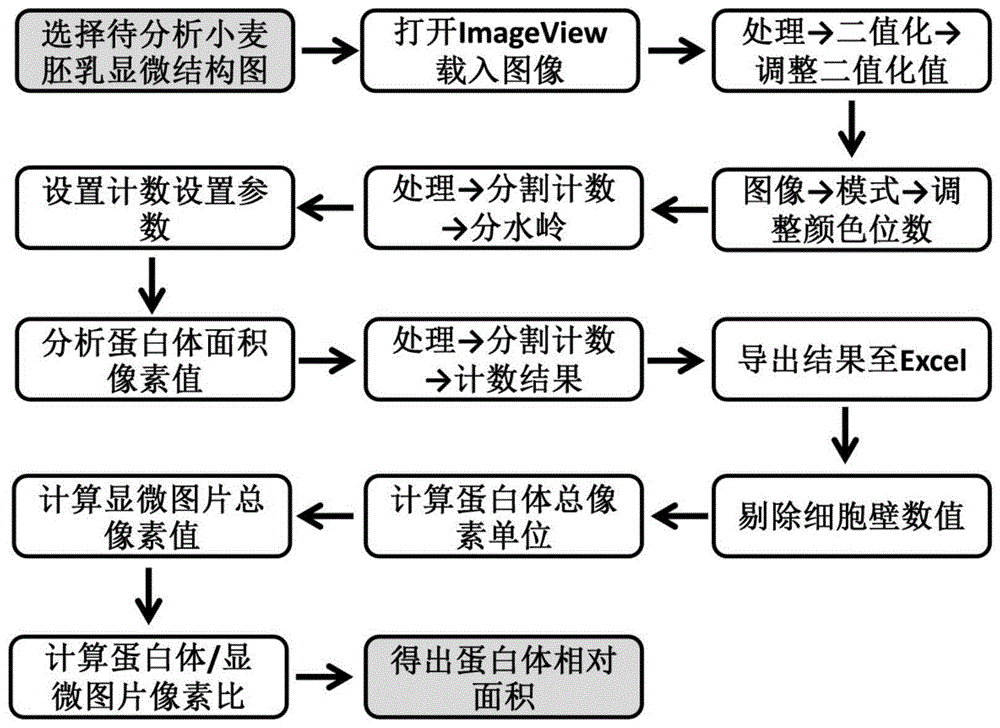
图1为本发明小麦胚乳蛋白体面积的分析方法的流程框图。
图2为本发明实施例中小麦胚乳显微结构图。
图3为本发明实施例中第一次二值化后的显微结构图。
图4为本发明实施例中第二次二值化后的显微结构图。
图5为本发明实施例中分水岭参数设置对话框示意图。
图6为本发明实施例中统计分析后的显微结构图。
图7为本发明实施例中蛋白体面积像素分析结果图。
图8为本发明实施例中删除噪音后的蛋白体像素值结果图。
图9为本发明实施例中显微图片总像素值的示意图。
具体实施方式
小麦胚乳蛋白体相对面积的计算一直是从事小麦胚乳发育研究人员遇到的难题之一,虽然现有一些方法可以统计蛋白体的相对面积,但其操作流程复杂,使用人群有限。因此,快速定量胚乳细胞中蛋白体的数量对科研人员而言显得尤为重要。本发明利用显微镜ccd配套软件imageview实现对小麦胚乳蛋白体相对面积的计算,整个实施过程操作简便,分析方法科学,结果可信度高。
本发明利用显微镜ccd配套软件imageview对蛋白体显微镜图像进行二值化处理,通过调整二值化数值获得最佳的蛋白体识别度。调整颜色位数后通过菜单中的分水岭功能实现对蛋白体的颜色识别,在统计结果中去除细胞壁噪音后可获得显微照片中蛋白体的像素值。最终通过蛋白体像素值与照片像素值的比值计算,完成对蛋白体相对面积的分析。结合图1,本发明小麦胚乳蛋白体面积的测定方法,包括以下步骤:
步骤1、利用显微镜ccd配套软件imageview对待分析的小麦胚乳显微镜图像进行二值化处理,通过调整二值化数值获得最佳的蛋白体识别度;
步骤2、调整步骤1所得二值化图像的颜色位数,然后通过分水岭功能实现对小麦胚乳蛋白体的区域识别及统计,在统计结果中去除细胞壁噪音后获得显微镜图像中蛋白体的像素值;
步骤3、将步骤2所得蛋白体像素值与原始小麦胚乳显微镜图像的总像素值进行比值计算,完成对小麦胚乳蛋白体相对面积的测定。
进一步地,步骤1所述通过调整二值化数值获得最佳的蛋白体识别度,具体为:
调整二值化数值,根据照片明亮度增加或降低二值化数值,使图片上蛋白体全部完整显示。
进一步地,步骤2中所述调整步骤1所得二值化图像的颜色位数,具体选择颜色位数为24位,以便软件能识别进行后续操作。
进一步地,步骤2中所述通过分水岭功能实现对小麦胚乳蛋白体的区域识别及统计,具体如下:
调用分水岭功能,将计数设置对话框的调整参数设置如下:拟合选择“不拟合”,孔洞选择“是”,风格选择“填充”,颜色1选择“黄色”,方法选择“是”,颜色2选择“黑色”,类型选择“序号”,面积和周长选择颜色位数为24位;点击确定完成区域识别及统计,在统计后的显微结构图中,被处理分析的区域呈现颜色1选择的黄色,不同区域以不同数字列出。
进一步地,步骤2中所述在统计结果中去除细胞壁噪音后获得显微镜图像中蛋白体的像素值,具体为:
将统计结果导出至excel表格中,在excel表格中得到所有分析区域的面积数值;观察统计后的显微结构图,并与原始显微结构图对比,将非蛋白体区域(非圆形区域)的编号删除,得出净蛋白体区域的面积像素值。
进一步地,步骤3所述将步骤2所得蛋白体像素值与原始小麦胚乳显微镜图像的总像素值进行比值计算,完成对小麦胚乳蛋白体相对面积的测定,公式如下:
ds=s/s
其中,ds为小麦胚乳蛋白体相对面积,s为原始小麦胚乳显微镜图像的总像素值,s为步骤2所得蛋白体像素值。
下面结合附图2~9及具体实施例对本发明做进一步详细说明。
实施例
本方法利用已拍摄的小麦胚乳显微结构图,通过imageview(购买于北京天诺翔科学仪器有限公司)分析图片中蛋白体的相对面积,具体实施方式如下:
(1)载入图片。选择待分析的小麦胚乳显微结构图,如图2所示,小麦品种:“烟农19”;时间:开花后18天;打开imageview软件,点击文件→打开图像。
(2)二值化处理。在imageview菜单栏点击处理→二值化,可预览到二值化后的显微图片如图3。调整二值化数值,此处根据照片明亮度调整数值高低,保证图片上蛋白体全部完整显示即可。本法选用的图片数值调整为126,保证蛋白体完全显示,如图4。
(3)图片颜色位数调整。在菜单栏点击图像→模式→颜色位数,选择颜色位数为24位,确保下步操作颜色识别功能正常发挥。
(4)蛋白体区域识别。在菜单栏点击处理→分割计数→分水岭,弹出计数设置对话框。调整参数设置如图5:拟合(不拟合),孔洞(是),风格(填充),颜色1(黄色),方法(是),颜色2(黑色),类型(序号),面积和周长(√)选择颜色位数为24位,确保下步操作颜色识别功能正常发挥。点击确定,蛋白体区域面积分析完成。此时可预览到统计后的显微结构图,图中被处理分析的区域呈现颜色1颜色(黄色)。不同区域以不同数字列出,如图6所示。
(5)查看处理分析结果。在菜单栏点击处理→分割计数→计数结果,可预览统计分析结果如图7。点击导出,数据自动转入excel表格中。在excel表格中可以得到所有分析区域的面积数值。观察图中区域,将非蛋白体识别区域(主要为细胞壁)的编号删除,得出净蛋白体的面积像素值,本法选用图片中蛋白体所占面积像素值为10542,如图8所示。
(6)计算蛋白体相对面积。打开原始显微结构图,查看图片总像素值,本法选用图片为800×600=480000像素如图9所示。计算图中蛋白体像素/图片总像素的比值,即可得出图片中蛋白体的相对面积:10542×100%/480000=2.20%。
由上可知,本发明实施过程操作简单不需要设定标尺,对使用者的要求不高,仅在imageview软件中简单操作即可完成,适合初学者使用。而如果使用image-proplus或imagej等软件时,则需要另外结合photoshop软件才能完成整个分析过程。另外,image-proplus和imagej这类软件使用前还需要提前设定标尺,在测量时需要选择标尺,操作过程繁琐初学者使用时容易出现标尺选择错误情况,最终使得分析结果产生错误偏差,不适合初学者使用。此外,计算蛋白体相对面积采用的是像素值,而前人使用的是具体的实际显微面积值,相比较前人使用标尺计算而言精确度更高,至像素级别。最终计算蛋白体相对面积时仅需删除细胞壁干扰,全程都是可视化操作,例如前人使用image-proplus软件分析图片中的蛋白体时,则需要先使用photoshop软件对待分析的图片进行前期处理,如去除污点、调节图片亮度和对比度及蛋白体颜色着色等,随后才能在image-proplus软件中进行图片的后期分析。另外,相比前人需要对照片进行前期处理而言该方法更加高效、快速。
- 还没有人留言评论。精彩留言会获得点赞!